Introducción
El síndrome de apnea central (SAC) consiste en el cese de la respiración durante el sueño debido a una pérdida transitoria del control ventilatorio, de forma que no se generan esfuerzos u oscilaciones de presión intratorácica1,2. Los pacientes con SAC constituyen únicamente del 4 al 10% de los individuos con síndrome de apnea en las poblaciones estudiadas en los laboratorios de sueño3. El SAC puede ser hiper, normo o hipocápnico. El primero forma parte del síndrome de hipoventilación alveolar, mientras que los no hipercápnicos conforman el idiopático o el secundario a causas diversas. Presentamos el caso de una paciente afectada de SAC no hipercápnico, en cuya aparición pudieron concurrir diversas causas y que se trató mediante BiPAP (Respironics Inc, Murrapville, PA, Estados Unidos), mientras se actuaba sobre las distintas causas desencadenantes, y posteriormente con presión positiva continua de la vía aérea (CPAP), con buena respuesta.
Observación clínica
Mujer de 75 años, procedente del servicio de medicina interna, donde permanecía ingresada por cuadro de un mes de evolución consistente en desorientación, debilidad generalizada y disminución del nivel de conciencia. Se realizó interconsulta al servicio de neumología al detectarse patrón ventilatorio "anormal". Como antecedentes personales presentaba hipertensión arterial, fibrilación auricular crónica con frecuencia controlada, miocardiopatía hipertensiva con fracción de eyección del ventrículo izquierdo (FEVI) del 55%, insuficiencia renal crónica (IRC) secundaria a nefroangioesclerosis (creatinina: 3,5 mg/dl) e hiperparatiroidismo primario con hipercalcemia crónica por hiperplasia de paratiroides. Dos años antes había comenzado a presentar somnolencia diurna, además de apneas referidas por un familiar, por lo que se le había practicado una pulsioximetría nocturna domiciliaria, que mostró un patrón en ondas de sierra y fue etiquetada de síndrome de apneas obstructivas durante el sueño (SAOS). Se le prescribió en aquel momento CPAP nasal nocturna, que no aceptó. En la exploración la paciente estaba somnolienta, con un patrón respiratorio consistente en apneas de larga duración, sin movimientos torácicos ni abdominales y sin ronquido, con respiración agónica (gasping) ocasional e intensa cianosis al final de las apneas. Despertarla resultaba muy difícil, estaba desorientada y mantenía prácticamente el mismo patrón respiratorio durante la vigilia. El hemograma y la coagulación fueron normales, y en la bioquímica únicamente destacaban los valores de creatinina (3,2 mg/dl) y calcio (11,3 mg/dl). Los marcadores tumorales, el análisis de orina y la radiografía de tórax fueron asimismo normales. La gasometría arterial respirando aire ambiente mostró pH: 7,41, presión arterial de oxígeno: 86 mmHg, presión arterial de anhídrido carbónico (PaCO2): 26,2 mmHg, HCO3: 16,3 mM, exceso de bases: 7 mM, indicativa y saturación arterial de oxígeno: 96,6%, indicativa de acidosis metabólica compensada con alcalosis respiratoria. La tomografía computarizada craneal mostró una marcada alteración de la sustancia blanca periventricular en relación con enfermedad isquémica de pequeño vaso. Dada la situación de intensa somnolencia de la paciente, no se pudo realizar una exploración funcional completa, a excepción de la medida de la presión de oclusión, que mostró valores al inicio de la "vigilia" de 2,77 cmH2O y al inicio de la apnea de 1,03 cmH2O; la concentración de anhídrido carbónico al final de la espiración fue de 18 mmHg al final de la apnea y de 24,8 mmHg al final de la "vigilia".
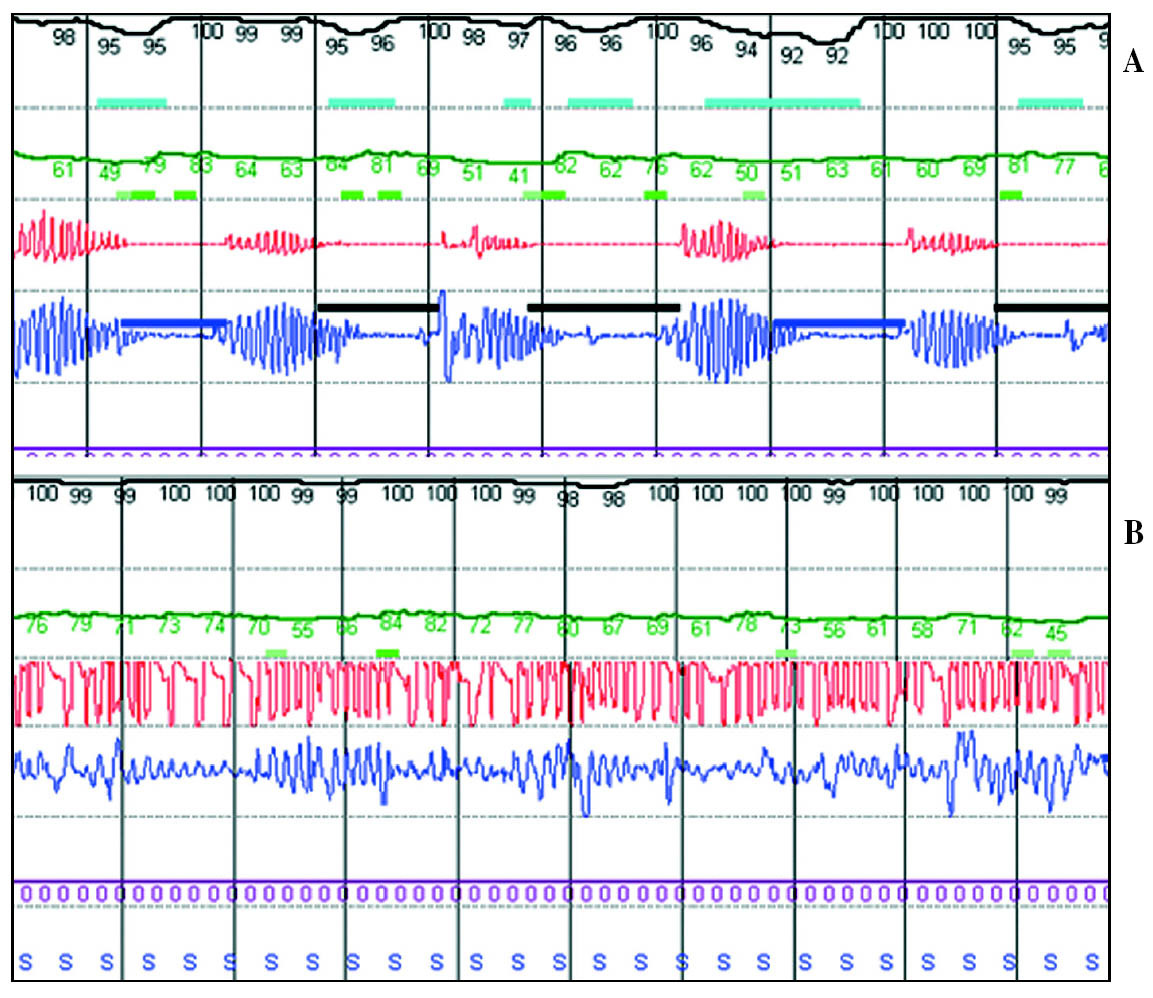
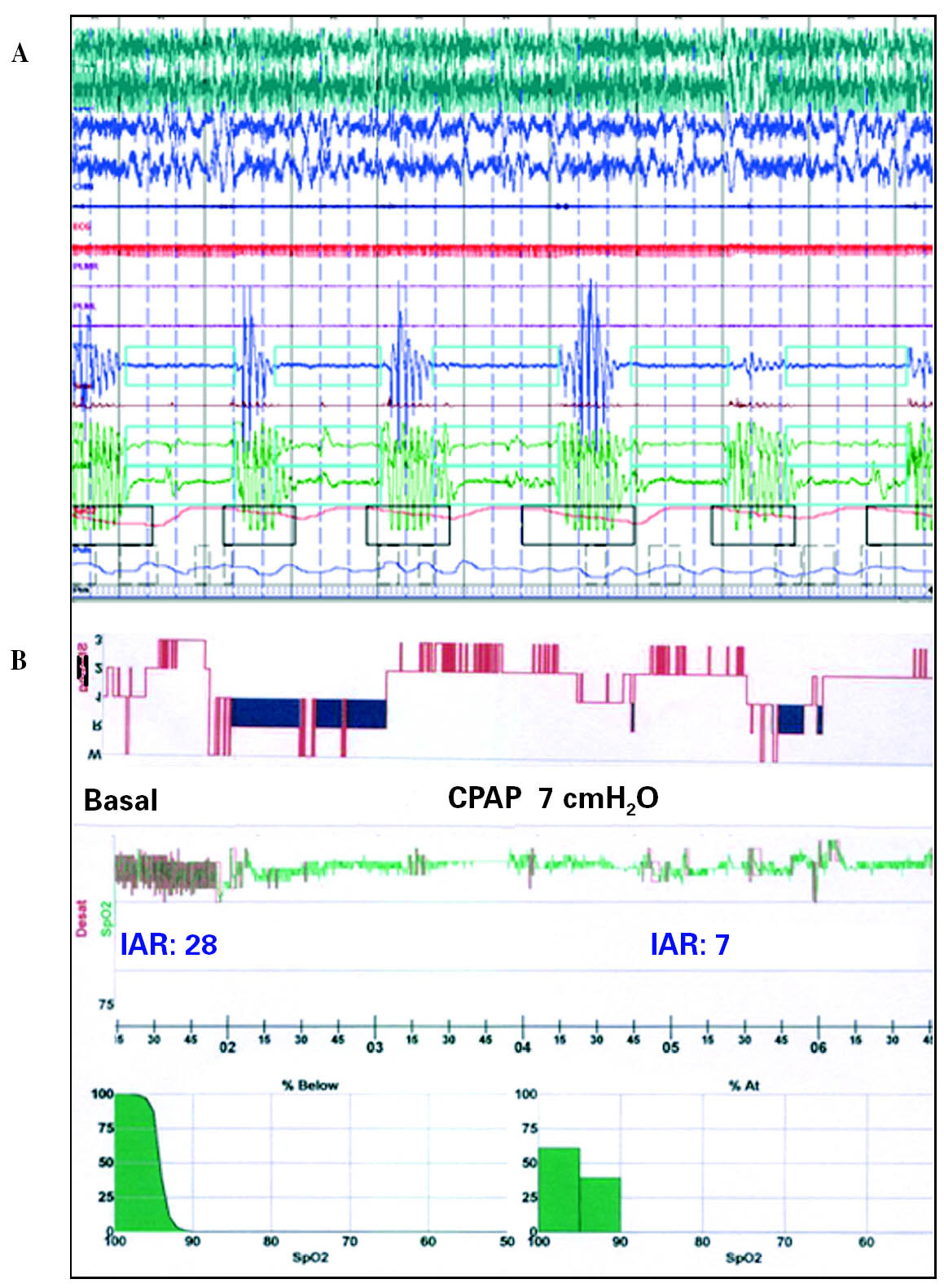
Se realizó una poligrafía respiratoria, que evidenció un índice de alteración respiratoria (IAR) de 62 a expensas de apneas centrales en su totalidad; índice de desaturaciones igual o mayor del 3% (ODI) de 59, y porcentaje de tiempo con saturación de oxígeno menor del 90% (TC90) del 2,5% (fig. 1A), por lo que se diagnosticó de SAC con respiración tipo Cheyne-Stokes. Con el fin de valorar el tratamiento más adecuado se efectuaron las siguientes poligrafías respiratorias: con CPAP a 7 cmH2O y 2 l/min de oxígeno; con BiPAP® en modo espontáneo/ciclado a 10/6 cmH2O, y finalmente con BiPAP® en modo espontáneo/ciclado a 14/6 cmH2O, a 10 ciclos/min, y oxígeno a 2 l/min (fig. 1B). Este último tratamiento se pautó a domicilio por considerarse el más adecuado, pues conseguía generar flujo aéreo y movimientos toracoabdominales, reducir el IAR a 25 y el ODI a 30, y mantener TC90 al 0,5%. Dados los antecedentes de la paciente se propuso cirugía de paratiroides y diálisis, en espera de un eventual trasplante renal. Tras la paratiroidectomía practicada 3 meses más tarde y el inicio de hemodiálisis, experimentó un cambio espectacular. Cuando acudió a la consulta, caminaba sola y no presentaba somnolencia (Epworth: 7), aunque usaba el soporte ventilatorio sólo 2-3 h diarias. La espirometría, la presión de oclusión, la concentración de anhídrido carbónico al final de la espiración y la gasometría arterial fueron normales. En la analítica destacaba una discreta disminución de la creatinina a 2,6 mg/dl, además de la normalización de la calcemia. Se practicó 15 días más tarde una polisomnografía en modo noche partida, que en la primera parte (fig. 2A) objetivó eficiencia de sueño en el 82%; estadio 1 en el 18%, estadio 2 en el 58%, estadio 3 en el 6%, estadio 4 en el 4%, estadio REM en el 14%, índice de despertares transitorios de 36, IAR de 28, a expensas exclusivamente de eventos centrales, ODI de 16 y TC90 del 1,3%. En la segunda parte, tras distintos ajustes de presión, comprobamos que 7 cmH2O de CPAP eran suficientes para mantener un IAR residual de 7, de modo que se pautó dicho tratamiento, con buena aceptación y tolerancia posterior (fig. 2B).
Fig. 1. Poligrafía respiratoria (A) que evidencia un síndrome de apnea central con respiración tipo Cheyne-Stokes, y poligrafía respiratoria (B) realizada con BiPAP® en modo espontáneo/ciclado a 14/6 cmH2O, a 10 ciclos/min, y 2 l/min de oxígeno.
Fig. 2. Polisomnografía en modo noche partida tras paratiroidectomía e inicio de hemodiálisis. En la primera parte de la polisomnografía (A) se observan apneas centrales; la segunda (B) se realizó con presión positiva continua de la vía aérea (CPAP) a 7 cmH2O. IAR: índice de alteración respiratoria.
Discusión
Dentro del SAC cabe distinguir la forma idiopática, que se define como excesiva somnolencia diurna o frecuentes despertares transitorios no explicados por otros factores, al menos 5 apneas-hipopneas centrales por hora de sueño y normo o hipocapnia durante la vigilia (PaCO2 < 45 mmHg)4,5. En la forma hipercápnica de SAC, el aumento de la PaCO2 es consecuencia de la reducción de la ventilación o de apneas producidas por una depresión del control respiratorio. El SAC no hipercápnico no se asocia con ninguna reducción primaria del control respiratorio o con debilidad de la musculatura respiratoria, sino que las apneas centrales se producen por episodios de hiperventilación e hipocapnia y hay un incremento de la orden ventilatoria1. Según los escasos estudios que analizan a pacientes con SAC sintomático, éste afecta en su mayoría a individuos de edad media y ancianos, de sexo masculino, y es menos frecuente en mujeres3. Sus características clínicas son similares a las del SAOS, aunque, en contraste, los síntomas de insomnio son más destacados. El SAC no hipercápnico no suele asociar policitemia o cor pulmonale, quizá porque no hay hipoxemia grave durante el sueño1.
Durante el sueño NREM (sin movimientos oculares rápidos), la ventilación está controlada por el sistema metabólico (cuerpo carotídeo para la hipoxia, y cuerpo carotídeo, junto con quimiorreceptores medulares, para la hipercapnia). La alcalosis hipocápnica reduce el estímulo ventilatorio hipercápnico, por lo que puede producir apneas centrales en individuos sanos. Además, las respuestas ventilatorias a la hipoxia y la hipercapnia están disminuidas durante el sueño NREM y, en mayor medida, durante el REM. La PaCO2 es probablemente el mayor estímulo durante el sueño; en este sentido, en la fisiopatología del SAC no hipercápnico es fundamental el concepto de umbral de apnea o valor de PaCO2 a partir del cual aparece una apnea. En la respiración periódica la apnea ocurre sólo cuando la PaCO2 precedente es relativamente baja, y puede abolirse elevando la PaCO2 por encima del umbral de apnea predeterminado (control quimiorreceptor), que es diferente para cada individuo. Además del umbral de apnea, se han propuesto otras hipótesis, como la inhibición de la respiración secundaria al aumento del volumen corriente de origen vagal. Si la sensibilidad al anhídrido carbónico es baja o está ausente, habrá poco estímulo para la ventilación y aparecerán apneas centrales, como sucede en el síndrome de Ondina o en el síndrome de hipoventilación-obesidad. Sin embargo, si la sensibilidad al anhídrido carbónico es muy alta, se observan 2 patrones ventilatorios: hipercapnia durante la vigilia y baja respuesta ventilatoria hipercápnica, o PaCO2 baja durante vigilia y alta respuesta hipercápnica, como sucedió en nuestra paciente3.
Estas anormalidades pueden producirse de forma primaria o secundaria a diversos trastornos. Las causas neurológicas incluyen lesiones aisladas o combinadas del sistema nervioso periférico, central o autonómico. Entre las causas no neurológicas más frecuentes destacan la insuficiencia cardíaca (IC), la IRC, el hipotiroidismo, la exposición a alta altitud, los fármacos (opiáceos, fenotiacinas en niños) y la titulación iatrogénica de CPAP1,6. En nuestra paciente cabría preguntarse qué factores pudieron concurrir potencialmente para producir el SAC, como son la IRC, el hiperparatiroidismo, la enfermedad vascular cerebral y la IC.
Se ha demostrado que el 80% de los pacientes en diálisis presentan trastornos del sueño7. El más común es el SAOS, que puede mostrar una prevalencia del 73%7, así como otras parasomnias, como piernas inquietas y movimientos periódicos de las piernas. La presencia de SAC, tal como sucedió en nuestra paciente, es excepcional y se atribuiría a la hipocapnia secundaria a la acidosis metabólica, la cual predispone a un patrón respiratorio inestable y aparición de apneas centrales. También las toxinas urémicas podrían afectar al sistema nervioso central y reducir el tono muscular durante el sueño, provocar una descoordinación del diafragma y de la musculatura de la vía aérea superior, o dar lugar a un control respiratorio inestable. Todos estos factores pueden originar excesiva somnolencia diurna7. Otros factores agravantes derivados de la elevada comorbilidad, como arteriosclerosis, diabetes mellitus, IC y acidosis metabólica crónica, pueden suponer un estímulo para inducir un descenso compensatorio de la PaCO2. Además, el umbral apneico está aumentado en la uremia crónica, lo que produce un aumento del riesgo. Otros hipotéticos factores que pueden contribuir son la anemia, las sustancias endógenas opioides, la neuropatía urémica, el aumento de citocinas, etc.8. La hemodiálisis convencional no reduce la prevalencia del SAOS, pero la nocturna9,10 y el trasplante renal han conseguido corregir tanto las apneas obstructivas como las centrales11,12. En nuestro caso, la hemodiálisis corrigió sólo parcialmente el SAC, tal vez porque su capacidad para corregir por completo las alteraciones metabólicas causantes de dicho síndrome eran limitadas debido a factores como el tiempo de cadencia entre sesiones de diálisis, lo que podría causar un SAC de gravedad "alternante", en función del tiempo transcurrido entre ellas.
Nuestra paciente presentaba hiperparatiroidismo, y en este sentido también se ha descrito una alta prevalencia de síntomas que pueden influir en la mala higiene del sueño: piernas inquietas, depresión, irritabilidad, ansiedad, debilidad muscular proximal, fatigabilidad y atrofia muscular. La mejoría de estos síntomas tras la paratiroidectomía y la normalización de los valores de hormona paratiroidea y calcio son ostensibles13-16. Con respecto a la enfermedad vascular cerebral, cualquier alteración neurológica que afecte al sistema de control respiratorio metabólico puede influir en el patrón ventilatorio produciendo apneas centrales6,17. La IC se asocia con frecuencia a respiración de Cheyne-Stokes durante el sueño y la vigilia. Esta respiración periódica probablemente es producto de una inestabilidad del control respiratorio resultante de un tiempo circulatorio prolongado y una respuesta aumentada a la elevación de PaCO218,19. En un estudio de 81 pacientes ambulatorios con IC por disfunción sistólica tratada y estable, se encontró SAC en el 40%20. La presencia de SAC en IC se ha asociado con peor pronóstico19.
El tratamiento del SAC es problemático, debido a que es un trastorno poco común sobre el que no existen estudios aleatorizados. Fármacos como la teofilina, sedantes, medroxiprogesterona, antidepresivos tricíclicos, inhibidores de la serotonina y acetazolamida muestran respuestas variables. En un estudio reciente con pacientes con IC21 la administración de una única dosis de acetazolamida antes del sueño mejoró el SAC y los síntomas diurnos. El oxígeno tiene una influencia desestabilizadora de la respuesta ventilatoria hipóxica en el control respiratorio. Cuando hay hipoxia, aparece hiperventilación, que produce alcalosis e hipocapnia, pudiendo así inhibir la respiración durante el sueño y provocar apneas centrales. La adición de oxígeno puede disminuir la influencia hipóxica y dar lugar a una respiración más regular, con disminución tanto del número como de la duración de las apneas3. Como las apneas centrales se ven precipitadas por fluctuaciones en la PaCO2 por debajo del umbral de apnea, el incremento de tan sólo 1 a 3 mmHg en la PaCO2 mediante la inhalación de gas enriquecido en anhídrido carbónico puede abolirlas, aunque este tratamiento no se utiliza, ya que produce hiperventilación22. En contraposición, tal como comprobamos en nuestra paciente tras la diálisis y la cirugía de paratiroides, la CPAP puede ser efectiva al aumentar la PaCO2, manteniéndola por encima del estímulo de la apnea. El papel de la CPAP frente a la BiPAP® es controvertido y no hemos encontrado referencias de tratamiento con ventilación domiciliaria en pacientes con SAC e IRC6. En un estudio reciente de Bradley et al23 con 287 pacientes con FEVI inferior al 25% y SAC, se ha comprobado que la CPAP atenúa las apneas centrales, mejora la oxigenación nocturna, aumenta la FEVI, disminuye los valores de noradrenalina y aumenta la distancia recorrida, pero no afecta a la supervivencia. Hay algunos dispositivos diseñados específicamente para el tratamiento del SAC, como la servoventilación adaptativa y de alta frecuencia24,25, pero aún no se ha probado su eficacia a largo plazo y con un número suficiente de pacientes.
Concluimos que el tratamiento del SAC debe ser individualizado, particularmente cuando se descartan las causas más frecuentes, valorando la respuesta a distintos regímenes terapéuticos, entre los que puede incluirse el soporte ventilatorio domiciliario.
Correspondencia: Dra. M. Llombart.
Sección de Neumología. Hospital Universitario San Juan de Alicante.
Ctra. Alicante-Valencia, s/n. 03550 San Juan de Alicante. Alicante. España.
Correo electrónico: llombart_mon@gva.es
Recibido: 6-6-2006; aceptado para su publicación: 2-8-2006.