El objetivo es obtener un modelo predictor de riesgo quirúrgico en pacientes sometidos a resecciones pulmonares anatómicas a partir del registro del Grupo Español de Cirugía Torácica Videoasistida.
MétodosSe recogen datos de 3.533 pacientes sometidos a resección pulmonar anatómica por cualquier diagnóstico entre el 20 de diciembre de 2016 y el 20 de marzo de 2018.
Definimos una variable resultado combinada: mortalidad o complicación Clavien Dindo IV a 90 días tras intervención quirúrgica. Se realizó análisis univariable y multivariable por regresión logística. La validación interna del modelo se llevó a cabo por técnicas de remuestreo.
ResultadosLa incidencia de la variable resultado fue del 4,29% (IC 95%: 3,6-4,9). Las variables que permanecen en el modelo logístico final fueron: edad, sexo, resección pulmonar oncológica previa, disnea (mMRC), neumonectomía derecha y DLCOppo. Los parámetros de rendimiento del modelo, ajustados por remuestreo, fueron: C-statistic 0,712 (IC 95%: 0,648-0,750), Brier score 0,042 y Booststrap shrinkage 0,854.
ConclusionesEl modelo predictivo de riesgo obtenido a partir de la base de datos Grupo Español de Cirugía Torácica Videoasistida es un modelo sencillo, válido y fiable, y constituye una herramienta muy útil a la hora de establecer el riesgo de un paciente que se va a someter a una resección pulmonar anatómica.
The aim of this study was to develop a surgical risk prediction model in patients undergoing anatomic lung resections from the registry of the Spanish Video-Assisted Thoracic Surgery Group (GEVATS).
MethodsData were collected from 3,533 patients undergoing anatomic lung resection for any diagnosis between December 20, 2016 and March 20, 2018.
We defined a combined outcome variable: death or Clavien Dindo grade IV complication at 90 days after surgery. Univariate and multivariate analyses were performed by logistic regression. Internal validation of the model was performed using resampling techniques.
ResultsThe incidence of the outcome variable was 4.29% (95% CI 3.6-4.9). The variables remaining in the final logistic model were: age, sex, previous lung cancer resection, dyspnea (mMRC), right pneumonectomy, and ppo DLCO. The performance parameters of the model adjusted by resampling were: C-statistic 0.712 (95% CI 0.648-0.750), Brier score 0.042 and bootstrap shrinkage 0.854.
ConclusionsThe risk prediction model obtained from the GEVATS database is a simple, valid, and reliable model that is a useful tool for establishing the risk of a patient undergoing anatomic lung resection.
El desarrollo de complicaciones posquirúrgicas incide significativamente en la estancia hospitalaria, la mortalidad posquirúrgica y los costes por paciente1.
Aunque existen numerosos modelos predictivos de morbimortalidad quirúrgica para distintos tipos de intervención, la realidad es que ninguno de ellos se emplea de forma universal y rutinaria.
Thoracoscore se desarrolló a partir de una amplia base de datos con población francesa para cualquier tipo de intervención quirúrgica torácica, incluyendo pacientes sin cáncer de pulmón2, y pese a haber sido validada en una muestra de pacientes estadounidenses3 no ha sido capaz de demostrar certeza suficiente cuando se ha probado en otros grupos de pacientes europeos4,5. La Sociedad Francesa de Cirugía Torácica ha publicado recientemente sobre una base de datos más amplia que Thoracoscore 2 modelos de riesgo quirúrgico para pacientes sometidos a cirugía exclusivamente por cáncer de pulmón (Epithor)6.
Por su parte, la European Society of Thoracic Surgeons ha desarrollado su propio modelo predictivo (ESOS.01)7, que se calcula a partir de 2 variables (FEV1 y edad), y los datos de predictibilidad en las publicaciones existentes al respecto arrojan conclusiones dispares5,8,9. Posteriormente se ha actualizado esta base de datos europea para resecciones pulmonares anatómicas, con los consiguientes modelos de morbimortalidad10. La situación es similar con otro tipo de modelos predictivos11,12.
Disponer de un modelo de riesgo quirúrgico en cirugía torácica permite mejorar el proceso de toma de decisiones en cuanto a la mejor opción terapéutica para un paciente determinado, así como optimizar la información a nuestros pacientes13,14.
Además, este tipo de modelos se puede usar como indicador de calidad de la atención médica para comparar los resultados de diferentes unidades de cirugía torácica. Por otro lado, conocer de forma objetiva el riesgo quirúrgico es especialmente interesante en el contexto actual, en el que se plantean tratamientos alternativos a la cirugía para determinados tipos de pacientes.
El objetivo de nuestro trabajo es desarrollar un modelo predictor de morbimortalidad posquirúrgica en pacientes sometidos a una resección pulmonar anatómica a partir de la base de datos del Grupo Español de Cirugía Torácica Videoasistida (GEVATS)15.
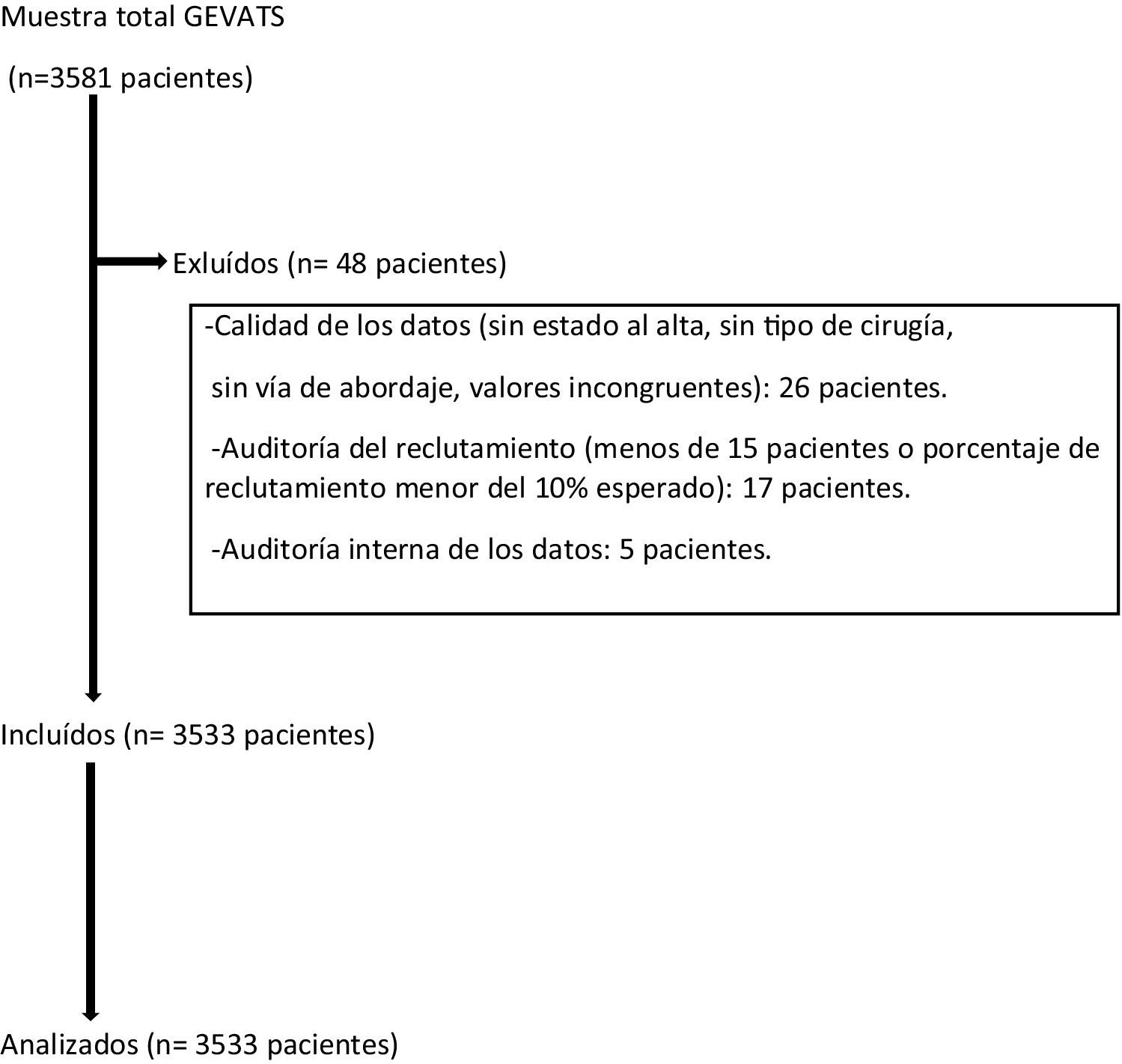
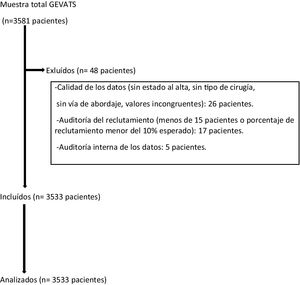
Material y métodosEn el año 2015 se constituyó el GEVATS como un proyecto en el seno de la Sociedad Española de Cirugía Torácica, con el objetivo de analizar los resultados de morbimortalidad y oncológicos de la cirugía de resección pulmonar en España. Se elaboró una base de datos online con pacientes sometidos a resección pulmonar anatómica por cualquier diagnóstico y vía de abordaje en todos los servicios de cirugía torácica del GEVATS durante 15 meses consecutivos (20 de diciembre de 2016-20 de marzo de 2018) (fig. 1).
El proyecto ha sido aprobado por los respectivos comités éticos de investigación de todos los centros participantes. Todos los pacientes firmaron un consentimiento informado específico para poder emplear sus datos clínicos con fines científicos.
Se excluyeron aquellos procedimientos quirúrgicos bilaterales y los pacientes menores de 18 años.
Se recogieron datos demográficos, de evaluación funcional y comorbilidad, relativos al procedimiento quirúrgico y de morbimortalidad postoperatoria (a 90 días) (material suplementario).
Todas las variables se adaptaron conforme a la norma publicada por parte de la Society of Thoracic Surgeons (STS) y la European Society of Thoracic Surgeons16.
Las complicaciones respiratorias, cardiovasculares o de cualquier otra índole se recogieron atendiendo a la guía de severidad de la clasificación Clavien-Dindo17.
Se excluyeron aquellos casos en los que no existieran datos referentes al tipo de resección pulmonar, tipo de abordaje quirúrgico y estado del paciente al alta hospitalaria. También se excluyeron los datos procedentes de centros con una tasa de reclutamiento inferior al 10% del esperado o que hubieran recogido menos de 15 pacientes durante el período de estudio.
La calidad de los datos recogidos se estableció mediante una auditoría interna por parte de los miembros del comité científico del GEVATS. Para ello se comparó la información que aparecía en la base de datos en cuanto a determinadas variables (fecha de intervención quirúrgica, tipo de resección, abordaje, estancia hospitalaria, complicaciones grado IIIb-IV y estado del paciente al alta) con la que figuraba en las historias clínicas de, al menos, el 20% de los casos remitidos por parte de cada uno de los centros participantes.
Análisis estadísticoEl análisis descriptivo se ha realizado mediante la obtención de las frecuencias absolutas y relativas para las variables categóricas, y con la media y desviación estándar, o mediana y percentiles 25 y 75 en las variables numéricas.
La variable resultado se define con una variable compuesta, en la que la presencia de alguna complicación Calvien-Dindo IV a los 90 días de la intervención o mortalidad por cualquier causa es el evento de interés. El análisis univariable se ha realizado mediante contrastes de hipótesis con la prueba Chi-cuadrado de Pearson o el estadístico exacto de Fisher, en el caso de las variables categóricas y con los test de Mann-Whitney para contrastes de las variables numéricas.
Con las variables que resultaron significativas en el análisis univariable y otras variables clínicamente relevantes (aunque no resultaran estadísticamente significativas), se ha desarrollado el modelo predictivo logístico multivariable. Se ha realizado un diagnóstico de colinealidad entre las variables independientes del modelo, eliminando aquellas que lo cumplieran. Se ha llevado a cabo una estrategia de modelización hacia atrás automática, en la que se han ido eliminando del modelo de forma sucesiva aquellas variables con un nivel de significación en el test de Wald p>0,05.
La validación interna del modelo se ha llevado a cabo por técnicas de remuestreo bootstrap con 100 replicaciones, incluyendo medidas de rendimiento global, calibración y discriminación. La calibración se evalúa mediante un gráfico de calibración, la discriminación con el C-statistic y el rendimiento global, mediante el Brier score18–21.
Por último, y para facilitar la interpretación de los modelos pronósticos, se ha desarrollado un nomograma con los resultados del modelo final empleando el parche «nomolog» para STATA22.
El nivel de significación se ha establecido en 0,05. El análisis estadístico se ha llevado a cabo con el paquete Stata/IC v.16 (StataCorp. 2019. Stata Statistical Software: Release 16. College Station, TX: StataCorp LLC).
ResultadosSe pudieron analizar los datos de mortalidad y complicaciones Clavien Dindo IV de 3.533 pacientes, procedentes de 33 servicios de cirugía torácica.
Las características de la muestra y las variables analizadas están recogidas en las tablas 1 y 2.
Resto de variables de la muestra
| Variables | |
|---|---|
| Tabaquismo activo | 980 (28,37%) |
| Consumo de alcohol | 224 (6,37%) |
| HTA | 1.561 (44,33%) |
| Diabetes mellitus | 657 (28,66%) |
| Insuficiencia cardíaca | 82 (2,32%) |
| Cardiopatía isquémica | 314 (8,92%) |
| Arritmia | 277 (7,87%) |
| Enfermedad vascular periférica | 318 (9%) |
| ACVA | 180 (5,1%) |
| Disnea mMRC | |
| 0 | 2.231 (63,45%) |
| 1 | 1.000 (28,44%) |
| 2 | 252 (7,17%) |
| 3 | 33 (0,94%) |
| Insuficiencia hepática | 33 (0,94%) |
| IMC | 26,86 (SD 4,57) |
| Albúmina (g/dl) | 4,1 (SD 0,54) |
| Creatinina (>2mg/dl) | 93 (2,64%) |
| Demencia | 19 (0,54%) |
| FEV1ppo | 69,96% (SD 18,26) |
| DLCOppo | 65,41% (SD 18,47) |
| Qmáxppo(ml/kg/min) | 13,83 (SD 3,57) |
| ASA | |
| I | 81 (2,30%) |
| II | 1.464 (41,69%) |
| III | 1.876 (53,42%) |
| IV | 91 (2,59%) |
| Cirugía torácica previa (oncológica) | 130 (4,23%) |
| Cirugía cardíaca previa | 63 (1,78%) |
| Años de experiencia del cirujano | |
| >20años | 834 (23,69%) |
| 10-20años | 1.108 (31,45%) |
| <10años | 1.356 (44,92%) |
| Residente | 222 (6,31%) |
| Experiencia VATS del cirujano | |
| >100casos | 981 (27,87%) |
| 50-100casos | 1.015 (28,84%) |
| <50% casos | 1.432 (40,68%) |
| Ninguna experiencia | 92 (2,61%) |
| Abordaje | |
| Abierto | 1.616 (45,74%) |
| VATS | 1.917 (54,46%) |
| Localización | |
| Central | 1.198 (39%) |
| Periférico | 1.873 (61%) |
| Afectación ganglionar por prueba de imagen (TAC) | |
| cN1 | 230 (7,5%) |
| cN2 | 315 (10,26%) |
| cN3 | 18 (0,59%) |
| Neoadyuvancia | |
| QT | 245 (7,97%) |
| RT | 74 (2,41%) |
| Diagnóstico | |
| Carcinoma broncogénico | 3.074 (87,33%) |
| Metástasis pulmonar | 244 (6,93%) |
| Otros diagnósticos | 202 (5,74%) |
| Número de segmentos resecados funcionantes | |
| 0 | 62 (1,76%) |
| 1-3 | 1.632 (46,39%) |
| 4-5 | 1.584 (45,03%) |
| ≥6 | 240 (6,82%) |
| Neumonectomía derecha | 90 (2,55%) |
| Reintervención | 122 (3,46%) |
| Complicaciones respiratorias | 791 (22,39%) |
| Fuga aérea persistente | 419 (11,86%) |
| Neumonía | 163 (4,61%) |
| Atelectasia | 124 (3,51%) |
| Derrame | 78 (2,21%) |
| Reintubación | 53 (1,50%) |
| Empiema | 44 (1,25%) |
| SDRA | 44 (1,25%) |
| Fístula broncopleural | 27 (0,76%) |
| TEP | 13 (0,37%) |
| CD I | 312 (39,44%) |
| CD II | 208 (26,30%) |
| CD III | 199 (23,89%) |
| CD IV | 37 (4,68%) |
| CD V | 45 (5,69%) |
| Complicaciones cardiovasculares | 248 (7,02%) |
| Arritmias | 170 (4,81%) |
| ACVA | 5 (0,14%) |
| Insuficiencia cardíaca | 20 (0,57%) |
| IAM | 3 (0,08%) |
| TVP | 1 (0,03%) |
| CD I | 33 (13,31%) |
| CD II | 170 (68,55%) |
| CD III | 12 (4,84%) |
| CD IV | 24 (9,68%) |
| CD V | 9 (3,63%) |
| Otras complicaciones | 236 (6,74%) |
| Digestivas | 43 (1,22%) |
| Urológicas | 82 (2,32%) |
| Psiquiátricas | 16 (0,45%) |
| SNC | 19 (0,54%) |
| Hematológicas | 18 (0,51%) |
| CD I | 97 (40,76%) |
| CD II | 98 (41,18%) |
| CD III | 17 (7,14%) |
| CD IV | 13 (5,46%) |
| CD V | 13 (5,46%) |
| Infección de herida quirúrgica | 50 (1,42%) |
| Supervivencia a los 90d | 97,07% |
| Supervivencia al alta | 98,41% |
| Estancia hospitalaria | 5d (P25-75: 4-7d) |
| Reingreso | 6,96% |
ACVA: accidente cerebrovascular agudo; ASA: American Society of Anesthesiology physical score; CD: Clasificación Clavien Dindo (I-V); cN1: presencia de adenopatías patológicas hiliares o intrapulmonares por prueba de imagen; cN2: presencia de adenopatías patológicas mediastínicas ipsilaterales por prueba de imagen; cN3: presencia de adenopatías mediastínicas contralaterales o supraclaviculares ipsilaterales por prueba de imagen; DLCOppo: valor predicho postoperatorio de la DLCO. Se calcula automáticamente en la base de datos a partir del número de segmentos funcionantes resecados; FEV1ppo: valor predicho postoperatorio del FEV1. Se calcula automáticamente en la base de datos en función del número de segmentos funcionantes resecados; IAM: Infarto agudo de miocardio; mMRC: Escala de disnea modificada del Medical Research Council; Qmáxppo: valor del consumo máximo de O2 predicho postoperatorio. Se calcula automáticamente en la base de datos a partir del número de segmentos funcionantes resecados; QT: quimioterapia; RT: radioterapia; SDRA: Síndrome de distrés respiratorio del adulto; SNC: sistema nervioso central; TEP: tromboembolismo pulmonar TVP: trombosis venosa profunda; VATS: Cirugía videotoracoscópica.
La incidencia de la variable compuesta (mortalidad a 90d+complicación tipo iv a 90d) fue del 4,29% (IC 95%: 3,6-4,9).
Hubo 2 casos de mortalidad intraoperatoria (0,06%). La mortalidad al alta fue del 1,59%, a los 90 días del 2,93%, y la tasa de reingresos fue del 6,96%.
La mediana de estancia hospitalaria fue de 5 días (P25 4d; P75 7d).
Más de la mitad de los pacientes de la muestra se intervino de forma mínimamente invasiva (54,26%). La tasa de reconversión fue del 15,85%.
En cuanto a las complicaciones posquirúrgicas observadas, las más frecuentes fueron las de tipo respiratorio (22,39%), y de ellas la fuga aérea prolongada fue la complicación más habitual (52,97%). El segundo tipo de complicación más frecuente fueron las cardiovasculares (7,02%) y el 68,51% de ellas fueron arritmias.
La incidencia de complicaciones más graves (Clavien Dindo IV) respiratorias, cardiovasculares y del resto de aparatos y sistemas fue del 1,04%, 0,68% y 0,36%, respectivamente.
Las variables asociadas a la variable resultado compuesta (mortalidad+complicación Clavien Dindo IV) se resumen en la tabla 3.
Análisis univariable
| Variables | Outcome 90d No | Outcome 90d Sí | p |
|---|---|---|---|
| Demográficas | |||
| Sexo | <0,001 | ||
| Mujer | 1.036 (30,7%) | 20 (13,2%) | |
| Varón | 2.333 (69,25%) | 131 (86,65%) | |
| Edad (años) | 64,77 (SD 10,11) | 68,14 (SD 8,40) | 0,001 |
| Comorbilidades | |||
| Tabaquismo | 0,001 | ||
| Nunca | 540 (16,3%) | 8 (5,4%) | |
| Ex-fumador ≤12m | 1.383 (41,8%) | 76 (51,3%) | |
| Ex-fumador>12m | 443 (13,4%) | 26 (17,6%) | |
| Fumador | 942 (28,5%) | 38 (25,7%) | |
| Desconocido | 942 (28.5%) | 38 (25,7%) | |
| Alcohol | <0,001 | ||
| Sí | 204 (6.1%) | 20 (13.2%) | |
| No | 3.165 (93,94%) | 131 (86,75%) | |
| Cardiovasculares | 0,045 | ||
| HTA sí | 1.482 (44,03%) | 79 (52,32%) | |
| HTA no | 1.884 (55,97%) | 72 (47,62%) | |
| Diabetes mellitus | 0,096 | ||
| Sí | 621 (18,44%) | 36 (23,84%) | |
| No | 2.747 (81,56%) | 115 (76,16%) | |
| Insuficiencia cardíaca | 0,171 | ||
| Sí | 76 (2,26%) | 6 (3,97%) | |
| No | 3.292 (97,74%) | 145 (96,03%) | |
| Cardiopatía isquémica | 0,013 | ||
| Sí | 292 (8,67%) | 22 (14,57%) | |
| No | 3.077 (91,33%) | 129 (85,43%) | |
| Arritmia | 0,973 | ||
| Sí | 265 (7,87%) | 139 (92,05%) | |
| No | 3.102 (92,13%) | 12 (7,95%) | |
| Enfermedad vascular periférica | 0,330 | ||
| Sí | 301 (8,94%) | 134 (88,74%) | |
| No | 3.067 (91,06%) | 17 (11,26%) | |
| ACVA | 0,216 | ||
| Sí | 169 (5,02%) | 11 (7,28%) | |
| No | 3.199 (94,98%) | 140 (92,72%) | |
| Disnea mMRC | <0,001 | ||
| 0 | 2.162 (64,25%) | 69 (45,70%) | |
| 1 | 940 (27,93%) | 60 (39,74%) | |
| 2 | 233 (6,92%) | 19 (12,58%) | |
| 3 | 30 (0,89%) | 3 (1,99%) | |
| Insuficiencia hepática | <0,001 | ||
| Sí | 27 (0,80%) | 145 (96,03%) | |
| No | 3.342 (99,20%) | 6 (3,97%) | |
| IMC | 26,85 (SD 4,58) | 26,96 (SD 4,39) | 0,783 |
| Albúmina | 4,11 (SD 0,53) | 3,82 (0,71) | 0,032 |
| Creatinina (>2mg/dl) | 0,114 | ||
| Sí | 86 (2,55%) | 7 (4,67%) | |
| No | 3.282 (97,45%) | 143 (95,33%) | |
| Demencia | 0,834 | ||
| Sí | 18 (0,53%) | 1 (0,66%) | |
| No | 3.351 (99,47%) | 159 (99,34%) | |
| Parámetros funcionales | |||
| FEV1ppo | 70,40 (SD 18,18) | 59,97 (SD 17,20) | 0,001 |
| DLCOppo | 65,85 (SD 18,36) | 56,18 (SD 16,50) | 0,001 |
| Qmáxppo | 13,97 (SD 3,54) | 12,34 (SD 3,65) | 0,001 |
| ASA | 0,002 | ||
| I | 81 (2,41%) | 0 | |
| II | 1.417 (42,15%) | 47 (31,33%) | |
| III | 1.781 (52,97%) | 95 (63,33%) | |
| IV | 83 (2,47%) | 8 (5,33%) | |
| Procedimiento quirúrgico | |||
| Cirugía torácica previa (oncológica) | 0,007 | ||
| Sí | 118 (4,02%) | 12 (8,76%) | |
| No | 2.815 (95,98%) | 125 (91,24%) | |
| Cirugía cardíaca previa | 0,285 | ||
| Sí | 62 (1,84%) | 1 (0,66%) | |
| No | 3.307 (98,16%) | 150 (99,34%) | |
| Años de experiencia del cirujano | 0,216 | ||
| >20años | 806 (23,92%) | 28 (1,54%) | |
| 10-20 años | 1.050 (31,17%) | 58 (38,41%) | |
| >10 años | 1.299 (38,56%) | 57 (37,75%) | |
| Residente | 214 (6,35%) | 8 (5,30%) | |
| Experiencia VATS del cirujano | 0,022 | ||
| >100 casos | 950 (28,20%) | 31 (20,53%) | |
| 50-100 casos | 962 (28,55%) | 53 (35,10%) | |
| >50 casos | 1.373 (40,75%) | 59 (39,07%) | |
| No experiencia | 84 (2,49%) | 8 (5,30%) | |
| Localización | 0,009 | ||
| Central | 1.130 (38,51%) | 68 (49,64%) | |
| Periférico | 1.804 (61,49%) | 69 (50,36%) | |
| Afectación ganglionar (TAC) | 0,034 | ||
| cN0 | 2.405 (82,03%) | 101 (73,72%) | |
| cN1 | 217 (7,40%) | 13 (9,49%) | |
| cN2 | 292 (9,96%) | 23 (16,79%) | |
| cN3 | 18 (0,61%) | 0 | |
| Neoadyuvancia | 0,919 | ||
| Sí | 250 (8,51%) | 12 (8,76%) | |
| No | 2.687 (91,49%) | 125 (91,24%) | |
| Diagnóstico | 0,433 | ||
| Carcinoma broncogénico | 2.937 (87,18%) | 137 (90,73%) | |
| Metástasis pulmonar | 236 (7,01%) | 8 (5,30%) | |
| Otros | 196 (5,82%) | 6 (3,97%) | |
| Segmentos funcionantes resecados | <0,001 | ||
| 0 | 56 (1,66%) | 6 (3,97%) | |
| 1-3 | 1.568 (46,57%) | 64 (42,38%) | |
| 4-5 | 1.529 (45,41%) | 55 (36,42%) | |
| ≥6 | 214 (6,36%) | 26 (17,22%) | |
| Neumonectomía derecha | <0,001 | ||
| Sí | 71 (2,11%) | 19 (12,58%) | |
| No | 3.298 (98,89%) | 132 (87,42%) | |
ACVA: accidente cerebrovascular agudo; ASA: American Society of Anesthesiology Physical Score; cN1: presencia de adenopatías patológicas hiliares o intrapulmonares por prueba de imagen; cN2: presencia de adenopatías patológicas mediastínicas ipsilaterales por prueba de imagen; cN3: presencia de adenopatías mediastínicas contralaterales o supraclaviculares ipsilaterales por prueba de imagen; DLCOppo: valor predicho postoperatorio de la DLCO. Se calcula automáticamente en la base de datos a partir del número de segmentos funcionantes resecados; FEV1ppo: valor predicho postoperatorio del FEV1. Se calcula automáticamente en la base de datos en función del número de segmentos funcionantes resecados; IMC: índice de masa corporal; mMRC: escala de disnea modificada del Medical Research Council; Qmáxppo: valor del consumo máximo de O2 predicho postoperatorio. Se calcula automáticamente en la base de datos a partir del número de segmentos funcionantes resecados; VATS: cirugía videotoracoscópica.
La albúmina demostró asociación estadística en el análisis univariante, pero debido a la alta proporción de valores perdidos (53%), y que no se puede asumir un patrón de pérdida de datos al azar (missing at random), se eliminó del análisis definitivo.
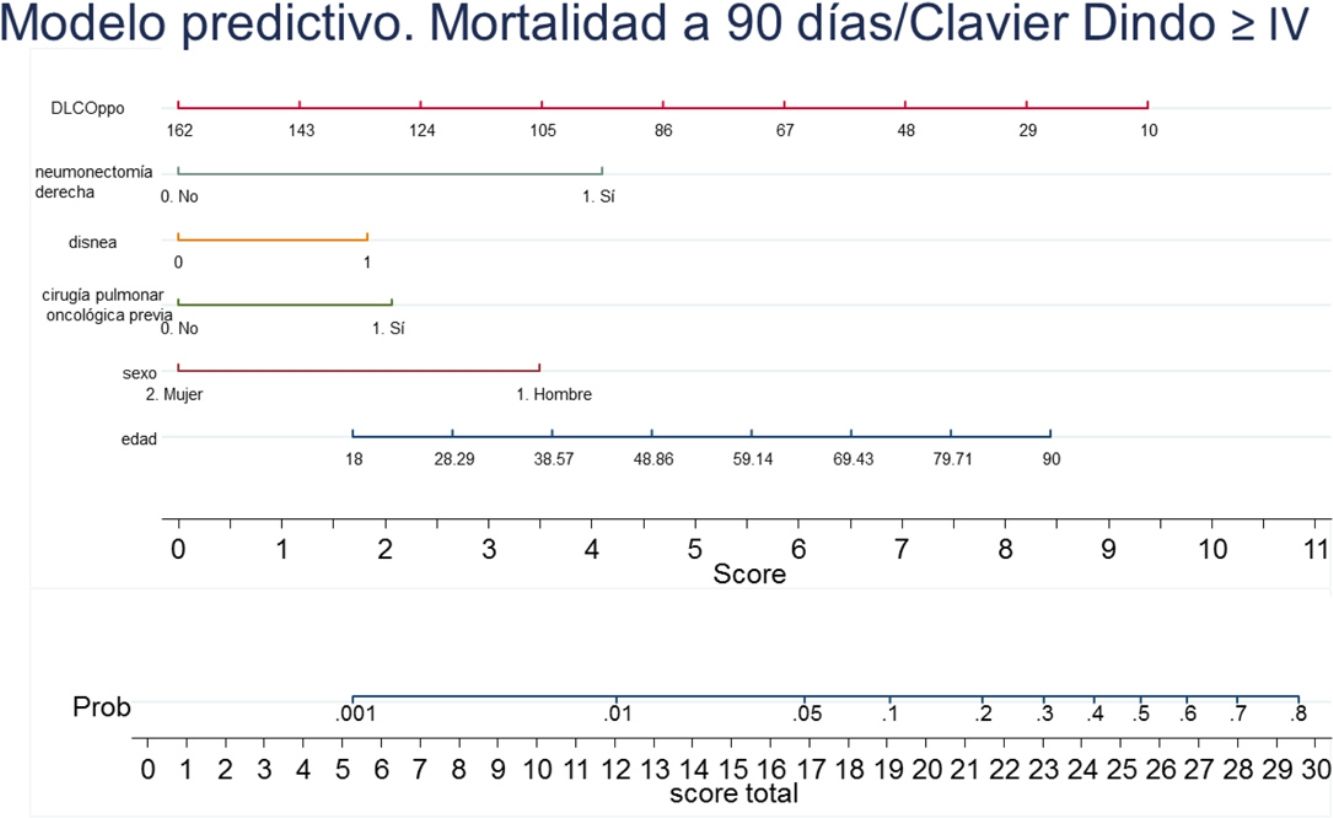
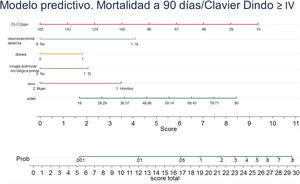
En el análisis de regresión logística multivariable, además de las variables que han demostrado significación estadística, se añadió la presencia de diabetes mellitus, al ser un factor que se asocia a un incremento en la morbimortalidad quirúrgica en algunas series23–25. Las variables insuficiencia hepática moderada-severa y el consumo de alcohol, aunque estadísticamente demostraron una fuerte asociación, se retiraron del análisis final porque no existía un valor concreto de consumo de alcohol ni definición sobre el diagnóstico o grado de severidad de la insuficiencia hepática en la base de datos que permitiera clasificar de forma objetiva a los pacientes. El modelo máximo se formó con edad, sexo, hábito tabáquico, hipertensión arterial, cardiopatía isquémica, diabetes mellitus, cirugía pulmonar oncológica previa, grado de disnea, ASA, tamaño tumoral, neumonectomía derecha, FEV1ppo, DLCOppo y experiencia quirúrgica videotoracoscópica del cirujano. Tras aplicar la estrategia de modelización hacia atrás se quedaron en el modelo final edad, sexo, cirugía pulmonar oncológica previa, disnea, neumonectomía derecha y DLCOppo (tabla 4).
Análisis multivariable
| OR (IC 95%) | p-valor | |
|---|---|---|
| Edad | 1,03 (1,00-1,05) | 0,007 |
| Sexo (femenino) | 0,30 (0,16-0,57) | <0,001 |
| Cáncer de pulmón previo | 2,02 (1,00-4,10) | 0,049 |
| Disnea mMRC | 1,87 (1,26-2,77) | 0,002 |
| Neumonectomía derecha | 4,06 (2,05-8,03) | <0,001 |
| DLCOppo | 0,98 (0,01-0,39) | 0,004 |
DLCOppo: valor predicho postoperatorio de la DLCO. Se calcula automáticamente en la base de datos a partir del número de segmentos funcionantes resecados; mMRC: escala de disnea modificada del Medical Research Council.
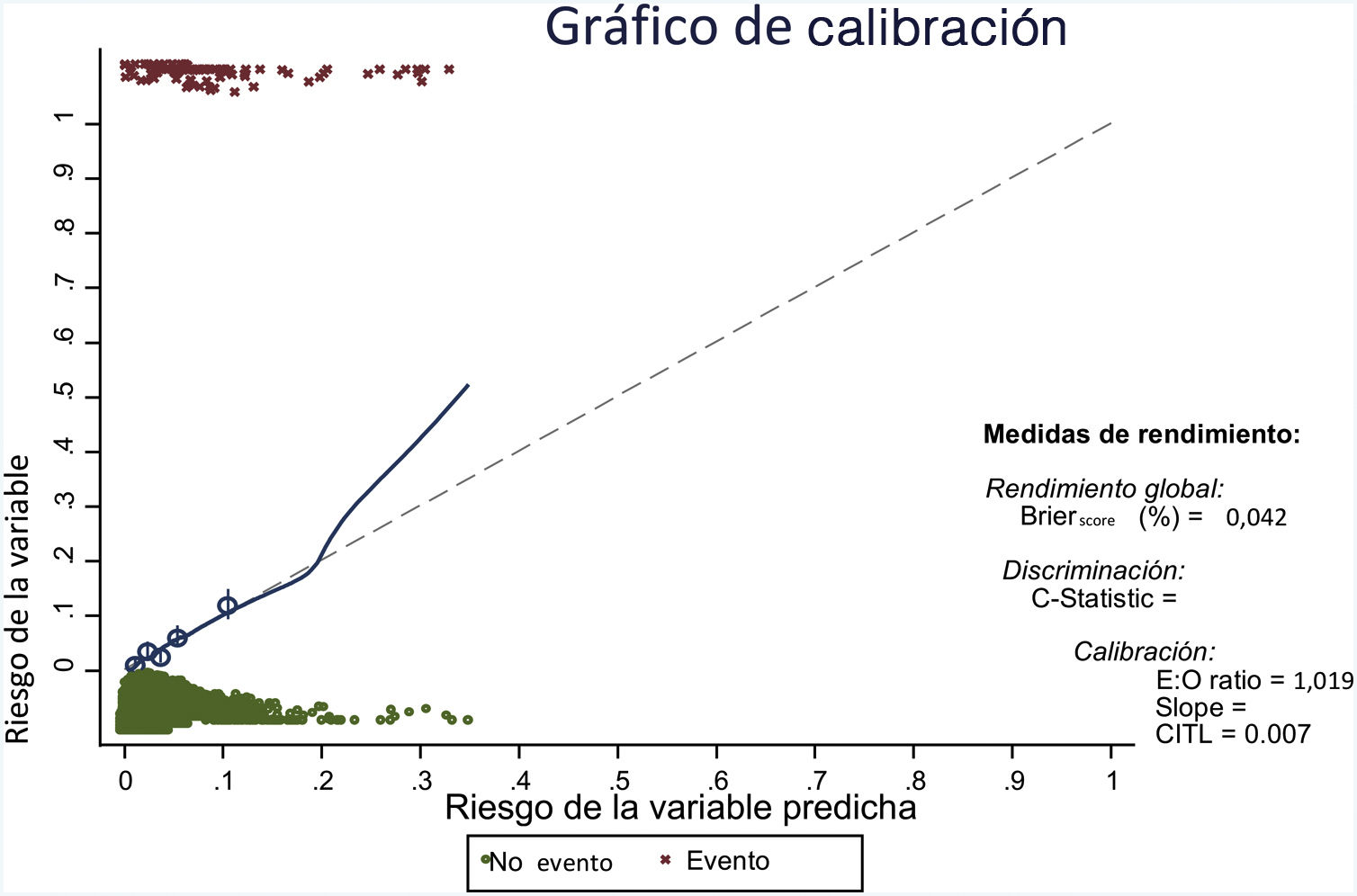
Se han obtenido 100 submuestras por técnicas de remuestreo bootstrap, repitiendo en cada una de ellas la estrategia de modelización. Los parámetros sobre rendimiento del modelo, ajustados por bootstrap, se recogen en la tabla 5, mostrando unos buenos resultados tanto en rendimiento como en calibración (fig. 2) y discriminación.
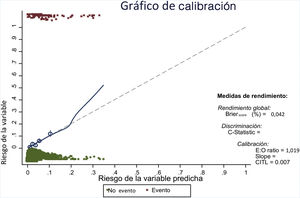
Gráfico de calibración.
E:O ratio: relación entre el número de casos pronosticados y el número de casos observados; CITL: calibration in the large.
En el gráfico la calibración ideal se muestra en la línea punteada y el ajuste entre riesgo esperado y observado en la línea continua. La línea ajusta bien en la mayor parte de los quintiles (mostrados por los círculos), y solo se desvía cuando hay un número pequeño de observaciones (a partir de un riesgo predicho del 20%).
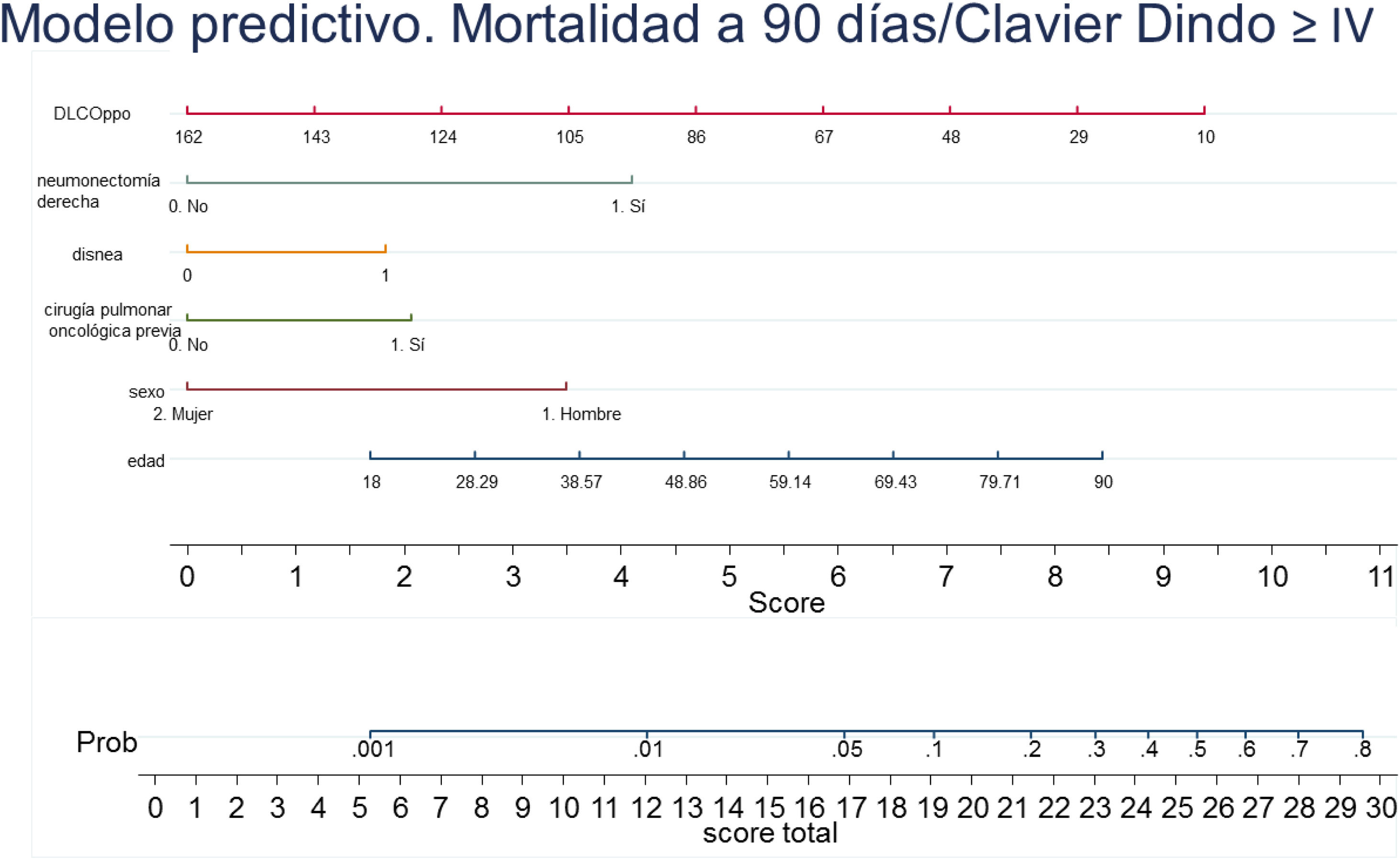
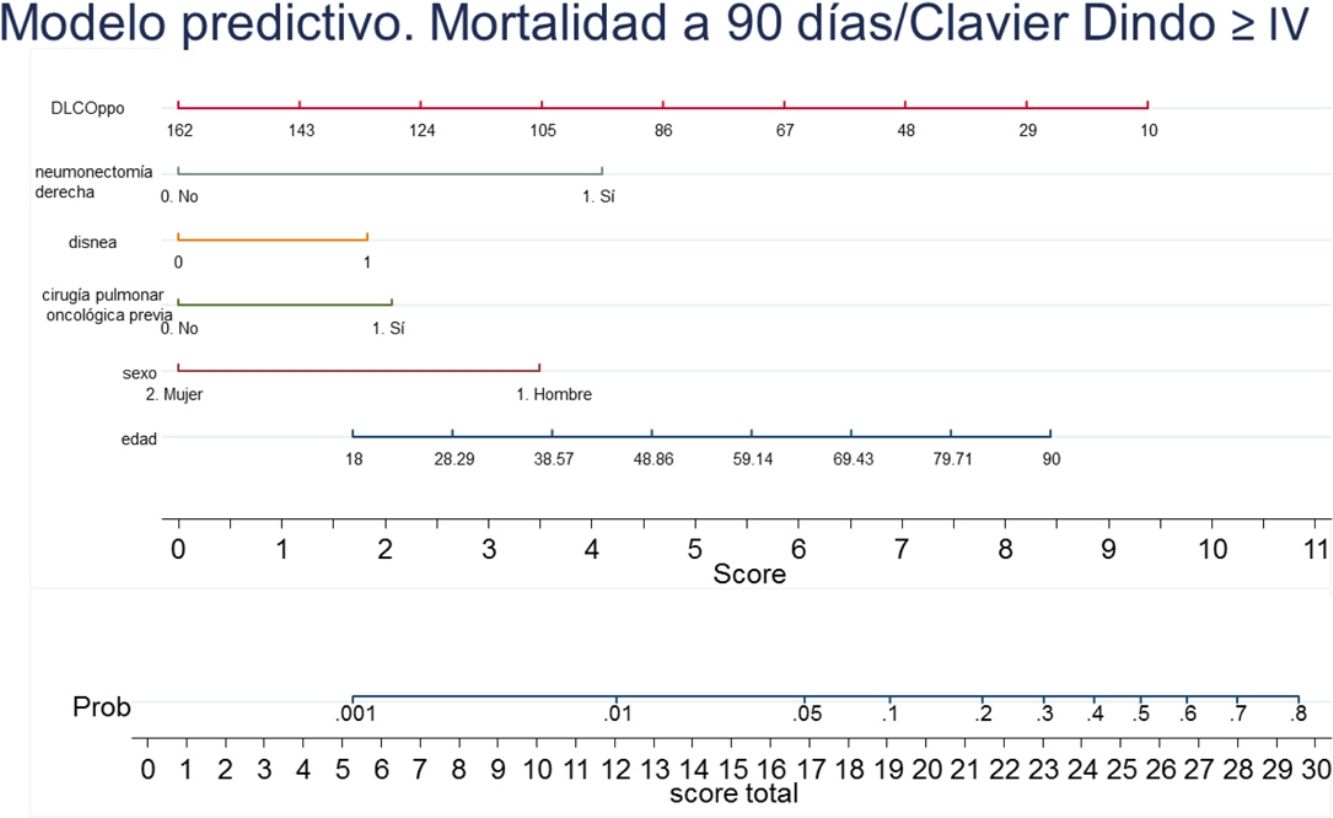
Con los resultados del análisis de regresión logística final se elaboró un nomograma, en el que se muestra gráficamente el peso que tiene cada variable. Sumando los puntos correspondientes a cada una de las variables del modelo final se obtiene una puntuación total, y con ella, una probabilidad predicha de sufrir el evento muerte o complicación Clavien Dindo≥IV a 90 días (fig. 3). Por ejemplo, un paciente varón (3,5 puntos) de 78 años (7 puntos) con disnea de moderados esfuerzos (2 puntos), sometido a una resección pulmonar por un adenocarcinoma previamente (2 puntos), que tiene una DLCOppo del 50% (6,5 puntos), al que se le plantea una resección anatómica, obtiene un valor total de 22, lo que corresponde un riesgo a 90 días de mortalidad postoperatoria o complicaciones importantes de en torno al 20%. El mismo paciente con una DLCO del 100% reduce su riesgo al 10%, y si además se trata de la primera resección pulmonar al 5%.
DiscusiónDisponer de una herramienta que permita anticipar qué pacientes pueden desarrollar complicaciones relevantes después de una intervención quirúrgica es fundamental a la hora de tomar decisiones en cuanto al mejor tratamiento disponible en cada situación, así como para poder establecer comparaciones entre las distintas unidades que prestan un servicio, en este caso, resecciones pulmonares anatómicas.
Los resultados en cuanto morbimortalidad de nuestra serie son superponibles a los de otras grandes series publicadas2,10,12. Sin embargo, llama la atención que mientras se estima que aproximadamente el 15% de los pacientes que precisan una resección anatómica se operan por cirugía mínimamente invasiva (CMI), en nuestra serie el porcentaje de pacientes que se intervienen por cirugía videotoracoscópica es ostensiblemente mayor (54,26%). Esto traduce una implantación de las técnicas de cirugía mínimamente invasiva más rápida respecto a países de nuestro entorno, y posiblemente también un elevado porcentaje de procedimientos realizados por especialistas en cirugía torácica.
Se conocen determinados parámetros funcionales y comorbilidades que se asocian a un incremento en el riesgo perioperatorio en pacientes sometidos a resecciones pulmonares, y se han diseñado diversos modelos predictores de morbimortalidad, principalmente basadas en bases de datos nacionales1,2,10,11. Sin embargo, ninguno de ellos se emplea de forma universal.
Esta escasa aplicabilidad se explica por varios motivos. En ocasiones, las características genéticas y sociosanitarias no son asimilables de una población a otra. Así, por ejemplo, Thoracoscore —un modelo de riesgo quirúrgico desarrollado con una base de datos francesa— no tiene un buen rendimiento aplicado en población norteamericana. Por otro lado, muchos de estos modelos son complejos de utilizar en el día a día y emplean variables que no están disponibles en el momento de informar al paciente desde la consulta (resecciones ampliadas, tipo de abordaje y estadio patológico).
En nuestro caso pretendemos predecir el riesgo quirúrgico de un paciente con las variables a nuestro alcance en la consulta. No es infrecuente que los hallazgos preoperatorios, o incluso el criterio del cirujano, sobreestimen la complejidad de la intervención a realizar. Además, en muchas publicaciones se incluyen como cirugías ampliadas intervenciones que no entrañan necesariamente una mayor dificultad técnica (p. ej. neumonectomía intrapericárdica, resección parcial de diafragma, de pared torácica, de pericardio, etc.)10,12.
La edad y el sexo son variables que persistentemente se asocian a un incremento del riesgo quirúrgico. De la misma forma, el grado de disnea de un paciente orienta sobre su situación cardiorrespiratoria, y en numerosos estudios ha demostrado tener un impacto pronóstico en pacientes con enfermedad respiratoria2,10,12.
Entre las recomendaciones actuales para un estudio completo sobre la operabilidad de un paciente que se va a someter a una resección anatómica pulmonar, el cálculo del valor de la DLCO predicha postoperatoria (DLCOppo) se acepta como el indicador más fiable de la reserva funcional del paciente, incluso por encima del FEV126. Sin embargo, en los modelos disponibles hasta la fecha no se incluye DLCOppo, fundamentalmente porque no se pide de forma extensiva. En nuestro caso FEV1 no es un factor predictor, pero DLCOppo sí, en consonancia con la evidencia científica disponible.
La neumonectomía derecha constituye de forma recurrente en las distintas series un factor pronóstico negativo27; en este trabajo se confirma su impacto en la morbimortalidad de los pacientes.
Es interesante destacar el valor predictivo de tener un antecedente de cáncer de pulmón previo. Esta variable no se recoge en ninguno de los modelos descritos hasta ahora, exceptuando la última revisión del Epithor6. Se estima que alrededor del 6% de los pacientes que se operan por cáncer de pulmón desarrollarán un segundo primario pulmonar, y cada vez es más frecuente que, como resultado de las TAC de cribado, se detecten lesiones susceptibles de abordaje quirúrgico en sus fases más precoces, permitiendo resecciones anatómicas más conservadoras, incluso en más de una ocasión. Establecer el riesgo añadido de una segunda intervención en un determinado paciente puede ayudar en muchos casos a tomar la decisión entre un abordaje quirúrgico u otras opciones terapéuticas.
Los parámetros de fiabilidad del modelo que hemos obtenido son aceptables, sobre todo en valores pequeños. Para valores más altos de riesgo el modelo tiende a sobreestimar, probablemente debido a que el número de eventos es reducido en comparación con la cantidad de variables predictoras incluidas en el modelo.
Este estudio presenta algunas limitaciones:
- -
En primer lugar se trata de una base de datos voluntaria. Ello puede ocasionar un sesgo de selección relevante. Sin embargo, cabe destacar que se excluyeron los pacientes procedentes de centros con bajas tasas de reclutamiento (la mediana de reclutamiento global fue del 99% (p25-p75: 76-100%), y se llevó a cabo una auditoría interna de la calidad de los datos (el grado de concordancia fue del 98%)15.
- -
Los niveles de albúmina en sangre, que en varios estudios ha demostrado un impacto pronóstico en pacientes sometidos a cirugía, no pudo ser analizado debido al elevado porcentaje de pacientes sin ese dato. Otras variables también interesantes a la hora de valorar el riesgo quirúrgico de un paciente, como la presencia de enfermedad hepática avanzada o el consumo de alcohol se recogían en la base de datos, pero sin una definición clara, por lo que también se descartaron a la hora de procesar los datos.
- -
Hemos incluido en el análisis a todos los pacientes sometidos a una resección anatómica pulmonar, independientemente de su diagnóstico. La mayoría de las series incluyen solo a pacientes con diagnóstico de cáncer de pulmón sin tener en consideración el tipo de resección pulmonar realizada6,12. Es innegable que el diagnóstico tiene implicaciones pronósticas para el paciente, pero parece lógico pensar que en el postoperatorio inmediato la aparición de complicaciones estará más relacionada con el tipo de resección que se lleve a cabo y por la situación clínica del paciente (operabilidad). Por otro lado, el patrón oro en el tratamiento quirúrgico del cáncer de pulmón es la lobectomía pulmonar, y en casos muy concretos la resección sublobar anatómica. En nuestra opinión la muestra GEVATS es más representativa de pacientes candidatos a tratamiento quirúrgico con intención curativa por cualquier diagnóstico que otras series más amplias.
Podemos concluir que el modelo predictivo de riesgo obtenido a partir de esta base de datos es un modelo sencillo, fiable y constituye una herramienta muy útil a la hora de clasificar a los pacientes que se van a someter a una resección pulmonar anatómica, facilitando la toma de decisiones por parte del propio paciente sobre su tratamiento.
FinanciaciónLos costes relacionados con el desarrollo y mantenimiento de la base de datos GEVATS han sido cubiertos por Ethicon, Johnson & Johnson. Los autores han tenido absoluta libertad y control en todos los aspectos relacionados con el diseño, metodología, análisis y redacción del trabajo.
GEVATS ha recibido una beca de investigación de la Sociedad Española de Cirugía Torácica en 2015.
Conflicto de interesesLos autores no tienen ningún conflicto de intereses que declarar.
Agradecemos a Johnson & Johnson su colaboración en el desarrollo de la base de datos GEVATS. También agradecemos a todo el personal responsable de documentación clínica de los centros participantes su colaboración en la auditoría del trabajo.