Entra por la puerta de la consulta con dificultad, sudoroso, “disneico” y “soplando, más que respirando”. No puede decir buenos días. En realidad no puede decir nada en ese momento. Se sienta y al cabo de 1–2min empieza la conversación con su médico. Es un paciente con enfermedad pulmonar obstructiva crónica (EPOC) en fase avanzada. Acaba de presentar un episodio de disnea de esfuerzo que podríamos equiparar a la angina de pecho de pacientes con insuficiencia coronaria, o al dolor de piernas en la claudicación intermitente. Los tres procesos tienen en común el estar asociados al tabaquismo, ser desencadenados por el esfuerzo y ceder con el reposo sin necesidad de medicación.
El editorial“Disnea” es la segunda palabra (la primera es “dolor”) que más búsquedas genera en PubMed y en Google Scholar. En el buscador de ArchivosdeBronconeumología hay 440 referencias de artículos que han tratado de alguna manera este tema, incluidos varios artículos especiales1,2. En esta ocasión el objetivo del presente editorial es revisar brevemente las ideas más prevalentes sobre los mecanismos implicados en la génesis de la disnea en pacientes con EPOC, así como plantear un modelo de integración patología-fisiología que facilite al clínico la comprensión del problema y su enfoque terapéutico.
El síntomaLa definición más aceptada de disnea es la de una “sensación incómoda de respirar”. En pacientes con EPOC, su intensidad determina de forma muy estrecha la calidad de vida de los pacientes y sus actividades en la vida diaria. Además, precipita la aparición de exacerbaciones y finalmente es un determinante independiente de la mortalidad3. Está claro que la presencia y la intensidad de la disnea y limitación al ejercicio en la EPOC tienen un origen multifactorial, y hay excelentes revisiones para el lector interesado4,5.
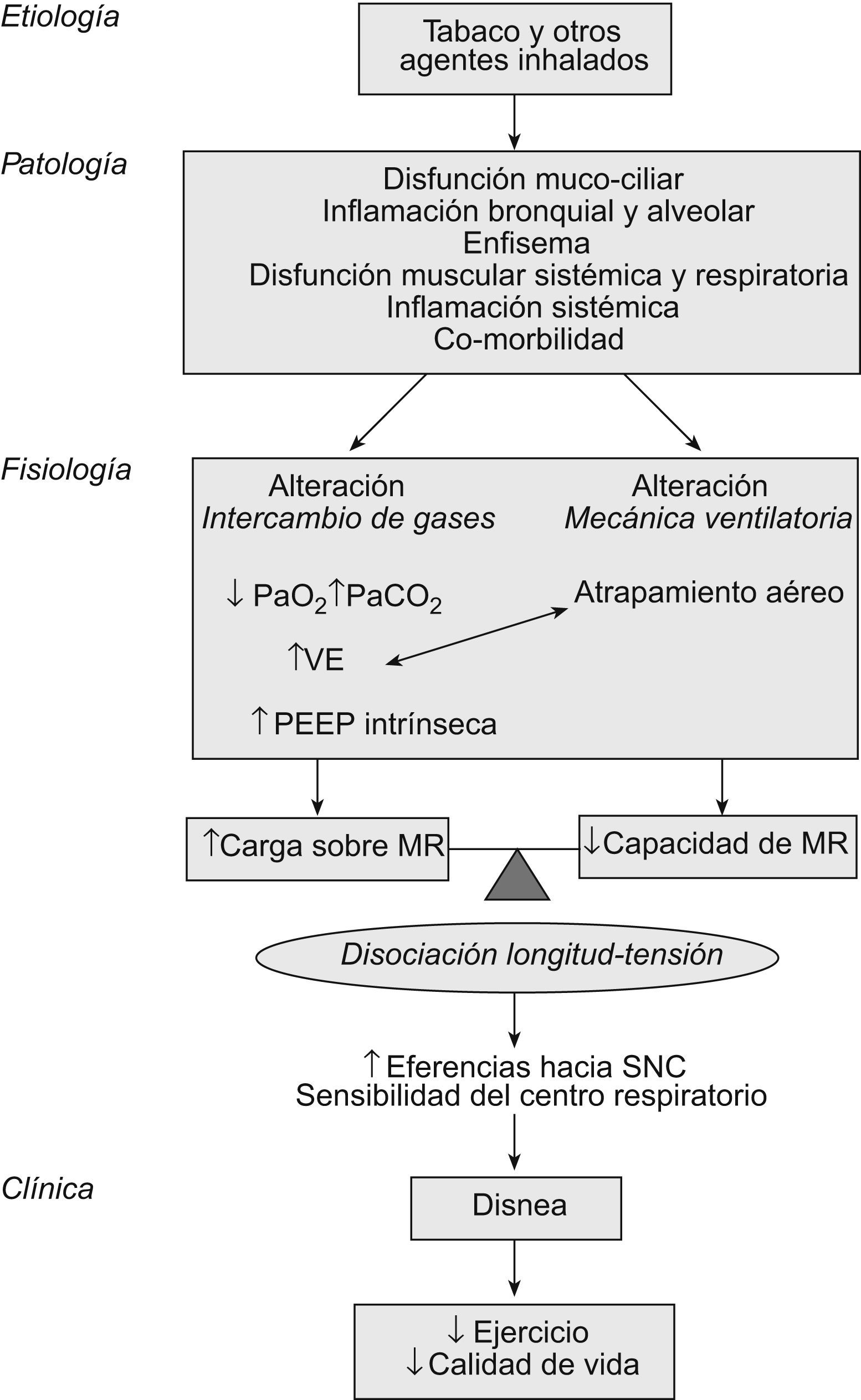
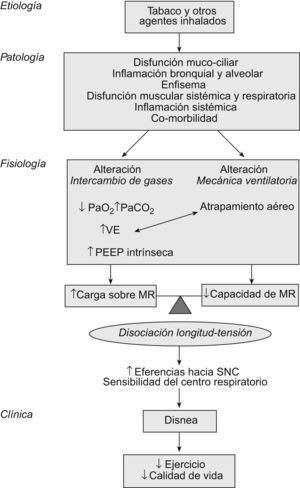
Etiología y patologíaLa inhalación de agentes nocivos ambientales, y especialmente el humo del tabaco, estimula un proceso de daño pulmonar y de vías aéreas, disfunción mucociliar e inflamación local y sistémica. En personas “predispuestas” se mantiene un estado inflamatorio y probablemente se desencadenan fenómenos autoinmunitarios que perpetúan y aceleran las alteraciones morfológicas de todo el aparato respiratorio6,7. La enfermedad, que inicialmente pudiera estar circunscrita al pulmón, se extiende y acaba teniendo compromiso multiorgánico. En este sentido, hace tiempo que Killian et al8 demostraron que la tolerancia al ejercicio en pacientes con EPOC no sólo está limitada por la disnea, sino también por las molestias en las piernas. Subsiguientes estudios morfológicos han encontrado anomalías moleculares y celulares en los músculos esqueléticos. Específicamente, se ha demostrado un exceso de producción de sustancias reactivas de oxígeno y bloqueo del transporte de electrones en las mitocondrias tanto de músculos respiratorios como periféricos9,10. Por esto, la capacidad aeróbica de los músculos esqueléticos de los pacientes con EPOC está reducida y la producción de ácido láctico es excesiva; en consecuencia, la ventilación está aumentada y el trabajo de la respiración es mayor (fig. 1).
Modelo fisiopatológico de la disnea y limitación en la capacidad de ejercicio en la EPOC. MR: músculos respiratorios; PaCO2: presión arterial de anhídrido carbónico; PaO2: presión arterial de oxígeno; PEEP: presión teleespiratoria positiva; SNC: sistema nervioso central; VE: ventilación minuto.
La limitación al flujo aéreo define la EPOC. En mayor o menor grado, tanto el aumento de las resistencias de la vía aérea (por los cambios patológicos “obstructivos”) como la pérdida de presión de retracción elástica (por la destrucción elastolítica del parénquima) son los responsables de la obstrucción. Como consecuencia, el vaciado pulmonar durante la espiración se enlentece. Si la frecuencia respiratoria aumenta, como sucede durante el ejercicio o las exacerbaciones, el tiempo de la espiración se reducirá y quedará “aire atrapado” en los alvéolos al final de la espiración: hiperinsuflación dinámica (HD)11. Al ir aumentando la capacidad residual funcional, la capacidad inspiratoria se reduce, la caja torácica se deforma (hacia un tórax en tonel), los músculos inspiratorios alteran su geometría y sus sarcómeros se acortan. Como la tensión que un músculo es capaz de desarrollar depende de su longitud inicial, la hiperinsuflación reduce la capacidad de generar fuerza muscular al acortar la longitud de los músculos inspiratorios en reposo. Por otra parte, el diafragma se hace más plano (mayor radio) y, de acuerdo con la ley de Laplace, es capaz de desarrollar menos tensión. El resultado final del proceso es un aumento de la carga de los músculos inspiratorios y menor capacidad de realizar trabajo.
El papel de los músculos espiratorios en el compromiso ventilatorio de la EPOC ha sido mucho menos estudiado. Lejos quedan los trabajos del grupo de Jere Mead que demostraron la existencia de reclutamiento de estos músculos durante el ejercicio en pacientes con EPOC grave12. Posteriormente se demostró que el exceso de actividad de los músculos espiratorios no sólo no contribuye a aumentar el flujo aéreo, sino que además genera compresión dinámica de las vías aéreas, presión teleespiratoria positiva y aumento adicional de la HD. Recientemente, en pacientes con EPOC grave se ha demostrado que incluso en reposo los músculos de la prensa abdominal están activos durante la espiración, y que frecuentemente presentan disfunción que reduce su fuerza y resistencia13. Continuando esta línea de trabajo, se describen en el presente número de ArchivosdeBronconeumología14 cómo este tipo de pacientes muestra una reducción de la resistencia de los músculos espiratorios al ejercicio. Este déficit se asocia con un mayor desarrollo de HD y disnea durante el esfuerzo y una peor calidad de vida. Los pacientes estudiados por los autores son un subgrupo muy específico. Se ha excluido a personas de bajo peso, con otras comorbilidades asociadas y con respuesta positiva a broncodilatadores inhalados. Pese a que los resultados de este estudio no puedan generalizarse, los hallazgos son relevantes y apoyan la idea de introducir programas específicos de entrenamiento de músculos espiratorios en el contexto de la rehabilitación respiratoria.
La desproporción entre la capacidad de los músculos de generar trabajo y la carga que sobre ellos se genera (simplificando: desproporción longitud-tensión) es transmitida al sistema nervioso central, que a su vez aumenta el impulso respiratorio nervioso hacia el tórax. Esta descarga central puede medirse mediante electromiografía de los músculos respiratorios y específicamente del diafragma. El impulso respiratorio nervioso es mayor en pacientes con EPOC respecto a personas sanas y se relaciona con una mayor intensidad de la obstrucción y de la HD.
ClínicaEl proceso por el cual el paciente percibe un determinado grado de disnea en las actividades de su vida diaria está lejos de entenderse por completo. En todo caso, según el esquema de la figura 1, y al menos en los pacientes con EPOC, la disnea vendría a explicarse por un conjunto de alteraciones de la función respiratoria, que incluyen la obstrucción al flujo aéreo, la hiperinsuflación pulmonar y la disfunción mecánica y biológica de los músculos. La sensación de respiración trabajosa refrena al paciente a la hora de realizar ejercicio o lo obliga a terminarlo antes de lo previsto. El resultado es un desentrenamiento progresivo y pérdida de calidad de vida.
El mensajeEl paciente descrito más arriba es habitual en las consultas de neumología y cada vez será más frecuente, dadas las previsiones sobre la prevalencia de la EPOC en nuestra sociedad. Artículos como el publicado en este número de Archivosde Bronconeumología por Mota et al demuestran que la investigación sobre los mecanismos fisiopatológicos de la EPOC se mantiene muy activa y con resultados provechosos para la práctica clínica. El conocimiento aportado por este y otros estudios recientes debe aplicarse lo antes posible a nuestros pacientes con EPOC grave. La evidencia disponible indica la necesidad de desarrollar unidades asistenciales específicas que tengan como prioridad mejorar en resultados de salud. El diseño de cada intervención deberá necesariamente individualizarse dados los muchos “fenotipos” de EPOC, pero en todo caso el objetivo será común: hacer que nuestros pacientes “respiren mejor”.