El objetivo actual en el tratamiento del asma es conseguir y mantener el control. Este estudio tiene como objetivos estudiar la relación entre el cuestionario ACT (Asthma Control Test) y los niveles de control según Global Initiative for Asthma para establecer los puntos de corte del ACT y evaluar su relación con la función pulmonar y la Fracción exhalada de óxido nítrico (FeNO).
Pacientes y métodosEstudio prospectivo multicéntrico con inclusión de 441 pacientes seguidos en consultas externas de neumología. Se realizó protocolo clínico, FeNO, espirometría forzada y ACT. Se clasificó la enfermedad según los niveles de control de la Global Initiative for Asthma. Se realizó estudio de sensiblidad, especificidad y área bajo la curva (ROC), estimándose los puntos de corte de ACT. Se estudiaron las diferencias entre los parámetros funcionales y FeNO entre los niveles de control.
ResultadosPara el asma controlada el punto de corte obtenido fue ACT≥21 (área bajo la curva 0,791) y para el no controlada fue ≤18 (área bajo la curva 0,774). Encontramos diferencias significativas en niveles de FeNO y función pulmonar entre ACT≥21 y ACT≤18, aunque solo el 26,3% de pacientes con ACT≤18 presentaron un FEV1<80% y el 40% FeNO elevado (≥35 ppb). Encontramos correlación entre FEV1 basal y ACT (r=0,19, p<0,01), así como entre ACT y FeNO (r=−0,16, p<0,01).
ConclusionesLos puntos de corte para el asma controlada serían ACT≥21, para el asma parcialmente controlada ACT=19–20 y para el asma no controlada ACT≤18. Una valoración más completa del control requeriría incluir parámetros funcionales y FeNO.
The current goal of asthma treatment is to achieve and maintain control. This study aimed to explore the relationship between the ACT (Asthma Control Test) questionnaire and the levels of control according to GINA (Global Initiative for Asthma) to establish the cut-off points for the ACT and evaluate its relationship with lung function and fractionated exhaled nitric oxide level (FeNO).
Patients and methodsA multi-centre prospective study including 441 patients followed up in an outpatient Chest Clinic. A clinical protocol was followed, and FeNO, spirometry and ACT performed. Disease was classified according to levels of control using GINA. The study analysed sensitivity, specificity and area under the curve (ROC), and the ACT cut-off points. We studied the differences between the functional parameters and FeNO between levels of control.
ResultsFor controlled asthma the cut-off obtained was ACT≥21 (area under the curve 0.791) and for uncontrolled ≤18 (AUC 0.774). We found significant differences in FeNO levels and pulmonary function among ACT≥21 and ACT≤18, although only 26.3% of patients with ACT≤18 had a FEV1 <80% and 40% higher FeNO (≥35 ppb). We found a correlation between baseline FEV1 and ACT (r=0.19, P<0.01) and between ACT and FeNO (r=−0.16, P<0.01).
ConclusionsThe cut-off points would be, for controlled asthma ACT≥21, partly controlled asthma ACT=19–20 and uncontrolled asthma ACT≤18. A more complete assessment would require including monitoring operating parameters and FeNO.
El asma es una enfermedad inflamatoria crónica de las vías aéreas con múltiples dimensiones y expresiones fenotípicas. Desde hace unos años las guías de tratamiento de la enfermedad han puesto el énfasis en el concepto del control. Según este esquema lo más importante en el manejo de esta enfermedad es conseguir y mantener el mejor control en cada paciente, modificándose el tratamiento según este objetivo. Desde el año 2006 en la Iniciativa Global para el Asma (GINA)1, el término control a efectos prácticos incluye las características clínicas de la enfermedad (síntomas y exacerbaciones), la limitación de actividades y las pruebas de función pulmonar (básicamente el FEV1 y PEF). Según estos datos se han establecido, de forma arbitraria, 3 niveles de control (asma controlada, parcialmente controlada y asma no controlada). Esta clasificación no ha sido validada desde el punto de vista clínico y es establecida por el facultativo en el momento de evaluar al paciente.
Recientemente se han desarrollado cuestionarios autoadministrados, simples, de fácil realización por los pacientes para facilitar la evaluación del grado de control en la clínica habitual. Así en 2004 Nathan et al2 desarrollaron el cuestionario conocido como ACT (Asthma Control Test), consistente en 5 preguntas en relación a la frecuencia de los síntomas asmáticos y uso de medicación de rescate que el paciente ha necesitado en las 4 semanas previas, con puntuaciones que pueden oscilar desde 5 (peor control) a 25 (control total). Este cuestionario ha sido validado de forma reciente al castellano3,4. Se ha estudiado la relación de este cuestionario con los grados de control según GINA u otros criterios fijados en cada estudio, para establecer los puntos de corte del mismo. Así, se han indicado valores de ACT≥20 para el asma controlada4,5, mientras que para el asma no controlada se han sugerido valores de ACT que oscilan desde ≤156,7,≤175, ≤192,3,8,9 o ≤2010. Estos puntos de corte son dependientes, en gran medida de los criterios aplicados para definir el control de la enfermedad, siendo aún escasos los estudios que han aplicado como criterio los niveles de control recogidos en la GINA.
Por otro lado se ha señalado cómo podría ser útil la medida de la fracción de óxido nítrico exhalado (FeNO) como marcador de la inflamación de la vía aérea, dada la correlación positiva que se ha demostrado con el grado de eosinofilia ya sea en sangre11, esputo12, lavado broncoalveolar13 o mucosa bronquial14. Sin embargo solo en los últimos años se ha examinado la relación entre los parámetros clínicos de control, ya sea según los grados de GINA o el ACT y el control de la inflamación, medido por FeNO15–18, existiendo aún escasos estudios que evalúen su posible utilidad en la práctica clínica habitual.
Por tanto, el presente estudio tiene como objetivo evaluar la relación entre la puntuación del ACT y los niveles de control según GINA en un grupo amplio de pacientes seguidos en consultas externas neumológicas, para establecer los distintos puntos de corte del ACT que se correlacionan mejor con esos niveles. Asimismo evaluaremos la relación de estos puntos de corte con la función pulmonar y el grado de inflamación medida por la FeNO.
Pacientes y métodosEstudio prospectivo múlticéntrico, realizado en 4 consultas externas de asma adscritas a servicios de neumología, desde marzo del 2007–marzo del 2009. Este trabajo incluye la visita basal del estudio más amplio de seguimiento a un año «FUSION» que tiene como objetivo principal analizar la evolución del test de ACT, la FeNO, y la reversibilidad del FEV1, su relación con la evolución de la enfermedad y el diseño de un índice de control multidimensional que incluya las 3 variables.
PacientesSe incluyeron a todos los pacientes diagnosticados de asma bronquial, según los criterios clínicos y funcionales establecidos en GINA 20061 y mayores de 12 años de edad. Los pacientes no habían realizado tratamiento con esteroides orales en el mes previo a su inclusión. En concreto en la historia clínica además de los síntomas compatibles con la enfermedad, debían tener antecedentes de reversibilidad en la obstrucción o ser objetivada en la espirometría realizada el día de la inclusión (prueba broncodilatadora con FEV1≥12% y ≥200ml). Podían tener antecedentes de tabaquismo actual o pasado, aunque el consumo acumulado debía ser menor de 10 paquetes año. Tampoco se incluyeron pacientes con asma muy severa, con múltiples agudizaciones o uso frecuente de pautas de esteroides orales. Podían utilizar tratamiento con fluticasona de 200 a 2.000mcg al dia, o dosis equivalente de budesonida, solos o asociados a B2 de larga duración, con/ sin montelukast 10mg cada 24h. No debían presentar antecedentes de otras patologías respiratorias (EPOC, bronquiectasias, patologías intersticiales o tumorales, etc.).
MetodologíaEl médico investigador realizó el día de la inclusión el protocolo inicial, que incluía las variables epidemiológicas y clínicas a estudio. Una vez estudiado en la consulta médica el paciente pasaba al Diplomado de Enfermería para la cumplimentación del ACT, la realización del FeNO, la espirometría forzada y la prueba de sensibilización alérgica si no había sido realizada con anterioridad. En los casos con tratamiento continuado se indicaba suspedieran la última dosis previa a la realización de las pruebas funcionales. La medida de FeNO se realizó por técnica electroquímica (NIOX MINO* aerocrine. Solna, Suecia). El paciente realiza una inspiración profunda desde el interior del equipo a través de un filtro y hasta capacidad pulmonar total. A continuación se realiza una espiración al interior del equipo a un flujo mantenido de 50ml/s, controlado por un sensor lumínico y acústico para facilitar y asegurar el flujo. Este procedimiento, siguiendo las recomendaciones del fabricante, requiere una única determinación y el resultado se expresa en la pantalla digital del equipo. La espirometría forzada se realizó con espirómetros Master Scope PC de Viasys Healthcare, software JLab, Lab. Manager, V 5.3.0, siguiendo las recomendaciones ATS/ERS19. Se efectuó prueba basal y tras 200mcg de salbutamol (postbroncodilatadora). Se expresaron el FEV1 en valores absolutos y % del teórico, así como FEV1/FVC basal y posbroncodilatador.
Se administró el cuestionario de ACT consistente en 5 preguntas en relación a síntomas de asma y utilización de medicación asmática en las 4 semanas previas. El paciente autocumplimenta este cuestionario, señalando en cada casillero de pregunta la respuesta numérica correspondiente a una escala que oscila desde 1 (peor situación)–5 (mejor situación), por lo que el rango de puntuación total oscila de 5–25.
La prueba de sensibilización alérgica se efectuó por la técnica del prick a los alergenos habituales en nuestro medio20. Como control positivo de usó dihidrocloruro de histamina (10mg/ml) y como control negativo, suero salino al 0,9%. La prueba se consideraba positiva si tras 15min el habón resultante era como mínimo 3mm de diámetro o de tamaño igual o mayor que el control positivo. La atopia se definió por la positividad de esta prueba.
Según los resultados de la entrevista clínica y las pruebas funcionales, el paciente fue clasificado en los distintos niveles de gravedad (intermitente, persistente leve, moderada o grave) y se establecíó el grado de control según GINA 20061 (controlada, parcialmente controlada, no controlada). El médico investigador no conoció en esta visita el nivel de FeNO ni la puntuación del ACT.
Se solicitó consentimiento informado por escrito para la inclusión de los datos clínicos en base de datos. En esta base de datos no constó ningún dato personal del pacientes (nombre, dirección, teléfono, historia clinica, etc.) y solo un número clave de referencia, relacionado con su historia clínica en ficha aparte guardada por los investigadores. El estudio fue aprobado por el comité ético de investigación clínica del hospital del investigador principal.
Análisis estadísticosLos datos fueron analizados con el paquete estadístico SPSS v.16. Los datos de las variables cualitativas se presentaron en porcentajes y los de las cuantitativas en medias y desviación típica (DS).
Se establecieron los valores de sensibilidad, especificidad, valores predictivos positivos y negativos, así como el índice de Youden (sensiblidad+especificidad−1), y se realizó el análisis (ROC) estimándose el área bajo la curva para cada punto de corte de ACT en relación al asma controlada o no controlada según GINA. Se establecieron los puntos de corte de ACT para asma controlada y no controlada, según la mejor relación sensibilidad, especificidad y mayor área bajo la curva. Una vez establecidos los puntos de corte de ACT para asma controlada, no controlada y, por eliminación, para parcialmente controlada, estudiamos la relación de estos puntos con los datos de función pulmonar y FeNO, así como estas diferencias para la propia clasificación según GINA.
Para la comparación de los grupos establecidos con niveles de control por ACT o GINA y niveles de FeNO o las variables funcionales se utilizó el test de ANOVA y las pruebas post hoc (comparación 2 a 2). Previamente se comprobó la homogeneidad de la varianza (Test Levene) entre los grupos, y para las variables no homogéneas se utilizó la prueba de igualdad de medias de Welch. Para analizar las diferencias entre los grupos (2 a 2) se ralizaron el Test de Bonferroni o Test de Games-Howell, según fuesen las varianzas homogéneas o no respectivamente. Las correlaciones lineales fueron evaluadas con el coeficiente de Pearson. Se consideraron diferencias significativas a partir de p<0,05.
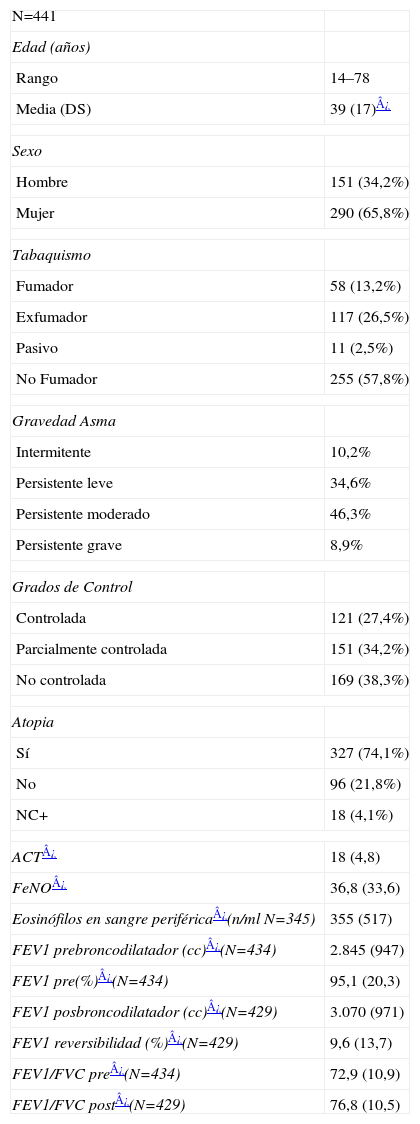
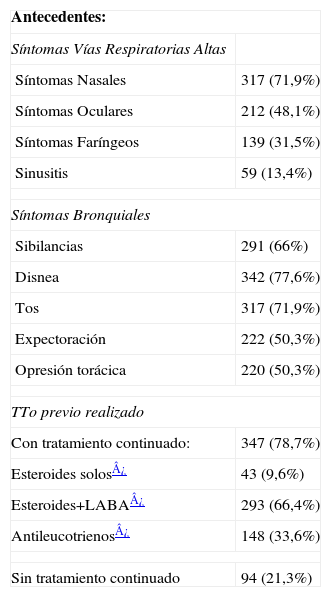
ResultadosDescripción de datos generales de la poblaciónSe incluyeron a 441 pacientes de 14–78 años, edad media 39 (17) y mayoritariamente mujeres (más del 65%). Como se puede observar en la tabla 1, aunque la mayoría eran no fumadores, había una proporción con antecedentes de exposición al tabaco, manteniendo el consumo activo más del 13%. La mayor proporción de pacientes presentaban un asma persistente moderada (46%), con sensibilización alérgica demostrada (atópicos) en más del 74% de los casos. Según los grados de control de GINA había una mayor proporción de pacientes con asma no controlada (38,3%) y en menor medida parcialmente controlada y controlada. El ACT presentó una puntuación media de 18 (4,8) y los niveles de FeNO exhalado 36,8 (33,6). Los valores de FEV1 basales expresados en % respecto al teórico presentaban unos valores medios relativamente elevados, 95,1 (20,3), presentando valores menores del 80% solo un 20% de todos los pacientes incluidos. Sin embargo el % de reversibildad presentó una media de 9,6 (13,7), con amplia variación según el caso, como se objetiva por la desviación estándar. En la tabla 2 se indica la sintomatología predominante y los tratamientos que estaban utilizando los pacientes en el momento de la inclusión. La mayoría de pacientes (78,7%) realizaban tratamiento previo, con una mayor proporción de esteroides+LABA (66,4%).
Características de los pacientes
| N=441 | |
| Edad (años) | |
| Rango | 14–78 |
| Media (DS) | 39 (17)¿ |
| Sexo | |
| Hombre | 151 (34,2%) |
| Mujer | 290 (65,8%) |
| Tabaquismo | |
| Fumador | 58 (13,2%) |
| Exfumador | 117 (26,5%) |
| Pasivo | 11 (2,5%) |
| No Fumador | 255 (57,8%) |
| Gravedad Asma | |
| Intermitente | 10,2% |
| Persistente leve | 34,6% |
| Persistente moderado | 46,3% |
| Persistente grave | 8,9% |
| Grados de Control | |
| Controlada | 121 (27,4%) |
| Parcialmente controlada | 151 (34,2%) |
| No controlada | 169 (38,3%) |
| Atopia | |
| Sí | 327 (74,1%) |
| No | 96 (21,8%) |
| NC+ | 18 (4,1%) |
| ACT¿ | 18 (4,8) |
| FeNO¿ | 36,8 (33,6) |
| Eosinófilos en sangre periférica¿(n/ml N=345) | 355 (517) |
| FEV1 prebroncodilatador (cc)¿(N=434) | 2.845 (947) |
| FEV1 pre(%)¿(N=434) | 95,1 (20,3) |
| FEV1 posbroncodilatador (cc)¿(N=429) | 3.070 (971) |
| FEV1 reversibilidad (%)¿(N=429) | 9,6 (13,7) |
| FEV1/FVC pre¿(N=434) | 72,9 (10,9) |
| FEV1/FVC post¿(N=429) | 76,8 (10,5) |
Sintomatología, tratamiento previo de los pacientes
| Antecedentes: | |
| Síntomas Vías Respiratorias Altas | |
| Síntomas Nasales | 317 (71,9%) |
| Síntomas Oculares | 212 (48,1%) |
| Síntomas Faríngeos | 139 (31,5%) |
| Sinusitis | 59 (13,4%) |
| Síntomas Bronquiales | |
| Sibilancias | 291 (66%) |
| Disnea | 342 (77,6%) |
| Tos | 317 (71,9%) |
| Expectoración | 222 (50,3%) |
| Opresión torácica | 220 (50,3%) |
| TTo previo realizado | |
| Con tratamiento continuado: | 347 (78,7%) |
| Esteroides solos¿ | 43 (9,6%) |
| Esteroides+LABA¿ | 293 (66,4%) |
| Antileucotrienos¿ | 148 (33,6%) |
| Sin tratamiento continuado | 94 (21,3%) |
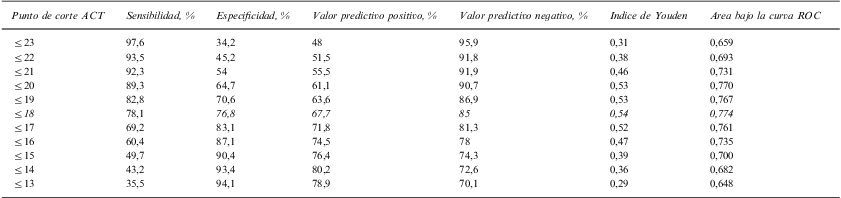
En la tabla 3 se recogen los resultados de sensibilidad, especificidad, valores predictivos y área bajo la curva de los diferentes puntos de corte de ACT para el asma controlada (en relación al asma parcial o no controlada, según GINA). Se presentan desde valores ≥15, dado que los valores para puntos de corte inferiores son muy bajos, por lo que no han sido incluídos. Como se puede apreciar para el asma controlada el punto de corte de ACT ≥21 muestra el mayor índice de Youden (0,58) y mayor área bajo la curva (0,791). El segundo punto de ambos valores más elevados es el 20, aunque con mínimas diferencias a favor del punto de corte indicado. En la tabla 4 se recogen los datos para el asma no controlada (en relación al asma parcialmente controlada y controlada). En este caso se presentan el análisis de puntos de corte a partir de ≤13. El mayor índice de Youden (0,54) y área bajo la curva (0,774) corresponde para el punto de corte de ACT≤18, siendo el segundo punto con valores más elevados el 19. Establecimos así los puntos de corte para asma controlada en ≥21, No controlada en ≤18 y, por eliminación, parcialmente controlada en los puntos 19 y 20.
Puntuaciones del Asma Control Test (ACT), validez de diferentes puntos de corte para clasificación de asma controlada¿
| Punto de corte ACT | Sensibilidad, % | Especificidad, % | Valor predictivo positivo, % | Valor predictivo negativo, % | Indice de Youden | Area bajo la curva ROC |
| 25 | 26,4 | 98,1 | 84,2 | 77,9 | 0,24 | 0,622 |
| ≥24 | 42,1 | 94,7 | 75 | 81,2 | 0,36 | 0,684 |
| ≥23 | 57,9 | 91,6 | 72,2 | 85,2 | 0,48 | 0,747 |
| ≥22 | 71,1 | 85 | 64,2 | 88,6 | 0,56 | 0,780 |
| ≥21 | 78,5 | 79,7 | 59,4 | 90,7 | 0,58 | 0,791 |
| ≥20 | 86 | 71,9 | 53,6 | 93,1 | 0,57 | 0,789 |
| ≥19 | 88,4 | 64,4 | 48,4 | 93,6 | 0,52 | 0,764 |
| ≥18 | 92,6 | 58,1 | 45,5 | 95,4 | 0,50 | 0,753 |
| ≥17 | 92,6 | 48,1 | 40,3 | 94,5 | 0,40 | 0,703 |
| ≥16 | 93,4 | 40,3 | 37,2 | 94,2 | 0,33 | 0,668 |
| ≥15 | 94,2 | 32,2 | 34,4 | 93,6 | 0,26 | 0,632 |
Puntuaciones del Asma Control Test (ACT), validez de diferentes puntos de corte para clasificación de asma no controlada¿
| Punto de corte ACT | Sensibilidad, % | Especificidad, % | Valor predictivo positivo, % | Valor predictivo negativo, % | Indice de Youden | Area bajo la curva ROC |
| ≤23 | 97,6 | 34,2 | 48 | 95,9 | 0,31 | 0,659 |
| ≤22 | 93,5 | 45,2 | 51,5 | 91,8 | 0,38 | 0,693 |
| ≤21 | 92,3 | 54 | 55,5 | 91,9 | 0,46 | 0,731 |
| ≤20 | 89,3 | 64,7 | 61,1 | 90,7 | 0,53 | 0,770 |
| ≤19 | 82,8 | 70,6 | 63,6 | 86,9 | 0,53 | 0,767 |
| ≤18 | 78,1 | 76,8 | 67,7 | 85 | 0,54 | 0,774 |
| ≤17 | 69,2 | 83,1 | 71,8 | 81,3 | 0,52 | 0,761 |
| ≤16 | 60,4 | 87,1 | 74,5 | 78 | 0,47 | 0,735 |
| ≤15 | 49,7 | 90,4 | 76,4 | 74,3 | 0,39 | 0,700 |
| ≤14 | 43,2 | 93,4 | 80,2 | 72,6 | 0,36 | 0,682 |
| ≤13 | 35,5 | 94,1 | 78,9 | 70,1 | 0,29 | 0,648 |
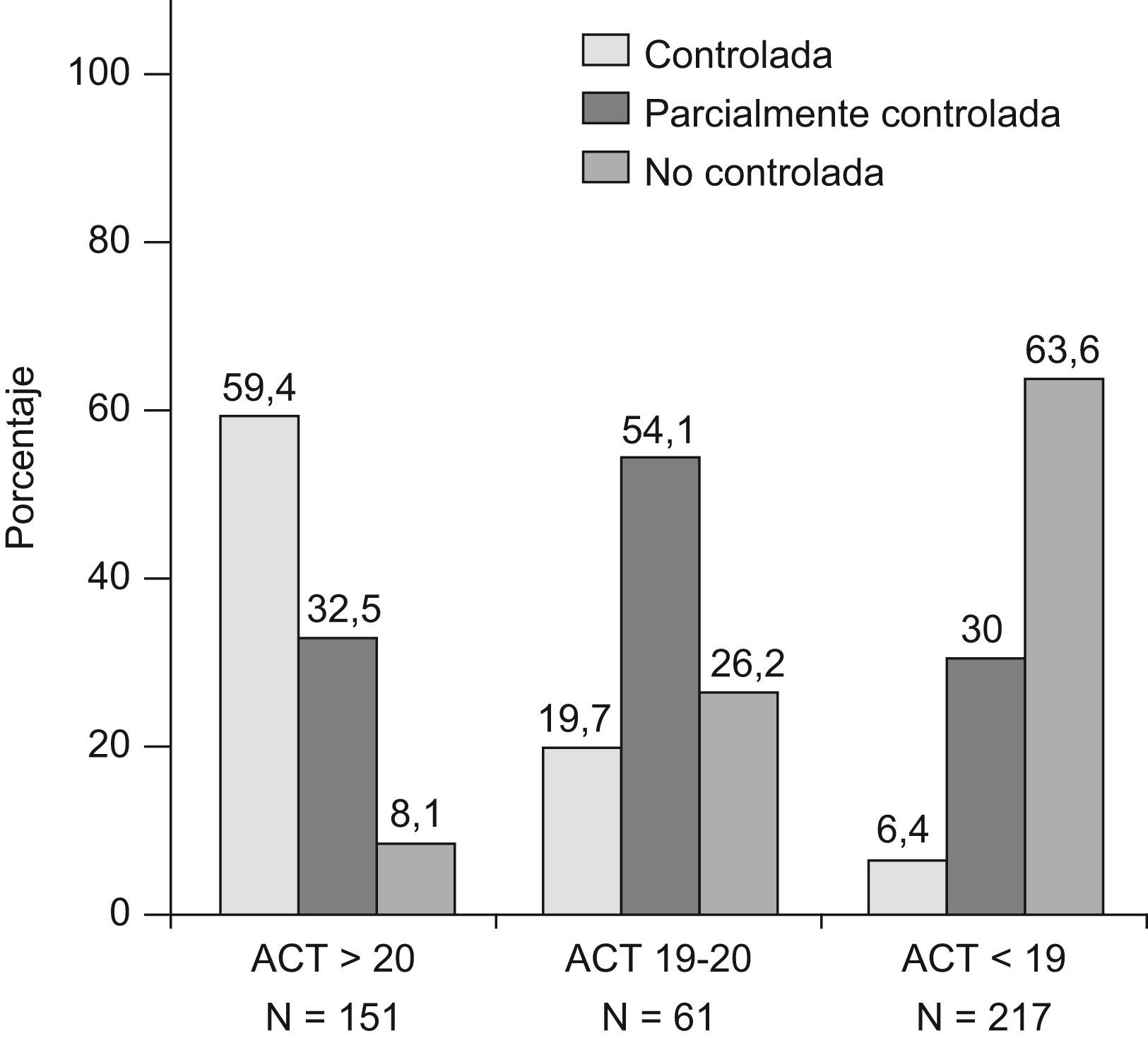
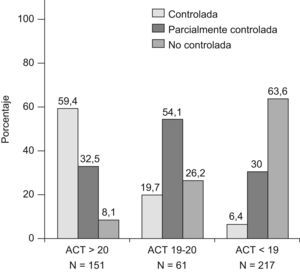
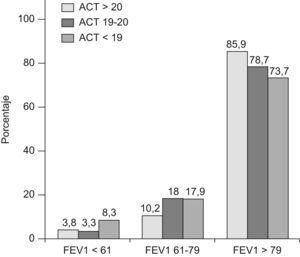
En la figura 1 se incluyen los porcentajes de pacientes en cada grupo de control, según los puntos de corte establecidos en ACT y los grados de control de GINA. La mayoría de pacientes tanto de asma controlada, como parcial o no controlada según GINA, están correctamente clasificados por el nivel de ACT (59,4%, 54,1% o 63,6% respectivamente). Solo el 6,4% de pacientes con asma controlada según GINA presentaron cifras de ACT≤18, mientras que por el contrario algo más del 8% de asma no controlada presentaron valores ≥21.
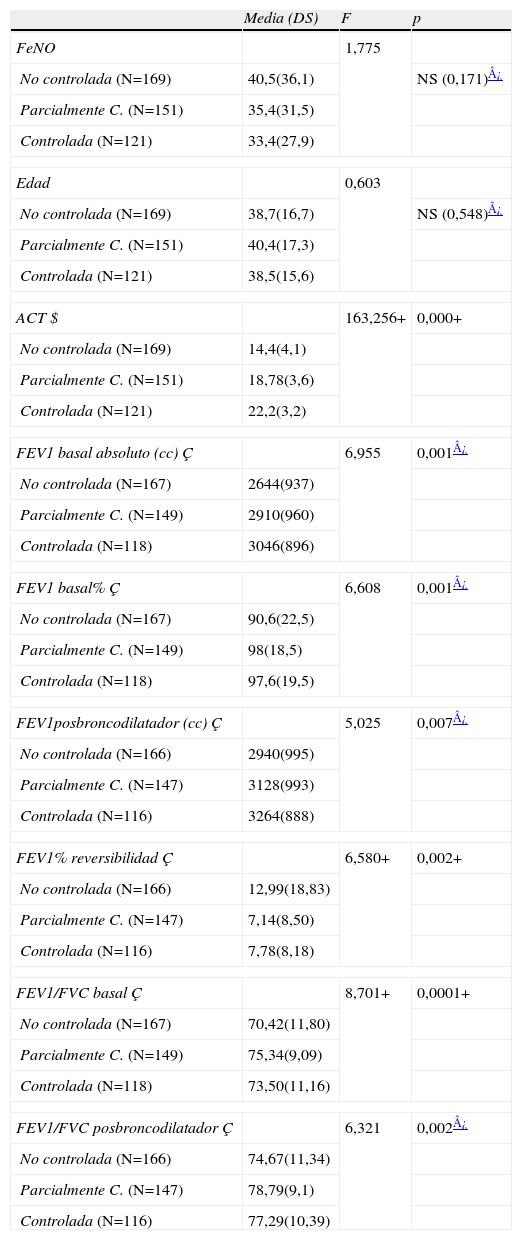
Diferencias en FeNO, datos funcionales entre los niveles de controlEn la tablas 5 y 6 se recogen las diferencias en FeNO, parámetros funcionales según los puntos de corte de ACT establecidos y los niveles de control de GINA. Los puntos de corte de ACT presentan diferencias significativas en medias de FeNO y en la mayoría de parámetros funcionales (FEV1 basal absoluto, % respecto al teórico, posbroncodilatador, % reversibilidad del FEV1) aunque en el análisis post hoc estas diferencias se dan entre los valores de ACT≤18 y ≥21, no existiendo diferencias entre el valor intermedio (19–20) y los anteriores. Por el contrario en los grados de control de GINA encontramos diferencias para los parámetros funcionales evaluados tanto entre el asma no controlada y controlada (excepto para FEV1/FVC basal), como entre el asma no controlada y parcialmente controlada (excepto para FEV1posbroncodilatador). No se encontraron diferencias entre el asma controlada y parcialmente controlada. Tampoco encontramos diferencias significativas en los valores de FeNO entre ningunos de los niveles de control de GINA. La correlación entre FEV1 basal en valores absolutos o % respecto al teórico y ACT fue baja pero significativa en ambos casos (r=0,19 o r=0,14, p<0,01 respectivamente).
Relación de niveles de control establecidos por ACT, según FeNO, edad y parámetros funcionales
| Media (DS) | F | p | |
| FeNO & | 4,749+ | <0,01+ | |
| ACT≤18 (N=220) | 41,1(37,9) | ||
| ACT 19–20 (N=61) | 36,9(28,5) | ||
| ACT≥21 (N=160) | 30,8(27,9) | ||
| Edad | 1,365 | NS (0,256)¿ | |
| ACT≤18 (N=220) | 40,4(16,9) | ||
| ACT 19–20 (N=61) | 36,8(17,5) | ||
| ACT≥21 (N=160) | 38,4(15,7) | ||
| FEV1 basal absoluto (cc) & | 7,848 | 0,0001¿ | |
| ACT≤18 (N=218) | 2686(940) | ||
| ACT 19–20 (N=61) | 2828(925) | ||
| ACT≥21 (N=155) | 3074(924) | ||
| FEV1 basal% & | 3,297 | 0,038¿ | |
| ACT≤18 (N=218) | 92,6(20,7) | ||
| ACT 19–20 (N=61) | 96,6(20,3) | ||
| ACT≥21 (N=155) | 97,9(19,2) | ||
| FEV1posbroncodilatador (cc) & | 6,425 | 0,002¿ | |
| ACT≤18 (N=217) | 2919(979) | ||
| ACT 19–20 (N=61) | 3142(903) | ||
| ACT≥21 (N=151) | 3281(964) | ||
| FEV1% reversibilidad & | 6,538+ | 0,002+ | |
| ACT≤18 (N=217) | 11,06(15,39) | ||
| ACT 19–20 (N=61) | 11,01(17,38) | ||
| ACT≥21 (N=151) | 6,86(8,18) | ||
| FEV1/FVC basal | 1,189 | NS (0,306)¿ | |
| ACT≤18 (N=218) | 72,32(11,03) | ||
| ACT 19–20 (N=61) | 72,42(11,36) | ||
| ACT≥21 (N=155) | 74,04(10,64) | ||
| FEV1/FVC posbroncodilatador | 0,852 | NS (0,427)¿ | |
| ACT≤18 (N=217) | 76,31(10,7) | ||
| ACT 19–20 (N=61) | 76,29(9,4) | ||
| ACT≥21 (N=151) | 77,69(10,49) | ||
Análisis post hoc dos a dos. Test de Bonferroni o Test de Games-Howell según varianzas homógeneas o no respectivamente: &Diferencias significativas entre ACT≤18 y ACT≥21 (todas variables p<0,01, para FEV1 basal% p<0,04). No significativo entre ACT 19–20 y resto de niveles.
Relación de niveles de control establecidos por GINA, según FeNO, edad y parámetros funcionales
| Media (DS) | F | p | |
| FeNO | 1,775 | ||
| No controlada (N=169) | 40,5(36,1) | NS (0,171)¿ | |
| Parcialmente C. (N=151) | 35,4(31,5) | ||
| Controlada (N=121) | 33,4(27,9) | ||
| Edad | 0,603 | ||
| No controlada (N=169) | 38,7(16,7) | NS (0,548)¿ | |
| Parcialmente C. (N=151) | 40,4(17,3) | ||
| Controlada (N=121) | 38,5(15,6) | ||
| ACT $ | 163,256+ | 0,000+ | |
| No controlada (N=169) | 14,4(4,1) | ||
| Parcialmente C. (N=151) | 18,78(3,6) | ||
| Controlada (N=121) | 22,2(3,2) | ||
| FEV1 basal absoluto (cc) Ç | 6,955 | 0,001¿ | |
| No controlada (N=167) | 2644(937) | ||
| Parcialmente C. (N=149) | 2910(960) | ||
| Controlada (N=118) | 3046(896) | ||
| FEV1 basal% Ç | 6,608 | 0,001¿ | |
| No controlada (N=167) | 90,6(22,5) | ||
| Parcialmente C. (N=149) | 98(18,5) | ||
| Controlada (N=118) | 97,6(19,5) | ||
| FEV1posbroncodilatador (cc) Ç | 5,025 | 0,007¿ | |
| No controlada (N=166) | 2940(995) | ||
| Parcialmente C. (N=147) | 3128(993) | ||
| Controlada (N=116) | 3264(888) | ||
| FEV1% reversibilidad Ç | 6,580+ | 0,002+ | |
| No controlada (N=166) | 12,99(18,83) | ||
| Parcialmente C. (N=147) | 7,14(8,50) | ||
| Controlada (N=116) | 7,78(8,18) | ||
| FEV1/FVC basal Ç | 8,701+ | 0,0001+ | |
| No controlada (N=167) | 70,42(11,80) | ||
| Parcialmente C. (N=149) | 75,34(9,09) | ||
| Controlada (N=118) | 73,50(11,16) | ||
| FEV1/FVC posbroncodilatador Ç | 6,321 | 0,002¿ | |
| No controlada (N=166) | 74,67(11,34) | ||
| Parcialmente C. (N=147) | 78,79(9,1) | ||
| Controlada (N=116) | 77,29(10,39) | ||
Análisis post hoc dos a dos. Test de Bonferroni o Test de Games-Howell según varianzas homógeneas o no respectivamente: $: Diferencias significativas entre los tres niveles (p<0,01). Ç: Diferencias significativas entre No controlada y Controlada (p<0,01), excepto FEV1/FVC basal (p<0,07) y entre No controlada y Parcialmente controlada (p<0.01), excepto para FEV1posbroncodilatador (p=0,124). No significativa entre Controlada y Parcialmente controlada.
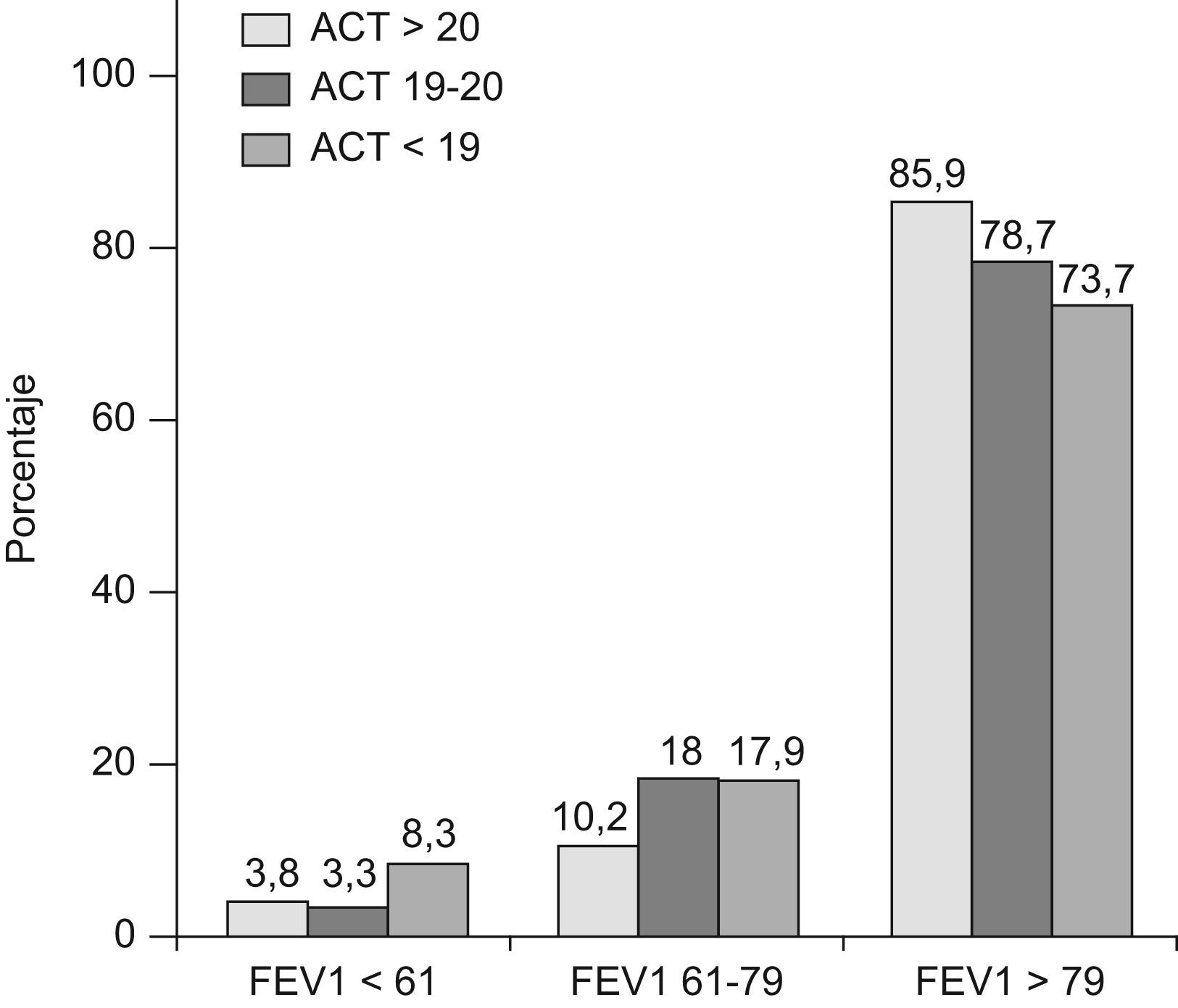
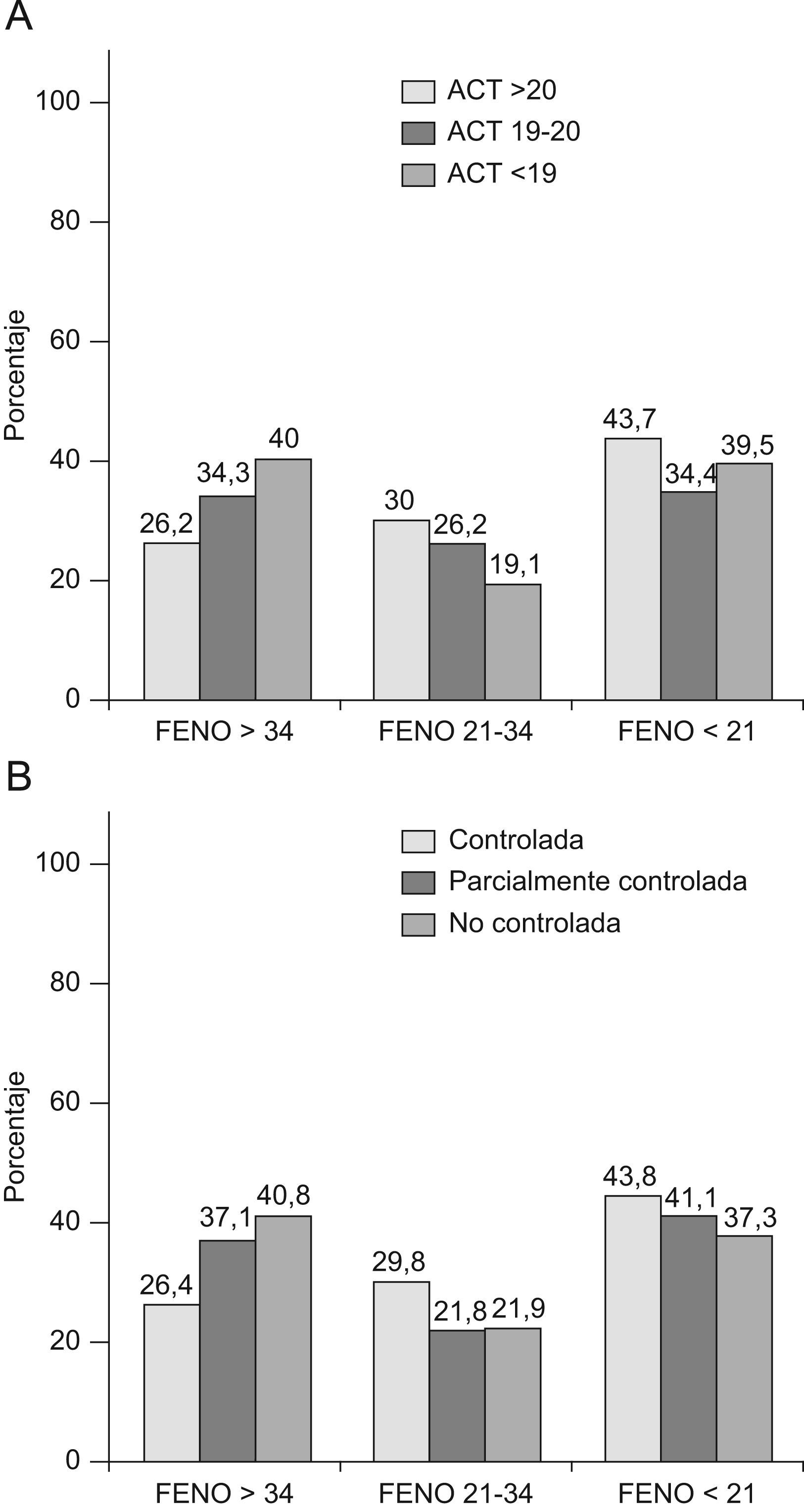
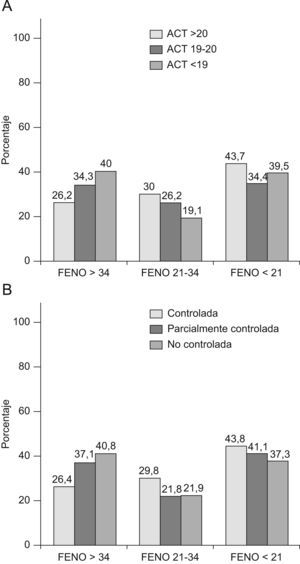
Por último en las figuras 2 y 3 se expresan los porcentajes de pacientes según los niveles de FEV1, FeNO y los niveles de control. La mayoría de pacientes (fig. 2) presentaba un FEV1 ≥80%, con una proporción ligeramente mayor para los pacientes con ACT≥21, aunque con escasas diferencias en relación al resto de niveles de control. Cabe destacar que solo el 26,3% de los pacientes con ACT≤18 (punto de corte de asma no controlada) presentaron un FEV1<80%. En cuanto al FeNO (fig. 3), tanto para los grados de control según ACT como de GINA se encontraron escasas diferencias en el porcentaje de pacientes según los 3 niveles del FeNO incluídos (Feno normal ≤20, medio 21–34, elevado ≥35). Es destacable como solo alrededor del 40% de pacientes con asma no controlada (o ACT≤18) presentaron cifras claramente elevadas de FeNO (≥35), mientras que por el contrario más del 26% de pacientes con asma controlada (o ACT≥21) presentaron estos niveles altos. La correlación entre ACT y FeNO fue significativa pero escasa, r=−0,16, p<0,01).
En el estudio presentado establecemos unos puntos de corte de ACT≥21, 19–20 o ≤18, respectivamente para el asma controlada, parcialmente controlada o no controlada. Es el primer estudio en nuestro medio que establece puntos de corte para los 3 niveles de control establecidos por GINA.
El cuestionario de control ACT ha sido evaluado previamente tanto en consulta de atención especializada2 como atención primaria8 y ha sido validado en lengua castellana3,4. Ha mostrado una buena relación, con las decisiones terapéuticas efectuadas por especialistas, incluso superior a la que aportarían las pruebas funcionales y el FeNO10.
Los puntos de corte que describimos en nuestro trabajo difieren con algunos de los estudios previos que establecieron puntos tanto para el asma controlada como no controlada. La causa de estas diferencias puede encontrarse en los distintos criterios empleados para la clasificación de asma no controlada e incluso puede tener un papel las diferencias étnicas que podrían ocasionar disparidades en la percepción del control del asma. Así, en el estudio inicial realizado por Nathan et al2 que desarrolló por primera vez el cuestionario, el criterio de definición de asma no controlada es fijado con una valoración efectuada por los especialistas (con una escala de 5 puntos desde totalmente no controlada a completamente controlada), por tanto diferente a los grados de GINA. No es de extrañar que el punto de corte (ACT≤19) sea ligeremente superior al que describimos, dado que incluiría no solo el asma no controlada, sino también en gran medida el asma parcialmente controlada. Esta misma metodología se siguió en el posterior trabajo de Shatz et al8 realizado en atención primaria y que describe el mismo punto de corte o el estudio de validación al castellano del cuestionario efectuado por Vega et al3 que incluye asma «pobremente controlada» y no controlada. Este mismo punto de corte (ACT≤19) se indica en el trabajo multicéntrico más reciente publicado por Thomas et al9 que, a diferencia de los anteriores, sigue los criterios de control de GINA. La diferencia metodológica con nuestro trabajo estriba en que en su analisis unen las categorías de GINA de asma parcial y no controlada (frente a controlada), mientras que nosotros analizamos el punto de corte de asma no controlada (en relación a parcial y controlada). Así pues, como en casos anteriores en ese trabajo el punto de corte establecido incluiría también a pacientes con asma parcialmente controlada. Ninguno de estos trabajos sugieren, por tanto, niveles de ACT para el asma parcialmente controlada. Por último hay 2 estudios recientes realizados en China con metodología similar a la nuestra y puntos de corte ligeramente diferentes. Así en el estudio de Fanny et al10 realizado en consulta especializada, se establece para asma no controlada en ≤20, mientras que en el de Zhou et al5, realizado en atención primaria, el punto de corte es ≤17 para asma no controlada, 18 y 19 para parcialmente controlada y ≥20 para controlada. Las diferencias de este trabajo en relación a nuestro estudio es la mayor gravedad de la población estudiada (28% presentaba asma severa, por un 8,9% de nuestros casos) y, por tanto mayor afectación funcional, con un mayor porcentaje (más del 50%) de asma no controlada. Estas circunstancias unido a las posibles diferencias culturales y étnicas en la percepción del control del asma, podrían justificar las disparidades.
En cualquier caso ambas medidas de control (la establecia por el facultativo y la autopercibida por el paciente) consideramos son complementarias y pueden aportar 2 visiones necesarias para una correcta valoración de la evolución clínica de la enfermedad. Así, a pesar de la metodología aplicada en nuestro trabajo, es de destacar como alrededor del 8% de pacientes que tienen en su valoración un ACT≥21, se clasificó como asma no controlada por el facultativo, lo que pudiera indicar que se trata de un grupo de pacientes hipoperceptores de sus síntomas.
Por otro lado encontramos una correlación significatriva pero escasa entre los niveles de FEV1, FeNO y el ACT. Resultado similar se han descrito para la relación con el FEV12,10 y FeNO10 mientras en otros trabajos las correlaciones para ambos parámetros son ligeramente más elevadas16–18. En nuestro estudio hallamos diferencias significativas en parámetros de función pulmonar solo cuando se comparan los puntos de corte de ACT para asma no controlada y controlada. Esta misma circunstancia cabe indicar para el FeNO. Hay que destacar el porcentaje de pacientes con asma no controlada y niveles normales de FeNO (cercano al 40% en ambas clasificaciones), o por el contrario el porcentaje de pacientes con asma controlada y niveles superiores a 35ppb (más del 26%). Estos mismos resultados se han descrito en estudios efectuados tanto en adultos15 como en niños17. El estudio de Khailii et al15 muestra cómo hasta un 38% de pacientes con asma bien controlada presenta valores de FeNO >35ppb. Estos casos podrían presentar una inflamación persistente subclínica que puede ocasionar problemas posteriormente. Así, en algunos estudios se ha indicado como un valor elevado de FeNO predice una exacerbación de asma con con un 80–90% de valor predictivo positivo21. También se ha descrito un descenso acelerado en la función pulmonar en pacientes con niveles elevados de FeNO, en relación a los que lo presentan normales22. En este punto es importante destacar que los niveles de FeNO pueden afectarse de forma significativa dependiendo de la zona y etnia estudiada (niveles mayores significativamente para paises orientales10,16), por el tratamiento previo con esteroides, dieta, comorbilidades o el tabaquismo activo, lo que puede hacer modificar la relación de esta medida con el ACT y la exploración funcional.
En definitiva estos resultados subrayan el hecho conocido de que el asma se puede presentar con diferentes expresiones fenotípicas, y que además cada expresión fenotípica puede mostrar una combinación específica de los diversos parámetros de control. Por tanto, consideramos que para una correcta y completa valoración del grado de control en cada paciente sería necesaria la combinación de estas medidas (funcionales, hiperreactividad bronquial, FeNO, cuestionarios clínicos).
La limitación de los resultados que hemos presentado es la necesidad de validar los puntos de corte sugeridos con el seguimiento de los pacientes al menos durante un año, para establecer su correlación con parámetros de evolución de la enfermedad. Dado que el «gold standard» de el cálculo de estos puntos ha sido los grados según GINA (que recordamos aún no han sido ratificados), consideramos necesaria esta validación clínica. Evaluaremos los resultados tras el seguimiento de los pacientes incluídos que estamos realizando a lo largo de un año. Otra posible limitación a los resultados, sobre todo en relación a los valores de FeNO es la inclusión de fumadores activos. Es conocido como esta circunstancia disminuye sus valores, lo que puede suponer un sesgo en los resultados de esta prueba concreta. Sin embargo no excluimos a este grupo de pacientes precisamente para mantener las condiciones de la práctica clínica habitual y que los resultados fueran extrapolables a toda la población de asmáticos y no solo a los no fumadores.
En conclusión hemos establecido unos puntos de corte de ACT de ≥21 para el asma contolada, 19–20 para el asma parcialmente controlada y ≤18 para no controlada. Los grados de control se correlaciónan significativamente pero de forma escasa con la situación funcional y grado de inflamación estimado por los niveles de FeNO, por lo que sería necesaria la inclusión de estos parámetros para una valoración más completa del control del asma.
FinanciaciónProyecto financiado parcialmente con BECA NEUMOSUR 2008.
Conflicto de interesesProyecto apoyado económicamente por GlaxoSmiKline.