El diagnóstico de la fibrosis pulmonar idiopática (FPI) es un proceso complejo que precisa la integración multidisciplinar de variables clínicas, radiológicas e histológicas. Cuando es preciso obtener muestras de parénquima pulmonar, la biopsia pulmonar quirúrgica ha sido el procedimiento recomendado por su rendimiento diagnóstico. Pero dada la morbimortalidad de esta técnica, se han explorado alternativas con menores riesgos. La más importante es la biopsia transbronquial con criosonda (criobiopsia transbronquial), que permite obtener tejido pulmonar con menor comorbilidad, con un rendimiento inferior a la biopsia quirúrgica pero superior a la biopsia transbronquial con pinza convencional. Por ello, en las recientes guías clínicas para el diagnóstico de la FPI se ha valorado esta opción, sin llegar a obtener una recomendación. En este artículo, resultado de un foro de discusión multidisciplinar, se pretende revisar la evidencia actual y hacer propuestas sobre el uso de la criobiopsia transbronquial para el diagnóstico de la FPI.
The diagnosis of idiopathic pulmonary fibrosis (IPF) is a complex process that requires the multidisciplinary integration of clinical, radiological, and histological variables. Due to its diagnostic yield, surgical lung biopsy has been the recommended procedure for obtaining samples of lung parenchyma, when required. However, given the morbidity and mortality of this technique, alternative techniques which carry a lower risk have been explored. The most important of these is transbronchial cryobiopsy —transbronchial biopsy with a cryoprobe— which is useful for obtaining lung tissue with less comorbidity. Yield may be lower than surgical biopsy, but it is higher than with transbronchial biopsy with standard forceps. This option has been discussed in the recent clinical guidelines for the diagnosis of IPF, but the authors do not go so far as recommend it. The aim of this article, the result of a multidisciplinary discussion forum, is to review current evidence and make proposals for the use of transbronchial cryobiopsy in the diagnosis of IPF.
El diagnóstico de las neumonías intersticiales idiopáticas (NII) se basa en el análisis multidisciplinar de datos clínicos, radiológicos e histológicos1. Tradicionalmente, la biopsia pulmonar quirúrgica (BPQ) había sido el procedimiento de elección para obtener muestras de tejido pulmonar puesto que las obtenidas mediante la biopsia transbronquial convencional (BTC) no resultaban óptimas en el diagnóstico de estas entidades2. La criobiopsia transbronquial (CBTB) consiste en la obtención de tejido pulmonar por vía endoscópica mediante el uso de criosondas3. El uso de esta técnica para el estudio de las NII se ha extendido en los últimos años como alternativa a la BPQ4. En pacientes con fibrosis pulmonar idiopática (FPI) también se ha propuesto su indicación, sin embargo, las guías clínicas ATS/ERS/JRS/ALAT recientemente publicadas concluyen que no existe suficiente evidencia científica como para establecer una recomendación sobre su uso5.
En el presente artículo se pretende realizar una discusión más amplia y multidisciplinar sobre el valor de la CBTB ante un paciente con sospecha de FPI y proponer un posible esquema diagnóstico incorporando esta técnica.
Diagnóstico de la fibrosis pulmonar idiopática. ¿Qué proponen las guías actuales?Proceso diagnóstico en la fibrosis pulmonar idiopáticaDurante 2018 se publicaron los dos importantes documentos sobre el diagnóstico de la FPI: la actualización de la guía diagnóstica de la ATS/ERS/ALAT/JRS y el «White Paper» de la Fleischner Society5,6. Basado en las recomendaciones actuales, el diagnóstico de la FPI se asienta en la valoración multidisciplinar del hallazgo, en el contexto clínico adecuado (más prevalente en pacientes mayores de 60 años, varones y exfumadores), de un patrón de neumonía intersticial usual (NIU), ya sea en la tomografía computarizada de alta resolución (TCAR) o mediante análisis del material histológico obtenido por biopsia pulmonar5,6. Por lo tanto, el proceso va encaminado a:
- •
Descartar posibles causas del origen de la neumopatía, mediante una historia clínica exhaustiva y pruebas complementarias dirigidas a descartar enfermedad autoinmune sistémica o estudiar exposiciones laborales, domésticas o fármacos con potencial neumotoxicidad7.
- •
Confirmar la presencia de un patrón de NIU según los criterios radiológicos e histológicos establecidos2.
Un hecho relevante desde la normativa del 2002 y que se ha visto incrementado en los más recientes posicionamientos es la valoración multidisciplinar como «gold standard» en el proceso diagnóstico, representando un salto diferencial sobre los criterios previamente establecidos donde el patrón histológico tenía un peso fundamental sobre el resto8. Además se propone cada vez más un proceso diagnóstico menos invasivo, reservando la biopsia solo para casos no concluyentes tras la primera valoración multidisciplinar.
Papel de la tomografía computarizada de alta resolución en el diagnóstico de la fibrosis pulmonar idiopáticaDe acuerdo con las directrices de las principales guías clínicas, la TCAR es un componente esencial en el diagnóstico de la FPI, la cual puede identificar NIU por: (a) la presencia de cambios fibróticos en ambos pulmones, con una predilección por las bases pulmonares y subpleurales aunque, a menudo, con patrón parcheado; (b) opacidades reticulares, a menudo asociadas con bronquiectasia por tracción; (c) panalización manifestada como espacios quísticos agrupados (diámetros de entre 3 y 10mm); y (d) demostrar la ausencia de otros hallazgos listados como patrón inconsistente de patrón NIU5.
Por lo tanto, el primer paso en el diagnóstico de la FPI es la utilización de una técnica adecuada, que nos permita obtener imágenes de alta calidad diagnóstica. Las diferencias esenciales entre una TC (convencional) y una TCAR (alta resolución) residen en el grosor de corte utilizado en la adquisición y reconstrucción de las imágenes9,10. En la TCAR las imágenes se obtienen mediante cortes de 1mm de grosor y, al igual que en la TC convencional, se obtienen en decúbito supino e inspiración profunda. Para la reconstrucción de las imágenes se utiliza un algoritmo de alta frecuencia y un campo de visión limitado al parénquima pulmonar11. La administración de contraste intravenoso no se utiliza en la TCAR. Las imágenes obtenidas en series espiratorias son muy útiles para mostrar atrapamiento aéreo12,13.
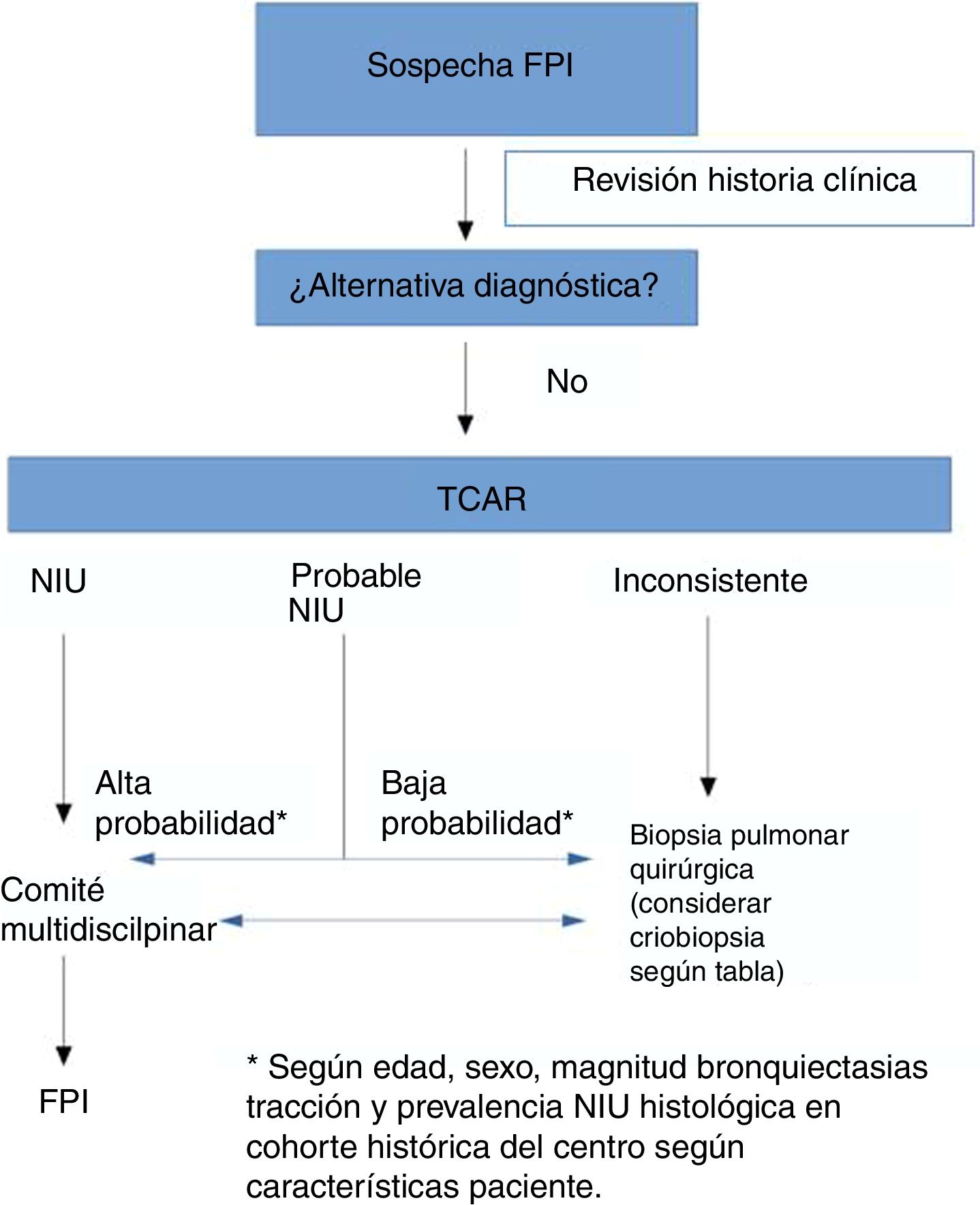
Debido a la variabilidad y las discrepancias interobservadores, los avances en la caracterización de la enfermedad, en las técnicas de imagen y en la obtención de muestras histológicas mediante criobiopsia, la Sociedad Fleischner ha publicado unos nuevos criterios radiológicos para diagnosticar la FPI y facilitar el acceso al tratamiento6. En esta revisión se han propuesto 4 nuevas categorías para diferenciar los patrones NIU en la TCAR: patrón NIU típico, probable, indeterminado y diagnósticos alternativos a FPI (tabla 1). Respecto a la anterior clasificación se cambia el patrón de «posible» por «probable» NIU y el de «inconsistente» por «indeterminado».
Categorías diagnósticas NIU basadas en la TCAR
| Patrón típico NIU | Patrón probable NIU | Patrón indeterminado para NIU | Hallazgos consistentes con un diagnóstico diferente a FPI | |
|---|---|---|---|---|
| Distribución | Predominio basal (ocasionalmente difusa) y subpleural; a menudo distribución heterogénea | Predominio basal y subpleural; a menudo distribución heterogénea | Variable o difuso | Fibrosis de predominio en lóbulos superiores o pulmón superior o medio; predominio peribroncovascular con preservación subpleural |
| Hallazgos | Panalización; patrón reticular con bronquiectasias de tracción o bronquiolectasias de distribución periférica; ausencia de hallazgos que sugieran un diagnóstico alternativo | Patrón reticular con bronquiectasias de tracción o bronquiolectasias de distribución periférica; ausencia de panalización; ausencia de hallazgos que sugieran un diagnóstico alternativo | Evidencia de fibrosis con algunas discretas características sugerentes de patrón no NIU | Cualquiera de los siguientes: predominio consolidación, opacidad en vidrio esmerilado (sin exacerbación aguda), extenso patrón de atenuación en mosaico, atenuación con significativo atrapamiento lobular en espiración, nódulos o quistes con afectación difusa |
FPI: fibrosis pulmonar idiopática; NIU: neumonía intersticial usual; TCAR: tomografía computarizada de alta resolución.
Fuente: Criterios propuestos por la Sociedad Fleischner6.
Según esta revisión, se puede realizar un diagnóstico preciso de FPI cuando las imágenes de la TCAR muestran un patrón NIU típico o probable14. Si el contexto clínico es indeterminado para FPI o el patrón de TCAR no es indicativo de NIU típico o probable, se debe considerar completar el proceso diagnóstico mediante la biopsia pulmonar.
La actualización de la guía ATS/ERS/JRS/ALAT propone también 4 patrones radiológicos en el diagnóstico de FPI, similares pero con alguna ligera variación respecto a los propuestos por la Sociedad Fleischner5,6. Los hallazgos básicos de los patrones de NIU y probable NIU son similares, pero el patrón indeterminado difiere al incluir la presencia de reticulación subpleural de predominio basal, patrón que también llaman de «early UIP», y el patrón realmente indeterminado, que sería uno de neumopatía intersticial fibrosante con hallazgos que realmente no orientan hacia ninguna etiología.
Una de las principales diferencias entre las guías ATS/ERS y el documento de la Sociedad Fleischner radica en la recomendación sobre si realizar o no biopsia pulmonar a pacientes con patrón de NIU posible, en un contexto clínico compatible con FPI, puesto que la primera sí hace una recomendación condicional favorable14. Podríamos resumir que, para los autores de la guía Fleischner, el riesgo de las comorbilidades de la BPQ supera al beneficio de encontrar un diagnóstico alternativo en el contexto de pacientes con alta sospecha clínica de FPI y una TCAR con patrón de NIU probable. Esto se basa en distintos estudios publicados en los últimos años que han analizado la correlación entre el patrón NIU probable y la presencia de NIU en la biopsia pulmonar15,16. Como bien refleja el estudio de Brownell et al., en aquellas cohortes de alta prevalencia de NIU histológica, el patrón de NIU posible en la TCAR es suficiente para predecir este diagnóstico y, con ello, evitar la BPQ17. No obstante, en otras situaciones, el valor predictivo positivo es más bajo, y por lo tanto necesitamos otras variables clínicas (como el sexo, la edad o la presencia de bronquiectasias de tracción) para identificar a los grupos de sujetos con un alto valor predictivo positivo para NIU histológica. Por lo tanto, la probabilidad pretest es muy importante para evaluar el patrón de NIU posible radiológico. En este debate, la CBTB podría ser una excelente alternativa, puesto que tiene menor comorbilidad que la BPQ y aunque su rendimiento diagnóstico es inferior a esta, puede ser suficiente para fundamentar el diagnóstico de FPI en casos con patrón de probable NIU.
Criterios diagnósticos histológicos de neumonía intersticial usualLas características del parénquima pulmonar en la biopsia con patrón de NIU se establecieron en diversos consensos y se han modificado discretamente en las actualizaciones posteriores de 2011, 2013 y la más reciente de 20181,5,18. La descripción actual, de la última guía de 2018, describe las siguientes características histológicas:
- •
Presencia de fibrosis intersticial que se asocia a marcada distorsión de la arquitectura pulmonar con una distribución característica de predominio periférico en el lobulillo secundario, es decir, paraseptal o subpleural.
- •
Presencia de focos fibroblásticos en áreas de interfase de fibrosis con parénquima preservado.
- •
Presencia de lesiones heterogéneas que dan lugar a combinación de áreas fibróticas de afectación avanzada, junto a áreas con septos alveolares preservados.
- •
Ausencia de características incompatibles con diagnóstico de NIU y que sugieren un diagnóstico alternativo. A pesar de mostrar todas las características histológicas de NIU, la presencia de granulomas u otras particularidades que correspondan a otra entidad descartan el diagnóstico.
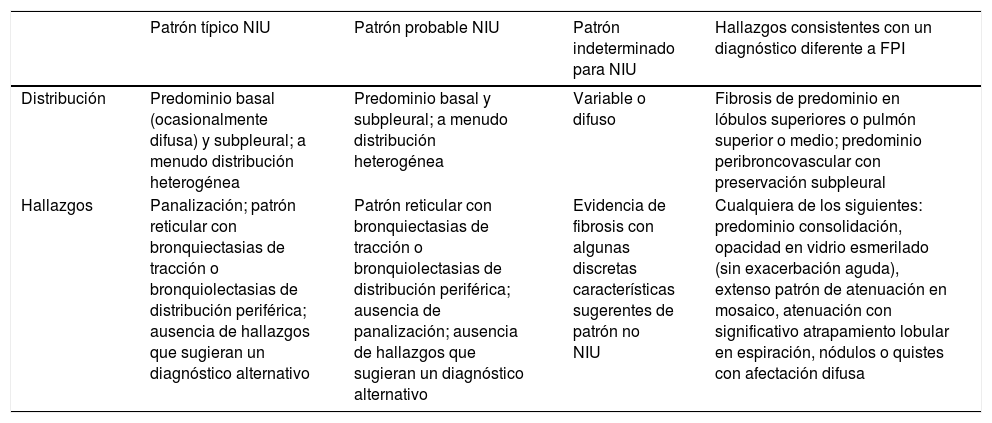
La comprensión de estas características no es simple, por lo que en la mencionada guía de 2018 se generan 4 opciones de probabilidad del diagnóstico de NIU, que se indican en la tabla 2, siguiendo el mismo esquema que la tabla 1.
Categorización de biopsias pulmonares
| Patrón NIU | Patrón de probable NIU | Patrón indeterminado para NIU | Diagnóstico alternativo |
|---|---|---|---|
| 1. Distorsión arquitectural con fibrosis densa (panalización) | 1. Características incompletas de la primera columna además de la ausencia de hallazgos de algún diagnóstico alternativo | 1. Fibrosis con o sin distorsión arquitectural, con características de otros patrones o favoreciendo otras causas | 1. Hallazgos de otros patrones histológicos de NII (p.ej., no focos fibroblásticos o fibrosis laxa) en todas las biopsias |
| 2. Predominio de la fibrosis en zona subpleural o paraseptal | o | 2. Alguna característica de la primera columna pero con datos que sugieran otro diagnóstico | 2. Rasgos indicativos de otra enfermedad (p.ej., sarcoidosis, NH, HCL, LAM) |
| Presencia solo de panalización | |||
| 3. Distribución heterogénea de la fibrosis | |||
| 4. Focos fibroblásticos |
HCL: histiocitosis de células de Langerhans; LAM: linfangioleiomiomatosis; NH: neumonitis por hipersensibilidad; NII: neumopatías intersticiales idiopáticas; NIU: neumonía intersticial usual.
Fuente: adaptado de la recomendación de la guía clínica de la ATS/ERS/JRS/ALAT5.
El concepto de CBTB surgió de la utilización de sondas de crioterapia flexibles modificadas y de la necesidad de mejorar el rendimiento diagnóstico de las BTC, cuyo papel había sido frecuentemente cuestionado en el diagnóstico de algunas enfermedades pulmonares intersticiales difusas (EPID)1,18. En cuanto a la estandarización del procedimiento, recientemente se ha publicado un consenso de expertos que analiza la evidencia científica, en relación con el rendimiento diagnóstico y la seguridad de la CBTB en los estudios publicados más relevantes19. En esta revisión, el rendimiento diagnóstico de la CBTB presentó un rango del 50,6-100% frente al 25-65% del rendimiento cuando se utiliza pinzas convencionales; la ocurrencia de neumotórax en el 1,4-26% y la presencia de sangrado en el 1-12%. Los autores recomiendan realizar la técnica con intubación orotraqueal, con sedación profunda o anestesia general, utilizar un balón de oclusión para el control hemorrágico y con control fluoroscópico. Además, recomiendan la obtención de 3-5 biopsias en diferentes segmentos pulmonares con una distancia de, al menos, 1cm de la pleura.
En 2009 se publicó el primer estudio que demostraba la viabilidad de la CBTB en el diagnóstico de la EPID, al conseguir muestras de parénquima pulmonar de mayor tamaño y calidad que las muestras obtenidas con la BTC. En este primer estudio, el tamaño medio de las muestras fue de 15,11mm2 en comparación con los 5,82mm2 de las muestras con la técnica convencional3. La primera CBTB en el ámbito nacional fue descrita en el año 201020. Posteriormente, se evaluó el rendimiento diagnóstico de la CBTB versus BTC en la EPID mediante un estudio prospectivo aleatorizado21. El diagnóstico histopatológico se identificó en más casos en el grupo de CBTB (74,4%) que en el grupo de BTC (34,1%, p<0,001), así como el diagnóstico final multidisciplinar del 51,3% versus 29,1%, respectivamente (p=0,038). Respecto a la FPI, Tomassetti et al. valoraron de forma retrospectiva el impacto de la CBTB versus BPQ en el diagnóstico multidisciplinar de FPI22. Los resultados de este estudio mostraron un aumento de la precisión diagnóstica tras la adición de la CBTB similar a la de la biopsia quirúrgica en el diagnóstico de FPI (BQ de 29 a 63%, p=0,0003 y CBTB de 30 a 65%, p=0,0016).
Iftikhar et al. realizaron una revisión de 16 estudios con CBTB versus 14 estudios con BPQ incluyendo más de 2.200 pacientes23. En este metaanálisis se objetivó un rendimiento diagnóstico global menor en la CBTB (83%) que en la BQ-VATS (92%). En un estudio prospectivo realizado por Romagnoli et al. se analizó la concordancia diagnóstica de la CBTB frente a la BPQ24. En este trabajo, 21 pacientes fueron intervenidos mediante ambas técnicas en un mismo día, en quirófano y durante la misma anestesia. Los resultados de este estudio muestran que en solo 8 de 21 pacientes (38%) el diagnóstico histológico preciso fue el mismo con ambos procedimientos, siendo el de la BPQ de mayor tamaño y superior para establecer patrones histológicos útiles en el diagnóstico multidisciplinar. Sin embargo, es de destacar que el resultado primario (concordancia diagnóstica histológica) se produjo con una evaluación patológica «ciega» a la información clínico-radiológica, cosa que no supone una práctica clínica habitual. Otro dato a destacar de este estudio es que solo se incluyeron 21 de los 61 pacientes seleccionados. Es decir, 40 pacientes no pudieron ser incluidos en el estudio, muchos por negarse a realizar una BPQ y otros tantos por comorbilidades que la desaconsejaban.
Otro de los argumentos a favor de la CBTB es el ahorro de costes en comparación con la BPQ por videotoracoscopia (VTC). En los análisis de coste se ha demostrado el potencial ahorro de la CBTB versus la BPQ-VTC de entre £210-647 paciente/año25 o entre 953,09€/paciente cuando la BPQ-VTC se hace de forma ambulatoria y un máximo de 1.925,29€/paciente cuando la BPQ supone un ingreso de 48h26.
Respecto a las contraindicaciones de la prueba, según el consenso de expertos, la edad no es limitante para la realización de CBTB siempre que las comorbilidades y los riesgos derivados de la anestesia no lo sean19. Asimismo, se ha descrito que los pacientes con peor funcionalismo pulmonar son los que presentan más complicaciones. Se recomienda como contraindicaciones relativas, si existe FVC<50%ref. o DLCO <35%ref. La presencia de hipertensión arterial pulmonar (HTP) puede incrementar el riesgo de sangrado, y en algunas series la presencia de HTP superior a 40-45mmHg ha sido considerada como contraindicación relativa3,21.
Por tanto, aunque la BPQ es el método de primera elección, la CBTB puede ser la alternativa a proponer en pacientes que rechazan o en los que es desaconsejable una biopsia quirúrgica.
Biopsia pulmonar quirúrgicaLa BPQ es hoy por hoy el «gold standard» para el diagnóstico histológico de la EPID. Actualmente la vía de abordaje de elección es la VTC, empleando uno, 2 o 3 puertos de entrada por los que se introduce la óptica y el instrumental27. La implementación de la cirugía mínimamente invasiva ha conseguido simplificar la técnica28. Con la ayuda de la TCAR se decide de forma multidisciplinar la zona a biopsiar, hecho que mejora la rentabilidad de la técnica. La resección se realiza mediante endosuturas mecánicas, cada vez más seguras, permitiendo la sección y sellado simultáneo del parénquima. Las muestras obtenidas se remiten para estudio anatomopatológico y cultivo microbiológico. La regla aproximada es una muestra de 3×2×1cm3, si bien hay autores que recomiendan una muestra de más de 2cm de diámetro. La BPQ es un procedimiento que normalmente se realiza bajo anestesia general con intubación selectiva, si bien es cierto que cada vez son más los grupos que realizan una intubación orotraqueal o incluso bajo sedación y mascarilla laríngea29,30. La seguridad ofrecida por las endosuturas utilizadas ha permitido minimizar la fuga aérea posquirúrgica, por lo que no es necesaria la colocación sistemática de drenaje pleural31,32. En los programas de cirugía ambulatoria, los pacientes ingresan 1-2h antes de la cirugía y el alta es a las 4-6h de la misma. La experiencia publicada sobre programas de cirugía ambulatoria ha reportado tasas de ingreso del 3% (mayoritariamente por fuga aérea) y tasas de reingreso también del 3% por neumotórax33. Para evaluar la aplicabilidad del abordaje ambulatorio de la BPQ-VTC en el diagnóstico de la EPID se llevó a cabo un estudio prospectivo y multicéntrico en el que participaron 224 pacientes y 13 servicios de cirugía torácica, y los resultados mostraron que la localización anatómica y el número de biopsias no influyen en el diagnóstico de la EPID, obteniéndose un diagnóstico específico en el 87% de los casos (de los cuales un 26,1% eran FPI) y los índices de morbilidad tras el alta fueron comparables entre ingresados (9/154: 5,8%) y ambulatorios (3/70: 4,3%)34.
Cuestiones abiertas¿Es posible establecer el diagnóstico de neumonía intersticial usual en una biopsia mediante criobiopsia?La CBTB es especialmente útil en enfermedades de distribución peribroncovascular o linfangítica, en enfermedades con características específicas o muy características, pero poco (o menos) útil en enfermedades donde es necesario identificar un patrón, como ocurre con la FPI, a pesar de lo cual, la CBTB va ganando utilidad.
Los criterios histológicos de NIU han sido establecidos en BPQ aunque también pueden ser identificados en CBTB. La presencia de pleura o septo será necesaria para el patrón de NIU puesto que la distribución de la fibrosis es uno de los 4 requisitos. Por tanto, las criobiopsias que no contengan estas estructuras solo podrán establecer un «patrón de NIU probable». Sin embargo, la distribución parcheada y los focos de proliferación fibroblástica son fácilmente identificables mediante CBTB. Otro elemento morfológico muy característico del patrón NIU es el panal. La presencia de panalización ha sido muy debatida en la literatura, considerándose que no siempre es factible. En un reciente estudio se concluye que las zonas de panal histológico se detectan en la CBTB cuando el número de fragmentos es mayor de 2 y se incluye la pleura. El tamaño de los fragmentos puede dificultar diferenciar entre panal y metaplasia bronquiolar.
Por lo tanto, en la CBTB pueden no estar presentes todos los criterios para establecer de forma definitiva un patrón de NIU aunque puede resultar de gran utilidad en el resto de opciones, tanto en las referidas a identificar características histológicas de patrón probable o posible de NIU como en apreciar otras características histológicas excluyentes de patrón NIU. Por este motivo es necesario establecer criterios mínimos de calidad en cuanto al número de muestras, distribución, tamaño de las mismas y hallazgos histológicos. A nivel microscópico se ha propuesto un tamaño mínimo de 5mm de parénquima bien expandido para poder hablar de un patrón, y aunque fragmentos más pequeños puedan contener todos los elementos, este sería el tamaño óptimo35.
SeguridadEn relación con la seguridad, las complicaciones descritas más frecuentes asociadas a la realización de la CBTB son la hemorragia grave y el neumotórax4. Respecto a la hemorragia tras el procedimiento, no existe un consenso en la definición y en la cuantificación del sangrado, por lo que en los diferentes estudios este resultado es muy heterogéneo. En general, los estudios realizados que comparan esta técnica con la BTC han objetivado un mayor porcentaje de hemorragias moderadas en el grupo de CBTB respecto al grupo de BTC. En el metaanálisis de Johannson et al. la frecuencia general de sangrado moderado/grave fue del 39%, con un rango del 0 al 78%, lo que demuestra una gran heterogeneidad36. En la revisión sistemática de Ganganah et al. compararon CBTB versus BTC e identificaron 3 estudios de comparación directa en la frecuencia de sangrado y solo en uno de ellos el sangrado fue mayor significativamente en la CBTB25. También se han publicado frecuencias del 20,99% (5,6-42,8%) de sangrados moderados en CBTB, incluyendo 3 muertes, con una frecuencia del 0,5% sobre el total37. En este sentido, la recomendación sobre la estandarización en el procedimiento de la CBTB incluye la utilización de un balón de oclusión para controlar un eventual sangrado19.
Con respecto al neumotórax, Sharp et al. concluyen que es el efecto adverso más frecuente en CBTB en un 20% de los casos (15% requirieron drenaje)37. La probabilidad combinada total de presentar un neumotórax fue del 0,06 (IC 95%: 0,02-0,11), mientras que la probabilidad de presentar un neumotórax con colocación de drenaje pleural fue del 0,03 (IC 95%: 0,01-0,08). Los estudios que muestran un mayor porcentaje de casos de neumotórax podrían estar en relación con las características de los pacientes incluidos (pacientes con neumopatía intersticial y patrón fibrótico) y con la obtención de un mayor número de biopsias subpleurales (<1cm)22,38.
Respecto a la BPQ, la incidencia de complicaciones asociadas son muy variables según las series publicadas, siendo la más frecuente el dolor postoperatorio y la más temida la exacerbación de la enfermedad subyacente. Tanto el dolor como la exacerbación se han reducido con la implementación de las técnicas mínimamente invasivas39,40. Kreider et al. publicaron en 2007 que la implementación de programas de VATS no reducía la morbimortalidad asociada a la BPQ41. La correcta selección de pacientes y el momento en que se indica la biopsia parecen ser factores importantes para reducir las complicaciones. Hutchinson et al. observaron en un análisis retrospectivo como la mortalidad asociada a la cirugía en pacientes intervenidos mediante cirugía no electiva ascendía a un 16%, mientras que en aquellos casos en que la cirugía era programada se reducía al 1,7%42.
En un metaanálisis que revisa ambas técnicas, la incidencia de hemorragia grado 2 (moderada a grave) en la CBTB fue del 4,9% (2,2-10-7%)23. En los estudios evaluados de BPQ-VATS, solo 5 reflejaron la incidencia de fuga aérea persistente que resultó del 2% (0,9-4%). La mortalidad a los 30-60 días en los estudios evaluados tras los procedimientos fue del 0,7% (0,4-1,2%) tras CBTB y del 1,8% (1,0-3%) tras BPQ-VATS. Otros indicadores de seguridad comparando CBTB versus BQ (VATS) fueron la frecuencia de efectos adversos (excluyendo neumotórax), que resultó del 2% versus 13,3% (p<0,0001), la media de hospitalización (días) de 2,6 (rango 0-17) versus 6,1 (rango 3-48) (p<0,0001) y la mortalidad del 0,3% versus 2,7% (p=0,045), respectivamente4.
Conclusión: propuesta multidisciplinar del papel de la criobiopsia en el diagnóstico de la fibrosis pulmonar idiopáticaEn el momento actual, disponemos de dos alternativas para el diagnóstico de la FPI en aquellos casos que requieran biopsia pulmonar. Aunque no existen aún estudios adecuados comparando ambas técnicas, y a pesar de que puedan mostrar resultados más o menos favorables a cada una de ellas, nuestra impresión es que ambos procedimientos presentan características diferenciadas, que las hacen más adecuadas en función de cada situación clínica. Por lo tanto, el reto no consiste en que las dos técnicas compitan en el diagnóstico del paciente con FPI, sino en ser capaces de definir en qué situaciones cada una de ellas es más óptima.
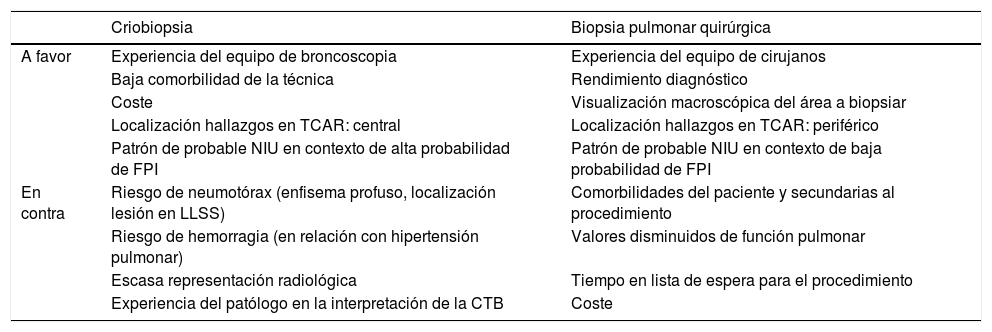
Basado en lo expuesto en este artículo, en la tabla 3 apuntamos algunas circunstancias que pueden ayudar a establecer nuestra decisión. Hechos como las comorbilidades, la función pulmonar, la experiencia del equipo de broncoscopia y del patólogo, la localización y extensión del patrón radiológico así como el coste de la técnica han de ser cuidadosamente valorados. Además, se ha de valorar el retraso diagnóstico, puesto que cada nuevo procedimiento incluido en el algoritmo provoca un aumento del tiempo hasta la obtención del diagnóstico. Por supuesto, este algoritmo propuesto requiere ser validado en estudios prospectivos para demostrar su utilidad clínica.
Factores a considerar en cada paciente y centro a la hora de decidir entre criobiopsia transbronquial y biopsia pulmonar quirúrgica
| Criobiopsia | Biopsia pulmonar quirúrgica | |
|---|---|---|
| A favor | Experiencia del equipo de broncoscopia | Experiencia del equipo de cirujanos |
| Baja comorbilidad de la técnica | Rendimiento diagnóstico | |
| Coste | Visualización macroscópica del área a biopsiar | |
| Localización hallazgos en TCAR: central | Localización hallazgos en TCAR: periférico | |
| Patrón de probable NIU en contexto de alta probabilidad de FPI | Patrón de probable NIU en contexto de baja probabilidad de FPI | |
| En contra | Riesgo de neumotórax (enfisema profuso, localización lesión en LLSS) | Comorbilidades del paciente y secundarias al procedimiento |
| Riesgo de hemorragia (en relación con hipertensión pulmonar) | Valores disminuidos de función pulmonar | |
| Escasa representación radiológica | Tiempo en lista de espera para el procedimiento | |
| Experiencia del patólogo en la interpretación de la CTB | Coste |
CTB: criobiopsia transbronquial; FPI: fibrosis pulmonar idiopática; LLSS: lóbulos superiores; NIU: neumonía intersticial usual; TCAR: tomografía computarizada de alta resolución.
En función de todas estas variables, y como se aprecia en la figura 1, cada centro, en cada caso, podrá determinar cuál de las dos puede tener un mejor riesgo-beneficio para obtener un diagnóstico histológico. Pero por supuesto, son necesarios estudios que comparen la rentabilidad diagnóstica y seguridad de la BPQ versus la CBTB en la FPI.
AutoríaDC y ASF organizaron la sesión-debate y fueron los responsables de la propuesta de realizar este artículo. DC, ASF y AT diseñaron el manuscrito. Todos los autores contribuyeron al mismo y han revisado la versión remitida para publicación.
Conflicto de interesesDC informa de los honorarios personales y el apoyo no financiero de Boehringer-Ingelheim y Roche, así como los honorarios personales de Bristol-Myers Squibb, fuera del trabajo enviado; JS informa de becas y honorarios personales de Boehringer-Ingelheim y Roche, y honorarios personales de Menarini, Glaxo, Novartis y Chiesi, fuera del trabajo enviado. MM-M informa de becas y honorarios personales de Boehringer-Ingelheim, Esteve-Teijin Healthcare y Roche, honorarios personales de Chiesi, y becas de GSK, fuera del trabajo enviado; el resto de autores no refieren conflicto de intereses respecto del trabajo enviado.
Este manuscrito es la transcripción de una sesión-debate patrocinada por Boehringer-Ingelheim.