El daño pulmonar agudo por isquemia reperfusión (IR) ha sido estudiado fundamentalmente en modelos experimentales y clínicos con IR fría. Son limitados los estudios que profundizan en las alteraciones bioquímicas durante la IR normotérmica (caliente). El objetivo del este trabajo es presentar un modelo de autotrasplante pulmonar en cerdo para el estudio de las fases más precoces del síndrome de IR normotérmica pulmonar.
Animales y métodosSeis cerdos de la raza Large-White fueron sometidos a neumonectomía izquierda, lobectomía craneal ex situ, reimplantación del lóbulo caudal y reperfusión del mismo durante 30 min. Durante el procedimiento se analizaron diferentes parámetros para identificar cambios hemodinámicos, gasométricos y bioquímicos en el modelo. El estudio estadístico se realizó con pruebas no paramétricas.
ResultadosTras la isquemia, se observó en tejido pulmonar un aumento significativo (p < 0,05) de metabolitos de peroxidación lipídica, de citoquinas y quemoquinas proinflamatorias (TNF-α, IL-1β y MCP-1), de actividad leucocitaria (mieloperoxidasa o MPO), de actividad óxido nítrico sintasa inducible y de la proteína quinasa MAPK p38, mientras que se observó un descenso de actividad tisular de las formas constitutivas de NOS y de monóxido de carbono sérico. Estas alteraciones se mantuvieron o acentuaron durante la reperfusión, donde se observó también una mayor actividad tisular hemo-oxigenasa constitutiva.
ConclusionesSe presenta un procedimiento experimental de IR normotérmica pulmonar describiendo en profundidad cambios hemodinámicos, gasométricos y bioquímicos. Tanto el modelo como los parámetros analizados podrían ser útiles en el estudio de nuevas terapias moduladoras del daño pulmonar agudo en situaciones clínicas de IR normotérmica.
Ischemia-reperfusion (IR) lung injury has been investigated extensively on clinical and experimental models of cold ischemia. However, relatively few studies examine the detailed biochemical changes occurring during normothermic (warm) IR.
The objective of this work was to establish an experimental lung autotransplant model to be carried out on pigs in order to study the early stages of normothermic lung IR.
Animals y methodsSix Large-White pigs underwent a lung autotransplant which entailed left pneumonectomy, ex situ cranial lobectomy, caudal lobe reimplantation and its reperfusion for 30 min. Throughout the procedure, several parameters were measured in order to identify hemodynamic, gasometric and biochemical changes. Non-parametric statistical analyses were used to compare differences between periods.
ResultsAfter ischemia, a significant increase (P < 0.05) in lipid peroxidation metabolites, proinflammatory cytokines and chemokines (TNF-α, IL-1β y MCP-1), neutrophil activation, inducible nitric oxide synthase activity and protein-kinase MAPK p38 levels were observed in lung tissue. However, constitutive nitric oxide synthase activity in lung tissue and carbon monoxide plasma levels were decrease. The same held true throughout the reperfusion period, when an increase in the constitutive heme-oxygenase activity was also shown.
ConclusionsAn experimental model of normothermic lung IR injury is presented and detailed changes in hemodynamic, gasometric and biochemical parameters are shown. Both the model and the studied parameters may be clinically useful in future investigations testing new therapies to prevent normothermic IR induced lung injury.
Diversas situaciones clínicas obligan a someter al tejido pulmonar a periodos de isquemia más o menos prolongados, con el consiguiente riesgo de daño pulmonar agudo tras la reperfusión. La mayoría de los estudios para preservar el tejido pulmonar de los efectos de la isquemia reperfusión (IR) se realizan en modelos experimentales o clínicos de trasplante pulmonar con isquemia fría1. Sin embargo, existen situaciones clínicas en las que no es posible el enfriamiento progresivo del pulmón, ni perfundirlo con una solución de preservación antes de interrumpir la circulación sanguínea. Entre estas situaciones destacan las resecciones pulmonares con angioplastia de la arteria pulmonar2–4 y los trasplantes de lóbulo pulmonar de donante vivo. Situaciones menos frecuentes, casi anecdóticas, son las resecciones pulmonares ex situ de tumores centrales con reimplantación del lóbulo o lóbulos pulmonares viables5. En estos casos, parte del tejido pulmonar sufre un periodo más o menos prolongado de isquemia caliente (normotérmica) y son frecuentes el edema de reperfusión y la necesidad de ventilación prolongada en el postoperatorio6.
En este contexto, el estudio del daño pulmonar por IR, y de potenciales terapias moduladoras del mismo, requiere modelos experimentales en los que la isquemia se inicie sin enfriamiento ni preservación previa del pulmón. Un modelo experimental que reproduce esta situación es el autotrasplante pulmonar en animales. El objetivo del presente trabajo es presentar un modelo de autotrasplante pulmonar en cerdo para el estudio de las fases más precoces del síndrome de IR pulmonar y analizar los cambios hemodinámicos, gasométricos y bioquímicos que tienen lugar durante este periodo.
Animales y métodosEl estudio se realizó con la aprobación del Comité de Investigación y Experimentación Animal de la institución, siguiéndose en todo momento la normativa europea y española respecto a la manipulación y cuidado de animales de experimentación.
En seis cerdos de la raza Large-White se realizó un procedimiento de autotrasplante pulmonar ortotópico. El peso medio de los animales fue 42,8 kg. La intervención consistió en una neumonectomía izquierda con lobectomía craneal ex situ, reimplantación del lóbulo caudal y reperfusión del mismo durante 30 min. El tiempo medio del procedimiento fue de 289 min (rango: 232-325 min) y el tiempo medio de isquemia pulmonar fue de 90 min (rango: 84-97 min). Al principio del procedimiento y durante los periodos de isquemia y reperfusión, se analizaron diferentes parámetros para identificar cambios hemodinámicos, gasométricos y bioquímicos en el modelo.
Procedimiento quirúrgicoSe mantuvo a los animales en ayunas para alimentos sólidos durante 18 h antes del procedimiento, disponiendo de agua ad libitum. La premedicación se realizó con ketamina intramuscular a 10 mg/kg de peso. Una vez en quirófano, se canalizó una vía periférica, se instauró una oxigenación previa 100% y se estableció una monitorización con electrocardiograma (ECG) y pulsioximetría. La inducción anestésica se realizó con propofol (4 mg/kg; Diprivan®, Fresenius K), fentanilo (3 μg/kg; Fentanest®, Kern Pharma) y atracurio (0,6 mg/kg; Tracrium®, Glaxo Smith Kline) a través de una vena dorsal de la oreja. La intubación se realizó con un tubo orotraqueal de 6-7 mm de diámetro interno. La asistencia respiratoria se llevó a cabo con un ventilador modelo Drager SA 1. La ventilación se controló por volumen (volumen corriente de 8 ml/kg, 12-15 respiraciones/min, relación entre inspiración y espiración de 1:2) y se ajustó durante la cirugía para mantener en sangre arterial entre 35 y 40 mmHg de anhídrido carbónico; la fracción inspirada de oxígeno (FiO2) se mantuvo en 1 durante todo el procedimiento. Se realizó una traqueotomía quirúrgica y, tras retirar el tubo orotraqueal, se introdujo un tubo anillado de 6 mm, lo que permitió con más facilidad la intubación selectiva del bronquio derecho durante la cirugía. La anestesia se mantuvo con propofol en perfusión continua (8-10 mg/kg/h), con fentanilo y el atracurio en bolos, según necesidades. Se mantuvo una perfusión intravenosa de ringer lactato a 5-6 ml/kg/h, y de una sustancia coloide, hidroxietil almidón, según requerimientos. Durante la intervención, la monitorización se realizó con ECG de 3 derivaciones, pulsioximetría, capnografía, presión arterial invasiva y presión venosa central, para lo que se cateterizaron la arteria y vena femorales. A través de la vena femoral se introdujo un catéter de arteria pulmonar (catéter de termodilución 7,5-F, Edwards, Irving, California, EE. UU.). Para controlar la diuresis se realizó una cistostomía suprapúbica.
Tras estos procedimientos preliminares, el animal fue situado en decúbito lateral derecho y se practicó una toracotomía izquierda con resección del cuarto o quinto arco costal. Para realizar la neumonectomía se disecaron sucesivamente la arteria pulmonar, la vena pulmonar craneal, la vena pulmonar caudal y el bronquio izquierdo. Entonces, se seccionó el bronquio izquierdo y se progresó, bajo visión directa, el tubo orotraqueal hacia el bronquio derecho, iniciando el periodo de ventilación unipulmonar. La arteria pulmonar izquierda se ocluyó con una pinza protegida cerca de la bifurcación de la arteria pulmonar principal y se seccionó distalmente dejando un margen de 5 a 10 mm para poder realizar la anastomosis arterial en el reimplante. La vena pulmonar craneal fue ligada cerca de la aurícula y seccionada. Para completar la neumonectomía, la vena pulmonar del lóbulo caudal se pinzó cerca de la desembocadura de la vena del lóbulo mediastínico, se seccionó a 1 o 2 mm de la pinza y fue suturada con punto continuo de prolene 6/0. Con esta maniobra se pudo conservar una longitud suficiente de vena del lóbulo caudal para la anastomosis venoauricular del reimplante. Para prevenir una trombosis de la arteria pulmonar, que se mantenía pinzada durante la cirugía de banco y el reimplante, se procedió, en el momento de su oclusión, a la heparinización con 300 UI/kg en bolo.
Se prosiguió con la cirugía de banco, realizando una lobectomía craneal. El pulmón izquierdo fue perfundido de forma anterógrada y retrógrada con solución de la Universidad de Wisconsin a 10-15°C, mientras se ventilaba con ambú (FiO2: 0,21), hasta conseguir un efluente claro por la arteria y venas pulmonares. Se disecó el pedículo del lóbulo caudal que iba a ser reimplantado: la arteria pulmonar izquierda (tras ligadura y sección de las ramas craneales), la vena pulmonar caudal (liberada de adherencias pleurales hasta las ramas segmentarias) y el bronquio principal izquierdo (tras sección y sutura del bronquio craneal).
Finalmente, el lóbulo caudal se reimplantó mediante anastomosis bronquial con sutura continua de prolene 4/0, sutura arterial continua con prolene 5/0 y sutura venoauricular continua con prolene 6/0. Entonces, el tubo anillado se retiró hacia la tráquea permitiendo la ventilación del implante. La reperfusión se realizó primero de forma retrógrada, despinzando la aurícula izquierda, y después anterógrada, despinzando la arteria pulmonar. La perfusión del lóbulo reimplantado se mantuvo durante 30 min, tras los cuales se procedió a la eutanasia del animal con profundización anestésica e inducción de cardioplejia con cloruro potásico.
Parámetros de estudioSe registraron: el peso del animal, los tiempos de isquemia y la duración total del procedimiento y el tiempo de ventilación unipulmonar durante la intervención.
Momentos de la medición de variables y recogida de muestrasComo estudio basal, se realizaron estudios hemodinámicos y gasometría arterial sistémica a los 30 min de comenzar la toracotomía, antes de iniciar la ventilación unipulmonar. Los mismos estudios hemodinámicos y gasométricos, junto con biopsias pulmonares y extracción de sangre venosa femoral para estudios bioquímicos, se realizaron en otros cuatro momentos: preneumonectomía (PreN) –antes de completar la neumonectomía, ya iniciada la ventilación unipulmonar–; pre-reperfusión (PreR) –antes de la reperfusión y ventilación del lóbulo reimplantado–; 10 min postreperfusión –tras 10 min de reperfusión del lóbulo reimplantado–; y 30 min postreperfusión –tras 30 min de reperfusión del lóbulo reimplantado–. Se extrajeron biopsias de pulmón tanto para cuantificar el edema pulmonar como para medir parámetros bioquímicos. Las dos primeras muestras, PreN y PreR, se extrajeron del lóbulo craneal del pulmón izquierdo; las dos últimas muestras, Rep-10’ y Rep-30’, se extrajeron del lóbulo caudal del pulmón izquierdo. Cada muestra de tejido fue dividida en dos: una, para cuantificar el edema pulmonar, se congeló en tubos de polipropileno a –40°C; la otra se empleó para realizar el estudio bioquímico, siendo congelada inmediatamente con nitrógeno líquido en criotubo y almacenada a –80°C hasta su análisis. Las muestras de sangre venosa femoral fueron centrifugadas durante 10 min a 1.000 xg y el suero sobrenadante congelado a –40°C hasta su análisis.
Estudios hemodinámicosLa frecuencia cardiaca fue monitorizada mediante ECG. Se utilizó el catéter arterial para medir la presión arterial media. El catéter de arteria pulmonar permitió la medición y el cálculo de los siguientes parámetros: presión arterial pulmonar media, presión capilar pulmonar, presión venosa central, índice cardiaco y volumen sistólico.
Estudios gasométricosEn los momentos mencionados, en sangre arterial sistémica se midió la presión parcial de oxígeno (PO2) y de dióxido de carbono (PCO2), y el pH. Además, a los 10 y a los 30 min de la reperfusión del lóbulo reimplantado se extrajo por punción una muestra de sangre de la vena pulmonar para estudiar la capacidad de intercambio de gases del injerto, midiéndose en dichas muestras PO2, PCO2 y pH.
Determinaciones bioquímicas en plasma- •
Óxido nítrico (NO): la concentración sérica de NO se basó en la reacción de Griess7.
- •
Monóxido de carbono (CO): para cuantificar la cantidad de CO formado, se añadió a todas las muestras hemoglobina y se determinó la proporción de carboxi-hemoglobina (CO-Hb) espectrofotométricamente según el método de Omura y Sato8.
Se expresa mediante la relación peso húmedo/seco. Se calcula mediante la fórmula peso húmedo-peso seco/peso húmedo, midiendo el peso seco tras incubar las muestras durante 24 h a 60°C.
Estudio del estrés oxidativo y activación leucocitaria en tejido pulmonarLos niveles de lipoperoxidasa (LPO) muestran el grado de degradación de la membrana lipídica de las células que ocurre como consecuencia de la oxidación. Se determinan utilizando un kit espectrofotométrico específico (K-assay LPO-CC, Kamiya Biochemical Company, EE. UU.). El malondialdehído (MDA) es un compuesto final de la peroxidación lipídica y un marcador de daño celular. Se analiza indirectamente cuantificando la formación de ácidos tiobarbitúricos9 en tejido pulmonar. La actividad de la mieloperoxidasa (MPO) indica el acúmulo de polimorfonucleares neutrófilos y se determina mediante el método de Bradley10 modificado.
Mediadores inflamatorios en tejido pulmonar: Expresión de citoquinas (TNF-α, IL-1β), óxido nítrico sintasas (endotelial-NOSe, neuronal-NOSn e inducible-NOSi) y hemoxigenasas (HO-1, HO-2)Se realizan por Western blot utilizando anticuerpos específicos anti TNF-α (Endogen), anti-IL-1β (Bio Génesis), anti-nitric oxide Synthase I, anti-nitric oxide Synthase II y anti-nitric oxide Synthase III (Chemicon International, Inc.), anti-Heme Oxigenase I y anti-Heme Oxigenase II (Chemicon International, Inc.). Se expresan como unidades arbitrarias.
Proteína quimitáctica de monocitos (MCP-1; Monocyte chemoattractant protein-1)Se midió en tejido pulmonar por ELISA utilizando kits comerciales específicos (Biosource International).
Proteínas quinasas activadas por mitógeno (MAPK): MAPK p38, JNK y ERKSe determinarón en tejido pulmonar por ELISA utilizando Kits comerciales específicos (Oncogene).
Análisis estadísticoLos datos se expresan mediante la media y el error típico de la media. El estudio estadístico se realizó utilizando el paquete estadístico SPSS 14.0 (SPSS Inc., Chicago, EE. UU.). Se empleó el test de Wilcoxon para muestras apareadas para detectar diferencias en la evolución de las variables entre los diferentes momentos del procedimiento experimental. Las diferencias se consideraron significativas estadísticamente para un valor de p < 0,05.
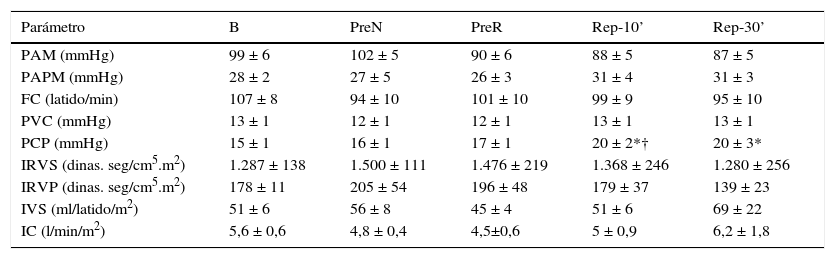
ResultadosHemodinámicosLa mayoría de las constantes hemodinámicas medidas se mantuvieron estables a lo largo del procedimiento. Sin embargo, se registró un significativo incremento de la presión capilar pulmonar durante la reperfusión del lóbulo reimplantado (tabla 1).
Parámetros hemodinámicos
| Parámetro | B | PreN | PreR | Rep-10’ | Rep-30’ |
|---|---|---|---|---|---|
| PAM (mmHg) | 99 ± 6 | 102 ± 5 | 90 ± 6 | 88 ± 5 | 87 ± 5 |
| PAPM (mmHg) | 28 ± 2 | 27 ± 5 | 26 ± 3 | 31 ± 4 | 31 ± 3 |
| FC (latido/min) | 107 ± 8 | 94 ± 10 | 101 ± 10 | 99 ± 9 | 95 ± 10 |
| PVC (mmHg) | 13 ± 1 | 12 ± 1 | 12 ± 1 | 13 ± 1 | 13 ± 1 |
| PCP (mmHg) | 15 ± 1 | 16 ± 1 | 17 ± 1 | 20 ± 2*† | 20 ± 3* |
| IRVS (dinas. seg/cm5.m2) | 1.287 ± 138 | 1.500 ± 111 | 1.476 ± 219 | 1.368 ± 246 | 1.280 ± 256 |
| IRVP (dinas. seg/cm5.m2) | 178 ± 11 | 205 ± 54 | 196 ± 48 | 179 ± 37 | 139 ± 23 |
| IVS (ml/latido/m2) | 51 ± 6 | 56 ± 8 | 45 ± 4 | 51 ± 6 | 69 ± 22 |
| IC (l/min/m2) | 5,6 ± 0,6 | 4,8 ± 0,4 | 4,5±0,6 | 5 ± 0,9 | 6,2 ± 1,8 |
Los datos se expresan como media ± error típico de la media.
*p < 0,05 vs B; †p < 0,05 vs PreN.
B: basal; FC: frecuencia cardiaca; IC: índice cardiaco; IRVP: índice de resistencia vascular pulmonar; IRVS: índice de resistencia vascular sistémica; IVS: índice del volumen sistólico; PAM: presión arterial media; PAPM: presión arterial pulmonar media; PCP: presión capilar pulmonar; PreN: preneumonectomía; PreR: pre-reperfusión; PVC: presión venosa central; Rep-10’: 10 min postreperfusión; Rep-30’: 30 min postreperfusión.
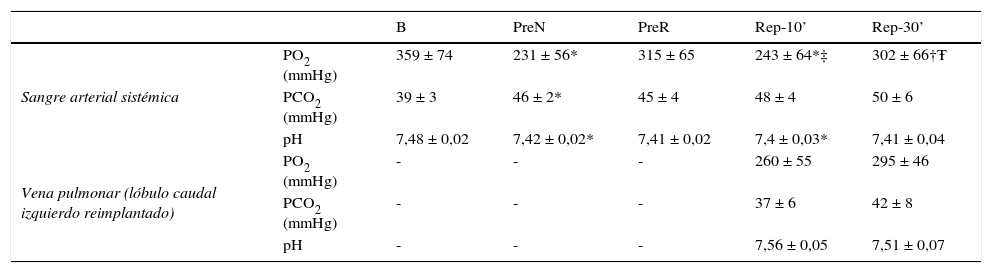
Los resultados de los estudios gasométricos en sangre arterial sistémica y en sangre venosa pulmonar procedente del lóbulo reimplantado se muestran en la tabla 2. Se observó un descenso de la PO2 arterial (p < 0,05) en las muestras extraídas antes de completar la neumonectomía y a los 10 min de reperfundir el pulmón implantado. La capacidad de oxigenación pulmonar mejoró significativamente tras 30 min de reperfusión.
Parámetros gasométricos
| B | PreN | PreR | Rep-10’ | Rep-30’ | ||
|---|---|---|---|---|---|---|
| Sangre arterial sistémica | PO2 (mmHg) | 359 ± 74 | 231 ± 56* | 315 ± 65 | 243 ± 64*‡ | 302 ± 66†Ŧ |
| PCO2 (mmHg) | 39 ± 3 | 46 ± 2* | 45 ± 4 | 48 ± 4 | 50 ± 6 | |
| pH | 7,48 ± 0,02 | 7,42 ± 0,02* | 7,41 ± 0,02 | 7,4 ± 0,03* | 7,41 ± 0,04 | |
| Vena pulmonar (lóbulo caudal izquierdo reimplantado) | PO2 (mmHg) | - | - | - | 260 ± 55 | 295 ± 46 |
| PCO2 (mmHg) | - | - | - | 37 ± 6 | 42 ± 8 | |
| pH | - | - | - | 7,56 ± 0,05 | 7,51 ± 0,07 |
Los datos se expresan como media ± error típico de la media.
*p < 0,05 vs B; †p < 0,05 vs PreN; ‡p < 0,05 vs PreR; Ŧp < 0,05 vs Rep-10’.
B: basal; PO2: presión parcial de oxígeno; PCO2: presión parcial de dióxido de carbono; PreN: preneumonectomía; PreR: pre-reperfusión; Rep-10’: 10 min postreperfusión; Rep-30’: 30 min postreperfusión.
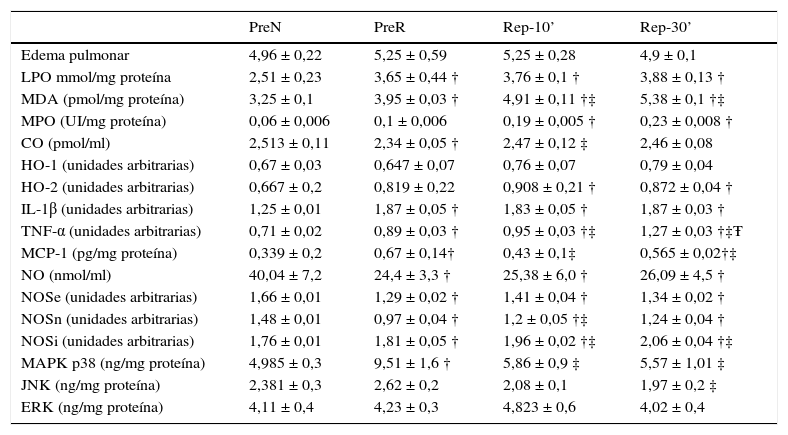
Las determinaciones de productos de peroxidación lipídica (LPO y MDA) en tejido pulmonar mostraron un aumento progresivo de los mismos en tejido pulmonar durante los periodos de isquemia y de reperfusión (tabla 3).
Determinaciones bioquímicas
| PreN | PreR | Rep-10’ | Rep-30’ | |
|---|---|---|---|---|
| Edema pulmonar | 4,96 ± 0,22 | 5,25 ± 0,59 | 5,25 ± 0,28 | 4,9 ± 0,1 |
| LPO mmol/mg proteína | 2,51 ± 0,23 | 3,65 ± 0,44 † | 3,76 ± 0,1 † | 3,88 ± 0,13 † |
| MDA (pmol/mg proteína) | 3,25 ± 0,1 | 3,95 ± 0,03 † | 4,91 ± 0,11 †‡ | 5,38 ± 0,1 †‡ |
| MPO (UI/mg proteína) | 0,06 ± 0,006 | 0,1 ± 0,006 | 0,19 ± 0,005 † | 0,23 ± 0,008 † |
| CO (pmol/ml) | 2,513 ± 0,11 | 2,34 ± 0,05 † | 2,47 ± 0,12 ‡ | 2,46 ± 0,08 |
| HO-1 (unidades arbitrarias) | 0,67 ± 0,03 | 0,647 ± 0,07 | 0,76 ± 0,07 | 0,79 ± 0,04 |
| HO-2 (unidades arbitrarias) | 0,667 ± 0,2 | 0,819 ± 0,22 | 0,908 ± 0,21 † | 0,872 ± 0,04 † |
| IL-1β (unidades arbitrarias) | 1,25 ± 0,01 | 1,87 ± 0,05 † | 1,83 ± 0,05 † | 1,87 ± 0,03 † |
| TNF-α (unidades arbitrarias) | 0,71 ± 0,02 | 0,89 ± 0,03 † | 0,95 ± 0,03 †‡ | 1,27 ± 0,03 †‡Ŧ |
| MCP-1 (pg/mg proteína) | 0,339 ± 0,2 | 0,67 ± 0,14† | 0,43 ± 0,1‡ | 0,565 ± 0,02†‡ |
| NO (nmol/ml) | 40,04 ± 7,2 | 24,4 ± 3,3 † | 25,38 ± 6,0 † | 26,09 ± 4,5 † |
| NOSe (unidades arbitrarias) | 1,66 ± 0,01 | 1,29 ± 0,02 † | 1,41 ± 0,04 † | 1,34 ± 0,02 † |
| NOSn (unidades arbitrarias) | 1,48 ± 0,01 | 0,97 ± 0,04 † | 1,2 ± 0,05 †‡ | 1,24 ± 0,04 † |
| NOSi (unidades arbitrarias) | 1,76 ± 0,01 | 1,81 ± 0,05 † | 1,96 ± 0,02 †‡ | 2,06 ± 0,04 †‡ |
| MAPK p38 (ng/mg proteína) | 4,985 ± 0,3 | 9,51 ± 1,6 † | 5,86 ± 0,9 ‡ | 5,57 ± 1,01 ‡ |
| JNK (ng/mg proteína) | 2,381 ± 0,3 | 2,62 ± 0,2 | 2,08 ± 0,1 | 1,97 ± 0,2 ‡ |
| ERK (ng/mg proteína) | 4,11 ± 0,4 | 4,23 ± 0,3 | 4,823 ± 0,6 | 4,02 ± 0,4 |
Los datos se expresan como media ± error típico de la media. El edema pulmonar se expresa por la relación: peso húmedo-peso seco/peso húmedo.
B: basal; CO: monóxido de carbono; ERK: quinasa regulada por señal extracelular; HO-1, HO-2: hemoxigenasa 1, 2; IL-1β: interleuquina-1β; JNK: quinasa c-Jun N-terminal;. LPO: hidroperóxido de lípidos; MCP-1: proteína quimiotáctica de monocitos-1; MDA: malondialdehído; MPO: mieloperoxidasa; NO: óxido nítrico; NOSe: óxido nítrico sintasa endotelial; NOSi: óxido nítrico sintasa inducible; NOSn: óxido nítrico sintasa neuronal; MAPK p38: proteína quinasa activada por mitógeno p38; PreN: preneumonectomía; PreR: Pre-reperfusión; Rep-10’: 10 min postreperfusión; Rep-30’: 30 min postreperfusión. TNF-α: factor de necrosis tumoral-α.
†p < 0,05 vs PreN; ‡p < 0,05 vs PreR; Ŧp < 0,05 vs Rep-10’.
La actividad de la enzima MPO medida en el tejido pulmonar se incrementó durante el procedimiento, observándose aumentos significativos durante la reperfusión del implante (tabla 3).
Sistema hemo-oxigenasa/monóxido de carbono (HO/CO)Durante la reperfusión, se observó un incremento de actividad de la isoforma constitutiva HO-2 en tejido pulmonar, mientras que los niveles sanguíneos de CO descendieron respecto de los basales tanto en la isquemia como en la reperfusión (tabla 3).
Citoquinas proinflamatoriasLos estudios con técnicas Western blot mostraron un incremento progresivo de las citoquinas TNF-α e IL-1β en el tejido pulmonar durante la isquemia y la reperfusión del mismo, como se refleja en la tabla 3.
Proteína quimiotáctica de monocitos-1La concentración tisular de MCP-1 en las biopsias pulmonares durante la isquemia y la reperfusión aumentó respecto de las mediciones basales, destacando este aumento tras el periodo de isquemia (tabla 3).
Metabolismo del óxido nítricoDurante el procedimiento se detectó un importante descenso de los niveles plasmáticos de NO. En el tejido pulmonar sometido a IR se observó una disminución de la actividad del las formas constitutivas de la óxido nítrico sintasa, mientras que se midió un incremento de actividad de la forma inducible (tabla 3).
Vía de señalización intracelular de las MAPKDe las diferentes rutas de señalización, se observó un incremento significativo de actividad de la MAPK p38, que presentó un pico de concentración tras la isquemia y mantuvo niveles elevados durante el tiempo de reperfusión (tabla 3).
DiscusiónLos modelos experimentales habituales que estudian la IR pulmonar suelen asociarse a enfriamiento progresivo del órgano, perfusión con soluciones de preservación o a circulación extracorpórea, por lo que no son idóneos para el estudio de situaciones como la reconstrucción de la arteria pulmonar o el trasplante lobular de donante vivo, en las que el órgano es sometido repentinamente a isquemia normotérmica o caliente. Es necesario el desarrollo y estudio de modelos experimentales que permitan el estudio de terapias que reduzcan el riesgo de lesión pulmonar aguda en estos pacientes. La mayoría de las investigaciones sobre isquemia caliente pulmonar se realiza en pequeños roedores mediante técnicas de oclusión vascular11,12, siendo menos frecuentes procedimientos quirúrgicos más parecidos a los realizados en humanos. El autotrasplante pulmonar en grandes mamíferos cumple en gran medida este objetivo; ha sido descrito en perros13–17, ovejas18 y cerdos19, pero pocos de estos trabajos profundizan en los mediadores inflamatorios durante la IR normotérmica20.
En el presente trabajo se investigaron cambios hemodinámicos, gasométricos y bioquímicos durante un procedimiento de autotrasplante pulmonar en cerdos. Van Raemdonck et al observaron que la tolerancia a isquemia caliente del pulmón de conejo no ventilado era de 1 h21 y Yamazaki et al, en un modelo canino de autotrasplante pulmonar, establecieron en 120 min el tiempo máximo tolerable de isquemia caliente para que el pulmón fuera viable y el animal sobreviviera22. El tiempo medio de isquemia pulmonar en nuestro estudio, 90 min, hace previsible el desarrollo de un daño pulmonar no letal pero con manifestaciones fisiopatológicas que permitan analizar el efecto de potenciales tratamientos.
En estudios experimentales de IR normotérmica, el daño pulmonar agudo se manifiesta clínicamente con aumento de la resistencia vascular pulmonar, edema pulmonar y deterioro de la capacidad de intercambio gaseoso. En la mayoría de estos estudios la isquemia se mantiene entre 2 y 3 h y estas alteraciones son patentes tras varias horas de reperfusión15,23,24. En nuestro modelo, diseñado para el estudio de la respuesta inflamatoria precoz, las diferentes variables hemodinámicas se mantuvieron relativamente estables a lo largo del procedimiento. Observamos un incremento significativo de la presión capilar pulmonar durante la reperfusión y alteraciones gasométricas tras el inicio de la ventilación unipulmonar y a los 10 min del inicio de la reperfusión. Consideramos que esta estabilidad clínica confiere mayor fiabilidad a los hallazgos bioquímicos observados.
En cuanto a los mecanismos bioquímicos implicados en el daño por IR de cualquier órgano, numerosos estudios señalan a la producción de radicales libres de oxígeno (RLO), la activación de leucocitos polimorfonucleares y la producción de citoquinas proinflamatorias, como importantes mediadores de la respuesta inflamatoria.
Durante la IR se generan RLO que provocan lisis celular por lipoperoxidación de los ácidos grasos libres de las membranas25. El grado de lipoperoxidación, e indirectamente la presencia de RLO, puede medirse por la presencia de lipoperóxidos (LPO) y de MDA tisular. En el presente modelo se observa un aumento progresivo de MDA y LPO en tejido pulmonar, desde la fase final de la isquemia hasta 30 min después de la reperfusión, lo que indica claramente que el aumento del estrés oxidativo tisular es una consecuencia precoz de la IR. Resultados similares, tras isquemia normotérmica, se han observado en pulmón aislado de rata26 y mediante oclusión in situ de la arteria pulmonar en perros27.
En nuestro experimento observamos un aumento significativo de MPO tisular durante la reperfusión, indicando un reclutamiento y activación progresiva de leucocitos en el tejido pulmonar. Hoy en día se sabe que el papel de los neutrófilos es importante en la fase tardía del la IR, pero durante las fases más precoces predomina el papel de macrófagos y linfocitos25. Eppinger et al, en un modelo de IR pulmonar caliente en ratas, demostraron que las alteraciones observadas durante los primeros 30 min de reperfusión eran independientes de la activación leucocitaria, cuyos efectos empezaban a ser patentes tras 4 h de reperfusión28. Nuestros datos muestran que esta infiltración/activación leucocitaria es un fenómeno que comienza a los pocos minutos de la reperfusión del órgano.
Una de las consecuencias del incremento tisular de RLO es la activación del sistema HO/CO. La HO es una enzima microsomal que cataliza el paso limitante de la degradación del grupo hemo, convirtiéndolo en biliverdina, CO y Fe+++. Existe una creciente evidencia del papel protector de esta enzima y sus metabolitos frente a la lesión por IR29. La isoforma constitutiva, HO-2, se expresa en condiciones basales en numerosos tejidos, mientras que la isoforma inducible, HO-1, también llamada proteína de choque térmico 32, se eleva ante situaciones de estrés como la IR. Por otra parte, el CO se presenta como una potente molécula antiinflamatoria y antiapoptótica, y su efecto parece mediado por la activación de la vía de las proteínas quinasas activadas por mitógenos (MAPK)30. En línea con estos trabajos, en nuestro estudio observamos un aumento de actividad tisular de HO durante la reperfusión, lo que indirectamente implica un aumento local de CO, mientras que el descenso de niveles de CO en sangre podría deberse a su consumo periférico al reaccionar con RLO y NO. Algunos autores han descrito resultados semejantes en ratas durante IR caliente hepática31 y pulmonar30.
Además de la activación del sistema HO/CO, se ha descrito que los RLO estimulan la síntesis y liberación de diferentes citoquinas y quemoquinas por parte de los macrófagos tisulares. Esta activación de los macrófagos se ha relacionado con la fase precoz de la respuesta inflamatoria a la IR25,32. La IL-1β y el TNF-α son citoquinas proinflamatorias cuya implicación en las primeras etapas de la respuesta inflamatoria a la IR es bien conocida, pero recientemente se ha atribuido un papel crucial en este proceso a la MCP-1, una quemoquina que regula la migración y activación de monocitos y macrófagos, aunque su función protectora o deletérea aún no ha sido bien definida32,33. En nuestro experimento, estas tres moléculas se elevan significativamente en el tejido pulmonar durante la isquemia, manteniéndose niveles elevados tras 10 y 30 min de reperfusión. Destaca el aumento progresivo del TNF-α, lo que respaldaría los resultados de otros autores que señalan a esta citoquina como un mediador inflamatorio crucial tanto en la fase inicial como tardía de la IR34. Nuestros datos podrían relacionarse con un estudio de Krishnadasan et al, realizado en ratones, en el que se observa un aumento de IL-1β y el TNF-α en tejido pulmonar a los 60 min de su reperfusión, tras un periodo de 90 min de isquemia caliente11. Sin embargo, en el mismo modelo experimental, la MCP-1 sólo es detectada tras 4 h de reperfusión pulmonar35, discrepancia que podría deberse a las diferencias en el modelo experimental o a la sensibilidad de la técnica de medición.
La alteración del metabolismo del NO ha sido ampliamente estudiada en diferentes modelos de IR, pero con conclusiones frecuentemente contradictorias debido al efecto polivalente del NO25. El NO producido por las isoformas constitutivas de la enzima óxido nítrico sintasa, NOSe y NOSn, sería responsable de efectos fisiológicos beneficiosos como el control del tono vascular o de la agregación de neutrófilos y plaquetas, mientras que el NO sintetizado por la isoforma inducible, NOSi, estaría implicado en procesos fisiopatológicos como el síndrome de IR36. Observamos en nuestro experimento un marcado descenso del NO sanguíneo y una menor actividad NOSe y NOSn en tejido pulmonar, tanto tras la isquemia como durante la reperfusión. Sin embargo, se produjo un significativo aumento de la actividad NOSi. En qué medida estos cambios, y su posible modificación terapéutica, afectan positiva o negativamente al daño por IR no ha sido aún aclarado y tendrá que ser objeto de ulteriores estudios.
Para profundizar en el perfil biomolecular de la respuesta inflamatoria de este modelo, estudiamos la activación de las MAPK. Recientes estudios implican a las MAPK como mediadores intracelulares de la respuesta inflamatoria a la IR, de forma que los componentes finales de esta vía de señalización se trasladan al núcleo y activan factores de transcripción y la expresión de determinados genes. Las MAPK incluyen diferentes familias de enzimas y rutas de activación, destacando las de la MAPK p38, la JNK y la ERK, pero el papel específico de cada una de ellas es aún discutido37. Las dos primeras son activadas por citoquinas proinflamatorias como la IL-1β y el TNF-α, y también por los RLO38. También se ha observado que la MCP-1 es capaz de activar las tres rutas de señalización39. Además, estudios in vitro (con células de endotelio pulmonar) e in vivo (IR caliente pulmonar en ratas) demuestra que el CO tiene un efecto anti-apoptótico durante la IR y que este efecto es mediado por la MAPK p3830. El aumento significativo de actividad MAPK p38 que detectamos en el pulmón isquémico sugieren la activación de esta vía de señalización intracelular en respuesta a diferentes mediadores como la IL-1β, TNF-α, MCP-1 o el CO que también encontramos elevados al final del periodo de isquemia. Igualmente, la generación de RLO, evidente por los productos de peroxidación lipídica, podría estar implicada en esta activación de la vía de las MAPK. Futuras investigaciones deberán esclarecer en qué grado esta vía amplifica y perpetúa la respuesta inflamatoria o, por el contrario, desempeña un papel protector frente a la IR.
En resumen, se presenta un procedimiento experimental de autotrasplante pulmonar en cerdo como modelo de estudio del síndrome de IR pulmonar en grandes mamíferos, y por ende en humanos. Se describen en profundidad cambios hemodinámicos, gasométricos y bioquímicos que pueden servir de parámetros de control en el estudio de nuevas terapias moduladoras del daño pulmonar agudo por IR. El modelo, además de presentar gran similitud con procedimientos quirúrgicos como la angioplastia pulmonar o el trasplante lobular de donante vivo, podría servir como paso previo al desarrollo de técnicas de autotrasplante pulmonar que, en un futuro, ofrezcan una esperanza real de tratamiento quirúrgico a pacientes con cáncer de pulmón y baja reserva funcional respiratoria. La asociación de novedosos procedimientos como la perfusión pulmonar ex vivo40 podría ampliar aún más el campo de investigación de este modelo.
FinanciaciónEl estudio ha contado con la financiación del Fondo de Investigación Sanitaria (FIS PI070840 y FIS PI070481) y de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR 2006/121).
Conflicto de interesesLos autores declaran no tener conflictos de intereses.