La neumonía asociada a ventilación mecánica es la primera causa de mortalidad por infecciones nosocomiales en la unidad de cuidados intensivos. Su incidencia oscila entre el 9 y el 67% de los pacientes que requieren ventilación mecánica. Hay múltiples factores de riesgo asociados y aumenta significativamente la estancia en la unidad de cuidados intensivos y en el hospital. El coste adicional por cada neumonía asociada a ventilación mecánica oscila entre 9.000 y 31.000 €.
Por tanto, su prevención debe considerarse una prioridad. Ésta podría disminuir tanto la morbimortalidad asociada como el coste de la atención, y mejorar la seguridad del paciente.
Ventilator-associated pneumonia (VAP) is the first cause of mortality due to nosocomial infections in the intensive care unit. Its incidence ranges from 9% to 67% of patients on mechanical ventilation. Risk factors are multiple and are associated with prolonged stays in hospital and intensive care units. Additional costs for each episode of VAP range from 9,000 € to 31,000 €.
Thus, its prevention should be considered as a priority. This prevention could decrease associated morbidity, mortality, costs, and increase patient safety.
La neumonía asociada a ventilación mecánica (NAV) es la primera causa de mortalidad atribuible a infecciones nosocomiales y tiene el mayor impacto en la morbimortalidad de los pacientes hospitalizados en la unidad de cuidados intensivos (UCI)1–4. Su incidencia oscila entre el 9 y el 67% de los pacientes intubados y se notifican de 4,4 a 15,2 casos por cada 1.000 días de ventilación mecánica (VM)5.
Los factores de riesgo para la NAV son múltiples y se dividen en modificables y no modificables2,6,7 (tabla 1). Ésta se clasifica en temprana o tardía según se desarrolle en los primeros 4 días de VM o posteriormente8,9. Los organismos causantes de la NAV temprana son los que generalmente producen las neumonías adquiridas en la comunidad, y los responsables de las NAV tardías generalmente son organismos multirresistentes10,11.
Factores de riesgo para la neumonía asociada a ventilación mecánica2,6,7
| Factores modificables |
| 1. Posición supina |
| 2. Sobredistensión gástrica |
| 3. Contaminación de las tubuladuras del respirador |
| 4. Traslados frecuentes del paciente |
| 5. Baja presión del neumotaponamiento |
| Factores no modificables |
| 1. Sexo masculino |
| 2. Edad mayor de 60 años |
| 3. Síndrome de dificultad respiratoria aguda del adulto |
| 4. Fallo multiorgánico |
| 5. Coma |
| 6. Enfermedad pulmonar obstructiva crónica |
| 7. Traqueotomía |
| 8. Reintubación |
| 9. Neurocirugía |
| 10. Traumatismo craneoencefálico con seguimiento de la presión intracraneal |
La mortalidad atribuible, en la que influyen múltiples factores, puede ser superior al 50%, y es más alta en el grupo de pacientes con bacteriemia o infecciones por Pseudomonas aeruginosa o Acinetobacter sp.12–16.
Varios autores han evidenciado un aumento de la estancia en la UCI debido a la NAV de entre 4,3 y 13 días13,14,17. El coste por cada NAV se calcula entre 9.000 y 31.000 €2,3,13,18.
Varios autores han descrito una disminución de la incidencia de la NAV del 44,5 al 59% aplicando la Ventilator Bundle, que es un grupo de intervenciones sencillas que se aplican conjuntamente, así como una reducción de los días de VM y los de estancia en la UCI y el hospital19–21.
Blot et al22, en el estudio EVIDENCE, realizaron un cuestionario sobre el conocimiento de las guías de prevención de la NAV entre profesionales de enfermería. Los encuestados obtuvieron una puntuación global del 41,2% de respuestas correctas.
Diferentes estudios han evaluado el cumplimiento de las guías. Rello et al23 comunicaron un incumplimiento de las guías no farmacológicas por parte del personal médico de un 19,6%. Las causas más comunes de no cumplimiento fueron el desacuerdo con los resultados de los ensayos, el hecho de no disponer de los recursos y el coste. Respecto al personal de enfermería, Ricart et al24 notificaron una falta de cumplimiento de las guías de un 22,3%. Las razones más comunes fueron la no disponibilidad de los recursos, el malestar del paciente, el desacuerdo con los resultados de los ensayos, el miedo a los efectos adversos y el coste.
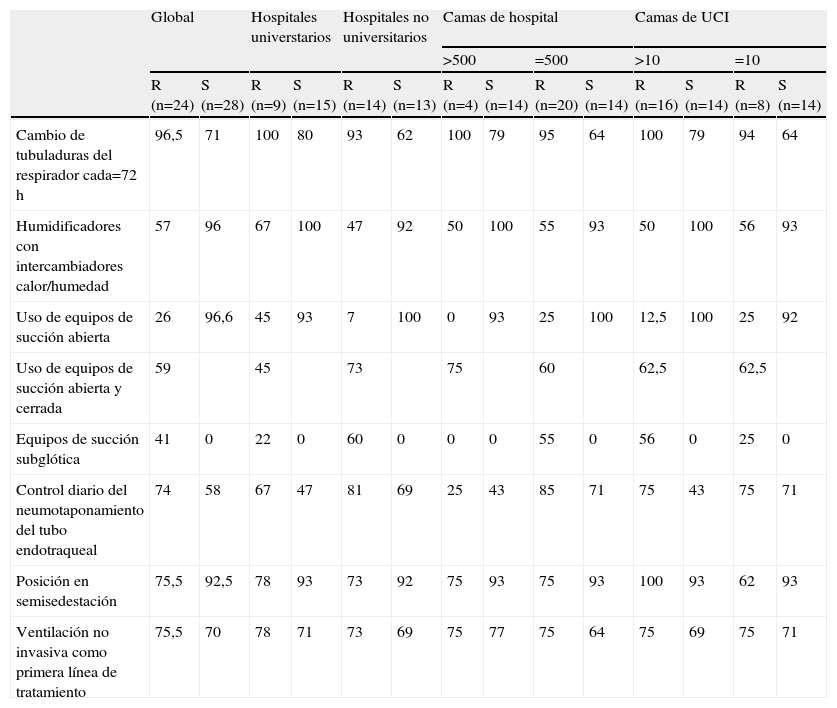
Al menos 2 estudios multicéntricos han evaluado el cumplimiento de las medidas no farmacológicas y han encontrado un cumplimiento elevado, aunque hay diferencias entre ellos, tal como se muestra en la tabla 225,26.
Comparación del cumplimiento de medidas no farmacológicas25,26
| Global | Hospitales universtarios | Hospitales no universitarios | Camas de hospital | Camas de UCI | ||||||||||
| >500 | =500 | >10 | =10 | |||||||||||
| R (n=24) | S (n=28) | R (n=9) | S (n=15) | R (n=14) | S (n=13) | R (n=4) | S (n=14) | R (n=20) | S (n=14) | R (n=16) | S (n=14) | R (n=8) | S (n=14) | |
| Cambio de tubuladuras del respirador cada=72h | 96,5 | 71 | 100 | 80 | 93 | 62 | 100 | 79 | 95 | 64 | 100 | 79 | 94 | 64 |
| Humidificadores con intercambiadores calor/humedad | 57 | 96 | 67 | 100 | 47 | 92 | 50 | 100 | 55 | 93 | 50 | 100 | 56 | 93 |
| Uso de equipos de succión abierta | 26 | 96,6 | 45 | 93 | 7 | 100 | 0 | 93 | 25 | 100 | 12,5 | 100 | 25 | 92 |
| Uso de equipos de succión abierta y cerrada | 59 | 45 | 73 | 75 | 60 | 62,5 | 62,5 | |||||||
| Equipos de succión subglótica | 41 | 0 | 22 | 0 | 60 | 0 | 0 | 0 | 55 | 0 | 56 | 0 | 25 | 0 |
| Control diario del neumotaponamiento del tubo endotraqueal | 74 | 58 | 67 | 47 | 81 | 69 | 25 | 43 | 85 | 71 | 75 | 43 | 75 | 71 |
| Posición en semisedestación | 75,5 | 92,5 | 78 | 93 | 73 | 92 | 75 | 93 | 75 | 93 | 100 | 93 | 62 | 93 |
| Ventilación no invasiva como primera línea de tratamiento | 75,5 | 70 | 78 | 71 | 73 | 69 | 75 | 77 | 75 | 64 | 75 | 69 | 75 | 71 |
En conclusión, es notoria la importancia de difundir las medidas preventivas de la NAV con el objetivo de mejorar los resultados.
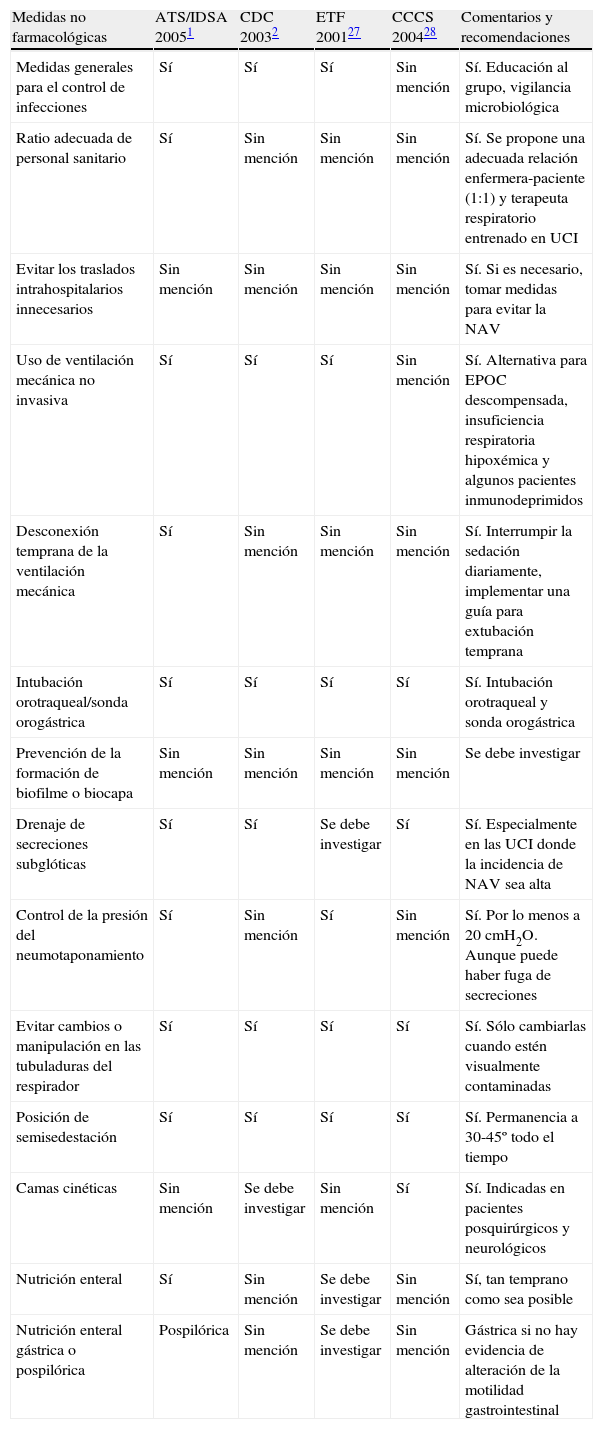
En este artículo se revisan las medidas no farmacológicas, que son las más económicas y, en su mayoría, fáciles de aplicar, dada la importancia de difundirlas para poder mejorar las consecuencias derivadas de la NAV (tabla 3)27,28.
Prevención de la neumonía asociada a ventilación mecánica (NAV). Resumen de las medidas no farmacológicas
| Medidas no farmacológicas | ATS/IDSA 20051 | CDC 20032 | ETF 200127 | CCCS 200428 | Comentarios y recomendaciones |
| Medidas generales para el control de infecciones | Sí | Sí | Sí | Sin mención | Sí. Educación al grupo, vigilancia microbiológica |
| Ratio adecuada de personal sanitario | Sí | Sin mención | Sin mención | Sin mención | Sí. Se propone una adecuada relación enfermera-paciente (1:1) y terapeuta respiratorio entrenado en UCI |
| Evitar los traslados intrahospitalarios innecesarios | Sin mención | Sin mención | Sin mención | Sin mención | Sí. Si es necesario, tomar medidas para evitar la NAV |
| Uso de ventilación mecánica no invasiva | Sí | Sí | Sí | Sin mención | Sí. Alternativa para EPOC descompensada, insuficiencia respiratoria hipoxémica y algunos pacientes inmunodeprimidos |
| Desconexión temprana de la ventilación mecánica | Sí | Sin mención | Sin mención | Sin mención | Sí. Interrumpir la sedación diariamente, implementar una guía para extubación temprana |
| Intubación orotraqueal/sonda orogástrica | Sí | Sí | Sí | Sí | Sí. Intubación orotraqueal y sonda orogástrica |
| Prevención de la formación de biofilme o biocapa | Sin mención | Sin mención | Sin mención | Sin mención | Se debe investigar |
| Drenaje de secreciones subglóticas | Sí | Sí | Se debe investigar | Sí | Sí. Especialmente en las UCI donde la incidencia de NAV sea alta |
| Control de la presión del neumotaponamiento | Sí | Sin mención | Sí | Sin mención | Sí. Por lo menos a 20 cmH2O. Aunque puede haber fuga de secreciones |
| Evitar cambios o manipulación en las tubuladuras del respirador | Sí | Sí | Sí | Sí | Sí. Sólo cambiarlas cuando estén visualmente contaminadas |
| Posición de semisedestación | Sí | Sí | Sí | Sí | Sí. Permanencia a 30-45º todo el tiempo |
| Camas cinéticas | Sin mención | Se debe investigar | Sin mención | Sí | Sí. Indicadas en pacientes posquirúrgicos y neurológicos |
| Nutrición enteral | Sí | Sin mención | Se debe investigar | Sin mención | Sí, tan temprano como sea posible |
| Nutrición enteral gástrica o pospilórica | Pospilórica | Sin mención | Se debe investigar | Sin mención | Gástrica si no hay evidencia de alteración de la motilidad gastrointestinal |
ATS/IDSA: American Thoracic Society/Infectious Diseases Society of America; CCCS: Canadian Critical Care Society; CDC: Centers for Disease Control and Prevention; EPOC: enfermedad pulmonar obstructiva crónica; ETF: European Task Force; UCI: unidad de cuidados intensivos.
Éstas se han dirigido a evitar la transmisión cruzada y a optimizar el uso de los dispositivos invasivos29–31. Dentro de las estrategias para prevenir la NAV figura un programa estricto de control de infecciones que incluye la educación del equipo sanitario, la adecuada desinfección de las manos, la utilización de los métodos de barrera y un protocolo de vigilancia microbiológica2,32,33.
Higiene de las manosLos organismos causantes de la NAV, en especial bacilos gramnegativos y Staphylococcus aureus, son propios del ambiente hospitalario, y su transmisión al paciente ocurre frecuentemente a partir de la colonización de las manos del personal sanitario34–36.
Las guías para la higiene de las manos en los centros sanitarios del Center for Disease Control and Prevention describen que, según múltiples estudios observacionales, el cumplimiento de la recomendación de lavarse las manos entre el personal sanitario es escaso, cercano al 40%30. Bonten et al37,38 comunican que el cumplimiento de esta medida es inferior entre los médicos (enfermeras: 40%; médicos: 25%). Sin embargo, el uso de soluciones alcohólicas ha aumentado el cumplimiento (del 48 al 66%) y disminuido la tasa de infecciones nosocomiales (del 17 al 9,9%)39.
Ratio adecuada de personal sanitarioNeedleman et al40 han encontrado una asociación importante entre el mayor número de horas de atención por la enfermera jefe y una disminución de la incidencia de 5 efectos adversos—infección urinaria, hemorragia digestiva alta, neumonía nosocomial, choque o paro cardíaco y “fallo en el rescate” (muerte de un paciente asociada a una complicación)—y de la estancia hospitalaria.
Cho et al41, en un estudio retrospectivo que incluyó a 124.204 pacientes, concluyeron que la sobrecarga de trabajo para el equipo de enfermería contribuye a que se presenten errores en las medidas de control de infecciones, como la desinfección de las manos y el aislamiento de pacientes infectados por organismos multirresistentes.
La participación de terapeutas respiratorios facilita el éxito de los programas educativos y de la implementación de protocolos dirigidos a disminuir la incidencia de NAV42. Se recomienda tener una ratio enfermera:paciente de 1:1. Además, los terapeutas respiratorios deben intervenir en la UCI con el objetivo de compartir responsabilidades y trabajar en equipo.
Evitar los traslados intrahospitalarios innecesariosA menudo es necesario el traslado de los pacientes con VM desde la UCI a otras áreas del hospital para la realización de pruebas diagnósticas y terapéuticas. Los pacientes pueden permanecer en posición supina durante largos períodos de tiempo y las tubuladuras del respirador son manipuladas a menudo, lo que facilita la aspiración de secreciones contaminadas. El traslado intrahospitalario de pacientes con VM aumenta el riesgo de desarrollar NAV.
Al menos 2 estudios describen que, de los pacientes que tuvieron como mínimo un traslado fuera de la UCI, el 24–26% presentó NAV, mientras que entre los pacientes no trasladados ésta ocurrió en un 4–10% (p=0,001)43,44. A pesar de todo, no se ha establecido la causa fisiopatológica que explica estos hallazgos. Se recomienda que, cuando sea necesario el traslado de estos pacientes, se tomen medidas preventivas, tales como suspender la nutrición enteral 4h antes del traslado, evitar el desplazamiento de condensaciones hacia la vía aérea inferior al manipular las tubuladuras del respirador y, si no hay contraindicaciones, trasladar al paciente en posición semisentado.
Uso de la ventilación mecánica no invasiva (VMNI)Los pacientes intubados tienen hasta 21 veces más riesgo de adquirir una neumonía nosocomial que los pacientes sin vía aérea artificial45. Además de la depresión de los mecanismos de defensa del paciente, la inserción de un tubo endotraqueal es una maniobra invasiva que puede producir lesiones en la mucosa traqueal y anular el reflejo tusígeno. Esto lleva a la acumulación de secreciones subglóticas que generan inóculos bacterianos y facilitan su entrada al pulmón46–48.
Las guías de la American Thoracic Society/Infectious Disease Society of America recomiendan la VMNI como alternativa para los pacientes con exacerbaciones agudas de enfermedad pulmonar obstructiva crónica o insuficiencia respiratoria hipoxémica, y para algunos pacientes inmunodeprimidos con insuficiencia respiratoria, infiltrados pulmonares y fiebre. La evidencia indica que se produce una disminución de la incidencia de neumonía nosocomial y de la mortalidad1,49,50.
La utilización de la VMNI para evitar la reintubación posterior a una extubación fallida es una medida cuestionada. En un estudio multicéntrico realizado en 37 centros de 8 países, se demostró que la aplicación de VMNI a pacientes con extubación fallida no evitó la necesidad de reintubación ni redujo la mortalidad. Sin embargo, el tiempo de reintubación fue mayor en los pacientes tratados con VMNI51. A pesar de esto, puede ser una alternativa para la extubación en pacientes con hipercapnia52–55.
Desconexión temprana de la ventilación mecánicaAunque no siempre es posible evitar la intubación endotraqueal, debe haber una estrategia para retirarla. La reducción del tiempo de VM tiene la capacidad de reducir la incidencia de NAV de manera importante y disminuir los costes56,57. Estudios no controlados han evidenciado que el seguimiento de un protocolo dirigido a la extubación temprana de los pacientes ventilados disminuye la duración de la VM58–61. Marelich et al42 publicaron los resultados de un ensayo clínico controlado en 385 pacientes donde los terapeutas respiratorios y enfermeras aplicaron un protocolo para la extubación temprana, el cual permitió reducir el tiempo de VM en 2,33 días. Ese mismo año, se publicó un metaanálisis donde se recomendaba la utilización de protocolos de desconexión temprana de la VM con la participación de enfermeras y terapeutas respiratorios en su implementación62. Estas estrategias—interrupción diaria de la sedación (a pesar de ser una medida farmacológica) y seguimiento de un protocolo de extubación temprana—han demostrado acortar el tiempo de la VM42,62–65.
Intubación orotraqueal/sonda orogástricaEstá demostrado que la inserción de sondas o tubos que impidan el drenaje de los senos paranasales durante más de 48h favorece la aparición de sinusitis nosocomial66,67. Holzapfel et al68 demostraron que, comparada con la intubación nasotraqueal, la intubación orotraqueal se asociaba a una menor incidencia de NAV. Se recomienda la utilización de la vía orofaríngea para la intubación endotraqueal y la inserción de sondas orogástricas, dada la disminución de la incidencia de sinusitis y de NAV69–72. Un estudio clínico controlado demostró que la búsqueda sistemática de sinusitis maxilar en los pacientes intubados por vía nasotraqueal podría disminuir la incidencia de NAV72. Sin embargo, no se recomienda la búsqueda sistemática de sinusitis en pacientes con intubación orotraqueal, ya que la literatura médica no es concluyente67,73.
Prevención de la formación de biofilme o biocapaEn 1986 Sottile et al74 describieron la presencia del biofilme o biocapa, compuesto por un agregado de bacterias formado en el interior del tubo endotraqueal que protege a los organismos de la acción de los antibióticos y de las defensas del paciente. Feldman et al75 estudiaron la colonización de los tubos endotraqueales de pacientes con VM y encontraron que todos los tubos tenían una biocapa en el tercio distal. Adair et al76 investigaron la resistencia antibiótica de la biocapa del tubo endotraqueal y los organismos pulmonares en la NAV, y concluyeron que el 70% de los pacientes con NAV tenía los mismos organismos en la biocapa del tubo y en las secreciones traqueales.
Otra estrategia consiste en evitar o reducir la formación de la biocapa, para lo cual se han diseñado tubos endotraqueales recubiertos de plata77. La plata previene la formación de la biocapa, tiene actividad bactericida, reduce la carga bacteriana y disminuye la inflamación77. Rello et al78 informaron de que la utilización del tubo endotraqueal recubierto de plata es segura, retrasa la colonización del tubo endotraqueal, reduce la formación de la biocapa y disminuye la carga bacteriana, y concluyeron que se requieren estudios clínicos controlados para establecer la eficacia del dispositivo en la prevención de la NAV. En noviembre de 2007, la Food and Drug Administration autorizó la venta del tubo endotraqueal recubierto de plata. En un ensayo clínico controlado con 2.003 pacientes intubados durante más de 24h, Kollef et al79 concluyeron que aquellos en quienes se utilizó el tubo endotraqueal recubierto de plata tuvieron una incidencia menor de NAV comprobada microbiológicamente (p=0,03). Además, se retrasó el desarrollo de NAV con el tubo endotraqueal recubierto de plata cuando se comparó con un tubo similar sin plata (p=0,005).
Drenaje de secreciones subglóticasUno de los mecanismos principales para el desarrollo de NAV es la colonización bacteriana de la orofaringe y la aspiración de secreciones subglóticas80. La presencia del tubo endotraqueal lleva a la acumulación de secreciones de la orofaringe o del tracto gastrointestinal por encima del balón del neumotaponamiento46 y, a pesar de un adecuado control de la presión del neumotaponamiento, puede haber aspiración de secreciones81. Por eso es lógico pensar que aspirar las secreciones subglóticas continuamente puede prevenir la aparición de NAV. Se diseñó para este efecto un tubo endotraqueal con un canal dorsal adicional que permite la aspiración continua o intermitente de secreciones subglóticas (HI-LO Evac-tube, Mallinckrodt, Hazelwood, Missouri, EE.UU.). Al menos 5 ensayos clínicos controlados y un metaanálisis demuestran una disminución de la incidencia de NAV, especialmente la de inicio temprano, pero no de la mortalidad, estancia en la UCI o tiempo de VM82–85. Es importante mencionar que el canal dorsal para la aspiración de secreciones puede obstruirse. Rello et al47 observaron una disfunción en la aspiración continua de secreciones con este tubo en el 34% de los pacientes. Además, una publicación reciente que ha investigado la causa de esta disfunción encontró que la más frecuente era el prolapso de la mucosa traqueal a través del puerto de succión subglótica, lo que expone al paciente a un posible riesgo de lesión traqueal en dicha zona86. Este estudio se realizó en pacientes con aspiración continua de secreciones subglóticas, de modo que queda por establecer si esta disfunción no se presenta en la succión intermitente.
Todo y la limitada evidencia, hay un tubo endotraqueal, Microcuff™, que incorpora un neumotaponamiento con membrana de poliuretano ultradelgada (7μ, en comparación con las 50μ de los neumotaponamientos convencionales) y proporciona un mejor sellado de la vía aérea, con lo que se reduce la formación de los pliegues que se crean cuando se infla el neumotaponamiento87. Por otra parte, el tubo endotraqueal SealGuard Evac (Mallinckrodt) incorpora neumotaponamiento de poliuretano y succión de secreciones subglóticas88. Un estudio prospectivo y aleatorizado con 280 pacientes comparó el tubo convencional con el tubo endotraqueal SealGuard Evac (Mallinckrodt), y encontró una disminución significativa, de más de 3 veces, de la incidencia de NAV temprana y tardía utilizando el drenaje de secreciones subglóticas de forma intermitente88.
En un estudio aleatorizado, Bouza et al89 compararon la aspiración convencional con la aspiración de secreciones subglóticas de forma continua en pacientes operados de cirugía cardíaca, y concluyeron que los pacientes con más de 48h de VM y aspiración subglótica tuvieron una incidencia menor de NAV (p=0,03) y que la medida disminuyó el uso de antibióticos (p<0,001).
Control de la presión del neumotaponamientoUna función fundamental del neumotaponamiento del tubo endotraqueal es sellar la vía aérea de tal manera que no permita la fuga de aire al exterior, que no comprometa la perfusión de la mucosa traqueal y que impida el paso de secreciones subglóticas a la vía aérea inferior47,90,91. Los neumotaponamientos convencionales, de alto volumen y baja presión, no pueden prevenir las microaspiraciones ni con presiones de hasta 60cmH2O92. A pesar de un control automático de la presión del balón, puede haber paso de secreciones hacia la vía aérea inferior81. Teniendo en cuenta la información disponible, se recomienda mantener la presión del balón de neumotaponamiento entre 20 y 30cmH2O, todo y que la prevención de las microaspiraciones no sea óptima, ya que el aumento de la presión del neumotaponamiento por encima de 30cmH2O puede producir lesión traqueal1,6,93–97.
Evitar cambios o manipulación de las tubuladuras del respiradorLas condensaciones que aparecen en las tubuladuras del respirador que utilizan humidificadores, especialmente los de agua caliente, corren el riesgo de contaminarse. Craven et al98 demostraron una mayor incidencia de NAV en los pacientes a quienes se cambiaban los circuitos del ventilador cada 24h, comparados con aquellos en quienes el cambio se realizaba cada 48h. Posteriormente Kollef99 describió que cambiar las tubuladuras del respirador cada 7 días no aumentaba la incidencia de NAV, pero sí incrementaba los costes.
Se deben implementar procedimientos adecuados para drenar las condensaciones y evitar que el personal sanitario facilite su desplazamiento hacia la vía aérea inferior con los movimientos del paciente o de las tubuladuras100–102. Por tanto, se recomienda cambiarlas cuando se encuentren visualmente contaminadas de sangre, vómito o secreciones purulentas1,103,104.
Con respecto a los humidificadores de agua caliente y a los intercambiadores de calor y humedad, se considera que estos últimos pueden reducir la acumulación de condensaciones y la colonización de las tubuladuras, pero no se ha asociado a una disminución de la incidencia de NAV103,105,106.
Posición de semisedestaciónAl menos 3 estudios con marcación radiactiva del contenido gástrico han demostrado que el reflujo gástrico y su posterior aspiración en los pacientes con VM podían evitarse con la semisedestación92,107,108. La posición supina facilita la aspiración de secreciones subglóticas, especialmente cuando el paciente recibe nutrición enteral92,109,110. Drakulovic et al110 demostraron el beneficio de la semisedestación (45°), que disminuyó la tasa de aspiración orogástrica y la incidencia de NAV (3 veces menos)110,111; además se observó una tendencia a disminuir la tasa de mortalidad cuando se comparó con la posición supina neutra (0°)110. Recientemente, Van Nieuwenhoven et al112, en un ensayo clínico controlado, cuestionan la viabilidad de mantener a los pacientes constantemente en semisedestación (45°) y su utilidad para prevenir la NAV. En 4 UCI de Holanda aleatorizaron a 221 pacientes en 2 grupos: uno con la cabecera a 45° y otro a 10°. No se logró la meta de cabecera a 45° durante el 85% del tiempo y la diferencia obtenida entre los 2 grupos (28 frente a 10°) no previno el desarrollo de NAV.
Se recomienda la semisedestación especialmente en pacientes que reciban nutrición enteral, debido al bajo coste que esta intervención requiere, su fácil aplicación y su establecida eficacia.
Camas cinéticasLos pacientes hospitalizados en la UCI, debido a su confinamiento en cama, corren más riesgo de presentar complicaciones pulmonares (atelectasias, mal manejo de las secreciones, etc.). Se ha propuesto el uso de camas cinéticas, que permiten la rotación continua de estos pacientes para disminuir la incidencia de la NAV. Ensayos clínicos controlados han demostrado una reducción del riesgo de NAV en el grupo de pacientes quirúrgicos y neuroquirúrgicos, sin demostrarlo en pacientes médicos113,114. Sin embargo, la utilización de estas camas tiene múltiples barreras: el mayor coste, la posibilidad de desconexión de catéteres endovenosos y la dificultad para controlar las zonas de presión113.
Nutrición enteralEstá establecido que la desnutrición en el paciente crítico produce deterioro del sistema inmunitario, disfunción del impulso respiratorio y debilidad de los músculos respiratorios, lo que lleva a la dependencia prolongada del respirador y al aumento de la morbimortalidad115, además de asociarse a mayor estancia hospitalaria115,116. A pesar de que no hay ensayos clínicos controlados que de manera significativa y definitiva demuestren beneficios en los resultados clínicos importantes, tales como la duración de la VM, de la estancia en la UCI y la mortalidad, el soporte nutricional se considera un componente integral de lo que debe ser el tratamiento óptimo de los pacientes en la UCI117,118.
Sin embargo, este tratamiento no está exento de complicaciones. La nutrición enteral se ha considerado un factor de riesgo para la NAV dada la posibilidad de aspiración del contenido gástrico2,92,109,117,119,120. Una publicación reciente describe que el establecimiento y seguimiento de un protocolo de nutrición enteral, que incluía la semisedestación (> 30°), logró que el 85% de los pacientes obtuviera la meta de nutrición enteral (un 78% antes del protocolo) y que la incidencia de NAV se redujera de 6,8 a 3,2 por cada 1.000 días de VM121.
En una revisión sistemática de la literatura médica que comparó la nutrición enteral con la parenteral en pacientes críticos con respecto a su evolución, no hubo diferencias estadísticamente significativas en cuanto a mortalidad, pero sí un aumento significativo de las complicaciones infecciosas, tales como NAV, neumonía aspirativa, infecciones urinarias, bacteriemia, abscesos intraabdominales y sepsis asociada a catéter, además de incrementar los costes122,123.
Un metaanálisis reciente de 11 ensayos clínicos controlados, realizados en la UCI, que evaluó la mortalidad, el riesgo de aspiración y la neumonía, no encontró diferencias significativas en la evolución y concluyó que, en los pacientes críticos sin evidencia de alteración de la motilidad gastrointestinal, la utilización de nutrición pospilórica no se asociaba a beneficios clínicos124.
ConclusionesEste artículo revisa la evidencia relacionada con las medidas no farmacológicas que han demostrado tener un impacto en la prevención de la NAV. Se recomienda implementar algunas de estas intervenciones de forma conjunta para obtener mejores resultados.
FinanciaciónFinanciado en parte por CibeRes y AGAUR SGR 05/520.
El Dr. Restrepo cuenta con una beca de UTHSCSA y NIH a través del mecanismo del CTSA (KL2 RR025766).
Conflictos de interesesEl Dr. Restrepo ejerce de speaker para Ortho-McNeil-Janssen, Johnson & Johnson, Pfizer, BARD Inc. y Covidien. También pertenece al comité de asesoramiento de Ortho-McNeil-Janssen y Johnson & Johnson.