En los últimos años existe un creciente interés por las acciones extraóseas de la vitaminaD.
En este artículo revisamos la fisiología de la vitaminaD, los aspectos fisiopatológicos asociados a su déficit y la evidencia existente sobre su papel etiopatogénico en enfermedades respiratorias. Teniendo en cuenta las acciones pleiotrópicas de la vitaminaD, existe plausibilidad biológica sobre un potencial papel patogénico del déficit de esta vitamina en el desarrollo de diversas enfermedades respiratorias. Sin embargo, los numerosos estudios epidemiológicos que han encontrado asociación entre niveles bajos de vitaminaD y mayor riesgo de desarrollar diversas enfermedades respiratorias o de conllevar un peor pronóstico no permiten demostrar causalidad. Los análisis post hoc de algunos ensayos clínicos, especialmente en enfermedad pulmonar obstructiva crónica (EPOC) y asma, parecen demostrar que ciertos subtipos de pacientes podrían beneficiarse de la corrección del déficit de vitaminaD. En este sentido, resultará interesante averiguar si las variantes genéticas implicadas en el metabolismo de la vitaminaD pueden explicar las diferencias interindividuales encontradas en cuanto al efecto del déficit de vitaminaD y la respuesta a su corrección. En último término, solo los ensayos clínicos adecuadamente diseñados permitirán determinar si los suplementos de 25-OHD pueden tener un efecto preventivo o mejorar la evolución de las distintas enfermedades respiratorias en las que se ha descrito asociación epidemiológica entre su pronóstico y el déficit de esta vitamina.
There has been growing interest in recent years in the extraosseous effects of vitamin D.
In this article, we review the physiology of vitaminD, the physiopathological effects associated with vitaminD deficit and the available evidence on its etiopathogenic role in respiratory diseases. Given the pleiotropic actions of vitaminD, it is biologically plausible that the deficit of this vitamin could play a pathogenic role of in the development of various respiratory diseases. However, the many epidemiological studies that have shown an association between low vitaminD levels and a higher risk of developing various respiratory diseases or a poorer prognosis if they do appear, were unable to show causality. Post-hoc analyses of some clinical trials, particularly in chronic obstructive pulmonary disease (COPD) and asthma, appear to suggest that some patient subtypes may benefit from correction of a vitaminD deficit. In this respect, it would be interesting to determine if the interindividual differences found in the effect of vitaminD deficit and responses to correcting this deficit could be explained by the genetic variants involved in vitaminD metabolism. Ultimately, only appropriately designed clinical trials will determine whether 25-OHD supplements can prevent or improve the course of the various respiratory diseases in which an epidemiological association between prognosis and vitaminD deficit has been described.
En los últimos años existe un creciente interés por las acciones extraóseas de la vitaminaD. En este artículo revisamos la fisiología de la vitaminaD, los aspectos fisiopatológicos asociados a su déficit y la evidencia existente sobre su papel etiopatogénico en enfermedades respiratorias.
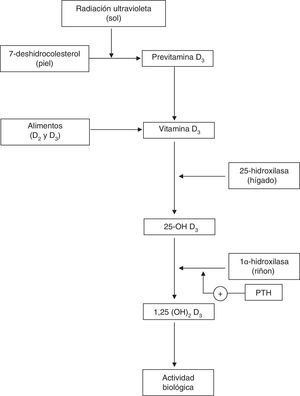
Fisiología de la vitaminaDLa vitaminaD desempeña un papel clave en la homeostasis del calcio y el metabolismo óseo (fig. 1)1. La forma más importante de vitaminaD (colecalciferol o vitaminaD3) se sintetiza en la piel a partir del 7-deshidrocolesterol, además de encontrarse en determinados alimentos. La vitaminaD obtenida a través de la síntesis cutánea o la dieta resulta biológicamente inactiva. Para su activación se requiere una primera hidroxilación hepática para su transformación en 25 hidroxi-vitaminaD (25-OHD), cuyos niveles reflejan los depósitos de vitaminaD en el organismo. La 25-OHD, requiere una segunda hidroxilación, fundamentalmente en el riñón, para ejercer su acción biológica1-3. La producción renal de la 1,25(OH)2D, se regula estrechamente mediante la hormona paratiroidea (PTH) y las concentraciones séricas de calcio y fósforo4. La unión de la 1,25(OH)2D a su receptor situado en núcleo celular, presente fundamentalmente en intestino delgado, riñón y hueso, entre otros tejidos1-3, estimula la absorción intestinal del calcio y el fósforo de la dieta5,6 y promueve la reabsorción renal de calcio2. La inadecuada mineralización de la matriz de colágeno asociada al déficit de vitaminaD causa raquitismo7 y osteomalacia8.
Niveles óptimos, prevalencia del déficit y requerimientos de vitaminaDEn la actualidad existe un intenso debate sobre cuáles son los niveles óptimos de vitaminaD y sobre la definición de deficiencia de vitaminaD1,2. La mayoría de autores definen el déficit de vitaminaD como niveles séricos de 25-OHD <20ng/ml1,3,9, y la insuficiencia, entre 20-30ng/ml. Se considera que la deficiencia y la insuficiencia de vitaminaD afectan a más de la mitad de la población general10, representando un problema emergente de salud en todo el mundo11. En nuestro país, un tercio de la población española presenta riesgo de desarrollar déficit de vitaminaD12–14.
En cuanto a los requerimientos de vitaminaD para el mantenimiento del metabolismo óseo, en población general adulta se recomiendan dosis de 800-1.000UI/día, si bien se han sugerido dosis diarias superiores (hasta 2.000UI/día) en sujetos ancianos, con osteoporosis o en tratamiento con esteroides que presentan deficiencia de vitaminaD15. Con respecto a los posibles efectos deletéreos de los suplementos de vitaminaD, no se ha evidenciado toxicidad en pacientes con niveles de 25-OHD por debajo de 100ng/ml9.
Efectos extraóseos de la vitaminaD y su papel en otras enfermedadesLa distribución ubicua del receptor de vitaminaD (VDR) permite inferir que esta vitamina desempeña funciones no relacionadas con el metabolismo fosfocálcico o que sus receptores pueden activarse por otros ligandos1. Así, se ha descrito actividad 1-α hidroxilasa en numerosas células extrarrenales que facilitaría la activación de la 25-OHD. El hecho de que la unión de la vitaminaD a su receptor específico regule la transcripción de unos 200genes implicados en la regulación del crecimiento y la maduración celulares, la inhibición del eje renina-angiotensina y la angiogénesis, la secreción de insulina y la sensibilidad a la misma, ha dado lugar a la hipótesis de que existe un potencial papel etiopatogénico en diversas enfermedades extraesqueléticas3,16. En este sentido, se han descrito asociaciones epidemiológicas entre déficit de vitaminaD y determinadas neoplasias, diabetes, enfermedades autoinmunes y cardiovasculares, entre otras1,2,15. Existen numerosas evidencias que apoyan el papel de la vitaminaD sobre el sistema inmunitario que, a su vez, condicionaría un posible efecto en el desarrollo de enfermedades respiratorias. Conviene señalar que casi todas las células mediadoras de la respuesta inmunitaria innata y adaptativa, incluyendo linfocitos CD4 y CD8 activados, linfocitosB, neutrófilos y células presentadoras de antígeno como macrófagos y células dendríticas, presentan receptores de vitaminaD que actuarían como un potente inmunomodulador17, lo que justifica una menor respuesta inmunitaria innata de monocitos y macrófagos con niveles de 25-OHD <20ng/ml18. En teoría, la activación macrofágica dependiente de la vitaminaD permitiría neutralizar microorganismos implicados en infecciones respiratorias y promovería un efecto inmunomodulador de la respuesta adaptativa impidiendo el efecto deletéreo de la misma sobre el huésped16. En línea con estos datos, se ha observado una asociación epidemiológica entre el déficit de vitaminaD y un aumento del riesgo de determinadas infecciones respiratorias19,20. También por este mecanismo la vitaminaD protegería frente a infecciones respiratorias que pueden desencadenar empeoramiento del asma21. Además, el efecto regulador de esta vitamina sobre las células inmunitarias implicadas en la patogenia del asma podría ejercer un efecto beneficioso sobre la hiperreactividad bronquial22.
Se ha sugerido que la mayor susceptibilidad a infecciones respiratorias en sujetos con déficit de vitaminaD favorecería la inflamación crónica en las vías aéreas que desempeña un papel central en la patogenia de la enfermedad pulmonar obstructiva crónica (EPOC)23. Resulta interesante que la 1,25-OHD constituye un potente inhibidor de la maduración de las células dendríticas, disminuyendo la expresión de moléculas de claseii del complejo mayor de histocompatibilidad y de coestimulación, reduciendo de esta forma la producción de citocinas proinflamatorias como interleucinas 2, 12, 23 e interferón gamma24. El déficit de vitaminaD contribuiría a la fisiopatología de la EPOC mediante sus efectos sobre el músculo liso de la vía aérea y el remodelado pulmonar por sus acciones sobre la proliferación de fibroblastos, la síntesis de colágeno y la modulación de los niveles de metaloproteinasa de matriz25. Además, la osteoporosis inducida por el déficit de vitaminaD aumenta el riesgo de fracturas costales y compresiones vertebrales, especialmente en estadios graves de la EPOC, disminuyendo el FEV1 y la FVC26,27. El efecto de la vitaminaD sobre el músculo esquelético ha planteado la hipótesis de que su déficit contribuye a la debilidad de los músculos respiratorios observada en las fases avanzadas de la EPOC22.
A continuación se revisa la relación entre la vitaminaD y distintas enfermedades respiratorias, basándose en estudios observacionales y ensayos clínicos.
Enfermedad pulmonar obstructiva crónicaEstudios recientes han mostrado que, comparados con fumadores sin EPOC, los pacientes con EPOC avanzada presentan frecuentemente déficit de vitaminaD, con prevalencias entre el 33 y el 77%, resultando mayores en fases avanzadas de la enfermedad28–30. Entre los factores que explicarían este hecho cabe destacar la alteración de la síntesis cutánea de vitaminaD debida a la edad y a los efectos tóxicos del tabaco, la escasa exposición a la luz solar, el aumento del catabolismo de la vitaminaD por los glucocorticoides, su secuestro en los adipocitos, una reducida absorción intestinal y la deficiente activación hepática y renal de los precursores de la vitaminaD, entre otros24.
Diversos estudios revelan una disminución del aporte diario dietético de vitaminaD en pacientes con EPOC31, especialmente en ancianos32. Aunque el aumento de la ingesta de vitaminaD parece asociarse a una mejor función respiratoria y una menor prevalencia de la EPOC33, un reciente estudio longitudinal en fumadores activos con EPOC leve o moderada no encontró relación entre niveles basales de vitaminaD bajos y el deterioro de la función respiratoria34 o el riesgo de presentar agudizaciones35. Otro reciente estudio prospectivo de cohortes tampoco demostró relación entre niveles basales de vitaminaD sérica y la tasa de mortalidad en un grupo de pacientes con EPOC moderada o grave36. Sin embargo, Janssens et al.29 encontraron que los niveles séricos circulantes de 25-OHD se correlacionan significativamente con el FEV1 en pacientes con EPOC, comparado con fumadores sanos. Una limitación de alguno de los estudios anteriormente mencionados es no haber tenido en cuenta la variación estacional y la latitud que modifican la exposición a la luz solar y, en consecuencia, los niveles de vitaminaD. En este sentido, se ha descrito una asociación más robusta entre niveles de vitaminaD y función respiratoria durante el invierno37.
Se ha señalado que la deficiencia de vitaminaD, debido al hiperparatiroidismo secundario que induce, se asocia al desarrollo de osteoporosis, y que su adecuada suplementación reduce el riesgo de fracturas osteoporóticas2,3. Diversos estudios observacionales han mostrado correlación entre densidad mineral ósea, gravedad de la EPOC y capacidad de ejercicio, demostrándose también asociación entre niveles de vitaminaD y la saturación de oxígeno38,39. Otro interesante estudio observacional confirmó una mayor prevalencia de osteoporosis y osteopenia en pacientes con EPOC, comparado con exfumadores sanos40.
La disparidad de resultados sobre la relación entre niveles séricos de 25-OHD y función respiratoria en pacientes con EPOC ha planteado la hipótesis de que existan subgrupos de pacientes con EPOC con distinta predisposición genética para desarrollar déficit de vitaminaD. De este modo, se ha descrito que la asociación entre niveles séricos de vitaminaD y la gravedad de la EPOC es especialmente significativa en los individuos portadores de determinadas variantes del gen de la proteína transportadora de vitaminaD, que a su vez se asocia de forma independiente con un aumento del riesgo de padecer EPOC29,41. Por otra parte, se ha comunicado que otros polimorfismos del gen de la proteína transportadora de vitaminaD protegerían del riesgo de desarrollar EPOC42, o de presentar exacerbaciones de esta enfermedad43. Por el contrario, no se ha encontrado ningún vínculo entre polimorfismos del VDR y riesgo de desarrollar infecciones respiratorias en pacientes con EPOC44.
En un reciente ensayo clínico se analizó el efecto de la administración de dosis altas de vitaminaD sobre la incidencia de exacerbaciones en pacientes con EPOC, sin encontrarse diferencias significativas en el tiempo hasta la primera exacerbación o primera hospitalización por este motivo, en la tasa anual de exacerbaciones, ni en la mortalidad45. Sin embargo, un análisis post hoc mostró que entre los pacientes con déficit grave de vitaminaD (25-OHD<10ng/ml) la tasa anual de exacerbación de la EPOC se redujo en un 43%, y que en este subgrupo de pacientes el tratamiento con vitaminaD se asoció con un aumento de la capacidad fagocítica de los monocitos. Conviene señalar que la administración de vitaminaD sin tener en cuenta los niveles basales o la presencia de polimorfismos genéticos de la proteína transportadora de dicha vitamina podrían haber minimizado el potencial efecto beneficioso de la suplementación. En un reanálisis de los datos de este estudio se observó que los suplementos de vitaminaD se asocian a una mejoría significativa de la fuerza muscular inspiratoria y del consumo de oxígeno46. Sin embargo, otro estudio piloto de suplementación con vitaminaD en EPOC no demostró mejoría del rendimiento físico a corto plazo47. Teniendo en cuenta los escasos ensayos clínicos y su limitado tamaño muestral, parecen necesarios estudios más amplios, con mayor periodo de seguimiento y que analicen el impacto de la administración de vitaminaD en pacientes con deficiencia vitamínica demostrada48. Actualmente se está realizando un estudio (VidiCo, NCT00977873) que analiza el efecto de la administración de vitaminaD sobre el riesgo de desarrollar exacerbaciones en pacientes con EPOC menos grave. Además, el subestudio Lung VITAL investigará el efecto de administrar 2.000UI diarias de vitaminaD sobre el riesgo de presentar exacerbaciones en pacientes con EPOC.
AsmaDesde hace varios años se ha sugerido un papel patogénico de la vitaminaD tanto en el desarrollo como en el curso del asma49. Existen datos de estudios poblacionales que muestran una mayor prevalencia de déficit de vitaminaD en niños asmáticos comparado con controles50. Además, el déficit de vitaminaD se asocia con una mayor probabilidad de presentar exacerbaciones graves en niños con asma persistente leve-moderada51. Asimismo, los niños con déficit de vitaminaD presentan reducción de la función pulmonar, mayor reactividad bronquial al ejercicio52 y aumento de las necesidades de corticoides inhalados53. Por contra, se han asociado niveles elevados de vitaminaD con una mejor función pulmonar, menor hiperreactividad bronquial y mejor respuesta a glucocorticoides54. Diversos estudios han analizado la relación entre exposición prenatal a la vitaminaD y el desarrollo de asma en la infancia, con resultados muy dispares55–57. En un estudio reciente se ha encontrado que en niños asmáticos con déficit de vitaminaD y asma grave resistente al tratamiento existe un aumento del músculo liso bronquial y un peor control de la enfermedad58.
Infección de vías respiratoriasLa mayor incidencia de infecciones respiratorias durante el invierno, coincidiendo con una menor exposición solar y niveles séricos subóptimos de vitaminaD, ha servido como base para establecer una hipotética relación entre los niveles de esta vitamina y una mayor susceptibilidad a desarrollar infecciones respiratorias. Como se mencionó previamente, la vitaminaD ejerce una acción moduladora sobre distintos mediadores celulares y moleculares implicados en la respuesta inflamatoria frente a diversos estímulos. Resulta interesante la asociación entre la expresión de polimorfismos del gen del VDR como el Fok-I y el Taq-I y un aumento del riesgo de infecciones de vías respiratorias59. A pesar de haberse observado una asociación entre niveles de vitaminaD e incidencia de infección de vías altas en el estudio NHANESIII, especialmente en pacientes diagnosticados de EPOC y/o asma60, un reciente estudio concluyó que la administración de suplementos de vitaminaD3 no reduce la incidencia de infecciones respiratorias de vías altas61. Sin embargo, conviene señalar que la inclusión en este ensayo de pacientes que no presentaban basalmente deficiencia de vitaminaD pudo haber atenuado el efecto de la suplementación.
TuberculosisDiversos estudios han demostrado que los pacientes con tuberculosis presentan una disminución de niveles séricos de vitaminaD comparado con controles sanos62,63. Al igual que en otras infecciones respiratorias, la vitaminaD desempeña un importante papel en la respuesta inmunitaria frente a la infección por Mycobacterium tuberculosis. Se han identificado varios polimorfismos del VDR y de la proteína transportadora de vitaminaD que influyen en el riesgo de desarrollar tuberculosis, así como en la respuesta al tratamiento64. En un ensayo clínico aleatorizado la administración de vitaminaD aumentó la proporción de conversión en esputo y de mejoría radiológica comparado con placebo65.
Fibrosis quísticaDiversos estudios han demostrado que los pacientes con fibrosis quística presentan niveles bajos de 25-OHD, pese al aporte de suplementos, y que los pacientes con fibrosis quística y déficit de vitaminaD requieren una mayor suplementación de vitaminaD66,67. Sin embargo, un metaanálisis reciente concluyó que no hay evidencia de beneficio o daño con los suplementos de vitaminaD en pacientes con fibrosis quística68.
Cáncer de pulmónAunque existen datos experimentales que sugieren un efecto supresor de la vitaminaD sobre el desarrollo de cáncer de pulmón, los estudios observacionales muestran datos controvertidos sobre la relación entre niveles de esta vitamina y riesgo de cáncer de pulmón69 En uno de estos estudios se observó que el déficit de vitaminaD era un factor de riesgo para cáncer pulmonar únicamente en mujeres y pacientes jóvenes69. Por contra, otro estudio no mostró relación entre niveles de vitaminaD y supervivencia global de pacientes con cáncer de pulmón70. A pesar de haberse descrito un efecto sinérgico de la vitaminaD con la quimioterapia del cáncer de pulmón, no se ha demostrado un claro efecto beneficioso de la vitaminaD en este tipo de neoplasias71,72. Sin embargo, resulta interesante que el incremento de la expresión del VDR en el cáncer de pulmón se asocia a una mayor supervivencia, atribuido a un menor estado proliferativo y a la detención del ciclo celular en la fase G173,74.
Enfermedad pulmonar intersticialSe ha postulado una hipotética implicación de la vitaminaD en el desarrollo de las enfermedades pulmonares intersticiales (EPI) al participar en la fibroproliferación como respuesta a la inflamación y en el daño producido sobre el epitelio bronquial75. En este sentido, se ha descrito una alta prevalencia de déficit de vitaminaD en pacientes con EPI, especialmente en aquellos con enfermedades del tejido conectivo; al asociarse a una función pulmonar reducida se ha sugerido un papel patogénico de esta vitamina76.
SarcoidosisEn el caso de la sarcoidosis, la vitaminaD y sus metabolitos ejercen un efecto negativo, debido a la posible inducción de hipercalcemia que aparece en aproximadamente el 5% de los pacientes77,78. También se ha observado que en pacientes con sarcoidosis los niveles elevados de 1,25(OH)2D se asocian a una mayor necesidad de tratamiento crónico y de ciclos repetidos de agentes inmunosupresores79.
Trasplante pulmonarDiversos estudios observacionales han mostrado una alta prevalencia de déficit de vitaminaD en receptores de trasplante de pulmón, encontrándose una relación directa entre niveles bajos de esta vitamina y reducción de la función pulmonar, peor evolución clínica y mayor incidencia de fenómenos de rechazo graves80,81. Un estudio reciente concluyó que la mortalidad al año en pacientes que mantuvieron déficit vitaminaD tras el trasplante fue mayor que en los que presentaron niveles normales de vitaminaD, y que el déficit de vitaminaD se asoció con una mayor incidencia de rechazo agudo y de infecciones82.
ConclusionesTeniendo en cuenta las acciones pleiotrópicas de la vitaminaD, existe cierta plausibilidad biológica de un potencial papel patogénico del déficit de esta vitamina en el desarrollo de diversas enfermedades respiratorias. Sin embargo, los numerosos estudios epidemiológicos que han encontrado asociación entre niveles bajos de vitaminaD y mayor riesgo de desarrollar diversas enfermedades respiratorias o de conllevar un peor pronóstico no permiten demostrar causalidad. Los análisis post hoc de algunos ensayos clínicos, especialmente en EPOC y asma, sugieren que ciertos subtipos de pacientes se beneficiarían de la corrección del déficit de vitaminaD. En este sentido, resultará interesante averiguar si las variantes genéticas implicadas en el metabolismo de la vitaminaD pueden explicar las diferencias interindividuales encontradas en cuanto al efecto del déficit de vitaminaD y la respuesta a su corrección. En último término, solo los ensayos clínicos adecuadamente diseñados permitirán determinar si los suplementos de 25-OHD pueden tener un efecto preventivo o mejorar la evolución de las distintas enfermedades respiratorias en las que se ha descrito asociación epidemiológica entre su pronóstico y el déficit de esta vitamina.
FinanciaciónEl presente manuscrito no cuenta con financiación alguna.
Conflicto de interesesLos autores declaran que no existe conflicto de interés relacionado con el contenido de este manuscrito.