Las escalas de probabilidad clínica (EPC) determinan la probabilidad pretest de embolia pulmonar (EP) y valoran la necesidad de las pruebas a realizar en estos pacientes. Nuestro objetivo es investigar si el diagnóstico de EP se realiza de acuerdo a las guías de práctica clínica.
Material y métodosEstudio retrospectivo de las sospechas clínicas de EP en el servicio de urgencias entre enero de 2010 y diciembre de 2012. Se consideró positivo un dímero-D≥500 ng/ml. El diagnóstico de EP se hizo en función de la angiotomografía computarizada multicorte y, en menor medida, por otras técnicas de imagen. La EPC utilizada fue la de Ginebra revisada.
ResultadosLas sospechas de EP fueron 3.924 (56% mujeres). El diagnóstico se estableció en 360 pacientes (9,2%) y la incidencia fue de 30,6 casos/100.000 habitantes/año. La sensibilidad y valor predictivo negativo del dímero-D fueron 98,7 y 99,2% respectivamente. La EPC solamente se calculó en 24 casos (0,6%) y los algoritmos diagnósticos no se siguieron en 2.125 pacientes (54,2%): en 682 (17,4%) porque no se pudo estimar la probabilidad clínica y en 482 (37,6%), 852 (46,4%) y 109 (87,9%) con probabilidad clínica baja, intermedia y alta respectivamente, porque no se aplicaron los algoritmos diagnósticos para tales probabilidades.
ConclusionesLas EPC para el diagnóstico de la EP raramente se calculan y el seguimiento del algoritmo diagnóstico en la práctica clínica es bajo. Esto puede ocasionar el realizar técnicas innecesarias que pueden dar lugar a importantes efectos secundarios, o a incurrir en un elevado riesgo de infradiagnóstico.
Clinical probability scores (CPS) determine the pre-test probability of pulmonary embolism (PE) and assess the need for the tests required in these patients. Our objective is to investigate if PE is diagnosed according to clinical practice guidelines.
Materials and methodsRetrospective study of clinically suspected PE in the emergency department between January 2010 and December 2012. A D-dimer value≥500 ng/ml was considered positive. PE was diagnosed on the basis of the multislice computed tomography angiography and, to a lesser extent, with other imaging techniques. The CPS used was the revised Geneva scoring system.
ResultsThere was 3,924 cases of suspected PE (56% female). Diagnosis was determined in 360 patients (9.2%) and the incidence was 30.6 cases per 100,000 inhabitants/year. Sensitivity and the negative predictive value of the D-dimer test were 98.7% and 99.2% respectively. CPS was calculated in only 24 cases (0.6%) and diagnostic algorithms were not followed in 2,125 patients (54.2%): in 682 (17.4%) because clinical probability could not be estimated and in 482 (37.6%), 852 (46.4%) and 109 (87.9%) with low, intermediate and high clinical probability, respectively, because the diagnostic algorithms for these probabilities were not applied.
ConclusionsCPS are rarely calculated in the diagnosis of PE and the diagnostic algorithm is rarely used in clinical practice. This may result in procedures with potential significant side effects being unnecessarily performed or to a high risk of underdiagnosis.
Las escalas de probabilidad clínica (EPC) son unas herramientas fiables y no invasivas que, basadas en la historia y en los hallazgos clínicos, determinan la probabilidad pretest y valoran la necesidad de llevar a cabo distintas pruebas diagnósticas en pacientes con sospecha de una embolia pulmonar (EP).
Se han validado diversos modelos de EPC para el diagnóstico de la EP, entre ellos la escala de Ginebra revisada1–4. Estas escalas, como parte de un algoritmo diagnóstico y en combinación con la determinación de un dímero-D (DD) en sangre, nos pueden excluir una EP en grupos de bajo riesgo y no son necesarias más exploraciones para descartar el diagnóstico5–12. A pesar de que parece bien establecido que las pruebas de imagen solamente deberían llevarse a cabo cuando existe una alta probabilidad clínica (PC) de EP10,12, es evidente que las guías no se siguen y se realiza una angiotomografía computarizada multicorte (TCMC) de pulmón o una gammagrafía pulmonar (GGP) de ventilación/perfusión (V/Q) como primer paso en el diagnóstico de la EP9,11. Así, en los últimos años, varios estudios han demostrado unas tasas de positividad en las TCMC, en pacientes con sospecha de EP, menores del 10%13–16, mientras que en ensayos clínicos prospectivos de hace 2 décadas, en los que se hacían evaluaciones clínicas pretest antes de la GGP, se demostraba la presencia de la enfermedad en al menos la tercera parte de los pacientes17,18. Estos resultados sugieren sobreuso de la técnica y, posiblemente, pobres criterios de selección. La probabilidad de tener una TCMC positiva para EP, en pacientes sin factores de riesgo, es extremadamente pequeña (0,95%), por lo que parece que, en este escenario, la TCMC es, probablemente, innecesaria19. Así, el uso indiscriminado de la TCMC es un motivo de preocupación por la mayor exposición a la radiación9.
Nuestra hipótesis es que, en la práctica, las EPC tienen una baja implantación y los protocolos diagnósticos no se aplican. Los objetivos de nuestro estudio son conocer, ante la sospecha de una EP, el grado de seguimiento de las EPC y de los algoritmos diagnósticos en la práctica clínica de nuestro hospital.
Material y métodosSelección de pacientesSe revisaron retrospectivamente las historias clínicas de los pacientes que acudieron al servicio de Urgencias de un hospital terciario que atiende a una población de 392.359 habitantes, por sospecha de EP. El periodo del estudio fue de enero de 2010 a diciembre de 2012. La búsqueda se hizo a través de las peticiones de DD y de TCMC solicitadas desde el servicio de Urgencias y se descartaron las que eran por sospecha de trombosis venosa profunda u otras causas.
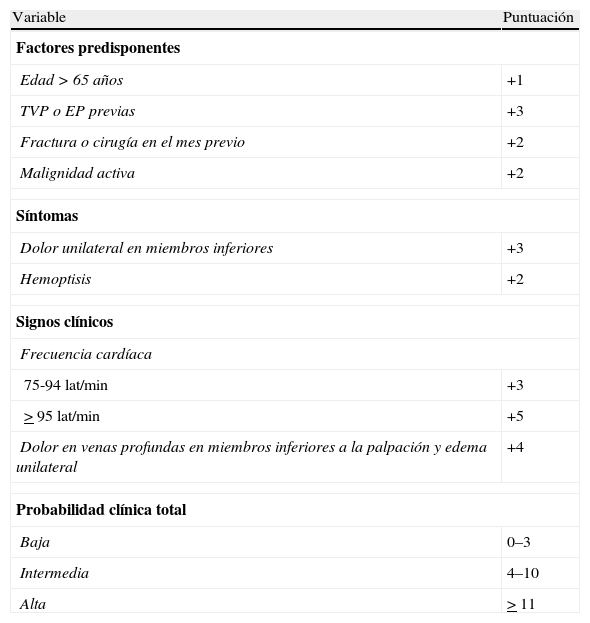
Se valoró si a los pacientes se les había realizado, durante el proceso diagnóstico, la EPC de Ginebra revisada o si se disponía de los datos necesarios en la historia clínica para calcularla a posteriori (tabla 1)4. Una vez calculada la EPC, se valoró si se había seguido el algoritmo diagnóstico adecuado20.
Escala de Ginebra revisada
| Variable | Puntuación |
| Factores predisponentes | |
| Edad>65 años | +1 |
| TVP o EP previas | +3 |
| Fractura o cirugía en el mes previo | +2 |
| Malignidad activa | +2 |
| Síntomas | |
| Dolor unilateral en miembros inferiores | +3 |
| Hemoptisis | +2 |
| Signos clínicos | |
| Frecuencia cardíaca | |
| 75-94lat/min | +3 |
| >95lat/min | +5 |
| Dolor en venas profundas en miembros inferiores a la palpación y edema unilateral | +4 |
| Probabilidad clínica total | |
| Baja | 0–3 |
| Intermedia | 4–10 |
| Alta | >11 |
EP: embolia pulmonar; TVP: trombosis venosa profunda.
El diagnóstico de EP se estableció por los resultados de una GGP de V/Q de alta probabilidad (de acuerdo a los criterios del estudio PIOPED: 2 o más defectos de perfusión segmentaria grandes [>75% de un segmento] sin anormalidades en la gammagrafía de ventilación o en la radiografía de tórax, o sustancialmente mayores que los defectos de ventilación o que las alteraciones radiológicas coincidentes; 2 o más defectos de perfusión segmentaria moderados [>25% y≤75% de un segmento] sin alteraciones coincidentes en la gammagrafía de ventilación o en la radiografía de tórax, con un defecto de perfusión segmentario grande no coincidente; 4 o más defectos de perfusión segmentaria moderados sin alteraciones en la gammagrafía de ventilación o en la radiografía de tórax)17, una ecografía con compresión venosa de los miembros inferiores que demostrara una trombosis venosa profunda proximal en pacientes con hallazgos no diagnósticos en la GGP de V/Q21, o una TCMC de tórax diagnóstica22. La GGP de V/Q solamente se llevó a cabo si existía riesgo de nefropatía por contraste al hacer la TCMC23 (creatinina sérica>1,3mg/dl; valores normales: 0,4-1,1mg/dl).
Análisis de dímero-DEl DD en suero se determinó mediante el HemosIL D-Dimer HS 500 (Instrumentation Laboratory, Milano Italia), un inmunoanálisis de partículas de látex automatizado en el ACL TOP 700 (Instrumentation Laboratory, Milano Italia) (inmunoanálisis turbidimétrico). El punto de corte para el DD fue de 500ng/ml. La sensibilidad y el valor predictivo negativo de este test, para todos los subgrupos de PC, es del 100% y el límite inferior del IC 95%, en pacientes con PC baja o moderada, es mayor del 95%24.
En los pacientes no diagnosticados de EP se registró si tenían un diagnóstico alternativo en el momento del alta de Urgencias. A todos se les hizo un seguimiento de 3 meses, a través de la historia clínica, para descartar una posible repetición de la EP.
Todos los pacientes firmaban un consentimiento informado antes de hacer la TCMC o la GGP pulmonar de V/Q. El estudio fue aprobado por el Comité Ético de Investigación Clínica de Galicia (registro 2012/430).
Análisis estadísticoSe llevó a cabo un análisis descriptivo de las variables analizadas mediante el porcentaje para las cualitativas, y la media, mediana, desviación típica y rango para las cuantitativas. Para la comparación de las variables cualitativas se utilizó la prueba de la Chi-cuadrado (χ2). Para el análisis de los datos se utilizó el programa estadístico de SPSS versión 18.0 para Windows. Para todo el análisis, el nivel de significación se fijó en 0,05.
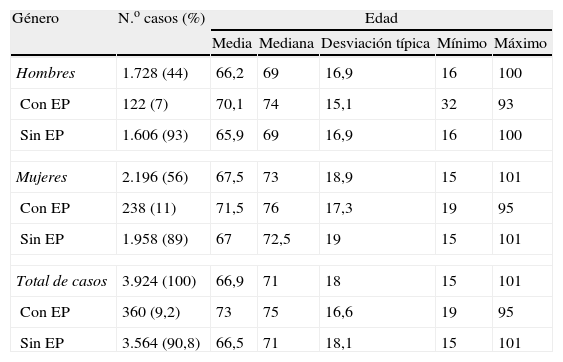
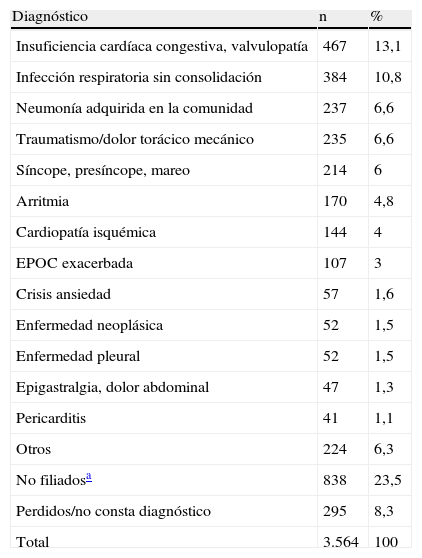
ResultadosDurante el periodo del estudio se establecieron 3.924 sospechas de EP (56% mujeres) y el diagnóstico se confirmó en 360 pacientes (9,2%). Sus datos demográficos constan en la tabla 2, y en la tabla 3 se muestran los diagnósticos más frecuentes de los pacientes que no presentaron una EP.
Datos demográficos de los pacientes estudiados
| Género | N.o casos (%) | Edad | ||||
| Media | Mediana | Desviación típica | Mínimo | Máximo | ||
| Hombres | 1.728 (44) | 66,2 | 69 | 16,9 | 16 | 100 |
| Con EP | 122 (7) | 70,1 | 74 | 15,1 | 32 | 93 |
| Sin EP | 1.606 (93) | 65,9 | 69 | 16,9 | 16 | 100 |
| Mujeres | 2.196 (56) | 67,5 | 73 | 18,9 | 15 | 101 |
| Con EP | 238 (11) | 71,5 | 76 | 17,3 | 19 | 95 |
| Sin EP | 1.958 (89) | 67 | 72,5 | 19 | 15 | 101 |
| Total de casos | 3.924 (100) | 66,9 | 71 | 18 | 15 | 101 |
| Con EP | 360 (9,2) | 73 | 75 | 16,6 | 19 | 95 |
| Sin EP | 3.564 (90,8) | 66,5 | 71 | 18,1 | 15 | 101 |
EP: embolia pulmonar.
Diagnósticos alternativos a la embolia pulmonar
| Diagnóstico | n | % |
| Insuficiencia cardíaca congestiva, valvulopatía | 467 | 13,1 |
| Infección respiratoria sin consolidación | 384 | 10,8 |
| Neumonía adquirida en la comunidad | 237 | 6,6 |
| Traumatismo/dolor torácico mecánico | 235 | 6,6 |
| Síncope, presíncope, mareo | 214 | 6 |
| Arritmia | 170 | 4,8 |
| Cardiopatía isquémica | 144 | 4 |
| EPOC exacerbada | 107 | 3 |
| Crisis ansiedad | 57 | 1,6 |
| Enfermedad neoplásica | 52 | 1,5 |
| Enfermedad pleural | 52 | 1,5 |
| Epigastralgia, dolor abdominal | 47 | 1,3 |
| Pericarditis | 41 | 1,1 |
| Otros | 224 | 6,3 |
| No filiadosa | 838 | 23,5 |
| Perdidos/no consta diagnóstico | 295 | 8,3 |
| Total | 3.564 | 100 |
EPOC: enfermedad pulmonar obstructiva crónica.
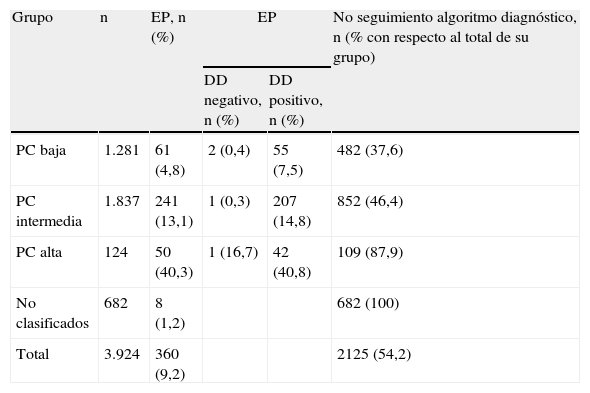
La EPC solamente constaba en la historia clínica en 24 pacientes (0,6%). En otros 3.218 (82%) se pudo hacer este cálculo a posteriori y, finalmente, en 682 casos (17,4%), los datos de la historia clínica no la permitieron calcular. En los 3.242 pacientes en los que se conoció la PC, esta fue baja en 1.281 (39,5%), intermedia en 1.837 (56,7%) y alta en 124 (3,8%) (tabla 4).
Número de pacientes incluidos por grupo de probabilidad; número de pacientes con embolia pulmonar (sin y con el resultado del dímero-D) y pacientes en los que no se siguió el algoritmo diagnóstico
| Grupo | n | EP, n (%) | EP | No seguimiento algoritmo diagnóstico, n (% con respecto al total de su grupo) | |
| DD negativo, n (%) | DD positivo, n (%) | ||||
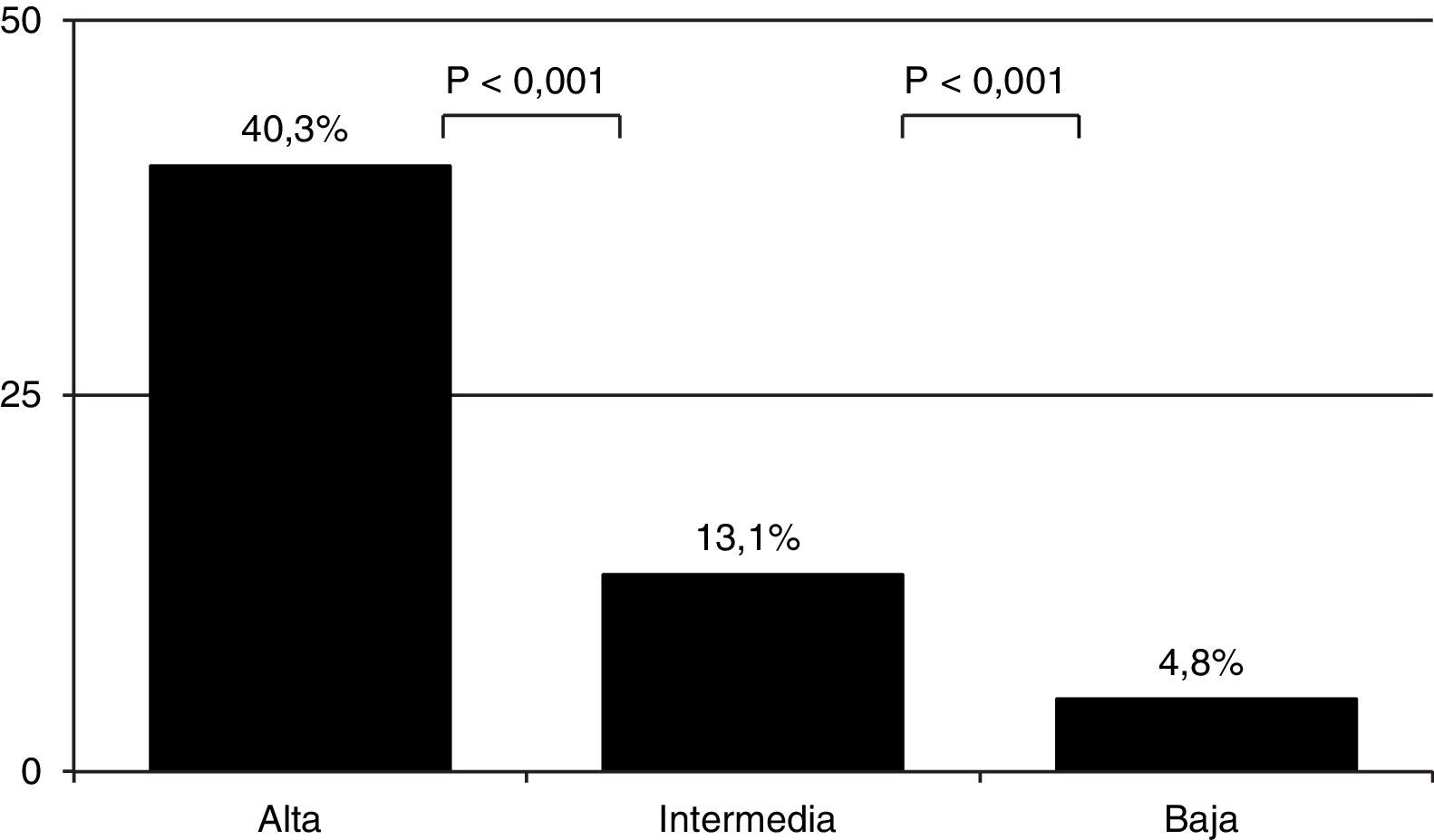
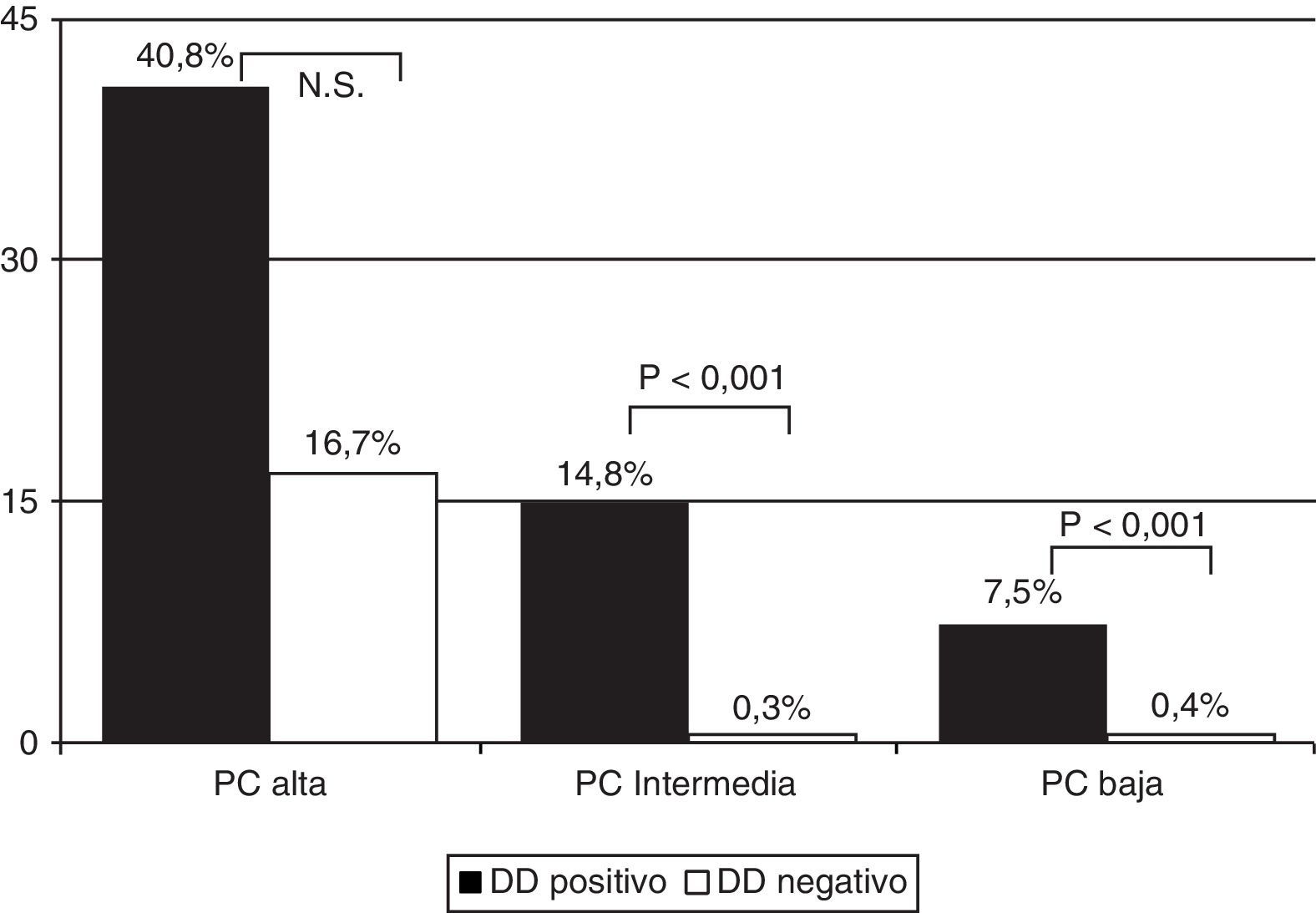
| PC baja | 1.281 | 61 (4,8) | 2 (0,4) | 55 (7,5) | 482 (37,6) |
| PC intermedia | 1.837 | 241 (13,1) | 1 (0,3) | 207 (14,8) | 852 (46,4) |
| PC alta | 124 | 50 (40,3) | 1 (16,7) | 42 (40,8) | 109 (87,9) |
| No clasificados | 682 | 8 (1,2) | 682 (100) | ||
| Total | 3.924 | 360 (9,2) | 2125 (54,2) | ||
DD: dímero-D; EP: embolia pulmonar; PC: probabilidad clínica.
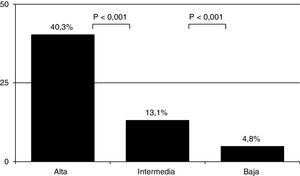
Como era de esperar, la prevalencia de EP varió en función de la PC (4,8% [61/1.281] en el grupo de probabilidad baja; 13,1% [241/1.837]) en el de probabilidad intermedia y 40,3% (50/124) en el de probabilidad alta) (fig. 1) (p<0,001 entre todas ellas). Se diagnosticaron 8 casos más de EP entre los 682 pacientes a los que no se les pudo calcular la PC (tabla 4). La prevalencia global de EP fue del 9,2% (360/3.924) y la incidencia de 30,6 casos/100.000 habitantes/año.
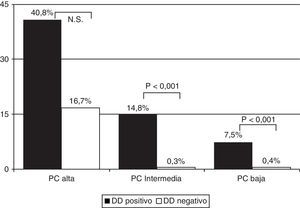
La prevalencia de EP en los pacientes con PC baja y DD positivo fue del 7,5% (55/737) y del 0,4% (2/512) en los que tenían un DD negativo. En los que presentaban una PC intermedia fue del 14,8% (207/1395) y del 0,3% (1/318), y en los que tenían una PC alta del 40,8% (42/103) y del 16,7% (1/6), respectivamente (fig. 2) (p<0,001 para las PC baja e intermedia entre DD positivo y negativo, pero no significativa en la PC alta) (tabla 4).
El DD se determinó en el 94,7% de los casos (3.071/3.242). Su sensibilidad para el diagnóstico de EP fue del 98,7% y su valor predictivo negativo del 99,2%. La TCMC no se realizó por riesgo de nefropatía por contraste en 70 pacientes.
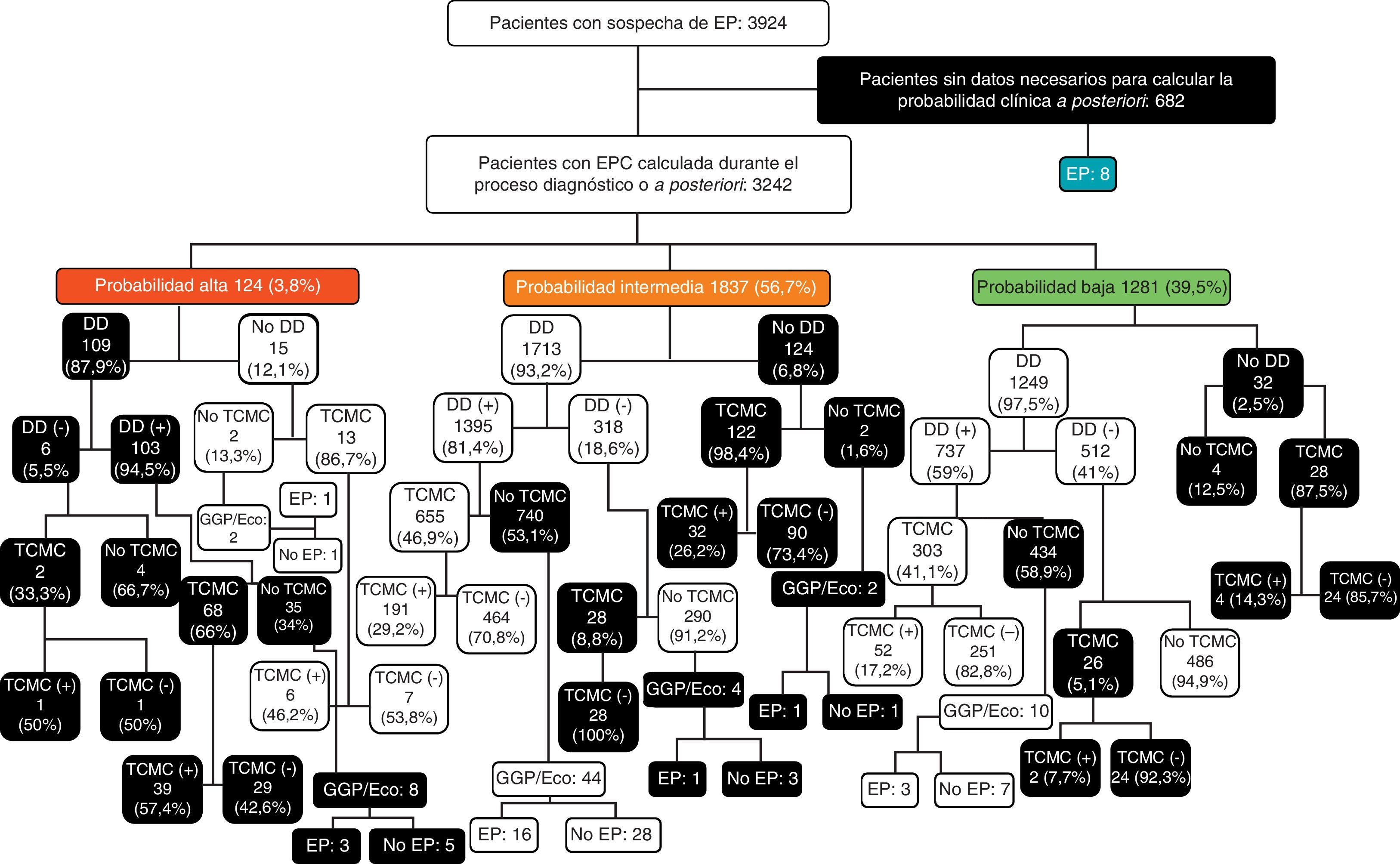
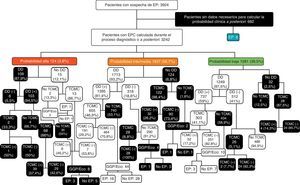
Entre los pacientes con una EPC baja, el DD no se determinó en 32 casos (2,5%). En los 1.249 en los que se llevó a cabo fue negativo en 512 (41%) y positivo en 737 (59%). En los que el DD fue negativo, se hizo una TCMC en 26 casos (5,1%) y fue positiva en 2 (7,7%). No se demostró EP en los 486 pacientes en los que el DD fue negativo y no se les hizo una TCMC. En aquellos pacientes que tenían un DD positivo (737), la TCMC solamente se realizó en 303 (41,1%), de los cuales 52 (17,2%) tenían una EP. Entre los 434 pacientes en los que no se llevó a cabo una TCMC, 3 presentaron una EP (3/10 en los que no se hizo una TCMC por riesgo de nefropatía por contraste). Entre los 32 pacientes a los que no se les realizó un DD, en 28 se hizo una TCMC, de los cuales 4 tenían una EP, y en 4 no se hizo ninguna otra prueba diagnóstica sin que finalmente se demostrara una EP en ninguno de ellos (fig. 3).
Diagrama de flujo de los pacientes estudiados según la probabilidad clínica, con los resultados de las pruebas diagnósticas para embolia pulmonar. DD: dímero-D; EP: embolia pulmonar; EPC: escala de probabilidad clínica; GGP/Eco: gammagrafía pulmonar de ventilación/perfusión o ecografía con compresión venosa de los miembros inferiores; TCMC: angiotomografía computarizada multicorte; (-): negativo; (+): positivo;
En los pacientes con una EPC intermedia, el DD no se determinó en 124 pacientes (6,8%). En los 1.713 en los que se llevó a cabo (93,2%), fue negativo en 318 (18,6%) y positivo en 1.395 (81,4%). En los primeros (DD negativo), se hizo una TCMC en 28 casos (8,8%) siendo negativa en todos. En los que no se hizo una TCMC (290), un paciente presentó una EP (1/4 en los que no se hizo una TCMC por riesgo de nefropatía por contraste). En los que el DD fue positivo se realizó una TCMC en 655 (46,9%) y fue positiva en 191 (29,2%). De los 740 pacientes con una EPC intermedia y DD positivo a los que no se les hizo una TCMC, 16 (2,2%) tenían una EP (16/44 en los que no se hizo una TCMC por riesgo de nefropatía por contraste). Por último, en los 124 pacientes a los que no se les hizo un DD, se llevó a cabo una TCMC en 122 (98,4%) de los cuales 32 (26,2%) tenían una EP. De los 2 pacientes a los que no se les hizo una TCMC por riesgo de nefropatía por contraste, uno tuvo una EP (fig. 3).
En los 124 pacientes con una EPC alta, se realizó un DD en 109 (87,9%) y fue positivo en 103 (94,5%). En los 6 pacientes con DD negativo, la TCMC solamente se hizo en 2 casos y en uno se demostró una EP. En los 4 en los que no se practicó una TCMC no se demostró EP. En los pacientes con un DD positivo (103), la TCMC se llevó a cabo en 68 (66%) y fue positiva en 39 (57,4%). Entre los 35 pacientes en los que no se realizó una TCMC a pesar de tener una alta PC de EP y un DD positivo, 3 presentaron una EP (3/8 en los que no se hizo una TCMC por riesgo de nefropatía por contraste). De los 15 pacientes a los que no se les determinó el DD, a 13 se les hizo una TCMC, siendo positiva en 6 (46,2%). De los 2 pacientes a los que no se les hizo DD ni TCMC, uno presentó una EP (1/2 en los que no se hizo una TCMC por riesgo de nefropatía por contraste) (fig. 3).
Del total de 3.924 pacientes con sospecha de EP, las EPC y los algoritmos diagnósticos no se siguieron en 2.125 (54,2%). En 682 casos (32,1%) porque no se recogieron los datos necesarios para estimar la PC; en 109 pacientes (5,1%) con una PC alta por hacer un DD; en 852 casos (40,1%) con una PC intermedia, por no hacer un DD (124), no realizar una TCMC con un DD positivo (696), o por hacer una TCMC u otras pruebas diagnósticas con un DD negativo (32); y en 482 pacientes (22,7%) con una PC baja, por no hacer un DD (32), no realizar una TCMC con un DD positivo (424), o por hacer una TCMC con un DD negativo (26) (tabla 4 y fig. 3).
DiscusiónEste estudio confirma la hipótesis de que las EPC en el diagnóstico de la EP raramente se calculan y que los algoritmos diagnósticos no suelen aplicarse en la práctica clínica, ya que solamente se utilizó de forma correcta en el 45,8% de las sospechas de EP.
El diagnóstico de EP requiere la utilización de diversas técnicas diagnósticas que deben usarse de forma secuencial. Dado que el uso de un estudio diagnóstico validado se asocia a una sustancial disminución del riesgo de complicaciones25, se recomienda que este diagnóstico se lleve a cabo de una forma estandarizada. Las EPC tienen por objeto identificar a los pacientes con una PC intermedia o alta ya que se necesita anticoagularlos hasta disponer de los resultados de las pruebas diagnósticas.
En 682 pacientes (17,4%) no se pudo conocer la PC porque los datos de la historia clínica eran insuficientes para poder calcularla, aunque se diagnosticaron 8 pacientes de EP. Se consideró que en ninguno de estos casos se había aplicado el protocolo diagnóstico correcto.
La determinación de DD es altamente sensible para excluir una EP si la concentración en sangre es<500 ng/ml, al menos en pacientes con una PC baja o intermedia26. En esta situación no está indicada la realización de una TCMC ya que la probabilidad de que exista una EP es baja1,2,6. De esta manera se evita un uso excesivo de la TCMC que podría ocasionar un aumento de la incidencia de cáncer atribuible a la radiación9, o la aparición de una nefropatía por contraste23. Por tanto, esta última técnica solamente se llevaría a cabo en los pacientes con una PC baja o intermedia, si el DD es>500 ng/ml. Para que este enfoque tenga el suficiente margen de seguridad para excluir una EP, se necesita utilizar métodos de determinación del DD que garanticen que el valor predictivo negativo sea>98%27. En nuestra serie, la sensibilidad del DD fue del 98,7% y su valor predictivo negativo del 99,2% (4 falsos negativos). En los pacientes con PC baja e intermedia, en los que el DD había sido <500 ng/ml, se hizo una TCMC al 5,1% (26/512) y al 8,8% (28/318) de los pacientes respectivamente. Estos resultados son similares a los obtenidos por Corwin et al. (7%)28. Sin embargo, si tenemos en cuenta que también se hizo directamente una TCMC en 28/32 pacientes con PC baja y en 123/124 (99,2%) con PC intermedia, en los que no se había determinado el DD, las TCMC que no se tenían que haber llevado a cabo (por una, u otra razón) fueron 205 (20,8% de los pacientes con DD negativo o que no se hizo), cifra aún inferior al 24% de los pacientes de la serie de Dunn et al.29.
Cuando la PC es baja o intermedia y el DD >500 ng/ml, el algoritmo diagnóstico establece que hay que hacer una TCMC u otra prueba diagnóstica para descartar la enfermedad. En nuestra serie, no se hizo al 52,5% de estos pacientes (1.120/2.132; 424/737 con una PC baja y 696/1.395 con una PC intermedia). Una razón por la que pudo no seguirse el protocolo es porque un DD positivo es inespecífico y es posible que en algunos casos se haya establecido otro diagnóstico alternativo (tabla 3). Sin embargo, eso no sería aplicable a todos los casos ya que, aunque algunos de estos diagnósticos pueden cursar con valores elevados de DD30, la mayoría no están relacionados con el sistema cardiopulmonar y, además, en muchos otros, el diagnóstico final no se llegó a establecer. Corwin et al. hallan que al 42% de los pacientes de su serie (605/1.431) con un DD positivo, tampoco se les hizo una TCMC28. Esto podría implicar que un porcentaje desconocido de pacientes con una EP no hayan sido diagnosticados, aspecto que no podemos descartar. El hecho de que hayamos seguido a estos pacientes, a través de la historia clínica, durante 3 meses, estaba más encaminado a confirmar que la EP no se repitiera a lo largo de ese tiempo, que a poder descartar que, en ese primer momento, el diagnóstico no fuera una EP. La incidencia de EP en nuestra serie (30,6 casos/100.000 habitantes/año) fue inferior a la descrita por otros autores31–33. A ello también podría contribuir un posible infradiagnóstico, al no realizar una TCMC en estos casos.
Entre los pacientes con una alta PC de EP, el protocolo diagnóstico solamente se aplicó de forma estandarizada en 15 pacientes (12,1%) ya que en 109 (87,9%) se determinó en primer lugar el DD.
El total de pacientes a los que no se les aplicó el algoritmo diagnóstico fue de 2.125 (54,2%). En un estudio reciente, Weiss et al. hallan que solamente el 23% de los médicos encuestados utilizan las escalas de predicción publicadas para evaluar la probabilidad pretest de EP y que el 73% prefiere hacer un enfoque no estructurado a pesar de conocer las guías publicadas34. Aunque se admite que esta probabilidad pretest de EP sea evaluada empíricamente12, ello no debería influir en una correcta aplicación de los protocolos diagnósticos establecidos.
Como era de esperar, la prevalencia de EP aumentó a medida que lo hacía la EPC35. De igual forma, dentro de la misma PC, la prevalencia de EP fue significativamente mayor (p<0,001) en los que el DD era positivo, excepto en los de PC alta. Es probable que esto se deba a que solamente 6 pacientes tenían un DD negativo, por 103 con un DD positivo. La prevalencia global de EP fue del 9,2%, ligeramente superior al 6% de Corwin et al.28, pero muy inferior al 27% de la serie de Prologo et al.36. Este descenso de las prevalencias de EP con respecto a series de décadas anteriores puede deberse al uso cada vez más frecuente de la TCMC en los servicios de urgencias con el consiguiente descenso del rendimiento. Cabe recordar que la especificidad del DD es muy baja y no es útil para diagnosticar una EP aguda. Si el DD se determina en casos en los que la sospecha de EP no está bien sustentada clínicamente, resultados elevados pueden llevar a realizar TCMC innecesarias.
La principal limitación de nuestro estudio es que es retrospectivo. Por este motivo, en el 17,4% de los casos (682) no se pudo establecer la EPC ni el seguimiento del cumplimiento del protocolo diagnóstico. Otra limitación es la imposibilidad de determinar si alguno de los pacientes con un DD positivo, a los que no se hizo una TCMC, presentaba realmente una EP. El seguimiento de la historia clínica durante 3 meses no descarta el diagnóstico en el momento en que los pacientes acudieron a Urgencias.
En resumen, en nuestro centro, las EPC para el diagnóstico de la EP raramente se calculan y los protocolos diagnósticos no suelen aplicarse en la práctica clínica. Esto puede acarrear, en algunos casos, el que se lleven a cabo técnicas de imagen innecesarias que pueden también dar lugar a importantes efectos secundarios y, en otros, a incurrir en un elevado riesgo de infradiagnóstico al no poder descartar la enfermedad con seguridad. Con la implantación de las EPC, como parte de un algoritmo diagnóstico, se conseguiría una mayor rentabilidad diagnóstica y se optimizarían los recursos disponibles.
Contribución de los autoresP. Sanjuán. Redactora y autora. Concepción y diseño. Recogida de datos. Análisis e interpretación de los datos. Aprobación final del manuscrito.
N. Rodríguez-Núñez. Coautora. Recogida de datos. Revisión crítica del manuscrito. Aprobación final del manuscrito.
C. Rábade. Coautor. Recogida de datos. Revisión crítica del manuscrito. Aprobación final del manuscrito.
A. Lama. Coautora. Recogida de datos. Revisión crítica del manuscrito. Aprobación final del manuscrito.
L. Ferreiro. Coautora. Recogida de datos. Revisión crítica del manuscrito. Aprobación final del manuscrito.
F.J. González-Barcala. Coautor. Recogida de datos. Revisión crítica del manuscrito. Aprobación final del manuscrito.
J.M. Álvarez-Dobaño. Coautor. Recogida de datos. Revisión crítica del manuscrito. Aprobación final del manuscrito.
M.E. Toubes. Coautora. Recogida de datos. Revisión crítica del manuscrito. Aprobación final del manuscrito.
A. Golpe. Coautor. Recogida de datos. Revisión crítica del manuscrito. Aprobación final del manuscrito.
L. Valdés. Redactor y autor. Concepción y diseño. Análisis e interpretación de los datos. Aprobación final del manuscrito. Autor de correspondencia
FinanciaciónBECAS: Este trabajo se ha hecho sin ningún tipo de becas o ayudas económicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentado en parte al 46 Congreso Nacional SEPAR. Barcelona, junio de 2013.