El análisis del condensado de aire espirado (o exhalado) es una técnica no cruenta que permite determinar diversas sustancias volátiles y no volátiles producidas en las vías respiratorias, y cuya medición puede ser útil para el diagnóstico y la supervisión de diversas enfermedades respiratorias.
ObjetivosEl objetivo del presente estudio fue producir un dispositivo reutilizable, de bajo coste, para obtener muestras del condensado de aire espirado en individuos voluntarios sanos y determinar la concentración de óxido nítrico en la muestra recolectada.
Material y métodosEl dispositivo se fabricó con un tubo de vidrio de borosilicato en forma de U. El tubo se introdujo en un recipiente con hielo y en el extremo distal se adaptaron válvulas respiratorias unidireccionales. Acto seguido, se determinó el óxido nítrico en el condensado de aire espirado (CAE) mediante un método de quimioluminiscencia.
ResultadosEl coste total del dispositivo fue de 120,20 dólares. Las muestras de CAE se obtuvieron a partir de 116 individuos de ambos sexos, de 20-70 años de edad. El volumen medio del condensado de aire espirado obtenido durante 10min fue de 1,0±0,6ml y el nivel medio del óxido nítrico fue de 12,99±14,38μM (mediana, 8,72μM). No hubo correlación entre los niveles de óxido nítrico en el condensado de aire espirado y la edad o el sexo.
ConclusiónDemostramos que es posible fabricar un dispositivo de bajo coste, eficiente y reutilizable, para obtener y determinar los niveles de óxido nítrico en el CAE. Tampoco hemos identificado una correlación entre los valores de óxido nítrico presente en el CAE obtenido a través de este método, la edad y el sexo.
The analysis of exhaled breath condensate (EBC) is a non-invasive technique that enables the determination of several volatile and nonvolatile substances produced in the respiratory tract, whose measurement may be useful for the diagnosis and monitoring of several respiratory diseases.
ObjectiveThe aim of this study was to produce a low-cost reusable device in order to sample exhaled breath condensate in healthy adult volunteers, and to determine the concentration of nitric oxide in the sample collected.
Material and methodsThe apparatus was made with a U-shaped tube of borosilicate glass. The tube was placed in a container with ice, and unidirectional respiratory valves were fitted to the distal end. Afterwards, nitric oxide was measured in the exhaled breath condensate (EBC) by chemiluminescence.
ResultsThe total cost of the device was $120.20. EBC samples were obtained from 116 volunteers of both sexes, aged between 20 and 70. The mean volume of exhaled breath condensate collected during 10minutes was 1.0±0.6mL, and the mean level of nitric oxide was 12.99±14.38μM (median 8.72μM). There was no correlation between the nitric oxide levels in the exhaled breath condensate and age or gender.
ConclusionWe demonstrate that it is possible to fabricate a low-cost, efficient, reusable device in order to collect and determine nitric oxide levels in EBC. We have identified no correlation between the nitric oxide levels present in the EBC obtained with this method with either age or sex.
Se ha propuesto el análisis de los biomarcadores en el condensado de aire espirado (CAE) como una técnica no cruenta de investigación de diversas enfermedades respiratorias inflamatorias y no inflamatorias y como herramienta de seguimiento de estas enfermedades1-4. Entre los biomarcadores de interés, el óxido nítrico (NO), un radical libre que puede participar en una amplia variedad de reacciones bioquímicamente pertinentes, ha emergido como un marcador biológico importante5-8. El NO espirado se ha investigado intensamente y parece ser un marcador de utilidad para el asma9 y la enfermedad pulmonar obstructiva crónica (EPOC)10. También se ha demostrado que sus valores aumentan en pacientes con cáncer de pulmón11 y puede correlacionarse con las puntuaciones clínicas de lesión pulmonar12.
A pesar de la disponibilidad comercial de dispositivos para la recolección del CAE, estos dispositivos son desechables y en muchos países no están fácilmente disponibles, sobre todo en los países en desarrollo, donde los costes de importación limitan su uso sistemático en la práctica clínica. Además, apenas se dispone de información sobre el contenido de NO en el CAE de individuos sanos. Algunos estudios proporcionan los valores de la concentración media en individuos sanos (tabla 1), y la variabilidad de los valores puede deberse a los diferentes tipos de dispositivos utilizados.
Valores de los estudios publicados que analizaron la concentración de óxido nítrico (NO)
| Autor | Año | Lugar | n | Edad (valores medios) | Método | Valores medios de NOx (μM) |
| Ganas et al.25 | 2001 | Grecia | 10 | 23 (4) | Artesano | 0,63 |
| Franklin et al.26 | 2006 | Australia | 25 | 23-55 | Artesano | 1,82 |
| Dressel et al.27 | 2010 | Alemania | 26 | 31 (8,3) | EcoScreen® | 3,73 |
| Liu et al.23 | 2007 | Australia | 15 | 65 (9,38) | Artesano | 9,89 |
| Hoffmeyer et al.24 | 2007 | Alemania | 16 | 26-62 | EcoScreen® | 7,11 |
| Ojoo et al.22 | 2005 | Londres | 15 | 39 (10) | Artesano | 11,4 |
Por esta razón, para resolver estas dificultades decidimos fabricar el instrumento propuesto por Horváth et al.13 en nuestra institución con unas pocas modificaciones, para obtener y analizar el NO en el CAE de una cohorte de adultos sanos.
MétodosEl presente estudio fue aprobado por el comité de investigación de nuestra institución (número de protocolo HCRP 4167/2009). Todos los experimentos se efectuaron de acuerdo con los principios éticos para la investigación médica emprendida en seres humanos (World Medical Association, Declaración de Helsinki).
Individuos voluntariosSe reclutaron 116 individuos voluntarios, sanos, de ambos sexos, de 20-70 años de edad, y se les asignó a grupos, estratificados de acuerdo con la edad en estratos de 10 años. Se excluyó a cualquier individuo voluntario con antecedentes de tabaquismo, drogadicción, enfermedad pulmonar y/o sistémica crónica, incluidas alergias; enfermedad infecciosa respiratoria aguda en los 30 últimos días, exposición reciente y/o constante a formaldehído y ozono; uso de fármacos como los inhibidores de la enzima conversora de la angiotensina, inhibidores de la fosfodiesterasa, fármacos donantes de NO (nitroprusiato), esteroides, oximetazolina, y fármacos antiinflamatorios no esteroideos. También se excluyó a cualquier individuo que hubiera ingerido alimentos 2h antes de la recolección de CAE o hubiera practicado ejercicio físico extenuante, consumido bebidas alcohólicas o cualquier medicación en las 24h previas.
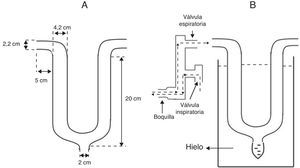
Dispositivo de recolección de condensado de aire espiradoEn pocas palabras, el dispositivo se fabricó con un tubo de cristal en forma de U (cristal de borosilicato Duran® Schott-Rohrglas, Mitterteich, Alemania), de 18mm de grosor. En el extremo distal inferior del tubo de cristal se efectuó una abertura en la que se conectó un tubo de polipropileno (capacidad de 1,5ml, Axygen Inc., California, EE. UU.) para la recolección del CAE. En el otro extremo abierto del tubo se conectaron válvulas respiratorias unidireccionales (K Takaoka, São Paulo, Brasil), que permiten separar el aire inhalado (ambiental) del exhalado, para dirigir todo el aire espirado a través del tubo. En el extremo opuesto se conectó un neumotacómetro digital (Ventronic II, DHD Healthcare, Nueva York, EE. UU.). La figura 1 muestra el diseño y las dimensiones del tubo de cristal, y el ensamblado para la recolección de CAE.
Después de cada utilización, las piezas de teflón y silicona se limpiaron con agua y jabón y se introdujeron en un recipiente con ácido peracético (Anioxyde 1000, Anios, Pavê Du Moulin, Lille, Francia) a una concentración de 1.471 partes por millón durante 30min. Acto seguido, se aclararon en agua y se secaron. El tubo de cristal se aclaró con abundante agua destilada (Milli-q) y se esterilizó usando autoclave (HI VAC, Baumer, São Paulo, Brasil).
Obtención del condensado del aire espiradoSe dieron instrucciones a todos los voluntarios acerca de los pasos necesarios, que se repitieron en un dispositivo similar antes de la obtención del CAE. Justo antes de la obtención, los individuos se enjuagaron la boca con agua destilada. Utilizando una pinza nasal, se dieron instrucciones a los individuos para que respiraran de forma tranquila a través de la boquilla del dispositivo durante 10min. Durante todo el procedimiento, tanto el tubo de cristal como el vial de recolección se mantuvieron cubiertos de hielo triturado, mezclado con sal, a una temperatura de –10°C, con una monitorización constante con un termómetro digital (Minipa, MVP363, China).
Almacenamiento y preparación del condensado de aire espiradoEl vial con las alícuotas del condensado de aire obtenido se mantuvo en hielo y se transportó rápidamente hasta un congelador, donde se mantuvieron a –70°C para su análisis posterior. Para el análisis, se desproteinizó el CAE de cada individuo con etanol puro (4°C) durante 30min y acto seguido se mantuvo en el congelador durante 30min (–20°C). Después de este período, se centrifugó a 4.000rpm durante 10min utilizando una centrifugadora refrigerada.
Evaluación del NOEl NO en el CAE se determinó mediante quimioluminiscencia4,14. En pocas palabras, la detección de NO se basa en la observación de la reacción del ozono con el NO, que produce NO2 y, al estabilizarse, puede medirse por quimioluminiscencia, ya que emite una radiación lumínica que es proporcional a la concentración de NO en el aire espirado. La luminiscencia generada se determina mediante un tubo fotomultiplicador sensible y es directamente proporcional a los valores de NO. El análisis se efectúa en el dispositivo Nitric Oxide Analyzer, 280i NOA (Sievers, Boulder, CO, EE. UU.).
Análisis estadísticoPara verificar la distribución de los datos se usaron la prueba de Shapiro-Wilk y gráficos Q-Q. Los resultados se presentan como medias±desviación estándar y/o medianas y cuartiles. Para las comparaciones se usaron la prueba de la U de Mann-Whitney y la de Kruskal-Wallis. Se efectuó una estimación de la curva usando un procedimiento de regresión para verificar la relación entre las variables. Todos los procedimientos estadísticos se efectuaron utilizando el programa informático SPSS 15.0.
ResultadosEn la tabla 2 se muestra la demografía. No se produjeron efectos adversos durante o después del procedimiento de recolección de CAE. El coste total de dispositivo, incluido el tubo de cristal y las válvulas respiratorias unidireccionales, fue de 120,2 dólares (56,68 y 63,52 dólares, respectivamente).
Datos demográficos
| Grupos de edad (años) | |||||
| 20-30 | 31-40 | 41-50 | 51-60 | 61-70 | |
| Mujeres/hombres | 21/14 | 7/11 | 18/6 | 14/6 | 14/5 |
| Edad media (años) | 26,7 ± 1,45 | 33,8 ± 3,0 | 45,35 ± 2,5 | 54,7 ± 3,0 | 63,81 ± 2,74 |
| Peso (kg) | 69,84 ± 18 | 83,55 ± 15,3 | 68,47 ± 13,28 | 68,12 ± 15,33 | 68,35 ± 11,53 |
| Estatura (cm) | 163,70 ± 29 | 171,88 ± 8,83 | 164,45 ± 9,02 | 147,61 ± 50,69 | 160,85 ± 7,1 |
| Volumen corriente (ml) | 554 (456-652)a | 594,01 (455-732)a | 552 (428-675)a | 465 (315-615)a | 528 (396-659)a |
| Volumen minuto (l) | 8,67 (7,18-10,16)a | 8,82 (7,03-10,62)a | 8,41 (6,93-9,88)a | 9,90 (6,81-12,99)a | 9,45 (7,43-11,47)a |
| Frecuencia respiratoria (min) | 12,4 (11,20-13,61)a | 12,70 (11,05-14,50)a | 12,95 (11,32-14,57)a | 13,55 (11,56-15,53)a | 15,05 (11,97-18,14)a |
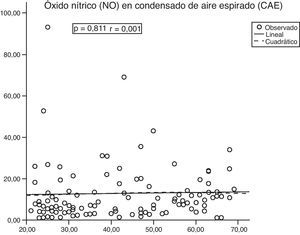
El volumen medio de CAE fue de 1,0±0,6ml. El volumen total de CAE durante la recolección fue de 95,3±42l. El valor medio del NO en el CAE fue de 12,99±14,38μM (mediana, 8,72; C1-C3: 4,31-15,54μM). Las diferencias en el contenido de NO en el CAE entre grupos de edad no fueron significativas (tabla 3). Tampoco fueron significativas las diferencias entre ambos sexos (tabla 4).
Óxido nítrico (NO) en el condensado de aire espirado (CAE) para cada grupo de edad
| Grupos de edad (años) | p | ||||||
| 20-70 | 20-30 | 31-40 | 41-50 | 51-60 | 61-70 | ||
| N | 112 | 34 | 18 | 24 | 17 | 19 | 0,301a |
| Media | 12,99 | 12,54 | 10,47 | 16,99 | 9,71 | 14,09 | |
| Error estándar | 1,35 | 3,02 | 2,25 | 3,96 | 1,32 | 1,92 | |
| Desviación estándar | 14,38 | 17,64 | 9,58 | 19,42 | 5,47 | 8,40 | |
| Intervalo de confianza del 95% | 10,30-15,69 | 6,38-18,70 | 5,70-15,23 | 8,79-25,19 | 6,89-12,52 | 10,04-18,14 | |
| Mediana | 8,72 | 6,90 | 6,49 | 9,14 | 9,40 | 12,45 | |
| C1-C3 | 1,11-93,45 | 4,03-13,51 | 3,10-17,50 | 3,72-20,18 | 6,58-11,25 | 9,65-19,62 | |
Óxido nítrico (NO) en el condensado de aire espirado (CAE) y volumen del condensado por sexo
| Sexo | Valor de pa | ||||||||
| Mujeres | Hombres | ||||||||
| n | Media | DE | Mediana | n | Media | DE | Mediana | ||
| NO(μM) | 73 | 12,96 | 13,42 | 9,82 | 39 | 13,05 | 16,21 | 8,30 | 0,847 |
| Volumen exhalado | 73 | 97,26 | 45,35 | 83,64 | 39 | 91,66 | 35,16 | 87,40 | 0,837 |
| Volumen CAE (ml) | 73 | 1,03 | 0,67 | 0,80 | 39 | 0,98 | 0,71 | 0,80 | 0,440 |
DE, desviación estándar.
No hubo una correlación entre el NO en el CAE y la edad (fig. 2), ni entre el volumen del CAE y el contenido de NO (p=0,994; r=0,001). Sin embargo, hubo una correlación positiva significativa entre el volumen de CAE y el volumen de aire espirado (p<0,001; r=0,622).
DiscusiónHay evidencias que demuestran el importante papel desempeñado por el NO en la fisiopatología de diversas enfermedades respiratorias, como el síndrome de dificultad respiratoria aguda (SDRA), la enfermedad pulmonar obstructiva crónica (EPOC), la fibrosis quística (FQ), el asma, la hipertensión pulmonar (HP), las bronquiectasias, la disfunción mucociliar primaria, las enfermedades pulmonares intersticiales y otras enfermedades de las vías respiratorias5,7. En los estudios publicados se ha documentado que en pacientes asmáticos aumentan los valores de NO en el aire espirado15,16 y los niveles de nitrito en el CAE, comparado con individuos sanos, posiblemente debido a la presencia de un estado inflamatorio17. La monitorización de las concentraciones de NO en el aire espirado es un marcador emergente de inflamación eosinófila en el asma que facilita el diagnóstico, la supervisión de la progresión de la enfermedad y la valoración de la respuesta al tratamiento18.
En pacientes con EPOC también se observan valores de NO espirado significativamente más altos que los encontrados en fumadores y no fumadores sanos19. Pero con respecto a los valores de los metabolitos de NO (NOx) en el CAE, los estudios han demostrado que en ex fumadores con EPOC los valores son más bajos en comparación con los detectados en individuos sanos, no fumadores y ex fumadores17,19.
El NO en el aire espirado disminuye significativamente tras cirugía cardíaca en seres humanos. Esto puede ser consecuencia de una disminución de la producción endógena de NO debido a la lesión endotelial vascular pulmonar20. Esta disminución en la producción de NO espirado puede asociarse con cambios de la función mecánica respiratoria durante la hipoxia. No obstante, se ha documentado que, tras reoxigenación, los valores de NO siguen siendo bajos, lo que posiblemente indica una lesión del epitelio bronquial21. Por consiguiente, el CAE también puede usarse en la supervisión y el estudio de las enfermedades respiratorias y para valorar la eficacia del tratamiento15,19.
En el presente estudio demostramos que el dispositivo que fabricamos es reutilizable, eficaz para la recolección de CAE y de coste razonable. El volumen de CAE que pudimos recolectar fue suficiente para valorar y determinar el NO, y creemos que es suficiente para el análisis de otros biomarcadores. Además, con esta metodología hemos determinado el contenido de NO en el CAE de individuos sanos y hemos demostrado que los valores de NO en el CAE de individuos sanos no se correlacionan con la edad y/o sexo.
De forma parecida a los resultados del presente estudio, Cruz et al.1 no identificaron una correlación entre la edad y la concentración de NO en el CAE.
El contenido de NO en el CAE detectado es similar a lo descrito por Ojoo et al.22, Liu et al.23 y Hoffmeyer et al.24 pero mayor que los valores descritos por Ganas et al.25, Franklin et al.26 y Dressel et al.27. Sin duda, las diferencias entre dispositivos y la determinación del NO son responsables de esta variabilidad. Además, es necesario tener en cuenta que la mayoría de estas investigaciones utilizaron muestras a pequeña escala.
Hasta la fecha, no hay pruebas suficientes con respecto a la correlación entre el contenido de NO en CAE y la edad y/o el sexo. En consecuencia, la American Thoracic Society/European Respiratory Society (ATS/ERS)28 ha recomendado que se tengan en cuenta tanto la edad como el sexo como factores que pueden afectar a la concentración de los biomarcadores en el CAE. Por esta razón, consideramos que el presente estudio contribuye a responder a estas preguntas. Al igual que en otros estudios1, en la presente investigación no se ha encontrado una correlación entre la edad y el sexo y la concentración de NO en el CAE, lo que contribuye a responder a esta pregunta.
También es motivo de preocupación la influencia de los parámetros ventilatorios en el CAE y su contenido. La correlación entre el volumen minuto y el volumen de CAE recolectado encontrada fue la predecible, al igual que han descrito otros investigadores. Liu et al.29 encontraron la misma correlación y sugirieron que el volumen minuto y el volumen corriente predirían el volumen del CAE. También observaron que el sexo y la edad no producían un efecto significativo sobre el volumen del CAE. Montuschi4 también documentó que el volumen de CAE es directamente proporcional al momento de la obtención y la frecuencia respiratoria de aire espirado. Y Franklin et al.26 han demostrado que los flujos respiratorios no influyen en el NO disuelto en el CAE de adultos sanos, un factor que también merece la atención del investigador, de acuerdo con los resúmenes publicados de un seminario organizado por la ATS28.
Otro problema que merece atención es el momento de la recolección del condensado. Una recolección a lo largo de 10min produjo un volumen suficiente para el análisis del NO, y probablemente de otros marcadores. Los tiempos más prolongados podrían traducirse en mayores volúmenes, puesto que Lema et al.30 obtuvieron 1,5ml después de 15min, y Vaughan et al.31 observaron que el aumento del período de recolección incrementa el volumen obtenido. Optamos por un período de 10min porque es bien tolerado y se traduce en un volumen medio de 1-2ml, según lo recomendado en los resúmenes publicados del seminario organizado por la ATS. Además, es necesario verificar la influencia potencial de las temperaturas durante la recolección y el almacenamiento, al igual que verificar cualquier influencia del material usado para fabricar el dispositivo.
Se requiere un mayor número de estudios no solo para usarlos como referencia de los diferentes biomarcadores sino también para determinar si puede ser útil un análisis secuencial para el seguimiento de la enfermedad de interés32.
Otro motivo de preocupación es el material usado en cada dispositivo. Los dispositivos EcoScreen® y Rtube® se fabrican, respectivamente, con teflón y aluminio19, pero los dispositivos manufacturados suelen fabricarse con cristal revestido de silicona13,33. Consideramos que el cristal de borosilicato, aunque es más frágil, es de menor coste y también es inerte, lo que reduce la probabilidad de influir en el marcador analizado. Liu et al.23 compararon los dispositivos EcoScreen® y Rtube® con dispositivos manufacturados con cristal revestido de silicona, pero las diferencias no fueron significativas, en comparación con cristal no recubierto. Soyer et al.34 también obtuvieron mayores volúmenes de CAE utilizando el dispositivo EcoScreen® comparado con Rtube®, y Rosias et al.35 encontraron que los dispositivos fabricados con cristal de borosilicato, cubiertos o no de silicona, eran más eficientes para determinar el 8-isoprostano y la albúmina, comparado con los fabricados con aluminio y teflón. Formularon la teoría de que el cristal posee menos propiedades adhesivas, lo que se traduce en un mayor número de moléculas disponibles en el CAE.
Por lo tanto, parece ser que los diferentes dispositivos pueden proporcionar resultados distintos para un mismo biomarcador, y no se ha alcanzado un consenso por lo que respecta al diseño y material más apropiados para cada biomarcador. Por lo tanto, son necesarios estudios adicionales para definir qué diseño y material son mejores para un biomarcador específico de interés en el CAE. Además, se requieren futuras investigaciones no solo para valorar los parámetros de referencia de los diferentes biomarcadores sino también para determinar si un análisis secuencial puede ser útil para el seguimiento de la enfermedad de interés32.
En conclusión, fabricamos un dispositivo reutilizable eficaz para la obtención de CAE y la valoración del contenido de NO. Además, hemos determinado el contenido de NO en el CAE de individuos voluntarios sanos y hemos demostrado que, usando esta metodología, el contenido de NO no se correlaciona con la edad o sexo.
FinanciaciónLa presente investigación recibió financiación de la Foundation to Support Teaching and Research (FAEPA) y el National Council for Scientific and Technological Development (CNPq), Brasil.
Conflicto de interesesLos autores no han declarado conflicto de intereses.