Definición y tipos
Las actuales guías de buena práctica clínica (GINA1 y GEMA2) establecen que el asma está bien controlada cuando no existen síntomas de la enfermedad, exacerbaciones, necesidad de emplear medicación de rescate ni restricciones de la actividad física habitual, la función pulmonar es normal y el tratamiento no ocasiona efectos adversos. En contraposición, el asma mal controlada es la que cursa con alguno o varios de los anteriores supuestos. En consecuencia, el asma de control difícil se puede definir como el asma insuficientemente (o mal) controlada a pesar de una estrategia terapéutica apropiada y ajustada al nivel de gravedad clínico. Si bien en la bibliografía anglosajona habitualmente se emplean los términos de asma refractaria al tratamiento3, asma de difícil control4 o asma difícil resistente al tratamiento5 para definir a esta asma más grave, en la presente Normativa, y siguiendo criterios de uso apropiado de la lengua española, se usará el de asma de control difícil (ACD). Este término aglutina a variantes o fenotipos de la enfermedad tales como el de asma muy grave, de riesgo vital, inestable, dependiente de corticoides o resistente a corticoides.
La GEMA2 discrimina 2 subgrupos de ACD, la verdadera y la falsa (grado de evidencia D). La falsa ACD agrupa otras causas, habitualmente ajenas a la enfermedad (ver apartado siguiente), que conllevan una escasa respuesta terapéutica y, por tanto, una aparente ACD. Bajo esta perspectiva, que contempla sólo la verdadera ACD como auténtica ACD, se han redactado los epígrafes de Epidemiología y factores de riesgo, Función pulmonar, Patología y Respuesta pobre o alterada a la medicación de esta Normativa. Con el objetivo de determinar si efectivamente se trata de una ACD verdadera, en los epígrafes de Actitud diagnóstica y Tratamiento se incluyen los 2 tipos de ACD, ya que para llegar a dicha conclusión es necesario descartar o tratar adecuadamente todos los factores que influyen en el control de la enfermedad. En el apartado Actitud diagnóstica se especifican las pruebas y pautas terapéuticas que se deben realizar para llegar al diagnóstico de verdadera ACD, a través de un proceso por el que se irán descartando todas las causas de ACD falsa. Por último, en el epígrafe Tratamiento se describen las recomendaciones que deben seguirse con los pacientes que no consiguen un buen control de la enfermedad a pesar de estar con la pauta terapéutica del escalón más alto (asma grave)2, así como las posibles alternativas para los refractarios al tratamiento, o sea, para los que tienen una ACD verdadera.
El diagnóstico de ACD se establece cuando coexisten los 2 criterios mayores, o bien 1 de éstos junto con 2 de los criterios menores que recoge la tabla I (grado de evidencia D)5. Estos criterios son los que se emplean habitualmente para establecer el grado de control del asma.
Asma de control difícil no atribuible a la propia enfermedad
En la mayoría de pacientes remitidos a consultas especializadas por mal control de su asma, esta circunstancia se produce por causas ajenas a la propia enfermedad: el diagnóstico de asma no es correcto, el paciente tiene además otras enfermedades con síntomas parecidos que crean confusión, existen factores agravantes no controlados, o el paciente no cumple adecuadamente con el tratamiento. Por ello, lo primero que debe hacerse es descartar este tipo de problemas, englobados bajo el término de falsa ACD (tabla II).
1. El diagnóstico de asma no es correcto. Otras enfermedades respiratorias (alveolitis alérgica extrínseca, neumonía eosinófila crónica, bronquiectasias o embolia pulmonar), e incluso no respiratorias (insuficiencia cardíaca izquierda), pueden crear confusión provocando errores diagnósticos y terapéuticos. En este apartado se incluirían las denominadas seudoasmas, que son enfermedades obstructivas de la vía aérea superior, como disfunción de cuerdas vocales, tumores laringotraqueales, cuerpos extraños inhalados, traqueomalacia o malformaciones traqueobronquiales. Estas alteraciones pueden manifestarse clínicamente como un asma, y su diagnóstico es especialmente difícil. Por todo ello se deben analizar cuidadosamente los criterios empleados para establecer el diagnóstico de asma y realizar en cada caso las maniobras diagnósticas oportunas para descartar este tipo de entidades clínicas (tabla III).
2. El paciente tiene asma pero, además, puede tener otras enfermedades que comparten síntomas con el asma y, por ello, no se ha pensado en ellas y no se han puesto en marcha las estrategias necesarias para su diagnóstico y posterior tratamiento. En este sentido, se debería considerar si el paciente con asma puede presentar patología obstructiva de la vía aérea superior, bronquiectasias, ansiedad-hiperventilación, hipertiroidismo o, lo que es más frecuente, nasosinupatía y/o reflujo gastroesofágico. El 75-80% de pacientes con asma presenta rinitis estacional o perenne, y el 7-15% tiene poliposis nasal. Su adecuado tratamiento mejora los síntomas de asma (grado de evidencia B)6. La prevalencia de enfermedad por reflujo entre los asmáticos es muy variable en las series y oscila entre el 15 y el 72% según el procedimiento empleado para su diagnóstico (clínico, pHmetría, manometría esofágica)7. Los pacientes con asma y reflujo presentan un peor control del asma (grado de evidencia C), si bien no está del todo claro que el tratamiento del reflujo mejore el asma.
3. Factores intercurrentes que agravan el asma y dificultan su control. El paciente puede estar expuesto de forma permanente a un alérgeno al cual es sensible (mascotas domésticas o alérgenos ocupacionales), o bien consumir habitualmente fármacos desencadenantes de asma. Debe interrogarse al paciente acerca de los medicamentos que consume, con especial hincapié en: a) bloqueadores beta, tanto por vía oral como tópica (conjuntival), y b) ácido acetilsalicílico y otros antiinflamatorios no esteroideos (AINE). En este último caso hay que recordar que están contraindicados en pacientes que presentaron episodios previos de intolerancia y se recomienda evitarlos en los asmáticos adultos (grado de evidencia D), puesto que entre el 4 y el 28% son susceptibles de presentar exacerbaciones en relación con estos fármacos, particularmente los afectados de poliposis nasal.
4. Pobre o ausente adhesión al tratamiento. En todas las enfermedades crónicas que precisan tratamientos prolongados existe una tasa no despreciable de abandonos de la medicación por parte del paciente. Estos abandonos pueden ser parciales o totales y voluntarios o involuntarios. El cumplimiento terapéutico del asma se estima que no supera el 30-50%8. Por ello, lo primero que debe plantearse el médico cuando la respuesta terapéutica no es la esperada es si el paciente cumple con la prescripción. En el asma es muy difícil utilizar métodos directos para evaluar el cumplimiento (medidas analíticas del fármaco en muestras biológicas), por lo que se recurre a métodos indirectos. Se pueden medir algunos parámetros, como el cortisol plasmático y el óxido nítrico exhalado, aunque su utilidad no está establecida. También se puede hacer un recuento de la medicación sobrante o usar dispositivos electrónicos de registro instalados en los inhaladores, aunque estos procedimientos son complejos y no del todo exactos. Por eso suele valorarse el cumplimiento del asmático con preguntas abiertas e indirectas9, o ayudarse de cuestionarios sencillos como el de Chambers10, que interroga sobre la frecuencia de la utilización de los esteroides inhalados. El elevado incumplimiento depende de muchos factores, algunos de ellos relacionados con las características de los fármacos empleados: tipo de dispositivo, vía de administración, complejidad de la pauta terapéutica que conlleva que el paciente no haya entendido las instrucciones dadas por el personal sanitario, temor a efectos secundarios o precio elevado, y otros relacionados con características del propio paciente, como el equilibrio emocional alterado (especialmente los rasgos depresivos) o las sociopatías (como el enolismo, el aislamiento social o la falta de soporte familiar). La personalidad del paciente, la actitud ante la enfermedad y su percepción de la gravedad del proceso tienen una relevancia especial en el cumplimiento (grado de evidencia B). También puede suceder que el paciente tome la medicación pero su técnica inhalatoria no sea correcta. La vía inhalatoria, que es la comúnmente empleada en el tratamiento del asma, requiere cierto entrenamiento y preparación específica para su correcta utilización. El personal sanitario debe explicar al paciente las características del dispositivo de inhalación elegido, mostrarle cómo se usa y pedirle que realice la maniobra con un dispositivo de placebo a fin de corregir los posibles errores (grado de evidencia B). Además, es aconsejable comprobar la destreza en la técnica en sucesivas visitas.
Epidemiología y factores de riesgo
No se conoce con exactitud la prevalencia de este tipo de asma. En la bibliografía médica se suele señalar como porcentaje posible el 5% del total de pacientes con asma3,11, cifra extrapolada de estudios realizados con diferentes metodologías en asmáticos graves. Lo que es seguro es que ese tipo de pacientes tienen un impacto desproporcionado en la utilización de recursos sanitarios y en los gastos, tanto directos como indirectos, por asma12,13.
Los factores que contribuyen a que el asma sea refractaria al tratamiento no son bien conocidos. Algunos estudios establecen asociaciones débiles entre determinadas alteraciones genéticas y varios factores ambientales. Por tanto, la evidencia científica es baja, y no pueden considerarse como factores de riesgo claramente demostrados.
Factores genéticos
Se han constatado diversas mutaciones relevantes que se han relacionado con la ACD. Mutaciones del gen IL-4 y su receptor14 parecen tener relación con la pérdida de función pulmonar y con episodios de asma de riesgo vital. Factores implicados en el remodelado de la vía aérea15,16, como el factor de transformación del crecimiento-β1 (TGF-β1) y la proteína quimiotáctica del monocito (MCP-1), ambos posibles promotores de reacciones fibróticas, se han relacionado con la gravedad del asma. Otro aspecto importante es la posibilidad de mutaciones de los receptores para los principales tratamientos utilizados en el asma bronquial, β2-adrenérgicos17 y glucocorticoides18,19, lo que implicará una mala respuesta a dichos tratamientos. En este sentido, la relación con factores genéticos se ha considerado en diversos tipos de asma que con frecuencia se comportan como asmas de control difícil: el asma corticorresistente, el asma corticodependiente y el síndrome ASA (asma severa, poliposis nasosinusal e intolerancia a los AINE)20.
Factores ambientales y/o externos
Se ha asociado con algún aspecto de la gravedad del asma la exposición continua a alérgenos (fundamentalmente ácaros21, alternaria22 y cucaracha23), el tabaquismo24, la intolerancia a los AINE25 y las infecciones por virus sincitial respiratorio26, por clamidias27 y por micoplasma28.
Función pulmonar
Las alteraciones funcionales que clásicamente definen a la ACD se sintetizan en 3 aspectos:
1. Limitación obstructiva al flujo aéreo que no se modifica tras un tratamiento esteroideo durante al menos 15 días.
2. Hiperreactividad bronquial intensa frente a estímulos que habitualmente no producen broncospasmo.
3. Variabilidad excesiva en el calibre de las vías aéreas.
Además de estas anomalías, que suponen sólo un extremo de lo que se considera características funcionales del asma, existen también diferencias en el comportamiento de la mecánica pulmonar que modifican las relaciones entre las presiones y flujos respiratorios y condicionan cambios en los volúmenes pulmonares. Las causas de estas anomalías no se conocen bien y se supone que se deben a cambios en la interfase de las vías aéreas con el parénquima pulmonar.
La disminución en el retroceso elástico pulmonar y la obstrucción bronquial determinan los fenómenos de hiperinsuflación, cierre precoz de las vías aéreas y limitación al flujo espiratorio. La capacidad de difusión permanece inalterada.
La medición de volúmenes pulmonares en estos pacientes muestra un patrón de atrapamiento aéreo con aumento del volumen residual, de la capacidad residual funcional y de la capacidad pulmonar total; por el contrario, la capacidad vital y todas sus subdivisiones están disminuidas. El volumen de cierre tiende a igualar o superar el volumen residual29.
El atrapamiento y la obstrucción al flujo aéreo empeoran aún más durante el esfuerzo, dando lugar a la aparición de hiperinsuflación dinámica. Este fenómeno, puesto de manifiesto por la disminución progresiva de la capacidad inspiratoria y la limitación al flujo espiratorio corriente, es el principal condicionante de la disnea y la escasa capacidad de ejercicio que presentan estos pacientes (grado de evidencia B).
Las modificaciones en el volumen pulmonar repercuten en la actividad de los músculos inspiratorios al disminuir su longitud. Esta carga se contrarresta con un aumento de la actividad tónica inspiratoria, tanto del músculo diafragma como de los músculos intercostales, que persiste al inicio de la espiración. Como consecuencia, el volumen pulmonar al final de la espiración nunca alcanza el volumen de relajación muscular, incrementándose aún más el atrapamiento aéreo30.
La resistencia de las vías aéreas aumenta hasta 3 veces su valor normal en pacientes con asma crónica persistente. El aumento en la resistencia de las vías aéreas depende fundamentalmente de las alteraciones inflamatorias de la mucosa bronquial y del grado de contracción del músculo liso. La relación entre los volúmenes y el flujo espiratorio máximo muestra una disminución de todos los flujos, especialmente de los flujos obtenidos a un volumen menor (FEF25-75). Es precisamente la resistencia a mejorar estos flujos, expresados siempre a isovolumen, lo que caracteriza la dificultad del control de estos pacientes.
En el intercambio gaseoso, las principales modificaciones tienen lugar sólo durante las crisis y consisten en un efecto shunt, debido a la presencia de tapones mucosos y atelectasias periféricas.
En pacientes con asma grave, especialmente en los que presentan alteraciones del estado emocional o antecedentes de asma de riesgo vital, se ha descrito una disminución del estímulo voluntario ventilatorio que disminuye el reclutamiento muscular y, por tanto, el riesgo de fatiga muscular, aunque suponga un aumento en la hipoventilación alveolar. Las causas son fundamentalmente de origen central y coinciden con una disminución en la percepción de la disnea31, la sensibilidad al estímulo hipóxico ventilatorio y las cargas resistivas inspiratorias (grado de evidencia B).
Patología
Los mecanismos patológicos íntimos de la ACD no están totalmente aclarados en la actualidad. La mayoría de los estudios identifican remodelado de la vía aérea con engrosamiento de la membrana basal, hipertrofia del músculo liso e hiperplasia glandular. Estos hallazgos se han puesto de manifiesto incluso en niños con asma grave32. Otro hecho patológico descrito es la afectación de la vía aérea distal con inflamación del bronquiolo terminal.
En el estudio mediante biopsias bronquiales y lavado broncoalveolar de pacientes con asma grave a pesar de tratamiento con altas dosis de esteroides33, se han propuesto 2 patrones patológicos diferenciados en función de la presencia o ausencia de eosinófilos. El perfil de los pacientes con un número elevado de eosinófilos pulmonares se asocia a un mayor engrosamiento de la membrana basal y al incremento de linfocitos CD3, CD4, CD8, macrófagos, mastocitos y TGF-β. Desde el punto de vista clínico, los enfermos con este patrón presentan mayor número de episodios de fracaso respiratorio que requieren intubación. Sin embargo, un estudio reciente aleatorizado, controlado y doble ciego34 cuestiona el fenotipo eosinofílico como fenómeno refractario, al constatar la normalización de los eosinófilos en el esputo tras el tratamiento con altas dosis de esteroides parenterales (triamcinolona).
En todos los casos de asma grave se ha identificado un incremento de neutrófilos, pero su significación patológica es controvertida. Podría reflejar la acción del tratamiento esteroideo por inhibición de la apoptosis de estas células, y se desconoce si representan algún papel en la fisiopatología de la enfermedad.
Respuesta pobre o alterada a la medicación
La resistencia al tratamiento esteroideo es muy poco común y afecta a uno de cada 1.000 a 10.000 pacientes asmáticos. La resistencia a esteroides se define por una pobre respuesta sobre el FEV1 (menor del 15% y 200 ml) tras un ciclo de 40 mg/día (en 2 tomas) de prednisona o prednisolona durante 2 semanas3. Si el paciente no responde, la dosis debe doblarse y monitorizarse durante 2 semanas más. Algunos pacientes con asma grave no cumplen los criterios de resistencia a esteroides, pero desarrollan una respuesta a dosis más altas que las esperadas, lo que sugiere una respuesta alterada a glucocorticoides, aunque no ausente.
Varios mecanismos intentan explicar la resistencia a los glucocorticoides observada en estos pacientes. Los monocitos y los linfocitos T aislados de estos pacientes tienen una respuesta disminuida a glucocorticoides in vitro. En algunos de ellos existe una disminución en la afinidad del receptor glucocorticoideo (RG) por el glucocorticoide, y ésta se puede reproducir incubando las células T con IL-2 e IL-4, lo que lleva a una inhibición funcional de los efectos del glucocorticoide35. En estos mismos pacientes existe una disminución de los efectos inhibitorios de los glucocorticoides sobre la activación del factor AP-1 y la expresión de citocinas, probablemente secundaria a una activación aumentada de las vías del AP-1 y JNK36. La mayor activación del AP-1 puede derivar en un secuestro del RG, lo que impide su interacción con otras proteínas y, por tanto, que se produzca resistencia a los glucocorticoides. Esta resistencia se produciría en el lugar de la inflamación, pero no en los sitios donde no existe, lo que explicaría por qué estos pacientes son resistentes a los efectos antiinflamatorios y no lo son a los efectos secundarios de los glucocorticoides37.
En la mayoría de pacientes asmáticos existe una correlación directa entre la capacidad del RG para translocarse en el núcleo de las células mononucleares y la capacidad de acetilación de residuos de histonas, que se traduce en una mayor transcripción de proteína. Sin embargo, en un pequeño porcentaje de estos pacientes se produce translocación nuclear del RG, pero ésta no es capaz de producir acetilación de histonas38. Al utilizar anticuerpos específicos antihistona, este defecto fue localizado en un residuo concreto de lisina, la lisina 5 en la histona H439. Este residuo es de importancia clave para las acciones de los glucocorticoides, ya que regula la secreción de inhibidor de la secreción de proteasa leucocitaria (SLPI) y la apoptosis de células T. Todo esto sugiere que existen defectos en la translocación nuclear y/o en la interacción del RG con la maquinaria de transcripción celular, que explican la pobre o nula respuesta al tratamiento glucocorticoideo.
Actitud diagnóstica ante la sospecha de ACD en una consulta especializada
Cuando se plantea la sospecha de ACD es preciso seguir un procedimiento diagnóstico que asegure que no se trata de una ACD falsa. Para ello, lo primero es hacer un diagnóstico de certeza de asma, y excluir otros trastornos con síntomas similares que pueden solaparse con el asma y cuyas molestias sean la causa aparente del ACD. Además, hay que investigar la existencia de factores agravantes y de incumplimiento terapéutico. En segundo lugar, hay que intentar controlar la enfermedad con una estrategia terapéutica específica y, por último, establecer el diagnóstico de ACD con los criterios de la tabla I.
Utilizar protocolos diagnósticos puede ayudar4,40-42, pero en la actualidad no hay ninguno que esté consensuado internacionalmente. La GEMA2 recomienda una aproximación diagnóstica con diferentes niveles de complejidad de las pruebas.
En esta normativa se propone un protocolo de actuación basado en las recomendaciones de diferentes consensos2,3,5 o revisiones de expertos4,42,43 y en la propia experiencia de los autores. Está estructurada por visitas médicas, con un mínimo de 3 visitas, pero que en algunos casos tendrá que desarrollarse en más consultas durante un período de entre 6 y 12 meses, hasta confirmar el diagnóstico (fig. 1), y se complementa con un esquema que conduce hasta el diagnóstico de ACD (fig. 2).
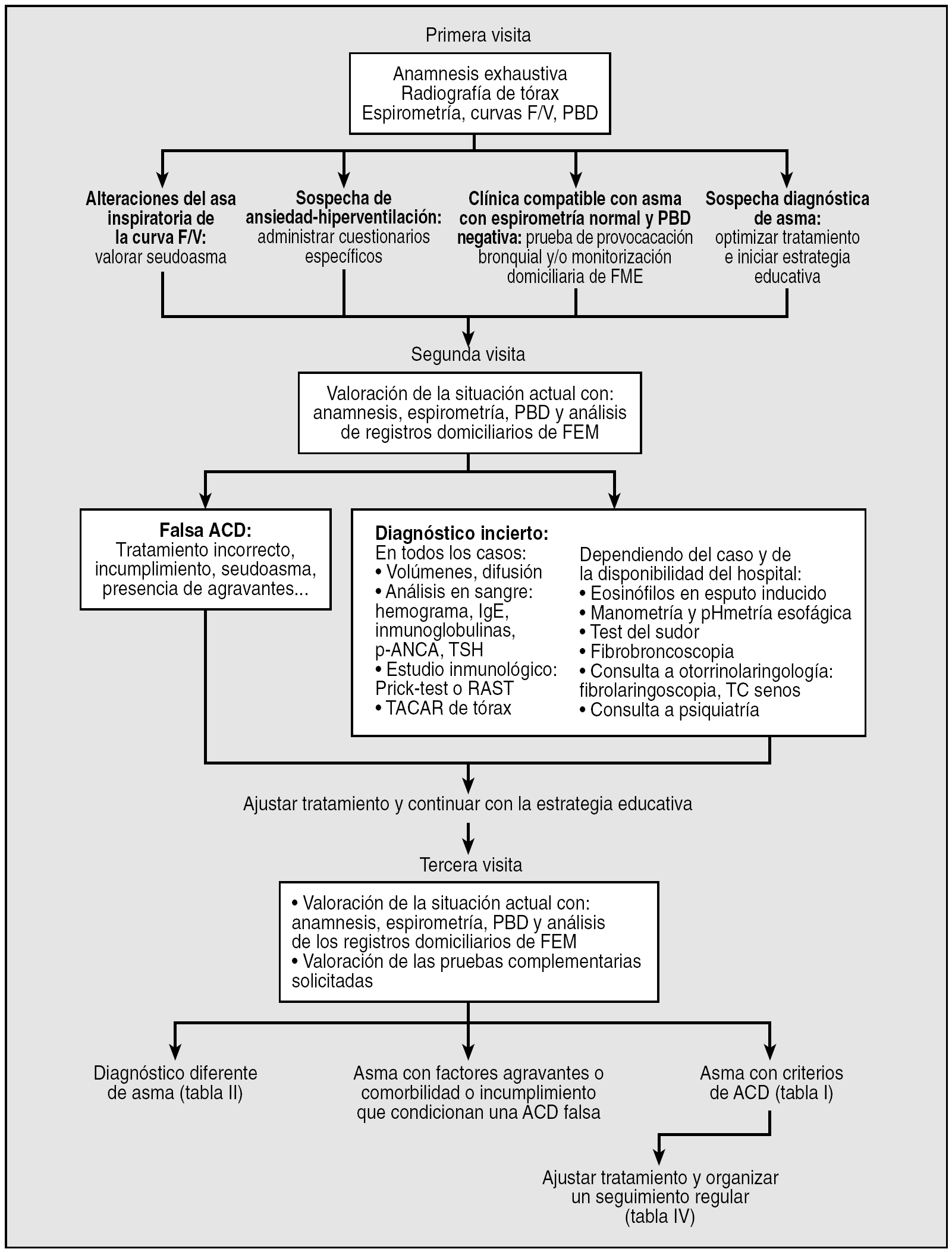
Fig. 1. Protocolo de actuación por visitas médicas. ACD: asma de control difícil; F/V: flujo/volumen; FEM: flujo espiratorio máximo; p-ANCA: anticuerpos anticitoplasma de los neutrófilos perinucleares; PBD: prueba broncodilatadora; RAST: prueba de radioalergoabsorbencia; TC: tomografía computarizada; TACAR: tomografía computarizada de alta resolución; TSH: hormona tirostimulante.
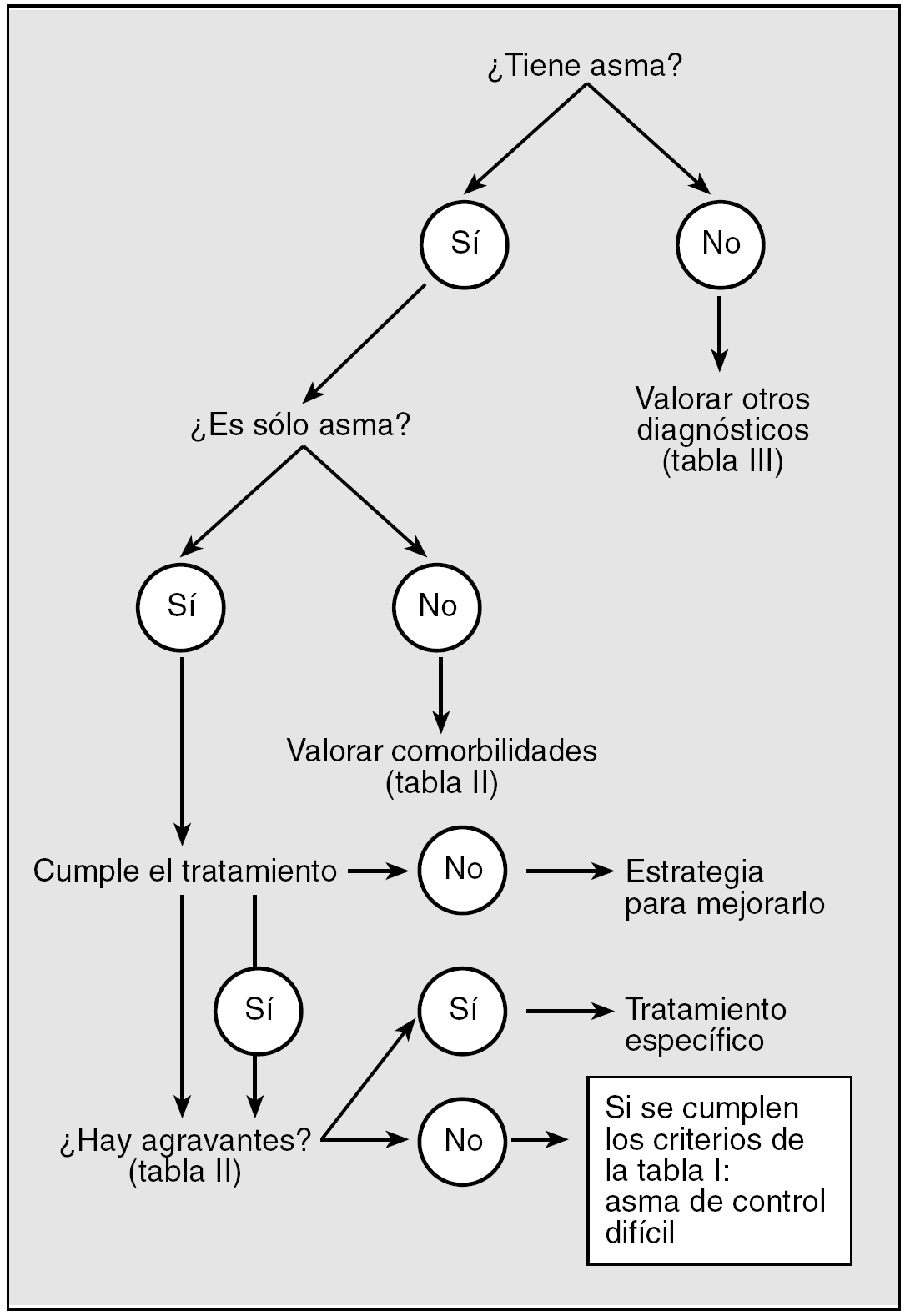
Fig. 2. Esquema de actuación para llegar al diagnóstico de asma de control difícil.
Primera visita
1. Anamnesis exhaustiva (haciendo una nueva historia clínica aunque el paciente sea conocido) de los síntomas principales, tipo de crisis, hospitalizaciones previas, existencia de desencadenantes (ocupacionales, alérgenos domésticos, fármacos, etc.), posibles comorbilidades (reflujo gastroesofágico, disfunción de cuerdas vocales, rinosinusitis, etc.) y tratamientos previos.
2. Radiografía de tórax, cuando no se disponga de ella.
3. Espirometría, curva flujo-volumen y prueba broncodilatadora.
4. Si existen alteraciones en el asa inspiratoria de la curva flujo-volumen (con valores de FEV1 dentro de la normalidad o cercanos a ella), debe valorarse la presencia de seudoasma.
5. Ante la sospecha de síndrome de ansiedad-hiperventilación, resultan útiles los cuestionarios específicos de hiperventilación44 y de ansiedad45.
6. Cuando la espirometría sea normal y la prueba broncodilatadora negativa, la realización de una prueba de provocación bronquial y la monitorización del flujo espiratorio máximo (FEM) en el domicilio también pueden ser de ayuda.
7. Una vez establecida la sospecha diagnóstica de asma, se optimizará el tratamiento y se iniciará una estrategia educativa que incluirá:
Explicar al paciente la presunción diagnóstica, las exploraciones que se le van a realizar y la estrategia terapéutica que se va a seguir.
Establecer una relación de confianza con el paciente, dialogando sobre las preocupaciones y creencias sobre su enfermedad y los objetivos que busca en la consulta.
Enseñar el uso correcto de inhaladores.
Enseñar a monitorizar el FEM en su domicilio.
Dialogar sobre el cumplimiento y mostrarle métodos para evitar el olvido.
8. Cita para la siguiente visita a corto plazo (entre 7 y 30 días, según los casos).
Segunda visita
1. Valoración de la situación actual y de la respuesta al tratamiento, indagando sobre síntomas, uso de β2-adrenérgico de acción corta y cumplimiento terapéutico, con la realización de una espirometría y prueba broncodilatadora y con el análisis de los registros de FEM en el domicilio.
2. Con el análisis en conjunto de todos los datos del punto anterior, en muchos casos se concluirá que se trata de una falsa ACD (por tratamiento previo incorrecto, incumplimiento terapéutico, presencia de agravantes o de seudoasma) y se actuará en consecuencia, mientras que en otros el diagnóstico será aún incierto, y será necesaria la realización de más pruebas para aclarar si se trata de una verdadera ACD o de otras enfermedades con síntomas similares (tabla III):
Pruebas de función pulmonar: curvas flujo-volumen, volúmenes estáticos y difusión.
Análisis de sangre: hemograma, IgE total, inmunoglobulinas, anticuerpos anticitoplasma de los neutrófilos perinucleares (p-ANCA), hormona tirostimulante (TSH).
Estudio inmunológico (Prick-test o prueba de radioalergoabsorbencia [RAST]).
Tomografía computarizada de alta resolución de tórax.
Eosinófilos en esputo inducido.
Manometría y pHmetría esofágica.
Test del sudor.
Fibrobroncoscopia.
Consulta a otorrinolaringología (fibrolaringoscopia, tomografía computarizada de senos).
Consulta a psiquiatría.
Las pruebas de los 4 primeros puntos son necesarias siempre, mientras que en las otras, sobre todo las más cruentas, su realización dependerá de la sospecha clínica.
3. Se seguirá con la estrategia educativa con el mismo esquema de la primera visita.
4. Se mantiene el tratamiento o se ajusta dependiendo de la situación actual y se cita al paciente para una nueva visita en un período de entre 1 y 3 meses.
Tercera visita
1. Valoración de la situación actual y de la respuesta al tratamiento, se indagará sobre síntomas, uso de β2-adrenérgico de acción corta y cumplimiento terapéutico, con la realización de una espirometría y prueba broncodilatadora y con el análisis de los registros de FEM en el domicilio.
2. Valoración de los resultados de las pruebas complementarias solicitadas en la visita anterior.
3. Con el análisis en conjunto de los datos de los 2 puntos anteriores, se seguirá el algoritmo de la figura 2 hasta llegar al diagnóstico definitivo de ACD, comprobando además que cumplan los criterios de la tabla I.
4. Se programará un seguimiento periódico, con plazos diferentes dependiendo del grado de control de la enfermedad.
Tratamiento
Las normativas para el manejo del asma1,2 recomiendan un tratamiento escalonado según la gravedad, con el objetivo de conseguir siempre el control de la enfermedad. Estas recomendaciones se aceptan universalmente porque están basadas en fuertes evidencias científicas, pero para los pacientes con asma que no se controlan a pesar de estar con el tratamiento del escalón más alto (asma grave) no hay pautas claras y consensuadas internacionalmente porque hay muy pocos estudios46-49 y éstos utilizan diferentes definiciones de ACD. Por tanto, la evidencia científica es insuficiente.
Cuando no se puede obtener un control óptimo, el objetivo del tratamiento debe ser el de conseguir los mejores resultados posibles con los mínimos efectos indeseables50 (grado de evidencia D). Esta filosofía es la que guía el esquema terapéutico que recomienda esta normativa (tabla IV).
Evitar todos los factores que puedan influir en el control de la enfermedad
Tratando las comorbilidades, fundamentalmente rinosinusitis y reflujo gastroesofágico.
Haciendo un control ambiental estricto.
Valorando y mejorando el cumplimiento terapéutico con una estrategia específica.
Tratamiento intensivo inicial hasta conseguir los mejores resultados posibles
La pauta terapéutica con la que se ha de comenzar será la recomendada para el asma grave, es decir, esteroides inhalados a dosis altas (budesonida 1.600 o fluticasona 1.000 µg/día), β2-adrenérgicos de acción prolongada 2 veces al día y una pauta corta de esteroides orales (40 mg de prednisolona durante 15 días) con el objetivo de conseguir el control o la mejor respuesta posible. Posteriormente se iniciará una estrategia de reducción de fármacos.
Si al retirar los esteroides orales se observa deterioro clínico o funcional, se añadirán otros fármacos (teofilinas, antileucotrienos, anticolinérgicos y esteroides orales). No hay estudios que ayuden a definir qué combinaciones son las más eficaces. Probablemente la mejor pauta es la de probar fármacos, monitorizar parámetros clínicos, funcionales y de inflamación, y retirar el fármaco con el que no se ha obtenido respuesta para probar el siguiente.
En los pacientes que requieran esteroides orales de forma continua es necesario recomendar medidas preventivas de la osteoporosis.
Cuando se detecte respuesta deficiente a esteroides orales, hay que investigar las posibles causas
Anomalías en la farmacocinética de los glucocorticoides: absorción incompleta de los glucocorticoides por trastornos gastrointestinales, fracaso en la conversión de la forma inactiva (prednisona) en activa (prednisolona) por alteraciones enzimáticas, y eliminación rápida por aumento del metabolismo por interacción con otros fármacos que inducen el citocromo P-450, como la rifampicina, la fenitoína, la carbamazepina y el fenobarbital37.
Resistencia a esteroides. Para constatarla, a los pacientes con FEV1 menor del 70% del teórico y con respuesta broncodilatadora positiva3,51 se les dará un ciclo de esteroides orales (40 mg de prednisona o prednisolona en 2 tomas) durante 2 semanas; si no hay respuesta, se doblará la dosis durante otras 2 semanas. Los que respondan a las dosis altas tendrán una respuesta alterada, pero no ausente, a los esteroides. Con esteroides por vía intramuscular como la triamcinolona (40 mg cada 10 días), algunos pacientes con aparente resistencia a los esteroides responden con mejoría clínica y funcional37,52,53 (grado de evidencia C). Su uso en la práctica está limitado por los efectos adversos y debe probarse de forma individual, y comprobar siempre su eficacia con espirometrías seriadas. Su posible utilidad sería en todo caso como alternativa a dosis muy altas de esteroides orales.
Cuando el paciente responde con cualquier pauta, se irá bajando la dosis para mantener la mínima (en toma única matutina) que mantenga el mejor control posible. Es recomendable usar siempre prednisolona (la forma activa), por si hay fallo en la conversión.
Tratamientos alternativos para disminuir la dosis de esteroides orales
Algunos pacientes necesitan el uso de esteroides orales a dosis altas como tratamiento de mantenimiento, lo que lleva a efectos secundarios indeseables. Por ello, desde hace varios años se están probando en el tratamiento de estos asmáticos fármacos que han demostrado un efecto antiinflamatorio útil en otros procesos nosológicos inflamatorios crónicos: colagenosis y angeítis sistémicas, principalmente. Los más empleados, y siempre con el objetivo de reducir el consumo de esteroides orales, han sido la colchicina, la cloroquina, la dapsona, la troleandomicina, las inmunoglobulinas, la azatioprina, las sales de oro, la ciclosporina y el metotrexato. Todos tienen alguna actividad «moduladora de la inflamación», junto a efectos secundarios que es necesario vigilar de cerca.
La evidencia científica hasta ahora disponible permite decir que:
No hay estudios científicos suficientes que actualmente justifiquen el uso en el tratamiento del asma, con el objetivo arriba indicado, de la colchicina54, la cloroquina55, la dapsona56 (grado de evidencia C para las 3), la troleandomicina57 (grado de evidencia B), las inmunoglobulinas intravenosas (esencialmente subclases de IgG obtenidas del plasma de personas sanas)58,59 y la azatioprina60 (grado de evidencia B para esta última).
Las sales de oro orales o parenterales61 y la ciclosporina62 consiguen una pequeña reducción en el consumo de esteroides orales, probablemente con significado clínico escaso, por lo que, unido a sus potenciales efectos secundarios, aún no se pueden recomendar de un modo rutinario con esta finalidad (grado de evidencia B).
Con el metotrexato es con el fármaco que más ensayos clínicos bien diseñados se han realizado63-65 (grado de evidencia B), pero estas evidencias solamente permiten obtener conclusiones modestas: se puede conseguir una reducción en el consumo diario de esteroides orales, pero quizá no tan grande como para disminuir de un modo significativo los efectos secundarios de la corticoterapia oral crónica y justificar, a su vez, el nada despreciable riesgo de la toxicidad hepática del metotrexato. De usarlo, no obstante, será en dosis orales semanales, con controles analíticos frecuentes, con administración simultánea de ácido folínico y, en asmáticas en edad fértil, con control anticonceptivo seguro.
Otro fármaco que debe considerarse es el omalizumab, un anticuerpo monoclonal antiinmunoglobulina E (IgE) que se ha evaluado extensamente en la enfermedad alérgica. En el asma atópica con valores elevados de IgE se observó que consigue reducir la dosis de esteroides en el 50% de los pacientes66 (grado de evidencia B). Es bien tolerado, aunque el perfil de seguridad requiere evaluaciones a largo plazo. La vía de administración es la subcutánea, y la dosis depende del valor basal de IgE y del peso del paciente (de 150 a 375 mg cada 2 o 4 semanas). Para simplificar el cálculo de la dosis individual se ha desarrollado una tabla67. Recientemente se ha publicado un ensayo clínico68 (grado de evidencia A) con asmáticos de control difícil que demuestra su eficacia, y muestra una disminución del número y gravedad de las crisis así como de las visitas a servicios de urgencias. En España todavía no está comercializado.
Seguimiento regular y planes de acción por escrito
En este grupo de pacientes es esencial realizar un seguimiento estrecho con revisiones repetidas hasta conseguir los mejores resultados (2 o 3 en los primeros 2 meses) y posteriormente espaciarlos (cada 3 meses) con algún sistema de comunicación médico-paciente ágil (teléfono, sistema telemático, etc.) para consultas no programadas.
Todos los pacientes con ACD tienen que tener un plan de acción por escrito individual basado en síntomas y en cifras de FEM, para lo que es necesaria una adecuada instrucción que permita poder llevarlo a la práctica. No en vano, disponer de un plan de autotratamiento evita crisis de riesgo vital69 y muertes por asma70 (grado de evidencia C).
Aspectos particulares en los niños
Afortunadamente, la ACD es muy infrecuente en la edad pediátrica. La mayoría de los niños con asma se controlan bien con los tratamientos actuales, y cuando esto no ocurre, se debe sospechar que el diagnóstico no es correcto o que no realizan adecuadamente el tratamiento o no siguen las medidas de control ambiental. El diagnóstico y manejo de la ACD en el niño mayor es muy parecido al del adulto, y se producen mayores diferencias en el asma del niño pequeño.
Problemas para definir el asma difícil en el niño pequeño
En primer lugar, existen enfermedades muy diversas que se manifiestan con sibilancias durante los primeros años de la vida y cuya presentación clínica puede ser muy similar en unas y en otras, y es un gran reto distinguirlas (tabla V). Cuanto menor es el niño con problemas respiratorios, mayor es la probabilidad de que tenga otras patologías que simulen el asma71. En segundo lugar, la definición de la ACD incluye la falta de respuesta a un tratamiento adecuado. No es raro encontrar niños con episodios de broncospasmo, incluso graves, exclusivamente durante las infecciones respiratorias, y que tienen una mala respuesta a un tratamiento antiasmático adecuado; en muchos de estos pacientes no se produce mejoría a pesar de que se aumente el tratamiento, aunque afortunadamente suelen mejorar con el tiempo72,73. En tercer lugar, no es fácil valorar la falta de control a estas edades, pues muchas veces los síntomas persistentes (tos, sibilancias...) no son específicos de asma, y es difícil objetivar la existencia de obstrucción bronquial mediante pruebas de función pulmonar en los niños más pequeños74,75.
Patología
Los estudios con lavado broncoalveolar han mostrado que los niños pequeños con episodios frecuentes de sibilancias tienen un incremento mayor de linfocitos y neutrófilos que de eosinófilos76, mientras que en niños mayores es más frecuente encontrar inflamación eosinofílica, aunque también en una parte importante tienen inflamación mediada por linfocitos o neutrófilos77. Probablemente existan diferentes subgrupos de niños con ACD. Algunos tienen un aumento del óxido nítrico (NO) que se reduce tras un tratamiento con prednisolona, mientras que en otros el NO persiste elevado a pesar del tratamiento78.
Manejo del niño pequeño con asma de control difícil
En un niño con clínica sugestiva de asma que no responda adecuadamente al tratamiento se debe, en primer lugar, hacer un diagnóstico diferencial exhaustivo que permita descartar las patologías referidas en la tabla V. Los estudios necesarios se indicarán de acuerdo con la clínica del paciente. Al menos habrá que descartar la existencia de fibrosis quística, reflujo gastroesofágico, inmunodeficiencia y malformaciones broncopulmonares o vasculares.
Una vez confirmado el diagnóstico de asma por exclusión de otras patologías, será necesario comprobar que se siguen correctamente las medidas de control ambiental y el tratamiento.
Varios autores recomiendan realizar una broncoscopia con lavado broncoalveolar y biopsia bronquial en los niños con ACD79, y sugieren que el resultado de la biopsia, junto con la respuesta a un ciclo de glucocorticoides sistémicos y el estudio de la función pulmonar, podría ayudarnos a definir mejor el fenotipo de asma que presenta el niño y así individualizar el tratamiento80.
El manejo farmacológico de la ACD en niños es similar al de los adultos. En primer lugar, se optimizará el tratamiento convencional con glucocorticoides inhalados a dosis altas en combinación con broncodilatadores de acción prolongada. Los antagonistas de los leucotrienos tienen un efecto aditivo a los glucocorticoides inhalados en el asma infantil81, pero no existen estudios sobre su efecto en el asma grave. Los niños no suficientemente controlados con este tratamiento deberán tratarse con glucocorticoides orales con una dosis inicial de 2 mg/kg/día durante el menor tiempo posible. Preferentemente se utilizarán ciclos cortos de no más de 7 días, pero cuando sea necesario prolongar su uso se deberá hacer a la menor dosis posible y en una única dosis matutina. Existe evidencia de que los niños que no se controlan bien con glucocorticoides orales podrían mejorar con el uso de triamcinolona por vía intramuscular82. No está claro si esta mejoría se produce por la mejor cumplimentación o porque la triamcinolona tenga un perfil antiinflamatorio mejor que los glucocorticoides orales. No existen ensayos clínicos controlados que avalen el uso de los fármacos inmunosupresores como metotrexato o ciclosporina en niños con asma grave, aunque sí hay algunas series de casos que sugieren un posible efecto83,84. Por ello, y por la posibilidad real de efectos secundarios importantes, se debe ser muy precavido con su uso.