Las micobacterias no tuberculosas (MNT) o micobacterias atípicas son bacterias aerobias del genero Mycobacterium, de potencial patógeno conocido desde los años cincuenta1. La pandemia del sida, el incremento progresivo de los estados de inmunosupresión y el perfeccionamiento de las técnicas microbiológicas, hacen que el aislamiento de estos microorganismos sea más común en nuestros días2.
Mycobacterium xenopi (M. xenopi) es una MNT relacionada con el agua que se encuentra fundamentalmente en América del Norte, sudeste de Gran Bretaña y norte de Francia3, y que se demostró por primera vez en pacientes inmunodeprimidos. El principal factor de riesgo para la enfermedad son las enfermedades pulmonares crónicas, en las que el microorganismo puede colonizar las vías respiratorias4. Se han publicado casos de infección por micobacteria en pacientes con diagnóstico de neoplasia5, pero son excepcionales los casos publicados por M. xenopi. Según la bibliografía consultada en los buscadores habituales, Medline y Pubmed, para artículos en castellano (palabras clave: Mycobacterium xenopi y lung cancer) no hemos encontrado referencias sobre el particular. Presentamos un caso de infección por M. xenopi en un paciente con EPOC grave y diagnóstico de carcinoma de células escamosas.
Varón de 73 años de edad, fumador activo y diagnosticado de EPOC grave en 2006. Consultó por astenia, dolor epigástrico, pérdida de peso y tos productiva sin fiebre. El único hallazgo relevante en la exploración física era un deficiente estado de nutrición. Analíticamente destacaba anemia normocítica normocrómica (hemoglobina 10,8g/dl), con VSG de 46mm y ferritina de 9,4ng/ml (valor normal: 30-400ng/ml). La radiografía de tórax reveló un infiltrado en el lóbulo superior izquierdo (LSI), granulomas dispersos y atrapamiento aéreo bilateral. El estudio endoscópico digestivo mostró esofagitis por Candida, duodenitis erosiva con test de la ureasa negativo y divertículos en colon. En 3 muestras de esputo se observaron bacilos ácido-alcohol resistentes, motivo por el cual se inició tratamiento con isoniacida, rifampicina, pirazinamida y etambutol, además de hierro oral y fluconazol. El cultivo de los 3 esputos en medio de Löwenstein evidenció crecimiento de M. xenopi, lo que motivó un cambio de la terapia antimicrobiana, iniciándose tratamiento con claritromicina, rifampicina y etambutol.
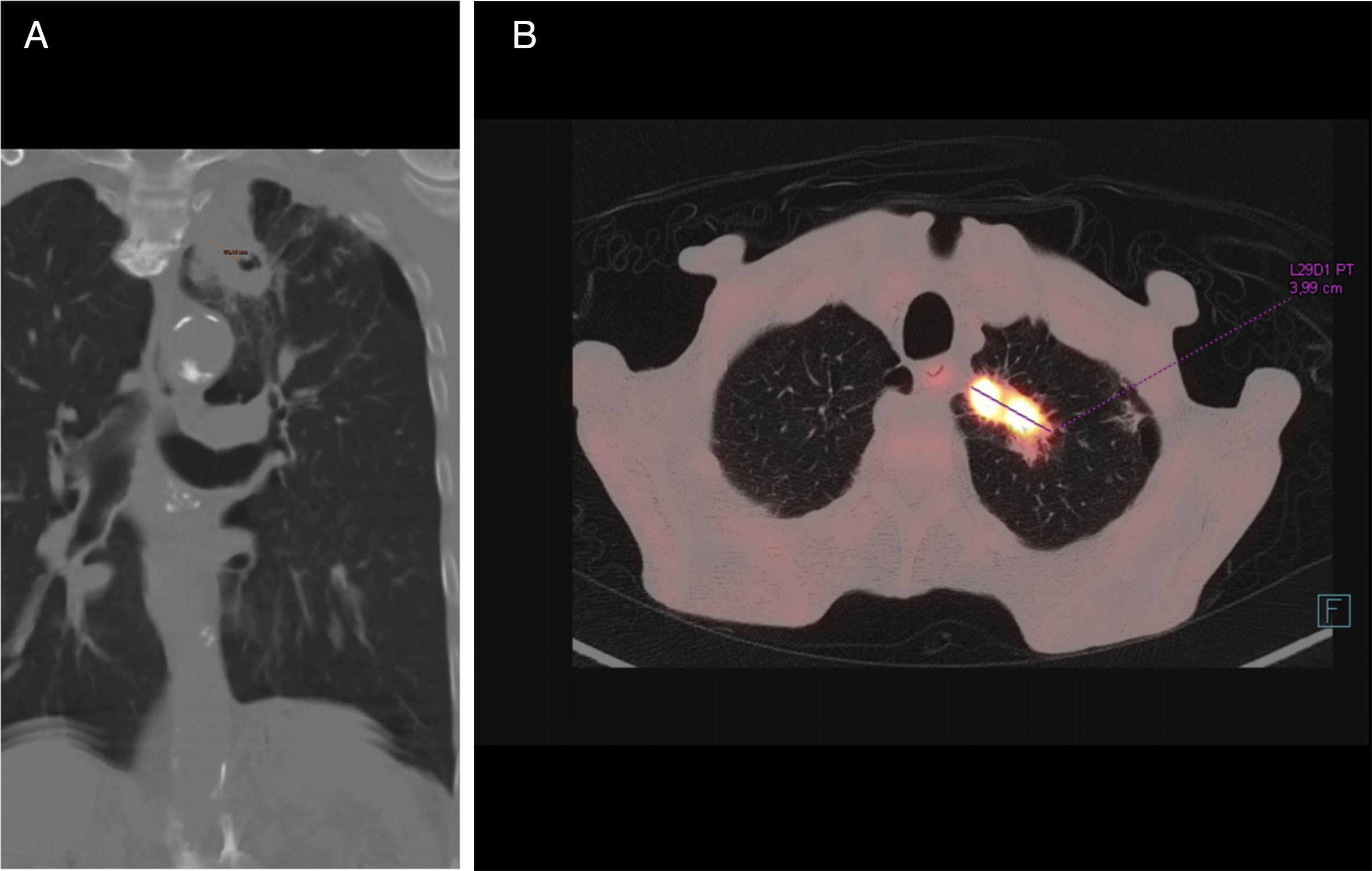
La TC de tórax (fig. 1) confirmó la existencia de una lesión sólida de bordes espiculados con cavitación central en el LSI, de 40×35mm, con una pared de 18mm de grosor, en contigüidad con otra lesión paramediastínica de 3cm, así como signos de enfisema y múltiples granulomas calcificados. En la broncoscopia no había lesiones endoluminales ni alteraciones de la mucosa. La PET-TC confirmó una masa hipermetabólica en el vértice pulmonar izquierdo que impresionaba de neoplasia pulmonar maligna. La biopsia transbronquial fue diagnóstica de carcinoma de células escamosas.
A) TC coronal con ventana de pulmón: masa cavitada con pared gruesa irregular de 18 mm en lóbulo superior izquierdo que se continúa hacia el mediastino. B) PET-TC axial: la masa muestra alta captación de fluorodesoxiglucosa, con un valor estándar de captación (standard uptake value) de 28,38 unidades.
Las infecciones por M. xenopi suelen manifestarse con sintomatología inespecífica como disnea, tos o pérdida de peso6, y afectan principalmente a varones con EPOC7,8. Las alteraciones radiológicas son diversas y tienden a persistir. Es frecuente la presencia de lesiones cavitadas en lóbulos superiores, masas, nódulos miliares y adenopatías mediastínicas o hiliares9. Woodring y Fried10 encontraron que la mayoría de cavidades con un grosor superior a 15mm se correspondía, como en nuestro caso, con neoplasias. Hasta donde hemos podido conocer se han publicado 3 casos de infección por M. xenopi asociado a cáncer de pulmón: adenocarcinoma11, células grandes5 y epidermoide12, en ninguno de los cuales el diagnóstico de las 2 entidades fue simultáneo, como en el que presentamos.
El diagnóstico de estas enfermedades exige el crecimiento de la micobacteria en 3 cultivos de esputo, así como una compatibilidad clínica y radiológica13. Se desconoce la asociación y duración óptima del tratamiento para las infecciones pulmonares por M. xenopi. Según los criterios actuales de infección por MNT (ATS/IDSA 2007)8 se recomienda la asociación de rifampicina, etambutol y claritromicina —o moxifloxacino, por su baja concentración inhibitoria frente a micobacterias14— durante al menos 12 meses.
Aunque la infección por M. xenopi es excepcional, creemos que el presente caso ilustra la conveniencia de descartar una infección por MNT ante la coexistencia de síntomas o signos inespecíficos como la pérdida de peso o la anemia en pacientes con EPOC y neoplasia pulmonar.