Presentamos el caso de un varón de 78 años, exfumador, con antecedentes de tuberculosis pulmonar tratada con neumotórax terapéutico izquierdo y empiema crónico izquierdo recidivante, que presenta empeoramiento de su situación general en los últimos meses con disnea, pérdida de peso, astenia, sequedad cutánea generalizada, síntomas de insuficiencia cardíaca derecha e insuficiencia respiratoria hipercápnica crónica.
Analíticamente destacaba anemia y discreta alteración de las enzimas hepáticas. La radiografía de tórax mostraba un incremento importante del derrame pleural izquierdo previo con desplazamiento mediastínico, por lo que se le realizó una toracocentesis, obteniendo un líquido pleural de aspecto turbio compatible con un exudado de predominio polinuclear con glucosa baja, proteínas, LDH y ADA elevados, CEA normal. La citología fue negativa para células malignas y en el cultivo no se evidenció crecimiento de bacterias ni micobacterias.
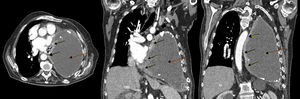
Ante la escasa mejoría clínica tras la evacuación de líquido pleural junto con los datos sugestivos de insuficiencia cardíaca derecha se realizó ecocardiografía transtorácica, objetivando una masa hipoecogénica en la pared inferolateral del ventrículo izquierdo, con dilatación de la aurícula izquierda, ligero derrame pericárdico, FEVI conservada y vena cava inferior dilatada sin colapso inspiratorio. Se realizó TC toracoabdominal, apreciándose una masa de partes blandas en la pared medial y caudal del hemitórax izquierdo, de 6×3cm, con infiltración pericárdica, efecto masa y pequeño derrame pericárdico asociado. Comparativamente con estudios previos se evidenció un importante incremento de la colección pleural conocida, que se encontraba ocupando la práctica totalidad del hemitórax, produciendo atelectasia compresiva del pulmón con desviación mediastínica contralateral y compresión cardíaca (fig. 1).
TC de tórax con contraste, corte axial (izquierda) y coronales (centro y derecha:): masa pleural en pared medial y caudal de hemitórax izquierdo con infiltración pericárdica (flechas continuas) y gran colección en hemitórax izquierdo correspondiente con piotórax crónico (flechas discontinuas), produciendo en su conjunto desplazamiento mediastínico contralateral y compresión cardíaca.
Se biopsió la masa de forma guiada por TC con resultado anatomopatológico compatible con linfoma no Hodgkin B difuso de células grandes, con nivel de proliferación del 70%, sin positividad para virus de Epstein Barr (VEB) ni para c-myc y sin infiltración de la médula ósea. Las serologías para VIH, VHB, VHC y CMV resultaron negativas. El paciente presentó un empeoramiento clínico acelerado en pocas semanas, que condicionó su derivación para tratamiento y seguimiento por cuidados paliativos, falleciendo a los 2 meses del diagnóstico.
El linfoma pleural primario es una entidad poco frecuente (aproximadamente 7% de los linfomas). Usualmente afecta a pacientes con VIH o piotórax crónico (PC), siendo excepcional en pacientes inmunocompetentes1. Aunque la ratio de PC es similar en ambos sexos, los hombres son más susceptibles al desarrollo de linfomas no Hodgkin (LNH) que las mujeres (ratio 5,2:1).
La estimulación inflamatoria de larga duración se ha señalado como un factor etiológico importante para el desarrollo de linfomas malignos, describiéndose periodos de tiempo desde el inicio del PC hasta el desarrollo de LNH mayores (>20años) que en pacientes con enfermedades autoinmunes o trasplantados renales (9,5 y 4 años, respectivamente). De hecho, tras los resultados de su estudio, Aozasa et al. distinguieron y acuñaron una entidad clínico-patológica característica denominada el «linfoma asociado a piotórax (PAL)». Esta entidad viene definida como un LNH-B desarrollado en la cavidad pleural de pacientes con PC de más de 20 años de evolución, en el que se ha apreciado además un perfil molecular exclusivo, la sobreexpresión de proteína 27 interferón-inducible, que juega un papel en la inflamación crónica2. El VEB infecta de forma latente el PAL con expresión tipo iii de proteínas relacionadas con el VEB en las células tumorales3, hecho que no se evidenció en nuestro paciente.
Aunque el síntoma más frecuente es el dolor torácico, también puede aparecer disnea si se acompaña de derrame pleural significativo, como ocurrió en el presente caso. Radiológicamente se presenta como un engrosamiento pleural nodular difuso, acompañado de masa pleural. La existencia de una masa de tejido blando pleural adyacente al margen de una cavidad de empiema coexistente sugiere la presencia de linfoma asociado a piotórax4. En otras ocasiones puede aparecer derrame pleural aislado previo al desarrollo de la masa pleural5. El conocimiento de los hallazgos radiológicos típicos y la ubicación ayuda en el diagnóstico de esta rara entidad patológica4. En consonancia con la literatura, nuestro paciente precisó en los meses previos toracocentesis evacuadoras de repetición por empiema recidivante, objetivándose posteriormente la masa pleural. En el presente caso, de forma inusual, la masa pleural se halló localizada en la pared medial y caudal del hemitórax izquierdo, extendiéndose al pericardio2.
Para el diagnóstico se recomienda realizar una biopsia pleural guiada por ecografía o TC, o mediante videotoracoscopia5. Histológicamente, todos los casos de PAL son LNH, siendo el LNH-B difuso de células grandes el más común5, como en nuestro caso. El tratamiento quirúrgico agresivo con pleuroneumonectomía presenta excelente eficacia en estadios precoces, estando al alcance, por tanto, de un número muy limitado de pacientes3. Se requiere quimioterapia sistémica basada en combinaciones CHOP, con eficacia variable. La radioterapia es efectiva para el control local, primario o de rescate tras quimioterapia. El pronóstico es pobre, con una supervivencia a 5 años del 20-30%3. Aunque se trata de un problema infrecuente, se debe tener en cuenta el diagnóstico de linfoma pleural en el seguimiento a largo plazo de pacientes con infección pleural crónica con el objetivo de evitar el retraso terapéutico.