El síndrome de apneas e hipopneas del sueño (SAHS) es una entidad con una prevalencia alta que puede llegar al 34% de los hombres y al 17% de las mujeres1, y en muchos casos está subdiagnosticado. El SAHS se ha asociado a la disfunción endotelial y a la aterosclerosis, procesos sobre los que tienen impacto además la obesidad y otros problemas metabólicos vinculados estrechamente con este trastorno respiratorio.
La leptina es una hormona peptídica producida en el tejido adiposo que regula la homeostasis energética y la saciedad en el sistema nervioso central; sus niveles indican el grado de adiposidad2, y hay evidencias crecientes de su papel en la cascada inflamatoria y en la fisiopatología cardiovascular3.
El SAHS conlleva un aumento de la carga cardiovascular, y la detección de signos de aterosclerosis precoz en estos pacientes podría complementar la estratificación del riesgo. Además, correlacionar la leptina con los marcadores ecográficos de aterosclerosis podría aportar información sobre el posible el rol de la hormona en el proceso de engrosamiento de la pared vascular.
Hemos realizado un estudio de casos y controles con el objetivo de investigar la relación entre la leptina sérica y los parámetros de la ecografía doppler de la arteria carótida común en pacientes con SAHS. El protocolo fue aprobado por el comité de ética local y se ajustó a la Declaración de Helsinki. Incluimos 28 individuos: 14 sujetos que cumplieron criterios de SAHS moderado (índice de apneas e hipopneas [IAH] entre 15 y 30) y severo (IAH>30) por polisomnografía nocturna4 (equipo Bitmed® modelo NGP-340), o grupo de casos, que fueron emparejados con otros 14 individuos sanos de fenotipo similar (edad, índice de masa corporal [IMC], circunferencia), o grupo control. A toda la muestra se le extrajo sangre para análisis de laboratorio, incluyendo la determinación del nivel basal en ayunas de leptina en suero (Leptin Human ELISA, Clinical Range® BioVendor, República Checa), y se realizó una ecografía doppler de ambas arterias carótidas comunes (equipo MayLab 30 Esaote, transductor lineal de 7,5Mhz) por un cardiólogo experimentado en la técnica y desconocedor del brazo al que pertenecían los pacientes y de los hallazgos del resto de pruebas. Se cuantificó el grosor íntima-media (intima-media thikness [IMT]), la velocidad sistólica de la onda de pulso (peak wave velocity [PWV]) y el diámetro intraluminal de la arteria carótida común, derecha e izquierda, a 10mm de la bifurcación. Las variables continuas se presentan como medias (±desviación estándar) y las variables categóricas se presentan como frecuencias y porcentajes. Las comparaciones entre los grupos se realizaron mediante la prueba t de Student para variables continuas y la prueba de chi-cuadrado para variables categóricas. Se utilizaron modelos de regresión logística y lineal multivariables para evaluar las asociaciones entre los parámetros de la PSG y los niveles de leptina con los marcadores de la ecografía. El análisis estadístico se realizó utilizando el paquete estadístico SPSS 20.0 (IBM Corp., Armonk, NY, EE.UU.).
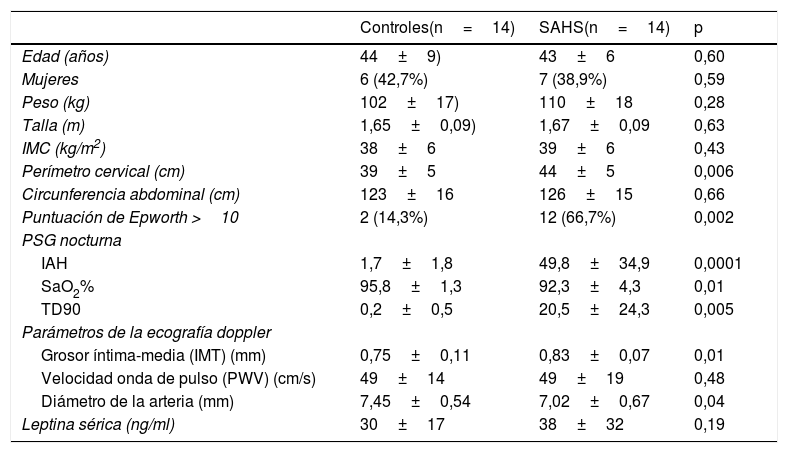
La tabla 1 muestra las características y los hallazgos de ambos grupos. No había diferencias en la composición por género ni en las características antropométricas, excepto el perímetro cervical, que fue mayor en el grupo SAHS. El IMT carotídeo fue mayor y el diámetro intraluminal menor en los pacientes con SAHS respecto al grupo control (p<0.05). Hubo una correlación significativa entre un mayor IAH y menor SaO2% con un IMT y PWV más altos (IAH-IMT r=0,54, p=0,025; IAH-PWV r=0,5, p=0,007; SaO2%-IMT r=−0,49, p=0,007; SaO2%-PWV r=−0,51, p=0,006). En términos de valor absoluto, los niveles de leptina fueron más altos en los individuos con SAHS, pero esta diferencia no alcanzó significación estadística. Niveles más altos de leptina se asociaron a menor saturación media nocturna (SaO2%) (r=−0,42, p=0,02) y hubo una correlación positiva de la concentración sérica de la hormona con el IMT de la arteria carótida común izquierda en toda la muestra (r=0,36, p=0,03).
Características clínicas, polisomnográficas, ultrasonográficas y analíticas
| Controles(n=14) | SAHS(n=14) | p | |
|---|---|---|---|
| Edad (años) | 44±9) | 43±6 | 0,60 |
| Mujeres | 6 (42,7%) | 7 (38,9%) | 0,59 |
| Peso (kg) | 102±17) | 110±18 | 0,28 |
| Talla (m) | 1,65±0,09) | 1,67±0,09 | 0,63 |
| IMC (kg/m2) | 38±6 | 39±6 | 0,43 |
| Perímetro cervical (cm) | 39±5 | 44±5 | 0,006 |
| Circunferencia abdominal (cm) | 123±16 | 126±15 | 0,66 |
| Puntuación de Epworth >10 | 2 (14,3%) | 12 (66,7%) | 0,002 |
| PSG nocturna | |||
| IAH | 1,7±1,8 | 49,8±34,9 | 0,0001 |
| SaO2% | 95,8±1,3 | 92,3±4,3 | 0,01 |
| TD90 | 0,2±0,5 | 20,5±24,3 | 0,005 |
| Parámetros de la ecografía doppler | |||
| Grosor íntima-media (IMT) (mm) | 0,75±0,11 | 0,83±0,07 | 0,01 |
| Velocidad onda de pulso (PWV) (cm/s) | 49±14 | 49±19 | 0,48 |
| Diámetro de la arteria (mm) | 7,45±0,54 | 7,02±0,67 | 0,04 |
| Leptina sérica (ng/ml) | 30±17 | 38±32 | 0,19 |
DE: desviación estándar; IAH: índice de apneas e hipopneas; IMC: índice de masa corporal; SaO2%: saturación de O2 media nocturna.
Los hallazgos ecográficos carotídeos en los pacientes con SAHS fueron más próximos a los signos de aterosclerosis carotídea incipiente que en el grupo control, y aunque no hubo diferencias en ambos grupos en la concentración sérica de leptina, niveles más altos se asociaron a peor SaO2% y a un mayor grosor íntima-media. La asociación del SAHS con aterosclerosis subclínica por ecografía ha sido reportada recientemente en una amplia cohorte de pacientes menores de 68años2. También, estudios previos3,5 han encontrado que los pacientes con SAHS tienen niveles más altos de leptina en comparación con sujetos sin SAHS; la diferencia con nuestros resultados podría estar explicada por el pequeño tamaño de nuestra muestra, sin descartar el posible papel de la variación circadiana de los niveles de la hormona. Niveles altos de leptina también se han asociado a mayores alteraciones en los parámetros polisomnográficos6, y uno de los mecanismos que podría mediar este fenómeno es la hipoxia intermitente, la cual tiene efecto estimulante en la liberación de la hormona por el tejido adiposo7. La leptina está asociada a un aumento de la actividad simpática, elevación de la presión arterial y de la frecuencia cardiaca, y también participa en la actividad inflamatoria y en el estrés oxidativo3, procesos que en su conjunto están implicados en la patogénesis de la aterosclerosis. Estos fenómenos han de mediar una mayor presencia de signos de aterosclerosis subclínica en relación con la leptinemia en estos pacientes. Se necesitan más estudios que refuercen esta hipótesis.
FinanciaciónEste estudio recibió financiación parcial por la Fundación para el de desarrollo de la Ciencia y la Tecnología (FUNDACITE) de Venezuela, registro RBV20091106.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.