La insuficiencia respiratoria hipercápnica aguda (IRHA) es una situación grave observada en algunos pacientes con síndrome de apneas-hipopneas del sueño (SAHS). El objetivo del presente estudio fue determinar las características clínicas de los pacientes con SAHS involucradas en el desarrollo de la IRHA y su pronóstico.
Pacientes y métodoSetenta pacientes con SAHS consecutivos que sobrevivieron un episodio de IRHA y 70 pacientes con SAHS apareados por edad sin antecedentes previos de IRHA fueron estudiados y seguidos de forma prospectiva durante 3 años.
ResultadosEl deterioro de la función pulmonar debido a la obesidad o a la coexistencia de enfermedad pulmonar obstructiva crónica fue frecuente en los pacientes con SAHS con IRHA. En el análisis multivariante, los factores de riesgo asociados con IRHA fueron la PaO2 basal, el porcentaje del valor teórico de la capacidad vital forzada y el consumo de alcohol y de benzodiacepinas. La mortalidad durante el seguimiento fue superior entre los pacientes que habían presentado IRHA respecto al grupo control. La principal causa de muerte fue la respiratoria, y la coexistencia de enfermedad pulmonar obstructiva crónica se identificó como un factor de riesgo de mortalidad.
ConclusionesEl desarrollo de IRHA en pacientes con SAHS se asocia con la presencia de deterioro de la función pulmonar y con el consumo de alcohol y benzodiacepinas. Después del episodio de IRHA los pacientes presentaron una mortalidad elevada, principalmente de causa respiratoria. Se precisan nuevos estudios que evalúen las distintas alternativas terapéuticas disponibles en estos pacientes.
Acute hypercapnic respiratory failure (AHRF) is a serious condition observed in some patients with sleep apnea-hypopnea syndrome (SAHS). The objective of the present study was to study the clinical characteristics of SAHS patients who develop AHRF and their prognosis.
Patients and methodA total of 70 consecutive SAHS patients who survived an AHRF episode and 70 SAHS patients paired by age with no previous history of AHRF were prospectively studied and followed up for 3 years.
ResultsThe deterioration of lung function due to obesity or concomitant chronic obstructive pulmonary diseases (COPD) was common in SAHS patients with AHRF. In the multivariate analysis, the risk factors associated with AHRF were baseline PaO2, the theoretical percentage value of the forced vital capacity, alcohol consumption, and benzodiazepines. The mortality during follow up was higher among patients who had AHRF than in the control group. The main cause of death was respiratory, and the coexistence of COPD was identified as a mortality risk factor.
ConclusionsThe development of AHRF in SAHS patients is associated with a deterioration in lung function and with alcohol and benzodiazepine consumption. The patients had a higher mortality after the AHRF episode, mainly a respiratory cause. New studies are required that evaluate the different available therapeutic options in these patients.
El síndrome de apneas-hipopneas del sueño (SAHS) fue descrito inicialmente en pacientes con síndrome de Pickwick, en la actualidad conocido como síndrome de obesidad-hipoventilación, caracterizado por la coexistencia de obesidad, somnolencia e hipercapnia1. En la actualidad sabemos que el SAHS no está presente en todos los pacientes con síndrome de obesidad-hipoventilación y, por otra parte, que solo una minoría de pacientes con SAHS desarrollan hipercapnia diurna. Aunque los mecanismos involucrados no son bien conocidos, estudios clásicos demostraron la relación entre la presencia de hipercapnia en pacientes con SAHS estables y la coexistencia de obesidad mórbida o de enfermedad pulmonar obstructiva crónica (EPOC)2,3. Estos hallazgos fueron confirmados por estudios más recientes4–6. Sin embargo, las características clínicas implicadas en el desarrollo de insuficiencia respiratoria hipercápnica aguda (IRHA) en el SAHS, una emergencia frecuente en la práctica de la Neumología, no han sido estudiadas. Solo disponemos de la descripción de casos individuales o de pequeñas series centradas en el tratamiento durante el episodio de IRHA7–11. En un intento de determinar las características clínicas de los pacientes con SAHS que desarrollan IRHA y su pronóstico a largo plazo, nosotros estudiamos prospectivamente y seguimos durante 3 años a un grupo de pacientes con SAHS ingresados por un episodio de IRHA y lo comparamos con un grupo de pacientes con SAHS apareados por edad y sin antecedentes de IRHA.
MétodosPacientesTodos los pacientes ingresados por un episodio de IRHA, entendido como la presencia de una presión parcial de dióxido de carbono (PaCO2) superior a 45mmHg y un pH arterial inferior a 7,35, y diagnosticados de SAHS en nuestro servicio durante un período de 2 años fueron incluidos de forma prospectiva. Un grupo control de 70 pacientes apareados por edad (±5 años) sin antecedentes de IRHA fue seleccionado entre los pacientes con SAHS diagnosticados en nuestra unidad del sueño. Para obtener los casos del grupo control, tras detectar un paciente con SAHS con IRHA se seleccionó el siguiente paciente diagnosticado con SAHS de forma consecutiva en nuestra unidad que cumpliese los criterios de inclusión y exclusión. Los criterios de exclusión fueron presencia de enfermedad neuromuscular o de caja torácica, diagnóstico previo de SAHS, asma, bronquiectasias, neumonía, enfermedad pulmonar intersticial difusa, neoplasia avanzada que pudiera comprometer la sobrevivencia a corto plazo, trasplante pulmonar o imposibilidad de un estudio del sueño debido a inestabilidad clínica. El estudio fue aprobado por el comité ético de nuestro hospital y los pacientes dieron su consentimiento informado.
ProcedimientosUna gasometría arterial respirando aire ambiente o, en aquellos que habían iniciado oxigenoterapia en la ambulancia durante el traslado al hospital, una FiO2 del 24 o del 28% administrada con mascarilla tipo Ventimask, una radiografía de tórax, un electrocardiograma y una muestra de sangre venosa fueron obtenidos de los pacientes al llegar al servicio de urgencias. El tratamiento inicial fue decidido por el personal del servicio de urgencias o por el neumólogo de guardia. Después del ingreso en el servicio de neumología, el tratamiento fue decidido por el neumólogo asignado. El servicio de neumología dispone de un neumólogo de guardia diario y mantiene los programas de alteraciones respiratorias del sueño y de ventilación mecánica no invasiva (VMNI) en nuestro hospital. Por estos motivos, los pacientes del servicio de urgencias candidatos a VMNI o con sospecha clínica de trastorno respiratorio del sueño son ingresados preferentemente en nuestro servicio. Los pacientes ingresados en otros servicios no fueron incluidos en el estudio.
Tras el ingreso, todos los pacientes con IRHA fueron introducidos en una base de datos por uno de los autores, y aquellos sin criterios de exclusión y sus familias fueron preguntados acerca de la presencia de somnolencia, evaluada mediante la escala de somnolencia de Epworth (ESS)12 y los criterios de la Academia Americana de Medicina del Sueño13. Además, se les preguntó acerca de la presencia de ronquidos, apneas observadas y sensación de sueño no reparador. Las respuestas posibles fueron valoradas de la siguiente manera: nunca o raramente=0, a veces=1, frecuentemente o siempre=2. Un valor global para cada paciente fue obtenido sumando la puntuación de las 3 preguntas. Con la intención de detectar los pacientes con SAHS se practicó una polisomnografía en los pacientes con al menos una de las siguientes características: a) índice de masa corporal (IMC) superior a 25kg/m2; b) ESS superior a 9 y/o somnolencia leve o mayor de acuerdo con los criterios de la Academia Americana de Medicina del Sueño, y c) valor global de la escala de síntomas superior a 0.
Se recogió información de los pacientes y sus familias acerca del consumo de alcohol, el tratamiento con medicación sedante y los antecedentes de tabaquismo. Se informó a los pacientes que como bebidas alcohólicas se incluía cualquier tipo de bebida con alcohol, incluyendo cerveza, vino, licores y combinados. Se solicitó a los pacientes el tipo, el número y el tamaño consumidos en una semana típica durante los pasados 12 meses. La ingesta de alcohol se cuantificó multiplicando el consumo de cada tipo de bebida por su contenido en alcohol. Adicionalmente, a los pacientes que reportaron consumo de alcohol se les solicitó el horario de este, y los que referían consumirlo usualmente (>4 días/semana) por la noche (con la cena o después de las 21h) fueron considerados bebedores nocturnos. Se diagnosticó cor pulmonale en los pacientes con signos clínicos de insuficiencia cardíaca derecha y/o hipertrofia ventricular o crecimiento auricular derecho en el electrocardiograma. Para disminuir la influencia de la retención de líquidos, el IMC se calculó al final de la estancia hospitalaria. Las comorbilidades se evaluaron mediante el índice de Charlson14.
En las últimas 24h del ingreso se practicó una espirometría y una gasometría arterial respirando aire ambiente. El diagnóstico de EPOC se estableció mediante la evaluación clínica y la espirometría (volumen espiratorio forzado en el primer segundo [FEV1] <80% del valor teórico y un cociente FEV1/capacidad vital forzada [FVC] <70%).
Se practicó una polisomnografía en las últimas 48 h del ingreso con el paciente clínicamente estable, sin precisar de ventilación mecánica durante más de 4 días, con buen descanso nocturno sin despertares motivados por disnea y capaz de deambular. La polisomnografía (Compumedics E Series®, Abbotsford, Australia) incluyó el registro del flujo oronasal (termistor), el movimiento torácico y abdominal, el electrocardiograma, el electromiograma submentoniano, el electrooculograma bilateral, el electroencefalograma (C4-A1, O3-A2), la saturación arterial de oxígeno, la posición, los movimientos de las piernas y el ronquido. Todos los estudios de sueño fueron revisados manualmente por un lector experto. Una apnea se definió como el cese del flujo aéreo superior o igual a 10s. Se diferenció entre apneas obstructivas y centrales en función de la presencia o la ausencia de movimientos toracoabdominales. Se definió como hipopnea la reducción superior al 50% en la señal de flujo aéreo acompañada de una desaturación cíclica superior o igual al 4%. El índice de apnea-hipopnea/hora de sueño (IAH) se obtuvo dividiendo la suma de apneas e hipopneas por el tiempo total de sueño. Un IAH superior o igual a 10/h se consideró indicativo de la presencia de SAHS. En los pacientes con IAH superior o igual a 30/h o con somnolencia se practicó un estudio de graduación de CPAP nasal mediante polisomnografía convencional, en el que se determinó la presión requerida para abolir apneas, hipopneas, ronquido y desaturaciones.
TratamientoLos pacientes con SAHS fueron tratados con CPAP nasal si presentaban un IAH superior a 30/h o una somnolencia significativa (ESS>10). En los pacientes con SAHS ingresados por IRHA y con PaCO2 superior a 55 en el momento del alta, la CPAP nasal fue sustituida por VMNI. Se añadió oxígeno suplementario a la CPAP nasal o a la VMNI si la SaO2 media durante el sueño con estos tratamientos era inferior al 88%. Además, se proporcionó a los pacientes una lista escrita de normas generales del tratamiento del SAHS, incluyendo recomendaciones de perder peso y evitar las bebidas alcohólicas y la medicación sedante. En los pacientes tratados con CPAP nasal que requirieron reingresar por nuevos episodios de IRHA o que presentaban una PaCO2 superior a 50mmHg durante el seguimiento, la CPAP fue sustituida por VMNI.
SeguimientoLos pacientes fueron visitados un mes después del alta o después del diagnóstico en el grupo control y les fue practicada una nueva espirometría y una gasometría arterial. Posteriormente fueron visitados cada 6 meses durante 3 años. El cumplimiento de la CPAP nasal o de la VMNI fue objetivado mediante el contador horario. Se telefoneó a los pacientes que no acudían a control y se les solicitó que acudiesen al menos a la visita anual requerida en nuestro sistema de salud para mantener vigente la terapia respiratoria. El estado vital de los pacientes perdidos durante el seguimiento fue establecido mediante la base de datos del Servicio Catalán de Salud y, en caso de muerte del paciente, se investigó la causa de esta mediante la revisión de la historia clínica y/o contactando telefónicamente con la familia.
Análisis estadísticoLos resultados se expresan como media±DE para las variables cuantitativas y como frecuencias y porcentajes para las variables cualitativas. Las comparaciones entre grupos se realizaron mediante la prueba t de Student para muestras apareadas o no apareadas en las variables cuantitativas, mientras que en el caso de las variables cualitativas se utilizó la prueba chi-cuadrado o el test de Fisher. Las curvas de sobrevivencia para los dos grupos de pacientes con SAHS, con y sin IRHA, se estimaron mediante el método de Kaplan-Meier y se compararon mediante el test de log-rank. El análisis de los factores de riesgo asociados al desarrollo de IRHA y a la mortalidad durante el seguimiento se realizó mediante modelos de regresión logística y de Cox, respectivamente. La selección de las variables independientes para el análisis multivariante se basó en la significación estadística obtenida en el análisis bivariante (p<0,10) o en su plausibilidad biológica. Se utilizó un procedimiento de selección progresiva (forward stepwise) y los resultados se expresaron como odds ratio o hazard ratio con intervalo de confianza del 95%. Todos los análisis se realizaron mediante el programa estadístico SPSS, versión 12 (SPSS Inc., Chicago, IL). La significación estadística se estableció en un valor p<0,05.
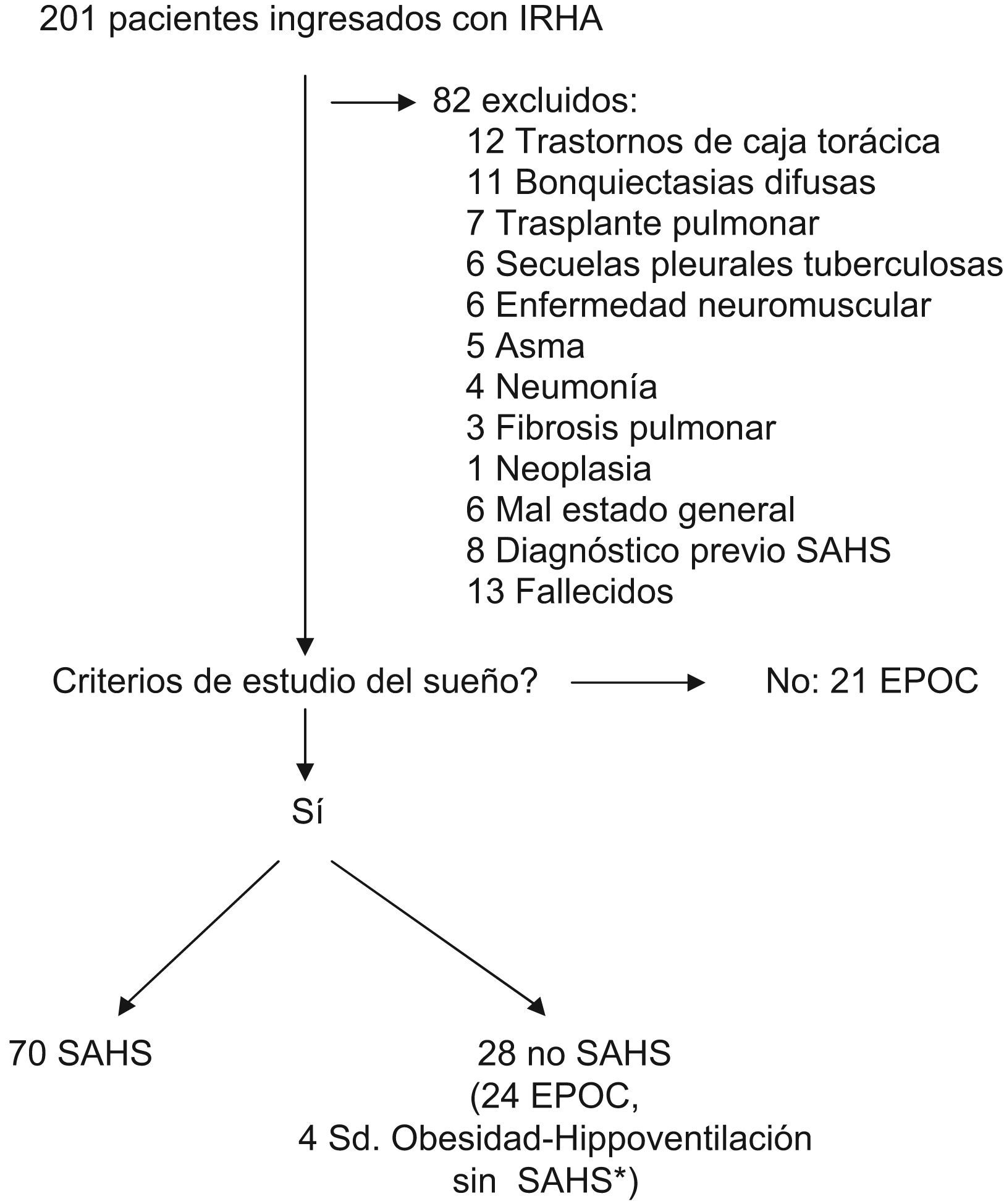
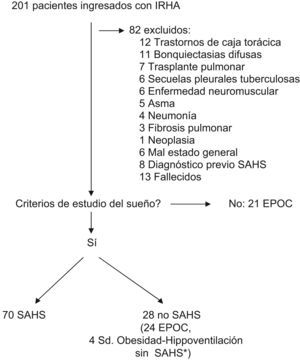
ResultadosDurante el período del estudio ingresaron 201 pacientes en IRHA. La selección de los pacientes se muestra en la figura 1.
Se diagnosticó SAHS en 70 pacientes, 49 (70%) habían requerido un ingreso por causa respiratoria en los 3 años previos. Estos ingresos previos fueron más frecuentes en los pacientes con EPOC asociada (28/32 en pacientes con EPOC versus 21/38 en pacientes sin EPOC; p<0,05). Los valores de la gasometría arterial al ingreso fueron: pH de 7,29 (0,07), PaO2/FiO2 de 206 (34) mmHg y PaCO2 de 72,8 (16,6) mmHg. Cincuentiún pacientes (73%) requirieron ventilación mecánica (45 no invasiva y 6 invasiva) durante 4,6 días (5,8), mientras que los 19 restantes (27%) fueron tratados inicialmente en el servicio de urgencias y posteriormente en planta de neumología con oxigenoterapia junto con el resto del tratamiento médico y no requirieron ventilación mecánica. La estancia hospitalaria media fue de 15,5 días (8,3). Al alta, 51 pacientes (73%) presentaban PaCO2 superior a 45mmHg.
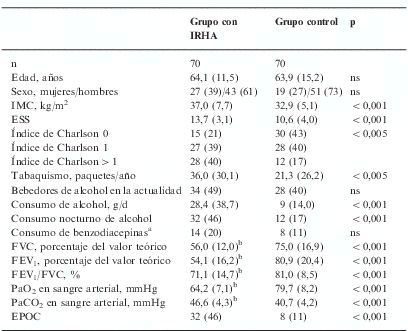
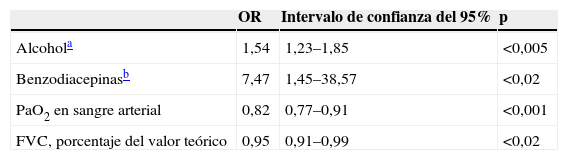
Comparados con el grupo control (tablas 1 y 2), los pacientes con SAHS con IRHA eran más obesos y presentaban mayor somnolencia y comorbilidad, consumían más tabaco y alcohol, el consumo de alcohol era más frecuentemente nocturno, presentaban con mayor frecuencia EPOC asociada, un mayor deterioro de los valores espirométricos y un SAHS más grave. El análisis mediante regresión logística incluyó las siguientes variables: el sexo, el IMC, el consumo de alcohol (g/día), la ingesta nocturna de alcohol, el índice de Charlson, el uso de sedantes, la PaO2 y la PaCO2 basales, la presencia de EPOC, la FVC (porcentaje del valor teórico) y el IAH. Como se detalla en la tabla 3, en el análisis multivariante permanecieron como variables predictoras del desarrollo de IRHA el consumo de alcohol, el uso de sedantes, la PaO2 basal y la FVC.
Características de los pacientes con síndrome de apneas-hipopneas del sueño
| Grupo con IRHA | Grupo control | p | |
| n | 70 | 70 | |
| Edad, años | 64,1 (11,5) | 63,9 (15,2) | ns |
| Sexo, mujeres/hombres | 27 (39)/43 (61) | 19 (27)/51 (73) | ns |
| IMC, kg/m2 | 37,0 (7,7) | 32,9 (5,1) | <0,001 |
| ESS | 13,7 (3,1) | 10,6 (4,0) | <0,001 |
| Índice de Charlson 0 | 15 (21) | 30 (43) | <0,005 |
| Índice de Charlson 1 | 27 (39) | 28 (40) | |
| Índice de Charlson>1 | 28 (40) | 12 (17) | |
| Tabaquismo, paquetes/año | 36,0 (30,1) | 21,3 (26,2) | <0,005 |
| Bebedores de alcohol en la actualidad | 34 (49) | 28 (40) | ns |
| Consumo de alcohol, g/d | 28,4 (38,7) | 9 (14,0) | <0,001 |
| Consumo nocturno de alcohol | 32 (46) | 12 (17) | <0,001 |
| Consumo de benzodiacepinasa | 14 (20) | 8 (11) | ns |
| FVC, porcentaje del valor teórico | 56,0 (12,0)b | 75,0 (16,9) | <0,001 |
| FEV1, porcentaje del valor teórico | 54,1 (16,2)b | 80,9 (20,4) | <0,001 |
| FEV1/FVC, % | 71,1 (14,7)b | 81,0 (8,5) | <0,001 |
| PaO2 en sangre arterial, mmHg | 64,2 (7,1)b | 79,7 (8,2) | <0,001 |
| PaCO2 en sangre arterial, mmHg | 46,6 (4,3)b | 40,7 (4,2) | <0,001 |
| EPOC | 32 (46) | 8 (11) | <0,001 |
DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; ESS: escala de somnolencia de Epworth; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IMC: índice de masa corporal; IRHA: insuficiencia respiratoria hipercápnica aguda; ns: no significativo; PaCO2: presión parcial de dióxido de carbono; PaO2: presión parcial de oxígeno.
Los datos se presentan en n (%) o media (DE).
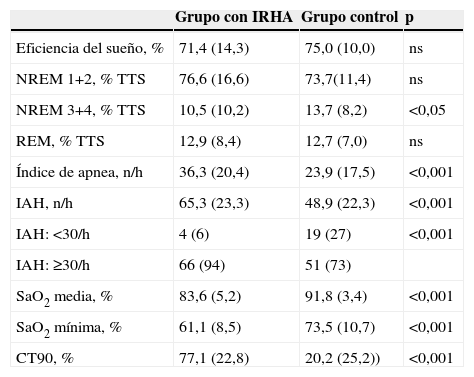
Características polisomnográficas de los pacientes con síndrome de apneas-hipopneas del sueño
| Grupo con IRHA | Grupo control | p | |
| Eficiencia del sueño, % | 71,4 (14,3) | 75,0 (10,0) | ns |
| NREM 1+2, % TTS | 76,6 (16,6) | 73,7(11,4) | ns |
| NREM 3+4, % TTS | 10,5 (10,2) | 13,7 (8,2) | <0,05 |
| REM, % TTS | 12,9 (8,4) | 12,7 (7,0) | ns |
| Índice de apnea, n/h | 36,3 (20,4) | 23,9 (17,5) | <0,001 |
| IAH, n/h | 65,3 (23,3) | 48,9 (22,3) | <0,001 |
| IAH: <30/h | 4 (6) | 19 (27) | <0,001 |
| IAH: ≥30/h | 66 (94) | 51 (73) | |
| SaO2 media, % | 83,6 (5,2) | 91,8 (3,4) | <0,001 |
| SaO2 mínima, % | 61,1 (8,5) | 73,5 (10,7) | <0,001 |
| CT90, % | 77,1 (22,8) | 20,2 (25,2)) | <0,001 |
Los datos se presentan como n (%) o media (DE).CT90: porcentaje del tiempo de sueño con saturación arterial de oxígeno inferior al 90%; DE: desviación estándar; IAH: índice de apnea-hipopnea/hora de sueño; IRHA: insuficiencia respiratoria hipercápnica aguda; NREM 1+2 : estadios 1 y 2 de sueño no REM; NREM 3+4: estadios 3 y 4 de sueño no REM; ns: no significativo; SaO2: saturación arterial de oxígeno.
Factores predisponentes para insuficiencia respiratoria hipercápnica aguda según análisis de regresión logística
| OR | Intervalo de confianza del 95% | p | |
| Alcohola | 1,54 | 1,23–1,85 | <0,005 |
| Benzodiacepinasb | 7,47 | 1,45–38,57 | <0,02 |
| PaO2 en sangre arterial | 0,82 | 0,77–0,91 | <0,001 |
| FVC, porcentaje del valor teórico | 0,95 | 0,91–0,99 | <0,02 |
FVC: capacidad vital forzada; OR: odds ratio; PaO2: presión parcial de oxígeno.
Comparados con los 45 pacientes con EPOC «pura» admitidos por IRHA, los pacientes con SAHS y EPOC eran de edad similar (66,0 [9,7] versus 69,0 años [10,1]; p no significativa), pero tenían un mayor IMC (32,7 [4,8] versus 25,5kg/m2 [5,3]; p<0,001) y una menor obstrucción en la espirometría (FEV1 del 43,1 [10,9] versus el 31,3% teórico [12]; p<0,005).
Al alta se prescribió CPAP nasal a 54 de los 70 pacientes con SAHS ingresados con IRHA, en 19 de ellos con oxígeno suplementario; 12 pacientes fueron tratados con VMNI domiciliaria (8 con ventilador de presión binivel y 4 con ventilador volumétrico), 6 de ellos con oxígeno suplementario. Los 4 pacientes restantes rehusaron el tratamiento. En los 65 pacientes sobrevivientes tras 1 año de seguimiento, la PaO2 había mejorado significativamente respecto al alta (61,5 [9,0] versus 66,8 [10,0]; p<0,001), mientras que la PaCO2 había disminuido (49,2 [6,3] versus 46,3 [8,2]; p<0,005). Cuarenta y siete de estos 65 pacientes tenían una PaCO2 superior a 45 al alta y 24 de ellos permanecían hipercápnicos al año (p<0,001). En el grupo control se prescribió CPAP nasal a 60 pacientes (86%), y 51 de ellos continuaban realizando este tratamiento al final del seguimiento.
Comparado con los 3 años previos, el grupo con IRHA requirió menos ingresos durante el seguimiento tras el diagnóstico del SAHS y el inicio de su tratamiento (27 versus 49, <0,01). En 7 pacientes de este grupo el tratamiento con CPAP nasal fue cambiado por VMNI durante el seguimiento, en 5 de ellos por requerir nuevas hospitalizaciones por IRHA y en 2 de ellos por persistencia de una PaCO2 superior a 50mmHg.
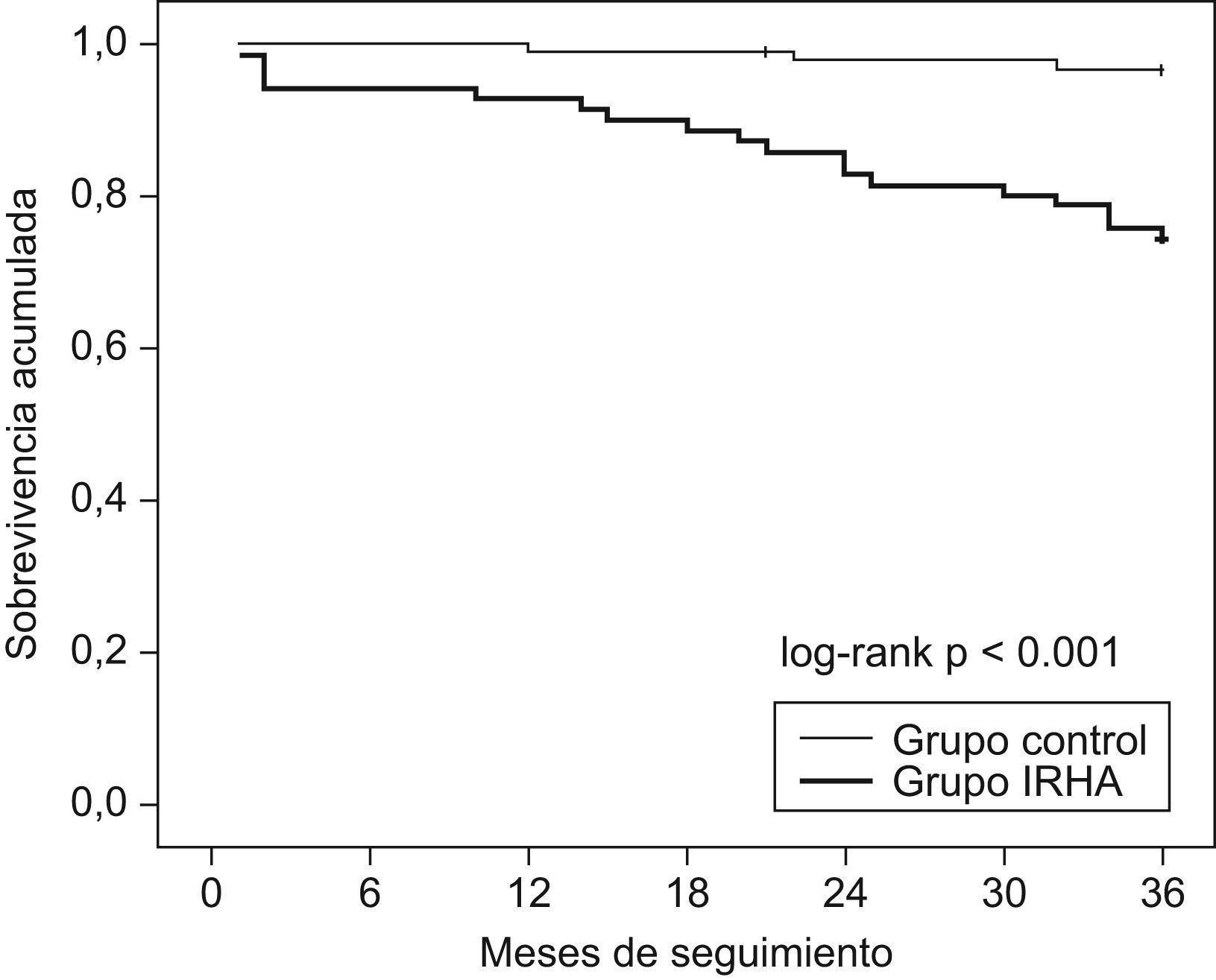
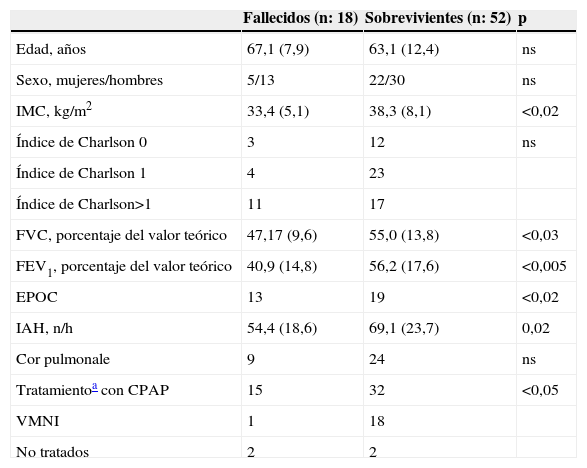
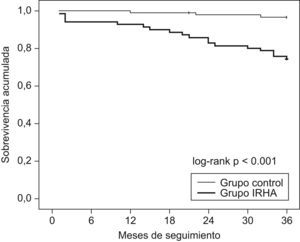
Veintiún pacientes con SAHS fallecieron durante el seguimiento y la mortalidad fue mayor entre los pacientes que habían presentado IRHA (fig. 2). Las causas de muerte fueron respiratorias en 10 pacientes, cardiovasculares en 7 pacientes, neoplasia en 3 pacientes (1 cavum, 1 colon, 1 pulmón) y pancreatitis en 1 paciente. Las características de los pacientes fallecidos durante el seguimiento que habían presentado IRHA comparadas con las de los sobrevivientes de este grupo se muestran en la tabla 4. Comparados con los pacientes sobrevivientes, los pacientes fallecidos recibían más frecuentemente tratamiento con CPAP y mostraban un peor cumplimiento de este, con un mayor número de pacientes con un cumplimiento inferior a 4h/día (8/15 versus 7/32 entre los sobrevivientes; p<0,05).
Curvas de sobrevivencia de Kaplan-Meier de pacientes con síndrome de apneas-hipopneas del sueño tras un episodio de insuficiencia respiratoria hipercápnica aguda comparados con pacientes con síndrome de apneas-hipopneas del sueño sin antecedentes de episodios de insuficiencia respiratoria hipercápnica aguda.
Características de los pacientes con síndrome de apneas-hipopneas del sueño que presentaron insuficiencia respiratoria hipercápnica aguda en función de su status vital al final del seguimiento
| Fallecidos (n: 18) | Sobrevivientes (n: 52) | p | |
| Edad, años | 67,1 (7,9) | 63,1 (12,4) | ns |
| Sexo, mujeres/hombres | 5/13 | 22/30 | ns |
| IMC, kg/m2 | 33,4 (5,1) | 38,3 (8,1) | <0,02 |
| Índice de Charlson 0 | 3 | 12 | ns |
| Índice de Charlson 1 | 4 | 23 | |
| Índice de Charlson>1 | 11 | 17 | |
| FVC, porcentaje del valor teórico | 47,17 (9,6) | 55,0 (13,8) | <0,03 |
| FEV1, porcentaje del valor teórico | 40,9 (14,8) | 56,2 (17,6) | <0,005 |
| EPOC | 13 | 19 | <0,02 |
| IAH, n/h | 54,4 (18,6) | 69,1 (23,7) | 0,02 |
| Cor pulmonale | 9 | 24 | ns |
| Tratamientoa con CPAP | 15 | 32 | <0,05 |
| VMNI | 1 | 18 | |
| No tratados | 2 | 2 |
DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IAH: índice de apnea-hipopnea/h de sueño; IMC: índice de masa corporal; ns: no significativo; VMNI: ventilación mecánica no invasiva.
Los datos se presentan como n o media (DE).
Se construyó un modelo de regresión de Cox que incluyó como variables la edad, la comorbilidad, la FVC (porcentaje teórico), la presencia de EPOC y el tratamiento al final del seguimiento. En el análisis multivariante únicamente la presencia de EPOC se asoció independientemente con una mayor mortalidad (hazard ratio [intervalo de confianza del 95%]: 3,9 [2,4–9,9]; p<0,02).
DiscusiónEn una cohorte de pacientes con SAHS, predominantemente grave, hemos encontrado que el desarrollo de IRHA se asocia con la presencia de deterioro de la función pulmonar y el consumo de alcohol y de benzodiacepinas. Durante el seguimiento, tras el diagnóstico del SAHS y su tratamiento, los pacientes requirieron un menor número de ingresos hospitalarios por causa respiratoria, pero presentaron una elevada mortalidad. La combinación de SAHS y EPOC se identificó como un factor de riesgo asociado a esta mortalidad.
Los principales factores implicados en el deterioro de la función pulmonar en nuestros pacientes fueron la obesidad y la presencia de EPOC. Estos hallazgos coinciden con observaciones previas en pacientes con SAHS hipercápnicos en fase estable en los que, como en nuestro trabajo, la retención de CO2 se acompaña de un IMC elevado e hipoxemia en vigilia y, especialmente, durante la noche2–6,16. Sin embargo, nuestros resultados constituyen la primera descripción en pacientes con IRHA y presentan varias diferencias comparados con los correspondientes a pacientes estables. Es conocido que pacientes con el mismo grado de obesidad pueden tener muy diferentes consecuencias sobre la función pulmonar15. De esta manera, nuestros pacientes con SAHS sin EPOC asociada ingresados por IRHA tenían un IMC medio de 41kg/m2, similar al encontrado en una reciente revisión de la literatura médica en pacientes con síndrome de obesidad-hipoventilación16, contrariamente, nuestros pacientes presentaban una FVC media del 58% de su valor teórico, menor que el hallado habitualmente en pacientes con obesidad-hipoventilación16. De forma similar, nuestros pacientes con SAHS con EPOC asociada ingresados por IRHA tenían una obstrucción bronquial más grave que la encontrada en los pacientes con ambas entidades en el grupo control y en las series clínicas de pacientes con SAHS4,17 y en los estudios en la población general18. Estos hallazgos apuntan hacia que la IRHA es una complicación del SAHS que afecta a pacientes con una disminución de la función pulmonar especialmente marcada.
Por otra parte, nuestros pacientes con SAHS y EPOC ingresados con IRHA tenían una obstrucción bronquial de menor intensidad que la observada en los pacientes con EPOC aislada ingresados con IRHA en nuestra serie y en trabajos previos19,20. En pacientes con EPOC avanzada y SAHS, recientemente Machado et al21 han mostrado que no tratar el SAHS se asocia con una mayor mortalidad, principalmente por insuficiencia respiratoria. Asimismo, Marín et al22 en un amplio estudio prospectivo en pacientes con EPOC han demostrado que la coexistencia de SAHS se asocia con un incremento de la mortalidad y del número de hospitalizaciones por exacerbación de la EPOC. Todos estos hallazgos sugieren que la coexistencia de SAHS favorece el desarrollo de IRHA en pacientes con EPOC.
Asimismo, hemos encontrado que el consumo crónico de alcohol y/o benzodiacepinas se asocia con el desarrollo de IRHA. El consumo grave de alcohol se ha asociado con la presencia de hipercapnia en pacientes con SAHS y EPOC de forma independiente al grado de obstrucción bronquial23. Es conocido que el alcohol reduce el impulso nervioso hacia las motoneuronas de la vía aérea superior y aumentan la gravedad del SAHS24. Sin embargo, trabajos previos en pacientes con SAHS estables no relacionaron la gravedad del SAHS con el desarrollo de hipercapnia2,3,6, lo que apunta hacia otros mecanismos por los que el alcohol conduciría al desarrollo de hipercapnia. Se ha sugerido también una actividad disminuida de los quimiorreceptores como causa de la hipercapnia en los pacientes con SAHS25, y estudios en animales han descrito una menor sensibilidad a la hipercapnia inducida por el alcohol26; sin embargo, estos hallazgos no han sido confirmados en humanos27. Como mecanismo alternativo, Ayappa et al mostraron que el desarrollo de hipercapnia viene condicionado por el acortamiento del período interapnea28. Este período se incrementa con el bloqueo de los receptores opiáceos29 y, basándonos en este hecho, nosotros especulamos para explicar nuestros hallazgos que podría verse acortado por la estimulación de estos receptores inducida por la liberación de opioides endógenos asociada con el consumo de alcohol30.
Nosotros detectamos un consumo de benzodiacepinas muy elevado en nuestros pacientes, más de cuatro veces la reportada en nuestra población general31. Es conocido que la medicación sedante debería usarse con precaución en pacientes con enfermedades pulmonares para evitar su efecto depresor sobre el sistema controlador de la respiración. Además, estos agentes han mostrado reducir el tono muscular de la vía aérea superior y disminuyen las reacciones de despertar inducidas por la hipercapnia32 y por la oclusión de la vía aérea33, y su uso es habitualmente contraindicado en el manejo clínico de los pacientes con SAHS. Sin embargo, disponemos de información limitada y con resultados opuestos acerca de los efectos clínicos de las benzodiacepinas sobre los pacientes con SAHS, habiéndose reportado en trabajos iniciales efectos perjudiciales32 que no han sido confirmados posteriormente33. Nuestros hallazgos constituyen la primera descripción de que su uso crónico en pacientes con SAHS constituye un factor de riesgo para el desarrollo de IRHA y sugieren la necesidad de vías alternativas de tratamiento de las quejas de sueño de mala calidad y/o de ansiedad de estos pacientes.
Los pacientes con SAHS con IRHA en nuestra serie presentaron una mayor mortalidad comparada con la presentada por el grupo control durante el seguimiento y, en contraste con el origen principalmente cardiovascular reportado previamente en pacientes con SAHS34–36, nosotros hallamos que la principal causa de muerte en nuestros pacientes fue respiratoria. Estos hallazgos sugieren que los pacientes con SAHS con un episodio de IRHA, aunque son una minoría de los pacientes con SAHS evaluados habitualmente en las consultas de patología respiratoria durante el sueño, constituyen un subgrupo con características clínicas específicas y elevada mortalidad. Estudios previos han reportado que la coexistencia de enfermedad respiratoria es un factor de riesgo de mayor mortalidad en pacientes con SAHS34,37–39, y en nuestros pacientes la mortalidad tras el alta hospitalaria fue más elevada entre los pacientes que presentaban SAHS con EPOC asociada. Nosotros observamos durante el seguimiento una reducción en el número de hospitalizaciones de causa respiratoria comparado con los 3 años previos así como una mejoría gasométrica, sugiriendo un beneficio del tratamiento del SAHS. Además, observamos una menor mortalidad en pacientes tratados con VMNI respecto a la presentada por los pacientes tratados con CPAP y una menor adherencia al tratamiento con CPAP en los pacientes que murieron durante el seguimiento. Sin embargo, nuestro estudio no fue diseñado para evaluar las distintas alternativas de tratamiento y las decisiones acerca de su instauración fueron tomadas de acuerdo con nuestra práctica clínica durante el período del estudio. Se necesitan nuevos estudios focalizados en el tratamiento de estos pacientes con randomización de las diferentes opciones terapéuticas.
Varias limitaciones de nuestro estudio deben ser consideradas. En primer lugar, nosotros únicamente apareamos por edad los grupos con SAHS con IRHA y el grupo control; sin embargo, la ausencia de descripciones previas de las características clínicas involucradas en el desarrollo de IRHA en el SAHS nos condujo a pensar que esta es una aproximación inicial válida para explorar un amplio abanico de variables biológicamente plausibles. En segundo lugar, en nuestro trabajo existe un sesgo de selección y los pacientes con SAHS se encuentran sobrerrepresentados respecto a la totalidad de pacientes con IRHA admitidos en un hospital terciario; sin embargo, este hecho no afecta sustancialmente los objetivos del estudio, que eran definir las características clínicas y el pronóstico de los pacientes con SAHS con IRHA. En tercer lugar, nosotros no realizamos una polisomnografía a todos los pacientes admitidos con IRHA, y algunos pacientes con SAHS podrían haber pasado en teoría inadvertidos; contrariamente, nosotros consideramos que los criterios utilizados para determinar la necesidad de un estudio polisomnográfico fueron altamente sensibles para detectar la presencia de SAHS. Por último, a pesar de que nuestros pacientes con SAHS e IRHA presentaban un IAH superior, el hecho de que el grupo control presentase también un IAH elevado puede haber limitado nuestra capacidad de identificar la gravedad del SAHS como factor implicado en el desarrollo de IRHA.
En resumen, hemos encontrado que la presencia de deterioro de la función pulmonar en relación con obesidad o EPOC y que el consumo de alcohol y de benzodiacepinas se asocian con el desarrollo de IRHA en pacientes con SAHS y que estos pacientes representan un subgrupo de los pacientes con SAHS con una elevada mortalidad asociada, principalmente por causas respiratorias. Nuestros hallazgos remarcan la necesidad de una detección precoz de estos factores de riesgo y la necesidad de estudios centrados en la evaluación de las distintas alternativas terapéuticas.