Este resumen ejecutivo del Informe de 2017 de la Global Strategy for the Diagnosis, Management, and Prevention of COPD (GOLD) se basa principalmente en las modificaciones y novedades del documento anterior. Los cambios más destacados incluyen: a) se ha diferenciado entre la exploración espirométrica y la de los síntomas para evaluar la enfermedad pulmonar obstructiva crónica (EPOC). En la propuesta actual, los grupos ABCD se refieren exclusivamente a síntomas y antecedentes de exacerbaciones de los pacientes; b) para cada uno de los grupos, se proponen estrategias de intensificación de los tratamientos farmacológicos; c) se introduce el concepto de reducción escalonada de la terapia en el esquema de evaluación del tratamiento; d) se detalla más extensamente el tratamiento no farmacológico; y, f) se revisa la importancia de las diferentes co-morbilidades en lo que respecta al tratamiento de la EPOC.
This Executive Summary of the Global Strategy for the Diagnosis, Management, and Prevention of COPD (GOLD) 2017 Report focuses primarily on the revised and novel parts of the document. The most significant changes include: 1) the assessment of COPD has been refined to separate the spirometric assessment from symptom evaluation. ABCD groups are now proposed to be derived exclusively from patient symptoms and their history of exacerbations; 2) for each of the groups A to D, escalation strategies for pharmacological treatments are proposed; 3) the concept of de-escalation of therapy is introduced in the treatment assessment scheme; 4) nonpharmacologic therapies are comprehensively presented and; 5) the importance of comorbid conditions in managing COPD is reviewed.
Este resumen del informe de 2017 de la Global Strategy for the Diagnosis, Management, and Prevention of COPD (GOLD) está basado en publicaciones con revisión externa por pares hasta octubre de 2016.
Cuando procede, se asignan grados de evidencia científica a cada una de las recomendaciones. Las definiciones correspondientes a cada una de las evidencias de datos científicos utilizadas se establecen en la Tabla S1 del suplemento.
Definición y factores que influyen en el desarrollo y la progresión de la EPOCPuntos clave generales:
- •
La EPOC es una enfermedad frecuente, prevenible y tratable que se caracteriza por síntomas respiratorios persistentes y limitación del flujo aéreo causada por alteraciones de las vías aéreas o de los alvéolos, usualmente producidas por una exposición significativa a partículas o gases nocivos.
- •
La disnea, la tos y la expectoración son los síntomas más frecuentes; los pacientes suelen referir menos síntomas de los que en realidad padecen.
- •
El tabaquismo es la exposición de mayor riesgo para la EPOC, pero también pueden contribuir exposiciones ambientales como los combustibles de biomasa y la contaminación atmosférica. Además de éstas, existen factores dependientes del huésped (anomalías genéticas, desarrollo pulmonar anómalo y envejecimiento acelerado) que pueden predisponer a padecer EPOC.
- •
La EPOC puede cursar con agudizaciones de los síntomas respiratorios, denominadas exacerbaciones.
- •
En la mayoría de los pacientes, la EPOC se asocia a enfermedades crónicas concomitantes importantes, que aumentan la morbi-mortalidad.
La enfermedad pulmonar obstructiva crónica (EPOC) es una enfermedad frecuente, prevenible y tratable que se caracteriza por la presencia de síntomas respiratorios persistentes y limitación del flujo aéreo a causa de alteraciones de las vías aéreas o de los alvéolos usualmente producidas por una exposición significativa a partículas o gases nocivos.
La limitación crónica del flujo aéreo que caracteriza a la EPOC es el resultado de una enfermedad de las pequeñas vías aéreas (bronquiolitis obstructiva) y de la destrucción del parénquima pulmonar (enfisema), cuya importancia relativa varía según individuos. La infección crónica provoca alteraciones estructurales, estrechamiento de las pequeñas vías aéreas y destrucción del parénquima pulmonar. La desaparición de las pequeñas vías aéreas contribuye a la limitación del flujo aéreo y a la disfunción mucociliar, un rasgo característico de la enfermedad.
Los síntomas respiratorios crónicos pueden preceder al desarrollo de la limitación del flujo aéreo y asociarse a episodios respiratorios agudos1. Se pueden dar síntomas respiratorios crónicos en personas con espirometría normal1,2. Además, un número significativo de fumadores sin limitación del flujo aéreo presenta signos estructurales de enfermedad pulmonar caracterizados por la existencia de enfisema, engrosamiento de las paredes de las vías aéreas y atrapamiento aéreo1,2.
Factores que influyen en el desarrollo y la progresión de la enfermedadAunque el tabaquismo es el factor de riesgo mejor investigado de la EPOC, los estudios epidemiológicos han demostrado que las personas no fumadoras también pueden experimentar limitación crónica del flujo aéreo3. En comparación con los fumadores con EPOC, las personas no fumadoras que presentan limitación crónica del flujo aéreo tienen menos síntomas, enfermedad más leve y menor inflamación sistémica4. Estos individuos no presentan mayor riesgo de cáncer de pulmón o enfermedades cardiovasculares concomitantes. Sin embargo, sí lo tienen de desarrollar neumonía y de mortalidad por insuficiencia respiratoria4.
Los procesos que se dan durante la gestación, el parto y las exposiciones durante la infancia y la adolescencia pueden afectar al crecimiento de los pulmones5,6. La reducción de la función pulmonar máxima desarrollada (medida por espirometría) identifica a aquellas personas con mayor riesgo de sufrir EPOC2,7. Los factores presentes en la infancia, denominados «limitantes» pueden ser tan influyentes en la predicción de la función pulmonar adulta, como un excesivo consumo de tabaco8. En un estudio longitudinal que incluyó a tres poblaciones independientes se halló que un 50% de los pacientes desarrolló EPOC por un deterioro acelerado del volumen máximo de aire espirado en el primer segundo (FEV1), mientras que en el otro 50%, la EPOC se presentó por un crecimiento y un desarrollo pulmonares anómalos.
Los individuos fumadores de cigarrillos tienen mayor prevalencia de síntomas respiratorios y de anomalías de la función pulmonar que los no fumadores, y sus tasas anuales de deterioro del FEV1 y de mortalidad por EPOC son más elevadas9. Otras clases de tabaco (tales como pipa, puro, pipa de agua)10–12 y marihuana13 son también factores de riesgo de EPOC. La exposición pasiva al humo del tabaco, conocida también como tabaquismo ambiental (TA), contribuye asimismo a los síntomas respiratorios y la EPOC14, al aumentar la cantidad total de partículas y gases inhalados en los pulmones. El tabaquismo durante el embarazo representa un riesgo para el feto al afectar al crecimiento y el desarrollo pulmonares en el útero y, posiblemente, por sensibilizar el sistema inmunitario15.
Las exposiciones profesionales, como polvo orgánico e inorgánico, productos químicos y humos, son factores de riesgo infravalorados en el desarrollo de la EPOC16,17.
La madera, el estiércol animal, los residuos agrícolas y el carbón que habitualmente se queman al aire libre o en estufas que funcionan de forma deficiente pueden contaminar el aire interior18. La contaminación doméstica por biomasa utilizada para cocinar y calentar viviendas mal ventiladas puede suponer un riesgo de EPOC19–21.
El asma representa un riesgo para el desarrollo de limitación crónica del flujo aéreo y EPOC22. Puede existir una hiperreactividad de las vías aéreas en ausencia de diagnóstico clínico de asma, lo que representa un factor independiente de predicción de EPOC y de mortalidad respiratoria en estudios de población23,24. Además, puede indicar cierto riesgo de deterioro excesivo de la función pulmonar en la EPOC leve25.
Los antecedentes de infección respiratoria grave en la infancia se han asociado con función pulmonar menor y con un aumento de los síntomas respiratorios en la edad adulta26. La infección por el virus de inmunodeficiencia humana (VIH) acelera el desarrollo de enfisema y de EPOC relacionados con el tabaquismo27. Por su parte, la tuberculosis también se ha identificado como factor de riesgo de EPOC y una co-morbilidad potencial28–30.
Diagnóstico y evaluación inicialesPuntos clave generales:
- •
Debe considerarse el diagnóstico de EPOC en todo paciente que presente disnea, tos crónica o expectoración y/o antecedentes de exposición a cualquiera de los factores de riesgo de la enfermedad.
- •
Es preciso realizar una espirometría para establecer el diagnóstico; un cociente FEV1/FVC < 0,70 tras la prueba broncodilatadora confirma la presencia de una limitación persistente del flujo aéreo.
- •
Los objetivos de la evaluación de la EPOC son determinar el grado de limitación del flujo aéreo, su impacto en el estado de salud del paciente y el riesgo de futuras agudizaciones (tales como exacerbaciones, ingresos hospitalarios o fallecimientos) a fin de orientar el tratamiento.
- •
Las enfermedades crónicas concomitantes (co-morbilidades) son frecuentes en los pacientes con EPOC y deben ser tratadas, porque pueden afectar de forma independiente a la mortalidad y las hospitalizaciones.
Debe considerarse el diagnóstico de EPOC en todo paciente que presente disnea, tos crónica o expectoración y/o antecedentes de exposición a factores de riesgo de la enfermedad (fig. 1 y tabla 1). Es necesario realizar una espirometría para establecer el diagnóstico en este contexto clínico31. En ella, un cociente FEV1/FVC < 0,70 tras la prueba broncodilatadora confirma la existencia de una limitación persistente del flujo aéreo e identifica la presencia de EPOC en pacientes con síntomas apropiados y riesgos compatibles
Puntos clave para establecer el diagnóstico de EPOC
| Se debe tener en cuenta la posibilidad de una EPOC y practicar una espirometría forzada si están presentes algunos de estos indicadores en una persona mayor de 40 años. Estos indicadores no son diagnósticos por sí mismos, pero la presencia de varios indicadores clave aumenta las probabilidades de que el diagnóstico sea EPOC. La espirometría es necesaria para establecer el diagnóstico de EPOC. | |
|---|---|
| Disnea que: | Es progresiva con el paso del tiempo. Empeora característicamente con el esfuerzo. Es persistente. |
| Tos crónica: | Puede ser intermitente y no productiva. Sibilantes recurrentes. |
| Expectoración crónica: | Con cualquier patrón. |
| Infecciones recurrentes de las vías aéreas inferiores | |
| Antecedentes de factores de riesgo: | Factores del huésped (genéticos, anomalías congénitas/del desarrollo, otros). Humo de tabaco. Humo de combustibles domésticos para cocinar y calentar. Polvos, vapores, humos, gases y otros productos químicos profesionales. |
| Antecedentes familiares de EPOC y factores en la infancia: | Bajo peso al nacer, infecciones respiratorias infantiles. |
La disnea crónica y progresiva es el síntoma más característico de la EPOC.
Disnea. La disnea es una causa fundamental de discapacidad y ansiedad en la EPOC32. Los términos utilizados para describir la disnea pueden variar según individuos y su nivel cultural33.
Tos. La tos crónica suele ser el primer síntoma de EPOC y el paciente a menudo la considera como una consecuencia del tabaquismo o de exposiciones ambientales.
Expectoración. La bronquitis crónica se define clásicamente como la expectoración regular ≥3 meses en 2 años consecutivos34, pero es una definición arbitraria que no refleja la magnitud de la expectoración de esputo presente en la EPOC. Los pacientes que producen con expectoración abundante pueden tener bronquiectasias subyacentes.
Sibilantes y opresión torácica. Pueden variar según los días y en un mismo día.
Otras características de la enfermedad grave. La fatiga, la pérdida de peso y la anorexia son frecuentes en pacientes con EPOC grave y muy grave35,36.
Historia clínicaUna historia clínica detallada de cualquier paciente con certeza o sospecha de EPOC debe incluir:
- •
Exposición a factores de riesgo, como tabaquismo y exposiciones profesionales o ambientales.
- •
Antecedentes clínicos, como asma, alergia, sinusitis o pólipos nasales, infecciones respiratorias en la infancia, otras enfermedades respiratorias crónicas y enfermedades no respiratorias.
- •
Antecedentes familiares de EPOC u otras enfermedades respiratorias crónicas.
- •
Características de los síntomas: edad de comienzo, tipo de síntoma, «resfriados en invierno» más frecuentes y prolongados, y restricciones sociales.
- •
Antecedentes de exacerbaciones u hospitalizaciones previas por trastornos respiratorios.
- •
Presencia de enfermedades concomitantes, como cardiopatía, osteoporosis, trastornos osteo-musculares y neoplasias, que puedan contribuir a limitar la actividad diaria.
- •
Repercusión de la enfermedad en la vida del paciente, como limitación de la actividad física, pérdida de trabajo y repercusión económica, y depresión o ansiedad.
- •
Apoyo social y familiar individuales.
- •
Posibilidad de reducción de los factores de riesgo, muy en especial el abandono del tabaco.
Aunque es importante para evaluar el estado general de salud del individuo, la exploración física rara vez es diagnóstica en la EPOC. No suele haber signos físicos de limitación del flujo aéreo hasta que se observa una anomalía funcional respiratoria significativa37,38.
EspirometríaLa espirometría es la medición más reproducible y objetiva para la detección de la limitación del flujo aéreo. Es una prueba no invasiva y fácilmente accesible. Se puede realizar una espirometría de calidad en cualquier ámbito sanitario y todos los profesionales que atiendan a pacientes con EPOC deben tener acceso a su práctica.
Un cociente FEV1/FVC < 0,70 tras la prueba broncodilatadora es el criterio espirométrico fundamental para el diagnóstico de limitación del flujo aéreo. Este criterio es simple e independiente de los valores de referencia y se ha empleado en numerosos ensayos clínicos. Sin embargo, su uso puede dar lugar a que se diagnostique EPOC con más frecuencia en individuos de edad avanzada39,40 y con frecuencia menor en adultos con edad <45 años40 y sobre todo en caso de enfermedad leve, si se compara con el valor del límite inferior de la normalidad (LIN) del cociente FEV1/FVC. Usar el LIN como criterio diagnóstico de obstrucción bronquial tiene varias limitaciones: 1) su valor depende de la elección entre las ecuaciones de referencia que incluyan valores post-broncodilatadores; 2) no existen estudios longitudinales que validen los valores del LIN; y, 3) la ausencia de estudios que hayan usado el LIN en poblaciones en las que el tabaquismo no sea la causa principal de EPOC.
Una espirometría normal puede también evaluarse mediante el nuevo enfoque de la Global Lung Initiative (GLI)41,42. Usando ecuaciones GLI, las puntuaciones z derivadas para los valores de FEV1, FVC y cociente FEV1/FVC se han comparado con los datos derivados del cociente FEV1/FVC fijo. Los resultados apuntan a que, en comparación con la espirometría normal definida por la GLI, el uso de un cociente FEV1/FVC fijo puede estimar erróneamente que los pacientes presenten anomalías funcionales pulmonares. Estos resultados deben ser confirmados con nuevos estudios adicionales en otras poblaciones.
El riesgo de realizar un diagnóstico erróneo y, por lo tanto, exceso de tratamiento debido al empleo del cociente FEV1/FVC fijo como criterio diagnóstico es limitado, porque la espirometría es solo uno de los parámetros utilizados para establecer el diagnóstico clínico de EPOC. GOLD aboga por el uso del cociente FEV1/FVC fijo en vez del LIN para simplificar y dar uniformidad al diagnóstico, elementos esenciales para el médico con exceso de trabajo.
No se recomienda valorar el grado de reversibilidad de la limitación del flujo aéreo en la toma de decisiones terapéuticas (midiendo el FEV1 antes y después de la prueba broncodilatadora o del uso de corticoides)43 porque no facilita el diagnóstico de EPOC, no diferencia la EPOC del asma, y tampoco predice la respuesta terapéutica a largo plazo44.
En los individuos asintomáticos no fumadores o sin exposición a otros estímulos nocivos no está recomendada la espirometría de cribado. Sin embargo, en los pacientes sintomáticos o con factores de riesgo (>20 paquetes-año de tabaco o infecciones respiratorias recurrentes), debe entonces practicarse una espirometría, pues el rendimiento diagnóstico en la EPOC es relativamente alto45,46. GOLD recomienda la búsqueda activa de casos potenciales45,47. Es decir, se aboga por realizar espirometría en pacientes sintomáticos o con factores de riesgo, pero no hacerlo de rutina en individuos asintomáticos sin factores de riesgo de EPOC.
EvaluaciónLos objetivos de la evaluación de la EPOC para orientar el tratamiento deben ser: 1) determinar el grado de limitación del flujo aéreo; 2) definir su repercusión sobre el estado de salud del paciente; y, 3) averiguar el riesgo de futuros episodios (como las exacerbaciones, las hospitalizaciones o las muertes).
Para lograr estos objetivos, la evaluación de la EPOC debe incluir por separado los siguientes aspectos de la enfermedad:
- •
Presencia y gravedad de las alteraciones espirométricas
- •
Naturaleza y magnitud actuales de los síntomas
- •
Antecedentes de las exacerbaciones y su riesgo potencial
- •
Presencia de enfermedades concomitantes
Se debe practicar una espirometría tras administrar una dosis adecuada de al menos un broncodilatador inhalado de acción corta para reducir al mínimo la variabilidad de la prueba.
El papel de la espirometría en el diagnóstico, la evaluación y el seguimiento de la EPOC se resumen en la tabla 2.
Papel de la espirometría
| • Diagnóstico |
| • Valoración de la gravedad de la obstrucción del flujo aéreo (para el pronóstico) |
| • Seguimiento |
| o Decisiones terapéuticas |
| Farmacológicas en determinadas circunstancias (cuando hay discrepancia entre la espirometría y la gravedad de los síntomas). |
| Considerar otros diagnósticos cuando los síntomas no son proporcionales con el grado de obstrucción del flujo aéreo. |
| No farmacológicas (esto es, alternativas intervencionistas). |
| o Identificación de un deterioro rápido |
Con anterioridad, se pensaba que la EPOC era una enfermedad caracterizada en gran medida por la presencia de disnea. Para evaluarla, se consideraba suficiente una cuantificación simple, como la obtenida con el cuestionario modificado del British Medical Research Council (mMRC) 48–51 Sin embargo, la EPOC afecta a los pacientes mucho más allá de la disnea52. Por este motivo, es recomendable la evaluación integral de todos los síntomas. Los cuestionarios de salud más detallados y específicos de la enfermedad son el Cuestionario Respiratorio Crónico (CRQ)53 y el Cuestionario Respiratorio de Saint George (SGRQ)54. Sin embargo, estos cuestionarios son demasiado complejos para su práctica de rutina. Por lo tanto, evaluaciones más simples como el Test de Evaluación de la EPOC (CATTM) pueden resultar más adecuadas.
Elección de los umbralesNo es frecuente que se dé una puntuación en el SGRQ < 25 en los pacientes con EPOC55 y una ≥25 en las personas sanas56,57. El punto de corte equivalente para la CATTM corresponde a 1058. En el mMRC, el umbral para separar «menos» y «más» disnea es ≥2.
Evaluación del riesgo de exacerbacionesEl mejor factor de predicción de las exacerbaciones frecuentes (definidas como ≥2 exacerbaciones al año) es el presentar antecedentes de tales episodios59. La hospitalización por una exacerbación de la EPOC tiene un pronóstico adverso y aumenta el riesgo de muerte60.
Recuento de eosinófilos en sangre. En un análisis post-hoc de dos ensayos clínicos de pacientes con EPOC y con antecedentes de exacerbaciones se observó que un recuento elevado de eosinófilos en sangre podía predecir el aumento de las tasas de exacerbación en pacientes tratados con un agonista β2 de acción prolongada (LABA, por sus siglas en inglés) sin corticoide inhalado (IC, por sus siglas en inglés)61,62. El efecto de la combinación IC/LABA, en comparación con un LABA sobre las exacerbaciones fue mayor en los pacientes con un recuento de eosinófilos más alto. Estos resultados dan a entender que este parámetro es 1) un biomarcador del riesgo de exacerbación en los pacientes con EPOC con antecedentes de exacerbaciones y 2) que puede predecir los efectos de los IC en la prevención de las exacerbaciones. No obstante, son necesarios más ensayos prospectivos para validar el uso de este recuento para predecir los efectos de los IC, determinar un punto de corte que prediga el riesgo de exacerbación y establecer los puntos de corte que podrían utilizarse en la práctica clínica.
Evaluación de las enfermedades crónicas concomitantes (co-morbilidades)Los pacientes con EPOC suelen padecer importantes enfermedades crónicas concomitantes porque la EPOC es un componente relevante de multimorbilidad, sobre todo en la población de edad avanzada60,63–65.
Evaluación combinada modificada de la EPOCLa clasificación ABCD del informe 2011 de GOLD representó un avance importante con respecto a la clasificación basada en espirometría de los documentos GOLD previos, ya que incorporaba los resultados comunicados por los pacientes («patient reported outcome» [PRO]) y resaltaba la importancia de la prevención de las exacerbaciones en el tratamiento de la EPOC. Sin embargo, adolecía de limitaciones importantes, ya que su capacidad para predecir la mortalidad u otros apartados relevantes del estado de salud no era superior a la de la clasificación basada exclusivamente en espirometría66–68. Además, la identificación del grupo «D» mediante el uso de dos parámetros (FEV1 y antecedentes de exacerbaciones) creaba confusión69. Para solventar estas cuestiones, el presente documento 2017 de GOLD mejora la evaluación ABCD al diferenciar los grados por espirometría de los correspondientes a la clasificación ABCD propiamente dicha. Así, para algunas recomendaciones terapéuticas, y en particular las farmacológicas, los grupos ABCD se basan exclusivamente en los síntomas y en los antecedentes de exacerbaciones. Sin embargo, la espirometría, considerada en conjunción con los síntomas del paciente y los antecedentes de exacerbaciones, continúa siendo fundamental para el diagnóstico, pronóstico y consideración de otras estrategias terapéuticas importantes, en particular las de tipo no farmacológico. Este nuevo enfoque clasificatorio queda reflejado en la figura 2.
En este nuevo esquema de evaluación, los pacientes deben ser sometidos a la práctica de una espirometría para determinar la gravedad de la limitación del flujo aéreo (esto es, el grado espirométrico). Asimismo, debe evaluarse la disnea con el cuestionario mMRC o el CATTM. Por último, hay que registrar los antecedentes de exacerbaciones (incluidas las hospitalizaciones anteriores).
De esta forma, el número proporciona información sobre la gravedad de la limitación del flujo aéreo (grados espirométricos, de 1 a 4), mientras que la letra (grupos A a D) facilita la información sobre importancia de los síntomas y el riesgo de exacerbación. El FEV1 es un parámetro muy importante en el ámbito poblacional para predecir consecuencias clínicas relevantes, como la mortalidad y las hospitalizaciones, o para considerar tratamientos no farmacológicos, como la reducción quirúrgica pulmonar o el trasplante de pulmón. Sin embargo, a escala individual, el FEV1 es menos preciso, por lo que no se puede utilizar aisladamente para decidir todas las opciones terapéuticas. Además, en algunas circunstancias, como en el supuesto de hospitalizaciones o de una visita no programada a un centro médico o a un servicio de urgencias, la evaluación de los pacientes basada en los síntomas y los antecedentes de exacerbaciones, con independencia del valor de la espirometría, autoriza al médico a iniciar un plan terapéutico basado en el nuevo esquema propuesto ABCD. Este nuevo enfoque reconoce las limitaciones del FEV1 en la toma de decisiones terapéuticas individualizadas, al tiempo que subraya la importancia de los síntomas y los riesgos de exacerbación de los pacientes al orientar el tratamiento en la EPOC. La distinción entre la limitación del flujo aéreo y los parámetros clínicos destaca lo que se debe evaluar al tiempo que facilita la clasificación. Esto permite recomendar de forma más precisa el tratamiento basado en los síntomas del paciente en cualquier etapa clínica.
Ejemplo. Considérense dos pacientes - ambos con un FEV1 < 30% del valor de referencia y puntuación en el CATTM de 18 en cada uno de ellos. El primero no tuvo ninguna exacerbación en el último año y el segundo tuvo tres exacerbaciones en dicho periodo de tiempo. Ambos tendrían la categoría (o grupo) GOLD D en el esquema de clasificación de 2011. Sin embargo, con el nuevo esquema actual, el paciente con tres exacerbaciones en el año anterior pertenecería al GOLD 4, grupo D. La decisión terapéutica farmacológica seguiría las recomendaciones de la evaluación ABCD para abordar el problema principal del paciente en ese momento, es decir las exacerbaciones repetidas. El otro paciente, sin exacerbaciones, se clasificaría como GOLD 4, grupo B. En estos pacientes — además del tratamiento farmacológico y la rehabilitación — la reducción quirúrgica pulmonar, el trasplante de pulmón o la bullectomía serían alternativas terapéuticas importantes atendiendo a los síntomas y la gravedad de la limitación espirométrica.
Déficit de alfa-1 antitripsina (DAAT)La Organización Mundial de la Salud recomienda que todos los pacientes con diagnóstico de EPOC sean sometidos una vez a un cribado de DAAT70. Una concentración baja (<20% de la cifra normal) indica carencia homocigótica. Hay que investigar también a los familiares y remitirlos con el paciente a centros especializados para consejo y tratamiento.
Otras pruebasSe pueden necesitar más pruebas para descartar otras enfermedades concomitantes que contribuyan a los síntomas respiratorios o cuando los pacientes no responden al plan de tratamiento según lo previsto. Es aconsejable obtener imágenes torácicas (radiografía y tomografía axial computarizada [TC]), determinar los volúmenes pulmonares y la capacidad de difusión pulmonar, así como realizar una pulsioximetría y gasometría arteriales, una prueba de esfuerzo y evaluar la capacidad física.
Puntuaciones combinadas. El método BODE (Body mass index, Obstruction, Dyspnea, and Exercise: índice de masa corporal, obstrucción, disnea y esfuerzo) proporciona una puntuación combinada que predice mejor la supervivencia que cualquier componente por separado71. Sin embargo, es necesario validar alternativas más simples que no incluyan la prueba de esfuerzo para confirmar su idoneidad para su uso clínico diario72,73.
Diagnóstico diferencial. Algunos pacientes tienen manifestaciones propias de asma y EPOC. Los términos de síndrome de solapamiento de asma-EPOC (ACOS, por sus siglas en inglés) o solapamiento de asma-EPOC (ACO, por sus siglas en inglés) reconocen la superposición de estos dos trastornos frecuentes que causan una limitación crónica del flujo aéreo, en lugar de un síndrome concreto. La mayor parte de los otros posibles diagnósticos alternativos son más fáciles de diferenciar de la EPOC.
Otras consideraciones. Algunos pacientes sin limitación del flujo aéreo tienen signos de enfermedad pulmonar crónica en las imágenes torácicas (enfisema, atrapamiento aéreo, engrosamiento de las paredes de las vías aéreas). Dichos pacientes refieren exacerbaciones de síntomas respiratorios o incluso requieren tratamiento farmacológico de forma continuada. No está claro si estos pacientes tienen una bronquitis aguda o crónica, una forma persistente de asma o una forma inicial de lo que sería una EPOC como se define actualmente, por lo que son necesarios más estudios.
Prevención y tratamiento de mantenimientoPuntos clave generales:
- •
El abandono del hábito de fumar es fundamental. La farmacoterapia y la sustitución de nicotina aumentan las tasas de abstinencia tabáquica a largo plazo.
- •
Son dudosas la eficacia y la seguridad de los cigarrillos electrónicos como soporte de ayuda para dejar de fumar.
- •
El tratamiento farmacológico alivia los síntomas de la EPOC, disminuye la frecuencia y la intensidad de las exacerbaciones, y mejora el estado de salud y la tolerancia al ejercicio físico.
- •
Hay que individualizar cada pauta de tratamiento farmacológico y basarla en la gravedad de los síntomas, el riesgo de exacerbaciones, sus efectos secundarios, las enfermedades concomitantes, la disponibilidad y el coste de la medicación, y la respuesta, preferencia y capacidad del paciente en el uso de los varios dispositivos de administración de fármacos.
- •
Es necesario comprobar con regularidad la técnica correcta de inhalación.
- •
Las vacunaciones contra la gripe y el neumococo disminuyen la incidencia de infecciones de las vías aéreas inferiores.
- •
La rehabilitación respiratoria mejora los síntomas, la calidad de vida y la actividad física y emocional en las actividades cotidianas.
- •
En los pacientes con hipoxemia crónica grave en reposo, la oxigenoterapia a largo plazo mejora la supervivencia.
- •
En los pacientes con EPOC estable y desaturación arterial de oxígeno moderada inducida por el esfuerzo o en reposo no se debe prescribir sistemáticamente oxigenoterapia a largo plazo, sino que hay que sopesar los factores individuales de cada paciente.
- •
En los pacientes con hipercapnia crónica grave y con antecedentes de hospitalización por insuficiencia respiratoria aguda, la ventilación no invasiva a largo plazo disminuye la mortalidad y previene nuevas hospitalizaciones.
- •
En determinados pacientes con enfisema avanzado resistente a un óptimo tratamiento farmacológico, las opciones quirúrgicas o broncoscópicas pueden ser beneficiosas.
- •
Los tratamientos paliativos son eficaces para controlar los síntomas en la EPOC avanzada.
El abandono del tabaquismo influye en la evolución natural de la EPOC. Si se dedican recursos eficaces y tiempo a dejar de fumar, se pueden conseguir tasas de éxito a largo plazo del 25%74.
Productos sustitutivos de la nicotina. El tratamiento sustitutivo de la nicotina aumenta las tasas de abstinencia a largo plazo75–77 y resulta más eficaz que el placebo. Cada vez se usan más los cigarrillos electrónicos como forma de tratamiento de sustitución de la nicotina, pero su eficacia sigue suscitando controversia78–82.
Medicamentos. La vareniclina83, el bupropión84 y la nortriptilina85 aumentan las tasas de abstinencia a largo plazo85, pero se deben usar como parte de un programa y no como intervención única.
Programas para dejar de fumar. Un programa de intervención en cinco fases86,87 brinda un contexto a los profesionales sanitarios para ayudar a los pacientes a dejar de fumar76,86,88. El asesoramiento de los profesionales sanitarios aumenta significativamente las tasas de abstinencia con respecto a las estrategias iniciadas por el propio paciente89. La combinación de farmacoterapia y apoyo conductual aumenta las tasas de abandono del tabaco90.
VacunacionesVacuna antigripal y vacunas antineumocócicasLa vacunación antigripal reduce la gravedad de la enfermedad91, la mortalidad92–95, el riesgo de cardiopatía isquémica96 y la cifra total de exacerbaciones92. Se recomiendan vacunas que contengan virus muertos o vivos inactivados97 porque son más eficaces en las personas de edad avanzada con EPOC98.
Se recomiendan las vacunas antineumocócicas, PCV13 y PPSV23 para todos los pacientes ≥65 años (véase la Tabla S2 en el suplemento).
Tratamiento farmacológico para la EPOC estableDescripción general de los medicamentosEl tratamiento farmacológico de la EPOC alivia los síntomas de la EPOC, disminuye la frecuencia y la gravedad de las exacerbaciones, y mejora el estado de salud y la tolerancia al ejercicio físico. No existe ningún medicamento que modifique el deterioro a largo plazo de la función pulmonar99–103. Las clases de medicamentos utilizadas para tratar la EPOC se muestran en la Tabla S3 del suplemento. La elección dentro de cada clase depende de la disponibilidad y el coste del medicamento y de que la respuesta clínica sea favorable con respecto a los efectos secundarios. Hay que individualizar cada pauta de tratamiento porque la relación entre la intensidad de los síntomas, la limitación del flujo aéreo y la intensidad de las exacerbaciones varía entre los pacientes.
BroncodilatadoresLos broncodilatadores aumentan el FEV1, reducen la hiperinsuflación dinámica en reposo y durante el esfuerzo físico104,105, y mejoran el rendimiento al aumentar el ejercicio físico. Los broncodilatadores se suelen administrar de forma regular para prevenir o aliviar los síntomas. Su toxicidad está relacionada con la dosis.
Agonistas β2. Los agonistas β2, que incluyen los agonistas de acción corta (SABA, por sus siglas en inglés) y los de acción prolongada (LABA), relajan el músculo liso de las vías aéreas. La estimulación de los receptores adrenérgicos β2 puede provocar taquicardia sinusal en reposo y desencadenar trastornos del ritmo cardíaco en pacientes predispuestos. Puede aparecer temblor corporal exagerado en algunos pacientes tratados con dosis altas de agonistas β2.
Fármacos antimuscarínicos. El ipratropio, un antagonista muscarínico de acción corta, tiene ciertas ventajas sobre los agonistas β2 de acción corta en lo que respecta a la función pulmonar, el estado de salud y la necesidad de corticoides orales106. El tratamiento con antagonistas muscarínicos de acción prolongada (LAMA, por sus siglas en inglés) mejora los síntomas y el estado de salud107,108, aumenta la eficacia de la rehabilitación respiratoria109,110 y disminuye las exacerbaciones y sus hospitalizaciones107. En los ensayos clínicos que comparan LAMA (tiotropio) y LABA se ha demostrado un mayor efecto de LAMA para reducir la frecuencia de las exacerbaciones111,112. Se ha observado un cierto incremento de los episodios cardiovasculares en pacientes con EPOC tratados regularmente con bromuro de ipratropio113,114. Por otro lado, en un ensayo de gran tamaño, no se observaron diferencias en las tasas de mortalidad y morbilidad cardiovasculares o la de exacerbación entre la administración de tiotropio en polvo seco con un inhalador convencional o mediante nebulización con el dispositivo Respimat®115.
Metilxantinas. La teofilina tiene un efecto broncodilatador moderado en la EPOC estable116 y mejora el FEV1 y la disnea cuando se asocia a salmeterol117,118. Hay pocos datos sobre el efecto de la teofilina en dosis reducidas sobre la frecuencia de las exacerbaciones, además de ser contradictorios119,120. Su toxicidad guarda relación con la dosis administrada, lo cual es un problema teniendo en cuenta que la mayor parte del beneficio aparece con la administración de dosis casi tóxicas116,121.
Tratamiento con broncodilatadores en combinaciónLa combinación de broncodilatadores con diferentes mecanismos y duraciones de sus efectos aumenta el grado de broncodilatación con menor riesgo de efectos secundarios, si se compara con el aumento de dosis de un solo broncodilatador (tabla 3)122. Hay numerosas combinaciones de LABA y LAMA en un solo dispositivo inhalador (Tabla S3). Estas combinaciones mejoran la función pulmonar en comparación con el placebo122 y tienen mayor influencia en los resultados comunicados por los pacientes que la monoterapia123–126. La combinación LABA/LAMA mejora los síntomas y el estado de salud en los pacientes con EPOC127, es más eficaz que la monoterapia con broncodilatadores de acción prolongada para prevenir las exacerbaciones128 y disminuye las exacerbaciones en mayor medida que la combinación de IC/LABA129.
Broncodilatadores en la EPOC estable
| • Los broncodilatadores inhalados son esenciales en la EPOC para tratar los síntomas y habitualmente se administran de forma continuada para prevenir o aliviar los síntomas (evidencia A). |
| • El uso regular y a demanda de agonistas β2 de acción corta (SABA, por sus siglas en inglés) o broncodilatadores colinérgicos de acción corta (SAMA, por sus siglas en inglés) mejora el FEV1 y los síntomas (evidencia A). |
| • Las combinaciones de SABA y SAMA son superiores a cualquiera de los fármacos por separado para mejorar el FEV1 y los síntomas (evidencia A). |
| • Los LABA y LAMA mejoran significativamente la función pulmonar, la disnea y el estado de salud y disminuye el número de exacerbaciones (evidencia A). |
| • Los LAMA reducen más la frecuencia de las exacerbaciones que los LABA (evidencia A) y disminuyen las hospitalizaciones (evidencia B). |
| • La combinación de un LABA con un LAMA tiene un efecto mayor sobre el FEV1 y los síntomas, en comparación con la monoterapia (evidencia A). |
| • La combinación de un LABA con un LAMA tiene un efecto mayor sobre la prevalencia de las exacerbaciones que la monoterapia (evidencia B) o el uso de LABA (evidencia B). |
| • El tiotropio mejora la eficacia de la rehabilitación respiratoria al aumentar el rendimiento al hacer esfuerzos físicos (evidencia B). |
| • La teofilina tiene un efecto broncodilatador discreto en la EPOC estable (evidencia A) que se acompaña de un beneficio moderado sobre los síntomas (evidencia B). |
Las exacerbaciones representan el principal criterio de valoración clínicamente relevante para evaluar la eficacia de los medicamentos con efectos antiinflamatorios (tabla 4).
Tratamiento antiinflamatorio en la EPOC estable
| Corticoides inhalados (IC) |
| • Un IC combinado con un LABA es más eficaz que los componentes individuales para mejorar la función pulmonar y el estado de salud y reducir las exacerbaciones en los pacientes con exacerbaciones en pacientes con EPOC moderada-muy grave (evidencia A). |
| • El tratamiento regular con CI aumenta el riesgo de neumonía, sobre todo en los pacientes con EPOC grave (evidencia A). |
| • El tratamiento inhalado triple con IC/LABA/LAMA mejora la función pulmonar, los síntomas y el estado de salud (evidencia A) y disminuye la frecuencia de las exacerbaciones (evidencia B), en comparación con el empleo regular de IC/LABA o la monoterapia con LAMA. |
| Corticoides por vía oral |
| • El uso a largo plazo de corticosteroides por vía oral tiene numerosos efectos secundarios (evidencia A) sin ningún beneficio adicional (evidencia C). |
| Inhibidores de la fosfodiesterasa (PDE)-4 |
| • En pacientes con bronquitis crónica, EPOC grave o muy grave y antecedentes de exacerbaciones: |
| • Un inhibidor de la PDE-4 mejora la función pulmonar y disminuye las exacerbaciones moderadas y graves (evidencia A). |
| • Un inhibidor de la PDE-4 mejora la función pulmonar y disminuye la frecuencia de las exacerbaciones en los pacientes tratados con una combinación IC/LABA a dosis fijas (evidencia B). |
| Antibióticos |
| • El tratamiento a largo plazo con azitromicina y eritromicina reduce el número de exacerbaciones tras un año de empleo (evidencia A). |
| • El tratamiento con azitromicina aumenta la incidencia de resistencias bacterianas (evidencia A) y puede reducir la capacidad auditiva (evidencia B). |
| Mucolíticos/antioxidantes |
| • El uso regular de N-acetilcisteína (NAC) y carbocisteína reduce el riesgo de exacerbaciones en determinados grupos de pacientes (evidencia B). |
| Otros antiinflamatorios |
| • La simvastatina no previene la aparición de exacerbaciones en pacientes con EPOC con mayor riesgo de exacerbaciones, sin indicaciones terapéuticas para su empleo (evidencia A). Sin embargo, se ha observado en estudios poblacionales que el uso de estatinas tienen algunos efectos beneficiosos en pacientes con EPOC por indicaciones cardiovasculares y metabólicas (evidencia C). |
| • Los modificadores de los leucotrienos no se han evaluado suficientemente en los pacientes con EPOC. |
En los pacientes con EPOC de moderada a muy grave intensidad y con exacerbaciones, un CI combinado con un LABA es más eficaz que cualquiera de sus componentes por separado para mejorar la función pulmonar y el estado de salud y disminuir el número de exacerbaciones130,131. Sin embargo, su empleo no afecta a la supervivencia132,133.
El uso de IC aumenta la prevalencia de candidiasis oral, afonía, equimosis y neumonía134. Los pacientes con mayor riesgo de neumonía son aquellos que son fumadores, edad ≥55 años, con antecedentes de exacerbaciones o neumonía e índice de masa corporal (IMC) < 25kg/m2, mayor disnea en el cuestionario mMRC y limitación grave del flujo aéreo135.
Se han obtenido resultados dispares en ensayos aleatorizados controlados (EAC) que han evaluado el riesgo de disminución de la densidad ósea y aparición de fracturas con el tratamiento con IC101,136–139. Algunos estudios observacionales han indicado que el tratamiento con IC aumenta el riesgo de diabetes o un control deficiente de esta140, cataratas141 e infecciones por micobacterias142, incluida la tuberculosis143,144.
Retirada de los IC. Los estudios de retirada de IC han proporcionado resultados dispares en relación a consecuencias negativas sobre la función pulmonar, los síntomas y las exacerbaciones145–149.
Tratamiento inhalatorio tripleLa combinación de un LABA con un LAMA y un IC (tratamiento triple) mejora la función pulmonar y los PRO150–153 y reduce el riesgo de exacerbaciones151,154–156. Sin embargo, en un EAC no se consiguió demostrar ningún beneficio sobre el número de exacerbaciones con la adición de un IC a la combinación de LABA/LAMA157. Se precisan más datos para comparar los beneficios del tratamiento triple (IC/LABA/LAMA) con los de LABA/LAMA.
Glucocorticoides por vía oralLos glucocorticoides orales no tienen utilidad en el tratamiento diario continuado de la EPOC por su falta de beneficios en relación a su elevada tasa de complicaciones sistémicas.
Inhibidores de la fosfodiesterasa-4 (PDE-4)El roflumilast reduce las exacerbaciones moderadas y graves tratadas con corticosteroides sistémicos en pacientes con bronquitis crónica, EPOC grave o muy grave y antecedentes de exacerbaciones frecuentes158. Los inhibidores de la PDE-4 tienen más efectos adversos que los fármacos inhalados para EPOC159. Los más frecuentes son diarrea, náuseas, disminución del apetito, pérdida de peso, dolor abdominal, trastornos del sueño y cefalea. Se debe evitar el uso de roflumilast en pacientes con bajo peso corporal y se debe usar con precaución en los pacientes con depresión.
AntibióticosLa azitromicina (250mg/día o 500mg tres veces a la semana) o la eritromicina (500mg dos veces al día) durante un año reducen el riesgo de exacerbaciones en los pacientes propensos a ellas160–162. El uso de azitromicina aumenta la incidencia de resistencia bacteriana y de anomalías auditivas162. El tratamiento intermitente con moxifloxacino en pacientes con criterios de bronquitis crónica y exacerbaciones frecuentes no disminuye la tasa de exacerbaciones163.
Mucolíticos (mucocinéticos, mucorreguladores) y antioxidantes (NAC, carbocisteína)El tratamiento regular con mucolíticos como la carbocisteína y la NAC en pacientes no tratados con CI disminuye el número de exacerbaciones y mejora moderadamente el estado de salud164,165.
Otros fármacos con potencial antiinflamatorioAunque los EAC indican que los inmunorreguladores disminuyen la intensidad y la frecuencia de las exacerbaciones166,167, se desconocen los efectos a largo plazo de este tratamiento. El nedocromilo y los modificadores de los leucotrienos no han sido evaluados suficientemente en la EPOC168. No hay indicios de ningún efecto beneficioso, pero sí algunos efectos secundarios, tras tratamiento con un anticuerpo anti-factor de necrosis tumoral alfa (TNFα) (infliximab) en la EPOC moderada-grave169. El uso de simvastatina no previno el número de exacerbaciones en pacientes con EPOC sin indicaciones metabólicas o cardiovasculares para el tratamiento con estatinas170. En estudios observacionales de pacientes con EPOC tratados con estatinas por indicación cardiovascular y metabólica se ha observado mejora en los PRO171. No hay indicios de que el suplemento de vitamina D reduzca el número de exacerbaciones en pacientes no seleccionados172.
Problemas relacionados con la medicación inhaladaEn estudios observacionales en la EPOC se ha observado que hay una relación significativa entre un mal uso de los inhaladores y el control de los síntomas173. Los factores determinantes de un mal uso de estos dispositivos son la edad avanzada, el uso de varios de ellos y la falta de instrucciones previas sobre la técnica de inhalación174. La técnica de inhalación mejora en algunos pacientes tras recibir instrucciones, pero no en todos174, en especial cuando se utiliza una técnica demostrativa en la que el paciente practica y explica lo aprendido al profesional sanitario175.
En la Tabla S4 del suplemento se resumen otros tratamientos farmacológicos de la EPOC.
Tratamiento del déficit de alfa-1 antitripsina. Estudios observacionales sugieren una reducción de la progresión espirométrica en pacientes con DAAT tratados con tratamiento sustitutivo al compararlos con pacientes no tratados176. En otros estudios en los que se midieron mediante TAC parámetros sensibles de progresión de enfisema se ha obtenido evidencia de un efecto sobre la conservación del tejido pulmonar en los pacientes tratados al comparar con placebo177–179.
Antitusivos. Los datos sobre la utilidad de los antitusivos en los pacientes con EPOC no son concluyentes180.
Vasodilatadores. En los estudios disponibles se indica que el intercambio gaseoso empeora181 mientras que la capacidad de esfuerzo o el estado de salud apenas mejoran en pacientes con EPOC182,183.
Rehabilitación, educación y autocontrolRehabilitación respiratoriaLa rehabilitación respiratoria es una intervención integral basada en una evaluación detallada del paciente seguida de tratamiento individualizado que puede consistir, p. ej., un programa de ejercicio, educación e intervenciones de autocontrol dirigidas a modificar el comportamiento para mejorar el estado físico y psicológico y promover la adopción de comportamientos que favorezcan la salud en los pacientes con EPOC184. Los efectos beneficiosos de la rehabilitación respiratoria son considerables (Tabla S5 del suplemento). La rehabilitación respiratoria puede disminuir las rehospitalizaciones y la mortalidad de los pacientes después de una exacerbación reciente (≤4 semanas con respecto a la hospitalización anterior)185. Sin embargo, el inicio de la rehabilitación respiratoria antes del alta del hospital puede comprometer la supervivencia186.
La rehabilitación respiratoria constituye un tratamiento integral del paciente aplicado por una serie de profesionales sanitarios187 en diversos lugares, como hospitales, centros ambulatorios o el domicilio del paciente184.
Educación, autocontrol y asistencia integradaEducación. Algunos ejemplos educacionales importantes son el abandono del tabaquismo, el uso correcto de los inhaladores, el reconocimiento precoz de las exacerbaciones, la toma de decisiones, la identificación del momento en que hay que pedir ayuda, las intervenciones quirúrgicas y la valoración de las voluntades anticipadas del paciente.
Autocontrol. Las intervenciones de autocontrol que utilizan planes de acción programados por escrito con el paciente sobre el empeoramiento de los síntomas disminuyen las hospitalizaciones por causas respiratorias (y por todas las causas) y mejoran su estado de salud188. Sin embargo, los beneficios en la salud de los programas de autocontrol de la EPOC podrían ser contrarrestados por un aumento de la mortalidad.189,190, por lo que su generalización en la práctica real sigue siendo difícil.
Programas atención integrada. Los programas asistenciales integrados podrían mejorar varios aspectos clínicos, pero no la mortalidad191. Sin embargo, esto no se confirmó en un gran estudio multicéntrico que se llevó a cabo en un sistema asistencial bien organizado192. La prestación de atención integrada mediante telemedicina no tiene beneficios importantes193.
Soporte y cuidados paliativos y terminalesControl de los síntomas y cuidados paliativosLa finalidad de los cuidados paliativos es prevenir y aliviar el sufrimiento y mejorar la calidad de vida de los pacientes y sus familias, con independencia del estadio de la enfermedad o la necesidad de otros tratamientos194. La asistencia paliativa debe centrarse en el alivio de la disnea, el dolor, la ansiedad, la depresión, la fatiga y la nutrición deficiente.
Cuidados del final de la vida y servicios socio-sanitariosEn las conversaciones sobre los cuidados terminales se debe incluir tanto a los pacientes como a sus familias195. La planificación de la asistencia anticipada disminuye la ansiedad de los pacientes y sus familias, garantiza que la atención sea acorde con sus deseos y evita costes innecesarios y no deseados y tratamientos invasivos costosos196,197. La Tabla S6 del suplemento resume los cuidados paliativos y terminales
Otros tratamientosOxigenoterapia y respiración asistidaOxigenoterapia. La administración domiciliaria de oxígeno (>15 horas al día) a los pacientes con insuficiencia respiratoria crónica aumenta la supervivencia de los pacientes con hipoxemia grave en reposo198. La oxigenoterapia domiciliaria no prolonga el tiempo hasta la muerte o la primera hospitalización ni tiene un beneficio sostenido en ninguno de los criterios de valoración medidos de los pacientes con EPOC estable o desaturación arterial de oxígeno moderada inducida por el esfuerzo o en reposo199.
Respiración asistidaSigue sin determinarse si está indicado utilizar soporte ventilatorio no invasivo (SVNI) de manera continuada en el domicilio para tratar a los pacientes con insuficiencia respiratoria aguda o crónica tras la hospitalización. Los estudios retrospectivos no han proporcionado datos concluyentes200,201. Los EAC han aportado datos contradictorios sobre el uso de SVNI domiciliario en la supervivencia y re-hospitalización en pacientes EPOC con hipercapnia crónica202–205. En los pacientes con EPOC y apnea obstructiva del sueño, la presión positiva continuada sobre las vías aéreas aumenta la supervivencia y evita episodios de hospitalización (Tabla S7 del suplemento)206.
Tratamiento intervencionistaIntervenciones quirúrgicasCirugía de reducción del volumen pulmonar (CRVP). En un EAC se confirmó que los pacientes con EPOC, enfisema de lóbulos superiores y poca capacidad de esfuerzo después de la rehabilitación experimentaron un aumento de la supervivencia cuando se les trató con CRVP, en comparación con el tratamiento médico207. En pacientes con buena capacidad de esfuerzo después de la rehabilitación respiratoria no se observaron diferencias en la supervivencia después de la CRVP, si bien su nivel de salud y capacidad de esfuerzo mejoraron. Se ha demostrado que la CRVP tiene una mortalidad superior que el tratamiento médico en pacientes con enfisema grave (un FEV1 ≤ 20% del valor teórico y enfisema homogéneo en la TAC de alta resolución o DLCO ≤ 20% del valor teórico)208.
Bullectomía. En determinados pacientes con un pulmón subyacente relativamente conservado, la bullectomía disminuye la disnea y mejora la función pulmonar y la tolerancia al esfuerzo209.
Trasplante de pulmón. En determinados pacientes el trasplante de pulmón mejora el estado de salud y la capacidad funcional, pero no prolonga la supervivencia209–211. Con el trasplante de ambos pulmones se ha observado una supervivencia más prolongada que con el de un solo pulmón en pacientes con EPOC, sobre todo en edades inferiores a los 60 años212.
Intervenciones broncoscópicas para reducir la hiperinsuflación en pacientes con enfisema graveSe han desarrollado métodos broncoscópicos menos invasivos para la reducción de volumen pulmonar213. En estudios prospectivos se ha demostrado que el uso de stents bronquiales no es eficaz214 y que la utilización de un sistema de sellado pulmonar produjo una morbi-mortalidad importante215. En un EAC en el que se evaluó el uso de válvulas endobronquiales se hallaron mejorías estadísticamente significativas del FEV1 y de la distancia recorrida en la prueba de marcha de 6 minutos a los 6 meses de la intervención en comparación con el tratamiento de control216. Sin embargo, la magnitud de las mejorías observadas careció de significación clínica. Con posterioridad, se examinó la eficacia de la misma válvula endobronquial en pacientes con enfisema heterogéneo217 o enfisema heterogéneo y homogéneo218, y se obtuvieron resultados dispares.
En dos ensayos multicéntricos se han examinado las espirales de nitinol implantadas en el pulmón, en comparación con el tratamiento habitual, y se han observado incrementos en la distancia recorrida en la prueba de marcha de 6 minutos con la espiral en comparación con el control y pequeñas mejorías del FEV1 y la calidad de vida, cuantificadas con el SGRQ219,220.
Se precisan más datos para definir la población óptima de pacientes que podría beneficiarse del uso de técnica broncoscópicas de reducción de volumen pulmonar, así como para comparar la duración a largo plazo de la mejora del rendimiento funcional o fisiológico de la CRVP en relación con sus efectos secundarios220.
Los puntos clave del tratamiento intervencionista en la EPOC estable se resumen en la Tabla S8 del suplemento.
Tratamiento de la EPOC establePuntos clave generales:
- •
El tratamiento de la EPOC estable debe basarse en una evaluación individualizada de los síntomas y del riesgo futuro de exacerbaciones.
- •
Todas las personas que fuman deben dejar de hacerlo.
- •
Los objetivos principales del tratamiento son la disminución de los síntomas y del riesgo futuro de exacerbaciones.
- •
Las estrategias terapéuticas no se limitan a los tratamientos farmacológicos y se deben complementar con intervenciones no farmacológicas adecuadas.
El tratamiento eficaz de la EPOC debe basarse en una evaluación individualizada para reducir los síntomas y el riesgo futuro de exacerbaciones (Figura S1 del suplemento).
Se propone personalizar el inicio y continuación (aumento o reducción) de los tratamientos basándose en la magnitud de los síntomas y en el riesgo de exacerbaciones del paciente. El fundamento de estas recomendaciones procede en parte de los datos obtenidos en EAC. Estas recomendaciones tienen por objeto respaldar la toma de decisiones de los médicos incorporando también las experiencias y preferencias de los pacientes.
Identificación y reducción de la exposición a los factores de riesgoEl tabaquismo es el factor de riesgo más frecuente y fácilmente identificable de la EPOC. Se debe recomendar en todo momento a los fumadores que abandonen el hábito. Hay que reducir la exposición personal total a polvo, humos y gases profesionales y a los contaminantes del aire doméstico y exterior.
Tratamiento de la EPOC estableTratamiento farmacológicoLos tratamientos farmacológicos disminuyen los síntomas y el riesgo e intensidad de las exacerbaciones, y mejoran el estado de salud y la tolerancia al esfuerzo. La elección dentro de cada clase depende de la disponibilidad del medicamento y de la respuesta y preferencia del paciente. (tablas 5–7)
Puntos clave para el uso de broncodilatadores
| • Se prefieren los LABA y los LAMA a los fármacos de acción corta, salvo en los pacientes con disnea ocasional (evidencia A). |
| • Los pacientes pueden iniciar un tratamiento broncodilatador individual de acción prolongada o un tratamiento broncodilatador doble de acción prolongada. Los pacientes con disnea persistente tratados con un solo broncodilatador deberían recibir otro broncodilatador adicional (evidencia A). |
| • Se prefieren los broncodilatadores inhalados a los broncodilatadores orales (evidencia A). |
| • No se recomienda la teofilina a menos que otros broncodilatadores a largo plazo no estén disponibles ni sean accesibles (evidencia B). |
Puntos clave para el uso de antiinflamatorios
| • No se recomienda la monoterapia a largo plazo con CI (evidencia A). |
| • Se puede considerar el tratamiento a largo plazo con CI en asociación con LABA para los pacientes con antecedentes de exacerbaciones a pesar de un tratamiento adecuado con broncodilatadores de acción prolongada (evidencia A). |
| • No se recomienda el tratamiento a largo plazo con corticosteroides orales (evidencia A). |
| • En los pacientes con exacerbaciones a pesar del tratamiento con IC/LABA o IC/LABA/LAMA, bronquitis crónica y obstrucción grave o muy grave del flujo aéreo, cabe considerar la adición de un inhibidor de la PDE4 (evidencia B). |
| • En los exfumadores que presenten exacerbaciones a pesar de un tratamiento adecuado se pueden considerar los macrólidos (evidencia B). |
| • No se recomienda tratamiento con estatinas para prevenir las exacerbaciones (evidencia A). |
| • Los mucolíticos antioxidantes se recomiendan únicamente en determinados pacientes (evidencia A). |
Puntos clave para el uso de otros tratamientos farmacológicos
| • Los pacientes con déficit grave de alfa-1 antitripsina y enfisema establecido son candidatos para recibir tratamiento con alfa-1 antitripsina (evidencia B). |
| • No se recomiendan los antitusígenos (evidencia C). |
| • Los medicamentos aprobados para la hipertensión pulmonar primaria no se recomiendan para los pacientes con hipertensión pulmonar secundaria a EPOC (evidencia B). |
| • Se pueden considerar los opioides de acción prolongada por vía oral y parenteral en dosis bajas para tratar la disnea en pacientes con EPOC grave (evidencia B). |
En la figura 3 se presenta un modelo propuesto para el inicio y continuación (aumento o reducción) del tratamiento farmacológico después de una evaluación individualizada de los síntomas y del riesgo de exacerbaciones futuras. En los documentos GOLD anteriores solo se daban recomendaciones para el tratamiento inicial. Sin embargo, muchos pacientes con EPOC ya reciben tratamiento y vuelven al médico con síntomas persistentes después del tratamiento inicial o, menos a menudo, con resolución de algunos síntomas, por lo que necesitan menos tratamiento. Por tanto, este documento incluye estrategias de aumento y disminución del tratamiento. Las recomendaciones están basadas en los datos disponibles de eficacia y seguridad. Se reconoce que no se ha evaluado sistemáticamente la intensificación del tratamiento, y que los ensayos de reducción del tratamiento son también limitados y solo incluyen los CI. Faltan datos directos que respalden las recomendaciones terapéuticas para los pacientes de los grupos C y D. Estas recomendaciones se reevaluarán en futuros informes a medida que se disponga de más datos.
Grupo ASe debe ofrecer un broncodilatador a todos los pacientes del grupo A para reducir la disnea. Puede ser de acción corta o acción prolongada en función de la preferencia de cada paciente. Hay que mantener el broncodilatador si se advierte un beneficio en los síntomas.
Grupo BEl tratamiento inicial debe ser un broncodilatador de acción prolongada. Los broncodilatadores de acción prolongada son superiores a los broncodilatadores de acción corta utilizados de manera intermitente106,221. No hay datos para recomendar en particular una clase de broncodilatadores de acción prolongada para aliviar los síntomas, por lo que su elección debe basarse en la respuesta de cada paciente.
Se recomienda usar dos broncodilatadores en los pacientes con disnea persistente que reciban monoterapia222. En los pacientes con disnea grave cabe considerar un tratamiento inicial con dos broncodilatadores.
Grupo CEl tratamiento inicial debe ser con un solo broncodilatador de acción prolongada. En dos estudios comparativos directos112,223, el LAMA resultó superior al LABA con respecto a la prevención de las exacerbaciones, por lo que se recomienda iniciar el tratamiento con un LAMA en este grupo.
Los pacientes con exacerbaciones persistentes se benefician de la adición de un segundo broncodilatador de acción prolongada (LABA/LAMA) o del uso de una combinación de un agonista β2 de acción prolongada y un corticosteroide inhalado (IC/LABA). Como los IC aumentan el riesgo de neumonía, nuestra primera elección es LABA/LAMA.
Grupo DEn este grupo se recomienda iniciar el tratamiento con una combinación de LABA/LAMA por los motivos siguientes:
- •
En estudios con PRO como objetivo principal, las combinaciones de LABA/LAMA obtuvieron mejores resultados que un solo broncodilatador.
- •
La combinación de LABA/LAMA fue superior a la combinación de IC/LABA para prevenir las exacerbaciones y mejorar otros PRO en pacientes del grupo D.
- •
Los pacientes del grupo D tienen mayor riesgo de neumonía cuando reciben IC111,135.
Si se elige inicialmente un solo broncodilatador, se prefiere un LAMA a un LABA para prevenir las exacerbaciones.
La combinación de IC/LABA es la primera elección para el tratamiento inicial en algunos pacientes. Estos pacientes pueden tener antecedentes o signos indicativos de solapamiento de asma-EPOC (ACO) o un recuento elevado de eosinófilos en sangre.
En los pacientes que presenten exacerbaciones a pesar del empleo de LABA/LAMA se recomiendan dos alternativas:
- •
Aumento a IC/LABA/LAMA (triple terapia)
- •
Cambio a IC/LABA. Si el tratamiento con IC/LABA no influye positivamente en las exacerbaciones o los síntomas, se puede añadir un LAMA.
Si los pacientes tratados con IC/LABA/LAMA siguen teniendo exacerbaciones, cabe considerar las opciones siguientes:
- •
Añadir roflumilast. Esto se puede considerar en los pacientes con un FEV1 < 50% del valor teórico y bronquitis crónica224, sobre todo si han requerido al menos una hospitalización por una exacerbación en el año anterior225.
- •
Añadir un macrólido aunque hay que tener en cuenta la posibilidad de inducir resistencia antibiótica.
- •
Suspender los IC. Esta recomendación está respaldada por datos que demuestran un riesgo elevado de efectos adversos (como neumonía) y ningún efecto negativo significativo al retirar los IC.
Una evaluación individual del paciente (p. ej. necesidades, preferencias y objetivos personales) y una valoración del riesgo (p. ej., exacerbaciones) facilita el diseño de un plan personalizado de autocontrol.
Programas de rehabilitación respiratoriaLos pacientes con muchos síntomas y/o elevado riesgo de exacerbaciones (grupos B, C y D) deben participar en un programa de rehabilitación integral que tenga en cuenta las características individuales de cada paciente y sus enfermedades concomitantes184,226,227.
Programas de ejercicioLa combinación de ejercicios por intervalos o de carga constante con ejercicios de resistencia obtiene mejores resultados que cualquiera de estos métodos por separado228. La adición de ejercicios de resistencia a los de tipo aeróbico mejora la resistencia, pero no el estado de salud ni la tolerancia al esfuerzo229. Los ejercicios de las extremidades superiores mejoran la fuerza y la resistencia de los brazos y aumentan la capacidad para las actividades de dichas extremidades230.
Educación mediante autocontrolUn programa pedagógico debe incluir abandono del tabaquismo, información básica sobre la EPOC, aspectos del tratamiento médico (fármacos respiratorios y dispositivos para inhalación), métodos para reducir al mínimo la disnea, consejos para saber cuándo hay que pedir ayuda y posiblemente una conversación sobre las voluntades anticipadas y las cuestiones del final de la vida.
Cuidados paliativos y terminalesEn pacientes muy graves hay que valorar (con ellos y/o sus familiares) si un ingreso en cuidados intensivos consiga sus objetivos asistenciales personales. Es necesario mantener conversaciones simples y estructuradas sobre estos posibles supuestos mientras los pacientes se encuentren estables231.
Soporte nutricionalSe recomiendan suplementos nutritivos para los pacientes con EPOC desnutridos.
VacunaciónSe recomienda la vacunación antigripal para todos los pacientes con EPOC. Se recomiendan las vacunas antineumocócicas, PCV13 y PPSV23, para todos los pacientes >65 años. La PPSV23 se recomienda también para pacientes jóvenes con EPOC que presenten enfermedades concomitantes importantes, como cardiopatía o neumopatía crónica232.
OxigenoterapiaEstá indicada la oxigenoterapia domiciliaria para los pacientes estables con:
- •
PaO2 ≤ 7,3kPa (55mm Hg) o SaO2 ≤ 88%, con o sin hipercapnia confirmada dos veces durante un periodo de tres semanas; o
- •
PaO2 de 7,3kPa (55mm Hg) a 8,0kPa (60mm Hg), o SaO2 del 88%, si hay signos de hipertensión pulmonar, edema periférico indicativo de insuficiencia cardíaca congestiva o policitemia (hematocrito >55%).
La ventilación no invasiva (VNI) se usa en ocasiones en los pacientes estables con EPOC muy grave, sobre todo aquellos con hipercapnia diurna y hospitalización reciente, pero se han obtenido datos dispares sobre su eficacia233. En los pacientes con EPOC y apnea obstructiva del sueño está indicada el uso de presión positiva continua en las vías aéreas206.
Broncoscopia y cirugía intervencionistas- •
En determinados pacientes con enfisema heterogéneo u homogéneo e hiperinsuflación importante, ambos resistentes al tratamiento médico optimizado, cabe considerar métodos quirúrgicos o broncoscópicos de reducción del volumen pulmonar (p. ej., válvulas endobronquiales o espirales pulmonares)234.
- •
En determinados pacientes con bullas grandes se puede considerar la bullectomía quirúrgica.
- •
En determinados pacientes con EPOC muy grave y sin contraindicaciones importantes cabe considerar el trasplante de pulmón.
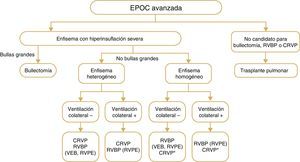
La elección de la reducción pulmonar broncoscópica vs quirúrgica para tratar la hiperinsuflación en un paciente enfisematoso depende de una serie de factores. Estos comprenden la extensión y el patrón del enfisema identificado en la TCAR, la presencia de ventilación colateral interlobular medida por la integridad de las cisuras en la TCAR o la evaluación fisiológica (oclusión endoscópica con balón y valoración del flujo), la pericia local en el rendimiento de los procedimientos y las preferencias del paciente y del médico. En la figura 4 se presenta un algoritmo que describe las diversas intervenciones basándose en sus características radiológicas y fisiológicas.
Tratamientos broncoscópicos y quirúrgicos intervencionistas para la EPOC. Descripción general de los diversos tratamientos utilizados para los pacientes con EPOC y enfisema en todo el mundo. Téngase en cuenta que no están aprobados todos los tratamientos para asistencia clínica en todos los países. Además, se desconocen los efectos de la RBVP en la supervivencia u otros criterios de valoración a largo plazo o la comparación con la CRVP.
Definición de las abreviaturas: RBVP, reducción broncoscópica del volumen pulmonar, VEB, válvula endobronquial, CRVP cirugía de reducción del volumen pulmonar, RVPE, reducción del volumen pulmonar con espirales.
* En algunos centros pero no en todos.
Los criterios para el trasplante de pulmón son EPOC grave, falta de idoneidad para la reducción endoscópica o quirúrgica del volumen pulmonar, índice BODE de 5 a 6, PaCO2 > 50mmHg (o 6,6kPa) o PaO2 < 60mmHg (o 8kPa) y FEV1 < 25% del valor téorico234. Los criterios recomendados que se deben incluir son uno de los siguientes: Índice BODE > 7, FEV1 < 15%-20% del valor teórico, tres o más exacerbaciones graves en el año anterior, una exacerbación grave con insuficiencia respiratoria hipercápnica aguda o hipertensión pulmonar moderada a grave235,236.
Los puntos clave para el uso de tratamientos no farmacológicos se resumen en la Tabla S9 del suplemento.
Vigilancia y seguimientoEs esencial un seguimiento sistemático de los pacientes con EPOC. Hay que controlar los síntomas, las exacerbaciones y las mediciones objetivas de la limitación del flujo aéreo para determinar cuándo se debe modificar el tratamiento e identificar las posibles complicaciones o enfermedades concomitantes que aparezcan. Con el fin de ajustar adecuadamente el tratamiento a medida que progresa la enfermedad, cada visita de seguimiento debe incluir una conversación sobre la pauta terapéutica en ese momento.
Se deben evaluar y tratar los síntomas que indiquen empeoramiento o aparición de otra afección concomitante.
Tratamiento de las exacerbacionesPuntos clave generales:
- •
Una exacerbación de la EPOC es un empeoramiento agudo de los síntomas respiratorios que requiere tratamiento adicional.
- •
Las exacerbaciones pueden desencadenarse por varios factores. Las causas más frecuentes son las infecciones de las vías aéreas.
- •
La finalidad del tratamiento de las exacerbaciones es reducir al mínimo la repercusión negativa de la exacerbación inmediata y prevenir episodios posteriores.
- •
Se recomiendan agonistas β2 inhalados de acción corta, con o sin anticolinérgicos de acción corta, como broncodilatadores iniciales para tratar una exacerbación aguda.
- •
Se debe iniciar un tratamiento de mantenimiento con broncodilatadores de acción prolongada lo antes posible, antes del alta hospitalaria.
- •
Los corticosteroides sistémicos mejoran la función pulmonar (FEV1) y la oxigenación y acortan el tiempo de recuperación y la duración de la hospitalización. La duración del tratamiento no debe ser superior a 5-7 días.
- •
Los antibióticos, cuando están indicados, acortan el tiempo de recuperación y reducen el riesgo de recidiva precoz y fracaso del tratamiento, y disminuyen la duración de la hospitalización. El tratamiento debe durar 5-7 días.
- •
No se recomiendan las metilxantinas por sus efectos secundarios.
- •
La ventilación mecánica no invasiva debe ser el primer método de ventilación utilizado para tratar la insuficiencia respiratoria aguda en pacientes con EPOC.
- •
Tras una exacerbación, hay que adoptar medidas adecuadas para prevenir las exacerbaciones.
Las exacerbaciones representan episodios importantes en el tratamiento de la EPOC porque afectan negativamente al estado de salud del paciente, las tasas de hospitalización y re-hospitalización, y la progresión de la enfermedad237,238. Las exacerbaciones de la EPOC son fenómenos complejos, habitualmente acompañados de aumento de la inflamación de las vías aéreas, aumento de la expectoración y atrapamiento aéreo. El aumento de la disnea es el síntoma fundamental de una exacerbación. Otros síntomas consisten en el aumento de la purulencia y el volumen del esputo, y aumento de la tos y los sibilantes239. Dado que las enfermedades concomitantes son frecuentes en los pacientes con EPOC, hay que diferenciar las exacerbaciones del síndrome coronario agudo, el empeoramiento de la insuficiencia cardíaca congestiva, la embolia pulmonar y la neumonía.
Las exacerbaciones de la EPOC se clasifican como:
- •
Leves (tratadas únicamente con broncodilatadores de acción corta, [SABD])
- •
Moderadas (tratadas con SABD más antibióticos o corticosteroides orales) o
- •
Graves (el paciente requiere hospitalización o visitas al servicio de urgencias). Las exacerbaciones graves se pueden asociar también a insuficiencia respiratoria aguda.
Las exacerbaciones se desencadenan principalmente por infecciones respiratorias virales, si bien las infecciones bacterianas y factores ambientales también pueden iniciar o potenciar estos episodios240.
Las exacerbaciones pueden acompañarse de aumento de la expectoración y, si esta es purulenta, se pueden identificar bacterias en el esputo239,241,242 Algunos datos avalan el concepto de que los eosinófilos están aumentados en las vías aéreas, los pulmones y la sangre en un porcentaje significativo de pacientes con EPOC durante una agudización. Las exacerbaciones asociadas con aumento del esputo o de los eosinófilos en sangre pueden ser más sensibles a los esteroides sistémicos243, pero se necesitan más datos prospectivos243.
Durante una exacerbación, los síntomas suelen durar entre 7 y 10 días, pero pueden ser más prolongados. A las 8 semanas, el 20% de los pacientes no ha recuperado su estado previo a la exacerbación244. Las exacerbaciones de la EPOC aumentan la predisposición a nuevos episodios59,245.
Los pacientes con EPOC predispuestos a las exacerbaciones frecuentes (definidas como ≥2 exacerbaciones al año) tienen un peor nivel de salud y una mayor morbilidad que los pacientes con menos exacerbaciones238. Otros factores que aumentan el riesgo de exacerbaciones (o su gravedad) son el incremento de un cociente dimensión transversal de la arteria pulmonar/dimensión transversal de la aorta (es decir, >1)246, un mayor porcentaje de enfisema o grosor de las paredes de las vías aéreas247 cuantificados por TAC torácica y la presencia de bronquitis crónica248,249.
Opciones de tratamientoÁmbito de tratamientoLos objetivos del tratamiento de las exacerbaciones son reducir al mínimo el efecto negativo de la exacerbación inmediata y prevenir la aparición de episodios posteriores250. En función de la intensidad de la exacerbación o de la gravedad de la enfermedad subyacente, la exacerbación se puede tratar en régimen ambulatorio u hospitalario. Más del 80% de las exacerbaciones se tratan en régimen ambulatorio con broncodilatadores, corticosteroides y antibióticos251-253.
Las indicaciones para la hospitalización durante una exacerbación de la EPOC se muestran en la Tabla S10 del suplemento. Cuando los pacientes con una exacerbación de la EPOC acuden al servicio de urgencias, deben recibir oxígeno suplementario y ser objeto de una evaluación para determinar si la exacerbación es potencialmente mortal y requiere ventilación no invasiva u hospitalización en la UCI o la unidad de cuidados respiratorios. Aparte de la farmacoterapia, el tratamiento hospitalario de las exacerbaciones incluye el soporte respiratorio (oxigenoterapia, ventilación).
El pronóstico a largo plazo después de la hospitalización por una exacerbación de la EPOC es adverso; la tasa de mortalidad a los cinco años es de un 50%254. Los factores asociados a una evolución desfavorable son una edad avanzada, un índice de masa corporal bajo, la presencia de enfermedades concomitantes (p. ej., enfermedad cardiovascular o cáncer de pulmón), las hospitalizaciones previas por exacerbaciones de la EPOC, la gravedad clínica de la exacerbación de referencia y la necesidad de oxigenoterapia domiciliaria en el momento del alta255,256. Los pacientes con una mayor prevalencia y gravedad de síntomas respiratorios, mala calidad de vida, peor función pulmonar, menor capacidad de esfuerzo y menor densidad pulmonar y engrosamiento de las paredes bronquiales en la TC tienen mayor riesgo de morir después de una exacerbación aguda257.
En la tabla 8 se presentan los puntos clave para el tratamiento de una exacerbación
Puntos clave para el tratamiento de las exacerbaciones
| • Se recomienda el uso de broncodilatadores β2 agonistas2 inhalados de acción corta, con o sin anticolinérgicos de acción corta, como tratamiento inicial de una exacerbación aguda (evidencia C). |
| • Los corticosteroides sistémicos mejoran la función pulmonar (FEV1) y la oxigenación arterial, y acortan el tiempo de recuperación y la duración de la hospitalización. La duración del tratamiento no debe ser mayor de 5-7 días (evidencia A). |
| • Los antibióticos, cuando están indicados, acortan el tiempo de recuperación y reducen el riesgo de recaída precoz y fracaso del tratamiento, y disminuyen la duración de la hospitalización. El tratamiento debe durar 5-7 días (evidencia B). |
| • No se recomiendan las metilxantinas por sus mayores efectos secundarios (evidencia B). |
| • La ventilación mecánica no invasiva (VNI) debe ser el primer método de ventilación utilizado en los pacientes con EPOC e insuficiencia respiratoria aguda que no tiene ninguna contraindicación absoluta porque mejora el intercambio gaseoso, reduce el trabajo respiratorio y la necesidad de intubación, disminuye la duración de la hospitalización y aumenta la supervivencia (evidencia A). |
Las clases de medicamentos más utilizadas para las exacerbaciones de la EPOC son los broncodilatadores, los corticosteroides y los antibióticos.
Broncodilatadores. Los agonistas β2 inhalados de acción corta, con o sin anticolinérgicos de acción corta, son los broncodilatadores iniciales recomendados para tratar las exacerbaciones258,259. No hay diferencias significativas en el FEV1 cuando se usan inhaladores dosificadores (ID) (con o sin cámara de inhalación) o nebulizadores para administrar el fármaco260, si bien estos últimos son más fáciles de utilizar por los pacientes más graves. No se recomiendan las metilxantinas intravenosas por sus efectos secundarios261,262.
Glucocorticoides. Los glucocorticoides sistémicos en las exacerbaciones de la EPOC acortan el tiempo de recuperación y mejoran el FEV1. También mejoran la oxigenación263–266, reducen el riesgo de recidiva precoz y fracaso del tratamiento267, y disminuyen la duración de la hospitalización263,265,268. Se recomienda una dosis de 40mg de prednisona al día durante 5 días269. El tratamiento con prednisolona oral es igual de eficaz que la administración intravenosa270. Los glucocorticoides son menos eficaces para tratar las exacerbaciones en los pacientes con un recuento menor de eosinófilos en sangre59,243,271.
Antibióticos. El uso de antibióticos en las exacerbaciones sigue suscitando controversia272–274. Los datos respaldan el uso de antibióticos en los pacientes con exacerbaciones y un esputo más purulento273,274. Una revisión reveló que los antibióticos reducían el riesgo de mortalidad a corto plazo en un 77%, de fracaso del tratamiento en un 53% y de purulencia del esputo en un 44%275. El tratamiento antibiótico guiado por pro-calcitonina reduce la exposición al antibiótico y los efectos secundarios con la misma eficacia clínica276,277. En un estudio de pacientes con antecedentes de exacerbaciones y necesidad de ventilación mecánica (invasiva o no invasiva) se observó un incremento de la mortalidad y una mayor incidencia de neumonía nosocomial cuando no se administraron antibióticos278. Se deben administrar antibióticos a los pacientes con exacerbaciones que tengan tres síntomas cardinales: aumento de la disnea y del volumen y de la purulencia del esputo; que tengan dos de estos síntomas esenciales y uno de ellos sea el aumento de la purulencia del esputo; o que precisen ventilación mecánica (invasiva o no invasiva)239,240. La duración recomendada del tratamiento antibiótico es de 5-7 días279.
La elección del antibiótico debe basarse en el patrón local de resistencias bacterianas. El tratamiento empírico inicial habitual consiste en una combinación de amino-penicilina con ácido clavulánico, un macrólido o tetraciclina. En los pacientes con exacerbaciones frecuentes, gran limitación del flujo aéreo280,281 o exacerbaciones con necesidad de ventilación mecánica282 hay que hacer cultivos del esputo o de otras muestras del pulmón para identificar la presencia de patógenos resistentes. La vía de administración depende de la capacidad de comer del paciente y de la farmacocinética del antibiótico.
Respiración asistidaOxigenoterapia. Hay que ajustar el flujo de oxígeno para alcanzar una saturación arterial del 88%-92%283. Una vez iniciada la oxigenoterapia, se debe practicar una gasometría arterial para comprobar que la mejor oxigenación no se acompaña de retención de dióxido de carbono ni empeoramiento de la acidosis.
Ventilación. Algunos pacientes tienen que ingresar en la unidad de cuidados intensivos. Puede ser conveniente ingresar a los pacientes con exacerbaciones graves en unidades de cuidados respiratorios intermedios o especiales si hay personal y equipos cualificados para tratar la insuficiencia respiratoria aguda.
Ventilación mecánica no invasiva (VNI). Se prefiere a la ventilación invasiva como método de ventilación inicial para tratar la insuficiencia respiratoria aguda en los pacientes hospitalizados por exacerbaciones graves de la EPOC. La VNI se ha estudiado en EAC que registraron tasas de éxito del 80%-85%284–288. La VNI disminuye las tasas de mortalidad e intubación traqueal284,289–291.
Ventilación mecánica invasiva. La indicación para comenzar la ventilación mecánica invasiva durante una exacerbación es el fracaso de la VNI inicial292. En los pacientes que no responden a la VNI como tratamiento inicial y reciben ventilación invasiva como tratamiento de rescate posterior, la morbilidad, la duración de la estancia hospitalaria y la mortalidad son mayores292.
Alta hospitalaria y seguimientoLa falta de evaluación espirométrica y de gasometría arterial favorece la re-hospitalización y la mortalidad293. La mortalidad guarda relación con la edad del paciente, la presencia de insuficiencia respiratoria acidótica, la necesidad de respiración asistida y enfermedades concomitantes como la ansiedad y la depresión294.
Se ha investigado la introducción de diversos paquetes de medidas en el momento del alta hospitalaria, como educación, optimización de la medicación, supervisión y corrección de la técnica de inhalación, evaluación y tratamiento óptimo de las enfermedades concomitantes, rehabilitación precoz, tele-monitorización y contacto continuo con el paciente295. No hay datos suficientes que indiquen que estas medidas influyen en las tasas de re-hospitalización, la mortalidad a corto plazo293,294,296,297 o la relación coste-efectividad294.
Se debe hacer un seguimiento inicial (<30 días) después del alta, cuando sea posible, porque disminuye las re-hospitalizaciones relacionadas con exacerbaciones186,298. El seguimiento precoz posibilita una revisión meticulosa del tratamiento en el momento del alta y brinda la oportunidad de modificarlo. Los pacientes que no acuden al seguimiento inicial tienen una mortalidad mayor a los 90 días.
Se recomienda un seguimiento adicional a los tres meses para garantizar la estabilidad clínica, revisar los síntomas del paciente y la función pulmonar (mediante espirometría) y, si es posible, determinar el pronóstico mediante sistemas de puntuación múltiples, como el BODE298,299. Asimismo, hay que evaluar la presencia y el tratamiento de las enfermedades concomitantes (Tabla S11 del suplemento)300.
Prevención de las exacerbacionesTras una exacerbación, hay que adoptar medidas para prevenir nuevas exacerbaciones (Tabla S12 del suplemento).
EPOC y enfermedades concomitantesPuntos clave generales:
- •
La EPOC suele coexistir con otras enfermedades (comorbilidades) que afectan significativamente a la evolución del paciente.
- •
La presencia de comorbilidades no debe modificar el tratamiento de la EPOC y estas afecciones se deben tratar conforme a la práctica habitual con independencia de la presencia de EPOC.
- •
Cuando la EPOC forma parte de un plan asistencial de múltiples enfermedades, hay que garantizar la simplicidad y reducir al mínimo la polifarmacia.
La EPOC suele coexistir con otras enfermedades (comorbilidades) que pueden influir significativamente en el pronóstico del paciente63,301–307. Algunas de ellas son independientes de la EPOC, mientras que otras están relacionadas causalmente, bien por compartir factores de riesgo, bien porque una enfermedad aumenta el riesgo o complica la intensidad de la otra308. El tratamiento del paciente con EPOC debe incluir la identificación y el tratamiento de sus afecciones concomitantes; a continuación se describen las más frecuentes en la EPOC.
Enfermedad cardiovascularInsuficiencia cardíacaLa prevalencia de insuficiencia cardiaca sistólica o diastólica en los pacientes con EPOC varía entre el 20% y el 70%309. La insuficiencia cardiaca no reconocida puede parecerse o acompañar a las exacerbaciones agudas de la EPOC; el 40% de los pacientes con EPOC que reciben ventilación mecánica por insuficiencia respiratoria hipercápnica tienen signos de disfunción ventricular izquierda310,311. El tratamiento con β-bloqueantes β1 aumenta la supervivencia en la insuficiencia cardiaca crónica, por lo que está recomendado. Se deben usar β-bloqueantes selectivos β1312.
Cardiopatía isquémicaHay un mayor riesgo de daño del miocardio en los pacientes con cardiopatía isquémica concomitante que experimentan una exacerbación de la EPOC. Los pacientes con niveles elevados de troponina tienen mayor riesgo de consecuencias adversas, como mortalidad a corto (30 días) y largo plazo313.
ArritmiasLas arritmias cardiacas son frecuentes en la EPOC y viceversa. La fibrilación auricular es frecuente y está relacionada directamente con el FEV1. Con anterioridad, se había dicho que los broncodilatadores son potencialmente pro-arrítmicos314,315. Sin embargo, los datos indican un perfil de seguridad global aceptable de los agonistas β2 de acción prolongada316 y los anticolinérgicos (y los corticosteroides inhalados)103,115,253,317–322.
Vasculopatía periféricaEn una amplia población de pacientes con EPOC y todo su espectro de gravedad, el 8,8% tenía un diagnóstico de arteriopatía periférica (AP), una cifra superior a la prevalencia en controles sin EPOC (1,8%)323. Los pacientes con EPOC y AP tenían una capacidad funcional y un estado de salud peores que los pacientes sin AP.
HipertensiónEs probable que la hipertensión sea la enfermedad concomitante más frecuente en la EPOC, lo que tiene consecuencias en el pronóstico308,324.
OsteoporosisLa osteoporosis se suele acompañar de enfisema325,326, un bajo índice de masa corporal 327 y poca masa magra328. Son frecuentes la baja densidad mineral ósea y las fracturas en los pacientes con EPOC incluso después de ajustarlas al uso de esteroides, la edad, los paquetes-año de tabaquismo, el tabaquismo activo y las exacerbaciones329,330. En estudios fármaco-epidemiológicos se ha observado una relación entre los corticosteroides inhalados y las fracturas. Los corticosteroides sistémicos aumentan significativamente el riesgo de osteoporosis.
Ansiedad y depresiónLa ansiedad y la depresión tienen un pronóstico adverso331,332
EPOC y cáncer de pulmónLa relación entre enfisema y cáncer de pulmón es más estrecha que entre limitación del flujo aéreo y cáncer de pulmón333–335. Una edad más avanzada y un consumo mayor de tabaco aumentan aún más el riesgo336.
Dos estudios de cribado con TC torácica a dosis reducidas (TCDR) indicaron una mayor supervivencia en los pacientes de 55-74 años, los fumadores corrientes o los que habían dejado de fumar en los 15 años anteriores, con un antecedente de tabaquismo de al menos 30 paquetes-año337,338. En la actualidad se recomienda la TCDR en los EE. UU. para los pacientes con estos datos demográficos, pero no es una práctica universal.
Síndrome metabólico y diabetesEl síndrome metabólico y la diabetes manifiesta son más frecuentes en la EPOC y es probable que esta última afecte al pronóstico302. Se ha calculado que la prevalencia del síndrome metabólico es superior al 30%339.
Reflujo gastroesofágico (RGE)El RGE es un factor de riesgo independiente de exacerbaciones y empeora el estado de salud de los pacientes251,340,341.
BronquiectasiasLas bronquiectasias prolongan las exacerbaciones342 y aumentan la mortalidad300.
Apnea obstructiva del sueño (AOS)Los pacientes con un «overlap syndrome» (esto es EPOC y AOS) tienen un pronóstico peor que los pacientes con EPOC o AOS por separado. Los episodios de apnea en los pacientes con AOS y EPOC cursan con hipoxemia más intensa y más arritmias cardíacas343. Además, estos pacientes tienen más probabilidades de padecer hipertensión pulmonar diurna344,345 que los pacientes con AOS o EPOC por separado.
Conflicto de interesesEl conflicto de intereses de los autores (GOLD-Disclosures-Authors) está disponible en el material adicional de este artículo en su versión electrónica en doi:10.1016/j.arbres.2017.02.001.













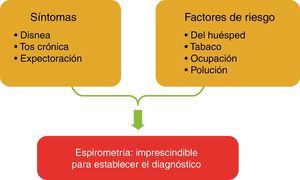

![Algoritmos de tratamiento farmacológico según el grado de GOLD [los recuadros y las flechas resaltados indican las vías de tratamiento preferidas]. Algoritmos de tratamiento farmacológico según el grado de GOLD [los recuadros y las flechas resaltados indican las vías de tratamiento preferidas].](https://static.elsevier.es/multimedia/03002896/0000005300000003/v4_201705130114/S0300289617300352/v4_201705130114/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w98FxLWLw1xoW2PaQDYY7RZU=)