en determinadas enfermedades pulmonares intersticiales difusas (EPID), el estudio del lavado broncoalveolar (LBA) define patrones típicos de cada enfermedad y tiene valor como apoyo al diagnóstico. El objetivo del estudio ha sido realizar un análisis descriptivo del estudio citológico y de las subpoblaciones linfocitarias en el LBA efectuado a pacientes con EPID.
Pacientes y métodosestudio prospectivo de 562 pacientes con EPID desde 1991 hasta 2005. Se realizó un estudio de la distribución celular y de la subpoblaciones linfocitarias en el LBA: CD3, CD4, CD8, CD3+CD4−CD8− y CD56.
Resultadosla edad media de los pacientes era de 53,4 años y el 53,3% eran mujeres. Se estudiaron las siguientes enfermedades: fibrosis pulmonar idiopática (n=132), sarcoidosis (n=123), enfermedades del colágeno (n=133), neumonía organizada criptogenética (n=89) y alveolitis alérgica extrínseca (n=85). Tanto en los casos de sarcoidosis como en los de alveolitis alérgica extrínseca fue frecuente la alveolitis linfocitaria aislada. En el resto de enfermedades la alveolitis mixta fue el patrón habitual. El índice CD4/CD8 fue el parámetro más útil, con un incremento en la sarcoidosis (mediana: 2,3). En el resto de las enfermedades el índice estaba invertido, con una mediana para la fibrosis pulmonar idiopática, la alveolitis alérgica extrínseca, la neumonía organizada criptogenética y la enfermedad del colágeno de 1,76; 0,45; 0,35, y 0,33, respectivamente.
Conclusioneslos parámetros del LBA, junto a los datos clinicorradiológicos, ayudan a discriminar entre las EPID. Por lo tanto, debe considerarse una técnica de gran utilidad en el manejo clínico, sobre todo cuando la biopsia pulmonar no resulta diagnóstica o no es posible realizarla.
Study of the bronchoalveolar lavage (BAL) fluid in some interstitial lung diseases can reveal patterns typical to each disease and that can support the diagnosis. The objective of this study was to perform a descriptive analysis of the cytologic study and of the lymphocyte subpopulations in BAL fluid from patients with interstitial lung disease.
Material and methodsIn this prospective, observational study of 562 patients between January 1991 and January 2005, BAL fluid was analyzed to determine the distribution of cell populations and of lymphocyte subsets: CD3, CD4, CD8, CD3+CD4−CD8−, and CD56.
ResultsThe mean age was 53.4 years and 53.3% of the patients were women. The following diseases were studied: idiopathic pulmonary fibrosis (n=132), sarcoidosis (n=123), connective tissue diseases (n=133), cryptogenic organizing pneumonia (n=89), and extrinsic allergic alveolitis (n=85). Isolated lymphocytic alveolitis was common in sarcoidosis and extrinsic allergic alveolitis. Mixed alveolitis was the most common pattern in the other interstitial lung diseases. The CD4:CD8 ratio was the most useful parameter. It was high in sarcoidosis (median, 2.3); the ratio was low or inverted in the other interstitial lung diseases, with median values of 1.76 in idiopathic pulmonary fibrosis, 0.45 in extrinsic allergic alveolitis, 0.35 in cryptogenic organizing pneumonia, and 0.33 in the connective tissue diseases.
ConclusionsBAL parameters, in association with clinical and radiologic data, help to discriminate between interstitial lung diseases. BAL should therefore be considered a very useful tool in clinical management, particularly when pulmonary biopsy is not conclusive or is not possible.
El diagnóstico de la enfermedad pulmonar intersticial difusa (EPID) se basa en la realización de una correcta anamnesis y exploración, estudio radiológico —incluida una tomografía computarizada de alta resolución (TACAR)—, análisis de sangre y pruebas de función respiratoria. Según los hallazgos de la TACAR, el paso siguiente es, en general, la realización de un lavado broncoalvolar (LBA) y biopsia transbronquial (BTB) si no hay contraindicación.
La BTB es muy rentable en el diagnóstico de la enfermedad granulomatosa, malignidad y enfermedad infecciosa oportunista1–4, pero poco rentable para el diagnóstico de las neumonías intersticiales idiopáticas. Si no se obtiene ningún hallazgo, la biopsia pulmonar, ya sea por videotoracoscopia, que es lo más frecuente, o por toracotomía, es la prueba de referencia para el diagnóstico. No obstante, ambas técnicas tienen sus contraindicaciones y se asocian a una morbilidad y mortalidad variables, dependiendo de la enfermedad subyacente, la situación funcional del paciente y la comorbilidad asociada. Por otra parte, la frecuencia con que se efectúan las técnicas de biopsia quirúrgica para la confirmación de estas enfermedades es muy variable en nuestro medio y en general no alcanza el 30%, como se ha puesto de manifiesto en 2 estudios realizados en nuestro país5,6, o es incluso menor según un estudio llevado a cabo por Johnston et al7 en el Reino Unido en 200 pacientes con fibrosis pulmonar idiopática (FPI). La frecuencia de utilización de la BTB se ha cifrado en un 33% y la de la biopsia pulmonar abierta en un 7,5%7. Aunque se observa un discreto incremento de la videotoracoscopia8 como técnica de elección, el manejo diagnóstico no ha variado de forma significativa en los últimos años. Sigue habiendo cierto pesimismo en cuanto a que la biopsia pulmonar confirmatoria modifique los planes de tratamiento y, por lo tanto, el diagnóstico se fundamenta en los criterios clínicos y radiológicos, sobre todo en la TACAR, aun cuando un tercio de los casos de neumonía intersticial usual pueden no diagnosticarse si se utiliza sólo esta técnica9.
El LBA es una técnica ideada en su inicio para la investigación de los mecanismos inmunitarios e inflamatorios que operan en el aparato respiratorio inferior y, por lo tanto, es esencial en el estudio de la patogenia de las enfermedades que afectan al intersticio2–4. Además, es muy útil tanto en el aislamiento de patógenos oportunistas como en el diagnóstico específico de determinadas enfermedades en que los hallazgos del LBA tienen valor diagnóstico: proteinosis alveolar, hemorragia alveolar difusa, eosinofilias pulmonares o carcinoma broncoalveolar. Sin embargo, en las enfermedades más frecuentes en nuestro medio, como la FPI, la sarcoidosis, la alveolitis alérgica extrínseca (AAE), la neumonía organizada criptogenética (NOC) o la enfermedad pulmonar intersticial asociada a enfermedades del colágeno (EPID-EC), se han descrito “patrones” de predominio de respuesta celular e inmunitaria que se relacionan con los procesos de inflamación alveolointersticial. Aunque en los próximos años la información del LBA se complementará con datos que identifiquen un predominio de respuesta de linfocitos T helper tipo 1 o 2 con la determinación de interleucinas, de momento la información más útil clínicamente se basa en el estudio de la distribución celular y de las subpoblaciones linfocitarias. No obstante, la utilidad real del estudio de estos parámetros en el LBA, en ausencia de confirmación histológica, es aún controvertida10,11.
El objetivo del trabajo ha sido realizar un análisis descriptivo de los hallazgos del estudio citológico y de las subpoblaciones linfocitarias en el LBA efectuado a pacientes con las EPID más frecuente en nuestro medio, a fin de valorar su utilidad diagnóstica.
Pacientes y métodosSe trata de un estudio observacional y prospectivo, en el que se ha incluido a todos los pacientes con sospecha de EPID entre enero de 1991 y enero de 2005. En su mayor parte procedían de nuestra área hospitalaria (Unidad de Neumopatía Intersticial y Unidad de Colagenosis de Medicina Interna). A todos ellos se les realizó un protocolo de estudio y se les derivó a la Unidad de Broncoscopia (Unidad Médico-Quirúrgica de Enfermedades Respiratorias, del Hospital Universitario Virgen del Rocío, Sevilla). Se recogieron los siguientes datos de la historia clínica: demográficos (sexo y edad), antecedentes personales (factores de exposición laboral y/o doméstica, hábito tabáquico, enfermedad de base, tratamientos previos), datos clinicorradiológicos (síntomas, radiografía de tórax, tomografía computarizada y/o TACAR), datos analíticos (hemograma, enzima conversiva de la angiotensina, complemento, anticuerpos antinucleares, anticuerpos anti-ADN, anticuerpos antimembrana basal), gasometría arterial, datos de espirometría forzada, análisis citológico y microbiológico del fluido del LBA, hallazgos en la BTB o en la biopsia pulmonar y diagnóstico definitivo.
En todos los casos se efectuó un LBA y se asoció BTB cuando no había contraindicaciones para su realización. El LBA se llevó a cabo según un protocolo establecido previamente12,13. En las muestras que cumplían criterios de representatividad del tracto respiratorio inferior, se determinó la concentración celular y se estudió la distribución celular en muestras citocentrifugadas que estaban teñidas con tinción de Giemsa modificada (Panóptico Rápido, QCA®), con identificación de macrófagos alveolares, linfocitos, neutrófilos, eosinófilos y células plasmáticas. En el caso de los macrófagos, se incluyó la descripción de determinadas características que con frecuencia se asocian a determinadas enfermedades (citoplasma con aspecto espumoso, antracosis, contenido de grasa o hemosiderina). Se consideró normal todo fluido de LBA con los siguientes límites en la distribución celular: un 80–90% de macrófagos alveolares, un 15% de linfocitos, un 3% de polinucleares neutrófilos y un 1% de eosinófilos (valores de normalidad bien establecidos en no fumadores)13. En los pacientes con alveolitis linfocitaria (definida como aquélla con más de un 15% de linfocitos en el LBA) se realizó un estudio inmunológico mediante la técnica de inmunocitoquímica (inmunoperoxidasa) en muestras criopreservadas. El estudio inmunológico incluyó la valoración de la expresión en los linfocitos, en términos porcentuales, de los antígenos asociados con la población de linfocitos T (CD3, CD4, CD8) y linfocitos citolíticos (CD56). Se estimó asimismo el porcentaje de linfocitos CD3+ y de falta de expresión de CD4 y CD8 (CD3+CD4−CD8− o doble negativas). CD3 identifica al receptor de células T; CD4 se relaciona con la presencia del receptor de clase II del complejo principal de histocompatibilidad (linfocitos inductores); CD8 identifica al receptor de clase I del complejo principal de histocompatibilidad (linfocitos T supresores citotóxicos), y CD56 identifica la molécula de adherencia de células neuronales (linfocitos citolíticos).
Criterios diagnósticosEn todos los pacientes se dispuso de un diagnóstico clínico y/o histológico. Todos los estudios (radiológicos, de biopsia y del fluido de LBA) fueron realizados por especialistas expertos en la materia. Para la interpretación de los hallazgos del LBA se tomaron siempre como base los datos clínicos más relevantes y los hallazgos radiológicos de la TACAR.
El diagnóstico de sarcoidosis se confirmó histológicamente. En un porcentaje de pacientes sin confirmación por biopsia se estableció el diagnóstico de alta probabilidad de sarcoidosis cuando el cuadro clinicorradiológico fue indicativo de la enfermedad y según criterios de celularidad del LBA consensuados1,14–17.
El diagnóstico de FPI se realizó mediante biopsia pulmonar, y en los casos en que no se obtuvo el diagnóstico se aplicaron los criterios diagnósticos mayores y menores, también establecidos por consenso, entre los que se incluyen los parámetros celulares del LBA18.
El diagnóstico de NOC, cuando no pudo realizarse por biopsia pulmonar confirmatoria, se estableció según los criterios de Poletti19,20, es decir, más de un 25% de linfocitos (con un índice CD4/CD8<0,9), combinado con al menos 2 de los siguientes criterios: más de un 20% de macrófagos espumosos, más de un 5% de neutrófilos y/o más de un 2% y menos de un 25% de eosinófilos (neutrofilia y/o eosinofilia moderadas).
Los criterios diagnósticos de las EPID-EC son los mismos que los de las neumopatías intersticiales idiopáticas sin colagenosis asociada16–23: clínica, TACAR, pruebas de función respiratoria y estudio del LBA.
Para el diagnóstico de AAE se exigieron criterios mayores y menores ya estandarizados24. Los criterios mayores son los siguientes: síntomas, evidencia de exposición, linfocitosis CD3+CD8+ en el fluido de LBA, histología indicativa y prueba de provocación bronquial positiva.
En todos los casos se realizó un seguimiento mínimo de 16 meses, período necesario para valorar la evolución clínica y confirmar la inclusión de cada paciente en cada uno de los grupos.
El diagnóstico final se estableció de 2 formas: a) con confirmación histológica, y b) diagnóstico clínico sin confirmación histológica (DSCH), basado en los datos clínicos y analíticos, estudio funcional, TACAR, parámetros celulares e inmunitarios en el LBA y el propio seguimiento de los pacientes a lo largo del tiempo.
Para valorar la utilidad diagnóstica del LBA, en un análisis posterior se seleccionó a los pacientes con sarcoidosis y NOC que tenían confirmación histológica y se calcularon la sensibilidad, la especificidad y los valores predictivos positivo y negativo de los criterios diagnósticos del LBA establecidos por consenso1,16,17,19,20.
Análisis estadísticoEn el análisis descriptivo se calcularon las frecuencias absolutas y relativas (variables cualitativas), y las medias y desviaciones estándar (variables cuantitativas), excepto para el cálculo de la medida de centralización del estudio de expresión de los antígenos CD3, CD4, CD8, CD56 e índice CD4/CD8, en el que se utilizaron la mediana y el rango intercuartílico, ya que la muestra tenía una distribución asimétrica. Se emplearon las pruebas de Kruskal-Wallis y de la U de Mann-Whitney para el estudio comparativo entre grupos. En todos los análisis se consideraron estadísticamente significativo los valores de p<0,05.
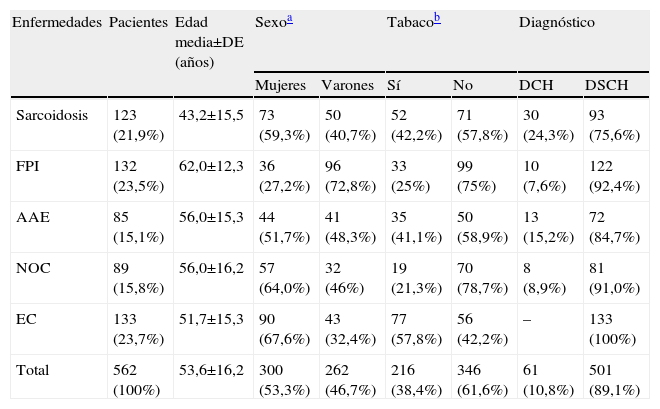
ResultadosPoblación incluida en el estudioSe incluyó a un total de 562 pacientes, que presentaban las siguientes enfermedades: FPI (n=132), sarcoidosis (n=123), NOC (n=89), AAE (n=85) y enfermedad del colágeno (n=133). Las enfermedad del colágeno más frecuentes de nuestro medio fueron: lupus (n=32), artritis reumatoide (n=25), esclerosis sistémica progresiva (n=24), enfermedad mixta del tejido conectivo (n=20), polimiositis/dermatomiositis (n=10) y síndrome de Sjögren primario (n=7). La edad media (±desviación estándar) de la muestra analizada era de 53,4±16,2 años. Se evidenciaron diferencias en la edad y el sexo para las distintas enfermedades (tabla 1): la edad media de presentación fue más temprana en la sarcoidosis y más tardía en la FPI, y se observó un predominio del sexo femenino en la enfermedad del colágeno, NOC y sarcoidosis, mientras que en la FPI predominó el sexo masculino. En todas las enfermedades, excepto en las colagenosis, se observó una mayor frecuencia de pacientes no fumadores, aunque dicha tendencia sólo fue significativa en la FPI y la NOC.
Datos epidemiológicos de la población incluida en el studio
| Enfermedades | Pacientes | Edad media±DE (años) | Sexoa | Tabacob | Diagnóstico | |||
| Mujeres | Varones | Sí | No | DCH | DSCH | |||
| Sarcoidosis | 123 (21,9%) | 43,2±15,5 | 73 (59,3%) | 50 (40,7%) | 52 (42,2%) | 71 (57,8%) | 30 (24,3%) | 93 (75,6%) |
| FPI | 132 (23,5%) | 62,0±12,3 | 36 (27,2%) | 96 (72,8%) | 33 (25%) | 99 (75%) | 10 (7,6%) | 122 (92,4%) |
| AAE | 85 (15,1%) | 56,0±15,3 | 44 (51,7%) | 41 (48,3%) | 35 (41,1%) | 50 (58,9%) | 13 (15,2%) | 72 (84,7%) |
| NOC | 89 (15,8%) | 56,0±16,2 | 57 (64,0%) | 32 (46%) | 19 (21,3%) | 70 (78,7%) | 8 (8,9%) | 81 (91,0%) |
| EC | 133 (23,7%) | 51,7±15,3 | 90 (67,6%) | 43 (32,4%) | 77 (57,8%) | 56 (42,2%) | – | 133 (100%) |
| Total | 562 (100%) | 53,6±16,2 | 300 (53,3%) | 262 (46,7%) | 216 (38,4%) | 346 (61,6%) | 61 (10,8%) | 501 (89,1%) |
AAE: alveolitis alérgica extrínseca; DCH: diagnóstico con confirmación histológica; DSCH: diagnóstico sin confirmación histológica; EC: enfermedades del colágeno; FPI: fibrosis pulmonar idiopática; NOC: neumonía organizada criptogenética.
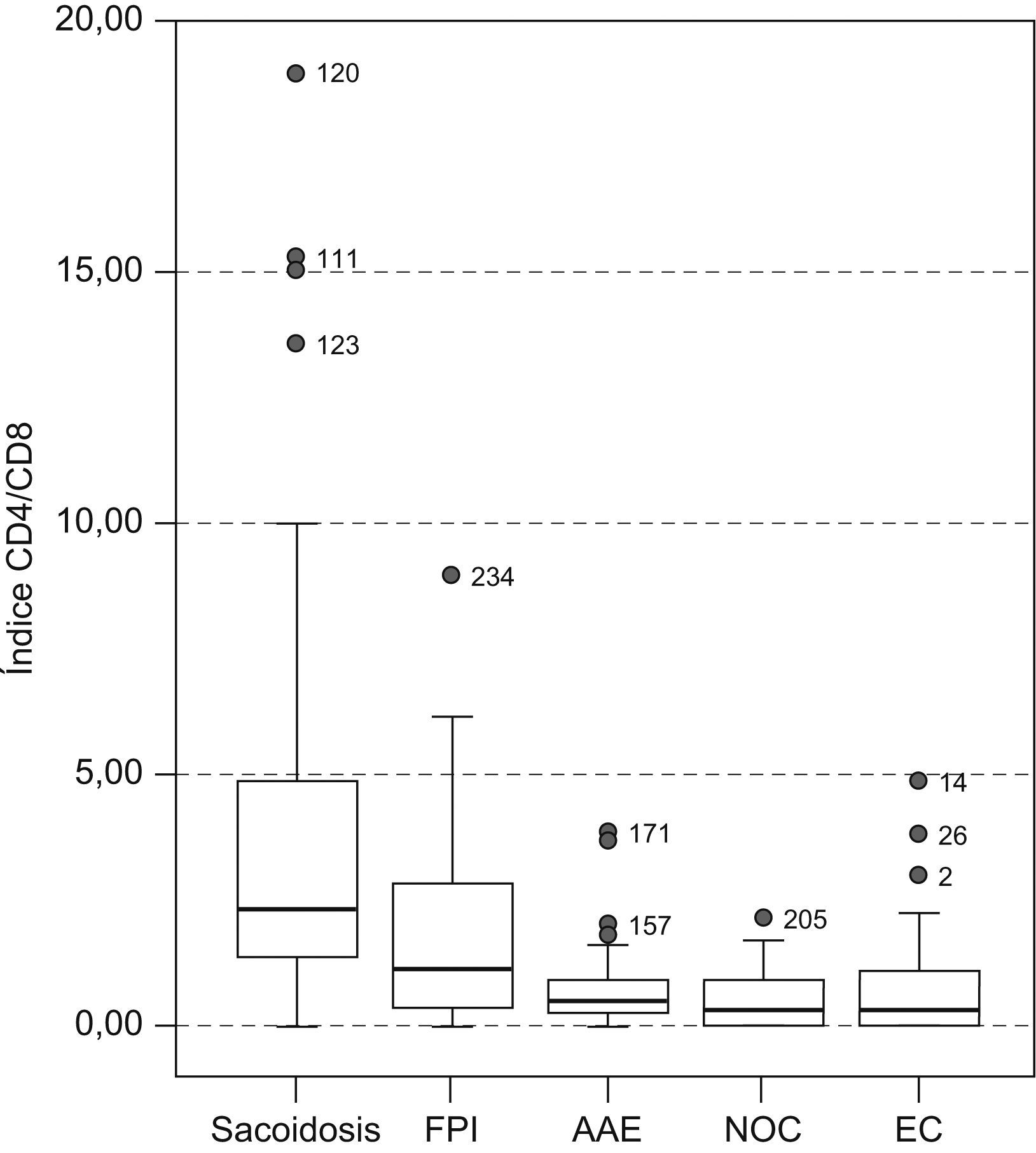
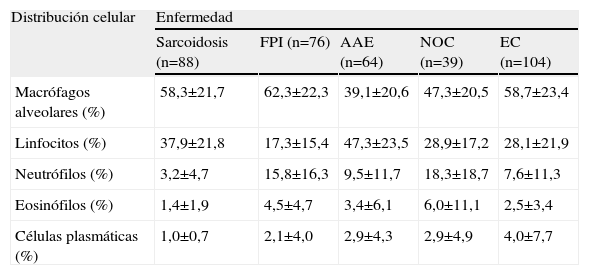
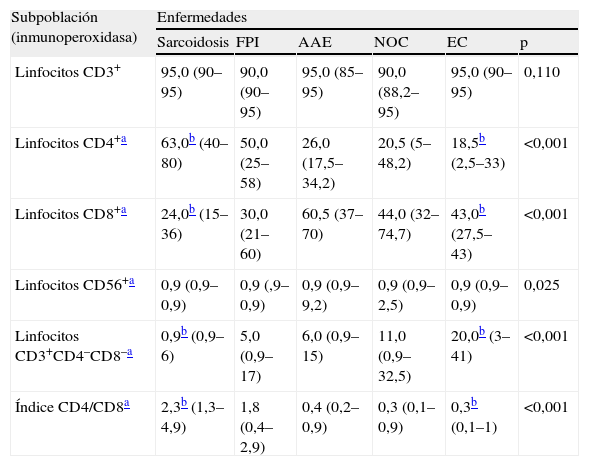
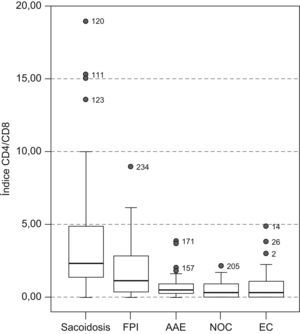
En el estudio de la distribución celular (tabla 2), el patrón de alveolitis linfocitaria aislada se observó casi exclusivamente en la sarcoidosis y la AAE. La alveolitis mixta se presentó en enfermedades como la FPI, NOC y enfermedad del colágeno. Las células plasmáticas se observaron con más frecuencia en las colagenosis (4%), seguidas de la AAE y NOC (2,9%). Al valorar el estudio inmunológico en el LBA se comprobó que el índice CD4/CD8 resultó el parámetro más útil, ya que aumentó claramente la capacidad de discriminación diagnóstica (fig. 1). Así, la sarcoidosis mostró un índice más elevado (mediana: 2,3) que el resto de enfermedades, en las que el índice estaba claramente invertido, con una mediana para la FPI, AAE, NOC y EPID-EC de 1,76; 0,455; 0,35, y 0,33, respectivamente. Esta inversión del índice CD4/CD8 no discriminaba entre estas enfermedades, que mostraban cierto solapamiento. Tan sólo la presencia de células CD3+CD4−CD8− (mediana: 20) demostró ser un hallazgo discriminativo de la enfermedad del colágeno frente al resto de enfermedades. El estudio de la expresión de los antígenos CD3, CD4, CD8 y CD56 en los linfocitos (tabla 3) permitió apreciar diferencias estadísticamente significativas entre todos los grupos estudiados en lo que respecta al porcentaje de células con expresión de CD4+, CD8+, índice CD4/CD8 y CD3+CD4−CD8− (p<0,001). Por otra parte, el recuento de células CD56+ (marcador de células citolíticas) sólo estaba incrementado en un porcentaje de pacientes con AAE.
Estudio de la distribución celular en el fluido del lavado broncoalveolar
| Distribución celular | Enfermedad | ||||
| Sarcoidosis (n=88) | FPI (n=76) | AAE (n=64) | NOC (n=39) | EC (n=104) | |
| Macrófagos alveolares (%) | 58,3±21,7 | 62,3±22,3 | 39,1±20,6 | 47,3±20,5 | 58,7±23,4 |
| Linfocitos (%) | 37,9±21,8 | 17,3±15,4 | 47,3±23,5 | 28,9±17,2 | 28,1±21,9 |
| Neutrófilos (%) | 3,2±4,7 | 15,8±16,3 | 9,5±11,7 | 18,3±18,7 | 7,6±11,3 |
| Eosinófilos (%) | 1,4±1,9 | 4,5±4,7 | 3,4±6,1 | 6,0±11,1 | 2,5±3,4 |
| Células plasmáticas (%) | 1,0±0,7 | 2,1±4,0 | 2,9±4,3 | 2,9±4,9 | 4,0±7,7 |
Datos expresados como media±desviación estándar.
AAE: alveolitis alérgica extrínseca; EC: enfermedades del colágeno; FPI: fibrosis pulmonar idiopática; NOC: neumonía organizada criptogenética.
Representación gráfica del índice CD4/CD8. La barra horizontal negra indica la mediana, y los 2 extremos de la caja, los percentiles 25 y 75. Las barras verticales representan la distribución de la muestra. Los círculos muestran valores extremos. AAE: alveolitis alérgica extrínseca; EC: enfermedades del colágeno; FPI: fibrosis pulmonar idiopática; NOC: neumonía organizada criptogenética.
Distribución de las subpoblaciones linfocitarias en el fluido del lavado broncoalveolar en cada una de las enfermedades
| Subpoblación (inmunoperoxidasa) | Enfermedades | |||||
| Sarcoidosis | FPI | AAE | NOC | EC | p | |
| Linfocitos CD3+ | 95,0 (90–95) | 90,0 (90–95) | 95,0 (85–95) | 90,0 (88,2–95) | 95,0 (90–95) | 0,110 |
| Linfocitos CD4+a | 63,0b (40–80) | 50,0 (25–58) | 26,0 (17,5–34,2) | 20,5 (5–48,2) | 18,5b (2,5–33) | <0,001 |
| Linfocitos CD8+a | 24,0b (15–36) | 30,0 (21–60) | 60,5 (37–70) | 44,0 (32–74,7) | 43,0b (27,5–43) | <0,001 |
| Linfocitos CD56+a | 0,9 (0,9–0,9) | 0,9 (,9–0,9) | 0,9 (0,9–9,2) | 0,9 (0,9–2,5) | 0,9 (0,9–0,9) | 0,025 |
| Linfocitos CD3+CD4–CD8–a | 0,9b (0,9–6) | 5,0 (0,9–17) | 6,0 (0,9–15) | 11,0 (0,9–32,5) | 20,0b (3–41) | <0,001 |
| Índice CD4/CD8a | 2,3b (1,3–4,9) | 1,8 (0,4–2,9) | 0,4 (0,2–0,9) | 0,3 (0,1–0,9) | 0,3b (0,1–1) | <0,001 |
Valores expresados como mediana (rango intercuartílico 25–75).
AAE: alveolitis alérgica extrínseca; EC: enfermedades del colágeno; FPI: fibrosis pulmonar idiopática; NOC: neumonía organizada criptogenética.
Al comparar las distintas enfermedades se observó una diferencia significativa (p<0,05; prueba de la U de Mann-Whitney) en las distintas subpoblaciones linfocitarias entre colagenosis y sarcoidosis, enfermedades en las que estos parámetros presentaron valores extremos.
Utilidad diagnóstica de los criterios del lavado boncoalveolar en pacientes con confirmación histológicaEn los casos con confirmación histológica se calcularon la sensibilidad, la especificidad y los valores predictivos positivo y negativo de los criterios diagnósticos de la NOC y de la sarcoidosis, enfermedades en que se aceptan criterios clínicos, radiológicos y de LBA en el diagnóstico cuando no se dispone de confirmación histológica.
Cuando se analizaron los casos de NOC (n=8), la sensibilidad, la especificidad y los valores predictivos positivo y negativo fueron del 87,5, el 94,3, el 70 y el 98%, respectivamente. En el caso de la sarcoidosis (n=30), dichos valores fueron del 40, el 96,8, el 92,3 y el 62,5%, respectivamente (tabla 4).
Valoración de la utilidad diagnóstica de los criterios basados exclusivamente en parámetros celulares e inmunitarios del lavado broncoalveolar, en pacientes con neumonía organizada criptogenética (NOC) o sarcoidosis confirmadas histológicamente
| NOC | Sarcoidosis | |
| Sensibilidad (%) | 87,5 | 40 |
| Especificidad (%) | 94,3 | 96,8 |
| Valor predictivo positivo (%) | 70 | 92,3 |
| Valor predictivo negativo (%) | 98 | 62,5 |
El diagnóstico de la EPID continúa siendo un problema clínico. La valoración de la clínica, los datos de exposición y del uso de fármacos, la afectación sistémica y la identificación de patrones radiológicos, sobre todo en la TACAR, aportan una información esencial que permite establecer en la mayor parte de los casos un diagnóstico de sospecha. La BTB tan sólo tiene una clara utilidad diagnóstica en la enfermedad granulomatosa12,15. En lo que respecta al LBA, su utilidad en la orientación diagnóstica de determinados pacientes con EPID ha sido objeto de numerosos trabajos19,24–30.
En nuestro estudio la confirmación histológica se consiguió en sólo el 11% de los casos (un 14% si excluimos a los pacientes con colagenosis, ya que habitualmente no se realiza biopsia pulmonar). En otras series la confirmación histológica varía, dependiendo de las características del centro, entre el 34% del estudio de Welker et al27 y el 7,5% del trabajo de Johnston et al7. Los principales condicionantes que determinan esta actitud diagnóstica son diversos: las comorbilidades del paciente, la propia morbimortalidad asociada al proceso diagnóstico y los medios disponibles en cada centro. Además, en determinados pacientes es posible que la biopsia pulmonar confirmatoria no modifique los planes de tratamiento.
En un porcentaje importante de casos, el diagnóstico no puede establecerse después de realizar la BTB y la biopsia quirúrgica no es posible o el paciente no la acepta. En estos casos, los datos clínicos, radiológicos y funcionales y los parámetros del LBA realizado durante la fibrobroncoscopia son los únicos datos disponibles para realizar un diagnóstico de sospecha.
Welker et al27 realizaron un estudio observacional y prospectivo con 1.748 pacientes para determinar el valor predictivo del BAL en las EPID. Mediante la fórmula de Bayes calcularon la probabilidad diagnóstica de una determinada EPID antes y después del LBA. De este modo demostraron que el LBA por sí mismo proporciona información diagnóstica sustancial en un número determinado de enfermedades (sarcoidosis, FPI y AAE).
En nuestra serie, el 92,5% de los casos de FPI no se confirmó histológicamente y el diagnóstico se realizó mediante los criterios de consenso18. En los LBA analizados fue predominante la alveolitis mixta, con predominio de linfocitos, neutrófilos y eosinófilos, patrón similar al de otros procesos fibrosantes (AAE, NOC, enfermedad del colágeno), aunque, a diferencia de éstos, el índice CD4/CD8 se mostró más conservado. Actualmente el valor del LBA en la FPI reside en llegar a un diagnóstico de exclusión de otros procesos, como se establece en los distintos consensos internacionales1,18. En nuestro estudio tanto el cumplimiento de dichos criterios como el seguimiento a largo plazo afianzaron el diagnóstico.
La rentabilidad de la BTB en el diagnóstico de la sarcoidosis es variable según el estadio radiológico y puede ser menor en los casos con afectación predominantemente adenopática que en las formas con afectación intersticial1,15,31,32. En estos casos el índice CD4/CD8 resulta útil en el diagnóstico junto a otras técnicas (BTB o punción-biopsia de adenopatías mediastínicas), al evitar la realización de pruebas más cruentas como la mediastinoscopia. En este sentido cabe destacar los resultados de 4 estudios que concluyen que, en pacientes con un cuadro clínico indicativo de la enfermedad, un índice CD4/CD8 elevado (>3,5) es diagnóstico de sarcoidosis, pudiéndose prescindir de la biopsia quirúrgica16,17,26,27,29.
De los 123 casos de nuestra serie diagnosticados de sarcoidosis, sólo 30 tuvieron confirmación histológica y en 93 el diagnóstico se realizó mediante la clínica, la TACAR y el LBA. En el subgrupo con confirmación histológica, el índice CD4/CD8 igual o mayor que 3,5 tiene una sensibilidad, especificidad, valores predictivos positivo y negativo del 40, el 96,8, el 92,3 y el 62,5%, respectivamente. Estos valores son similares a los descritos por otros autores como Costabel16 y Winterbauer et al17, cuando lo que se busca es una variable con especificidad elevada que ayude en el diagnóstico. No obstante, debe tenerse en cuenta que la celularidad en esta enfermedad es diferente según los estadios radiológicos, como ha analizado nuestro grupo en un trabajo reciente28 que confirma lo descrito por otros autores. En efecto, en estadios iniciales, con un predominio de adenopatías hiliares o mediastínicas y sin afectación visible del intersticio en la TACAR, el LBA puede mostrar una intensa alveolitis linfocitaria y un incremento muy significativo del índice CD4/CD8 en comparación con estadios más evolucionados, en los cuales el índice puede incluso normalizarse o disminuir.
El estudio de Costabel16, realizado en 117 pacientes consecutivos con confirmación histológica, mostró una sensibilidad y una especificidad del 52 y el 94%, respectivamente, para el mismo punto de corte del índice CD4/CD8. Winterbauer et al17, en un estudio con 27 pacientes, describieron una sensibilidad y especificidad del 59 y el 96% para un índice CD4/CD8 igual o mayor que 4,0, y Thomeer29 halló una sensibilidad y especificidad del 55 y el 94% con un índice CD4/CD8 mayor o igual que 4,0 en un grupo de 42 pacientes con confirmación histológica. Desde el punto de vista clínico, resulta más útil en el diagnóstico que este punto de corte tenga alta especificidad. En nuestro estudio, como ya se mencionado, la especificidad es alta para un punto de corte de 3,5, obteniéndose un valor algo superior a lo publicado.
La presentación clínica en algunas formas de la sarcoidosis es similar a la de las enfermedades del colágeno. Establecer un rasgo distintivo entre estas 2 entidades nos parece interesante, ya que ambas suelen presentarse con clínica insidiosa y manifestaciones sistémicas acompañantes. El estudio sistemático del LBA en estas 2 enfermedades presenta diferencias claramente significativas: en las enfermedades del colágeno se observan una clara inversión del índice CD4/CD8 y alteraciones en la expresión de ambos antígenos, con un porcentaje alto de células CD3+CD4−CD8−. Este inmunofenotipo es común en las enfermedades del colágeno más frecuentes, como el lupus eritematoso sistémico, la esclerodermia y el síndrome de Sjögren, cuando se presentan con evidencia radiológica de afectación intersticial, y tiene además gran interés para definir la participación precoz del intersticio pulmonar independientemente de la ausencia de hallazgos significativos en la TACAR y en las pruebas de función respiratoria. Por otro lado, estas enfermedades, sobre todo la esclerosis sistémica progresiva, en fases más avanzadas muestran una clínica, una radiología, un defecto funcional y una histología muy semejantes a los de la FPI. Sin embargo, el LBA ofrece rasgos distintivos al mostrar un índice claramente disminuido23,33, con mayor descenso de linfocitos CD4+ con respecto a la población de CD8+. El papel de la población de linfocitos CD8+ en esta enfermedad (con función supresora citotóxica) como productores de citocinas del tipo linfocitos T helper tipo 2 es objeto de estudios en los últimos años25,30,33.
La NOC es una EPID que, desde el punto de vista anatomopatológico, se caracteriza por la presencia de neumonía organizada, con un curso subagudo de tos y disnea progresiva, y radiológicamente muestra imágenes de condensación uni o bilaterales, en ocasiones migratorias y recidivantes. Aunque el diagnóstico histológico es el ideal, en ocasiones no es posible y, dadas las características evolutivas de la enfermedad, pocas veces se opta por la biopsia pulmonar confirmatoria. Por este motivo, el LBA es una técnica de apoyo al diagnóstico que resulta útil en la valoración de estos pacientes, en los que evidencia una linfocitosis marcada con un cociente de linfocitos T CD4/CD8 disminuido. Utilizando una serie de criterios arbitrarios según los parámetros citológicos e inmunitarios del LBA, Poletti et al19 analizaron a 35 pacientes con NOC y valoraron la utilidad del LBA y de la BTB en aquéllos con hallazgos clinicorradiológicos indicativos de la enfermedad. En su estudio, la probabilidad de diagnóstico correcto con la suma de LBA y BTB fue del 62% y el valor predictivo positivo de la BTB fue del 94%. Para estos autores, la presencia de celularidad mixta con predomino linfocitario, inversión del índice CD4/CD8 y macrófagos con citoplasma de aspecto espumoso permite un diagnóstico de alta probabilidad de NOC sin que llegue a ser precisa la biopsia quirúrgica confirmatoria. Al estudiar la utilidad diagnóstica de los parámetros celulares del LBA se demostraron una sensibilidad, especificidad, valores predictivos positivo y negativo del 63, el 57, el 85 y el 29%, respectivamente.
En nuestro estudio, en el subgrupo de pacientes con NOC confirmada por histología, los criterios de Poletti et al19 tienen una sensibilidad, especificidad, valores predictivos positivo y negativo del 87,5, el 94,3, el 70 y el 98%, respectivamente. A partir de los resultados obtenidos podemos concluir que la aplicación de los criterios de Poletti tiene en nuestra serie una sensibilidad, una especificidad y un valor predictivo negativo adecuados, aunque, a diferencia de lo observado en dicho trabajo, nosotros encontramos dichos criterios más específicos y con un mayor valor predictivo negativo. El cumplimiento de estos criterios junto a los datos clínicos y los hallazgos de la TACAR permite establecer una alta sospecha diagnóstica de NOC. Dada la frecuencia de esta enfermedad, probablemente infraestimada, deberían realizarse más trabajos en este sentido para poder verificar dichos resultados.
Por último, en el caso de la AAE, el diagnóstico se basa fundamentalmente en criterios clínicos, y el LBA resulta útil cuando estos criterios no están presentes en su totalidad (sobre todo cuando no hay respuesta clínica tras la separación del antígeno) o la TACAR hace pensar en otro proceso que debe descartarse. De forma esquemática, en la AAE el LBA permite identificar alteraciones en todos los pacientes, de tal forma que un LBA normal prácticamente excluye esta enfermedad (posee un alto valor predictivo negativo). Aunque la celularidad es cambiante según la presentación y evolución de la enfermedad, habitualmente el LBA presenta un patrón de celularidad mixta con un claro predominio linfocitario y una inversión del cociente CD4/CD819.
En definitiva, al igual que en otros estudios, constatamos una escasa frecuencia de diagnósticos confirmados histológicamente. En esta situación, los parámetros del LBA, si se interpretan de forma adecuada tomando como base los datos clínicos y de la TACAR, ayudan a establecer una sospecha diagnóstica. Aunque el estudio de la distribución celular en el fluido del LBA ha mostrado cierto solapamiento entre las distintas entidades, el estudio inmunológico permite estrechar el diagnóstico diferencial. En la sarcoidosis el índice CD4/CD8 se muestra como un parámetro útil, que brinda un claro apoyo al diagnóstico. En la NOC y AAE el estudio celular e inmunitario del LBA tiene gran utilidad al evidenciar una inversión del índice CD4/CD8 con aumento de linfocitos CD56+. En la FPI y EPID-EC, 2 enfermedades similares en cuanto a presentación clínica y radiológica, el LBA muestra rasgos distintivos en la distribución celular y patrón inmunológico, con presencia en esta última de una fuerte inversión del índice CD4/CD8, con linfocitos CD3+CD4−CD8−.
Es necesario realizar más estudios del fluido del LBA en las EPID para confirmar estos hallazgos y describir otros marcadores citológicos, de expresión inmunitaria o de medida de citocinas o componentes solubles más específicos que contribuyan a mejorar su potencial papel diagnóstico como técnica complementaria junto a las técnicas de biopsia.