La American Thoracic Society (ATS), en un documento de posicionamiento publicado en 1995, reconoció oficialmente que la agudización de la enfermedad pulmonar obstructiva crónica (EPOC) era difícil de definir, y su patogenia muy poco conocida. Por aquel entonces, el documento ya planteaba la necesidad de disponer de una definición estandarizada, que fuese universalmente aceptada y útil para clínicos, investigadores y otros proveedores de la salud1. Cinco años más tarde, respondiendo a aquel desafío, un grupo de expertos liderados por el Dr. Rodríguez-Roisin2, definió la agudización como un «empeoramiento mantenido de la condición clínica del paciente con EPOC, que va más allá de las variaciones diarias de síntomas, que es agudo en su comienzo y necesita un cambio en la medicación habitual». Desde aquella propuesta inicial han trascurrido 2 décadas y se ha profundizado sustancialmente en el conocimiento de la EPOC, que ahora mismo se entiende como un síndrome complejo y heterogéneo que exige una aproximación cada vez más personalizada3. Sin embargo, el concepto, el diagnóstico y el manejo de la agudización apenas han cambiado. Seguimos empleando de forma indiscriminada broncodilatadores de acción corta, esteroides sistémicos y antibióticos con pobres resultados. Los fracasos terapéuticos son elevados, la tasa de reingresos a los 30 días se sitúa en el 20%, la mortalidad intrahospitalaria es del 5%, aumentando hasta el 11% a los 3 meses. Una proporción no despreciable de pacientes presentan agudizaciones de repetición, no contamos con un buen sistema de clasificación, ni con modelos predictivos de riesgo de uso generalizado, no están estandarizados los criterios de ingreso y los ensayos clínicos todavía definen la agudización o su gravedad en función del uso de recursos4–7. Como consecuencia, los resultados científicos son muy heterogéneos y el avance científico inconsistente.
El origen de esta confusión lo encontramos en el constructo de la propia definición, que no identifica el mecanismo biológico subyacente, no reconoce la heterogeneidad del cuadro y, al estar fundamentado en los síntomas, se muestra muy poco específico. Otras muchas enfermedades concomitantes (comorbilidades) también pueden producir ese mismo empeoramiento de síntomas en el paciente con EPOC. La insuficiencia cardíaca, las arritmias, la cardiopatía isquémica, la ansiedad, la embolia pulmonar o las neumonías son enfermedades que aparecen con frecuencia en la EPOC y que cursan con un incremento de síntomas respiratorios. Sin embargo, y por consenso, no se consideran agudizaciones de EPOC. Para poder descartar estas otras enfermedades es necesario realizar un minucioso diagnóstico diferencial, que no siempre resulta sencillo. La neumonía, por ejemplo, es una entidad que se diferencia clásicamente de la agudización por la presencia de infiltrados en el parénquima pulmonar. Sin embargo, la separación entre ambas entidades es muy sutil. Hasta un tercio de los pacientes con agudización de EPOC presentan infiltrados en la tomografía computarizada que no son visibles en la radiografía simple de tórax8. Estos pacientes, son clasificados y juzgados como agudizaciones de EPOC, cuando en realidad son neumonías. ¿Son entidades diferentes o fases de una misma enfermedad? El microbioma pulmonar es prácticamente idéntico, los agentes causales muy parecidos, la expresión clínica, la repercusión pronóstica y el tratamiento, similares8,9. Algo parecido sucede con la insuficiencia cardíaca, la cardiopatía isquémica o la embolia pulmonar, que con frecuencia se solapan con la propia agudización10–12. La consecuencia directa de todo este entramado es la confusión y la heterogeneidad de los resultados clínicos, el escaso avance en el conocimiento de los mecanismos que subyacen y la imposibilidad de acceder a un tratamiento personalizado. Es urgente, por tanto, un cambio de estrategia. Necesitamos una nueva definición, que aún a riesgo de perder algo de sensibilidad, se ampare en criterios más objetivos y específicos. Una definición qué, además, contemple la heterogeneidad de la presentación, ayude a identificar los endotipos biológicos y sirva de lanzadera para la medicina de precisión.
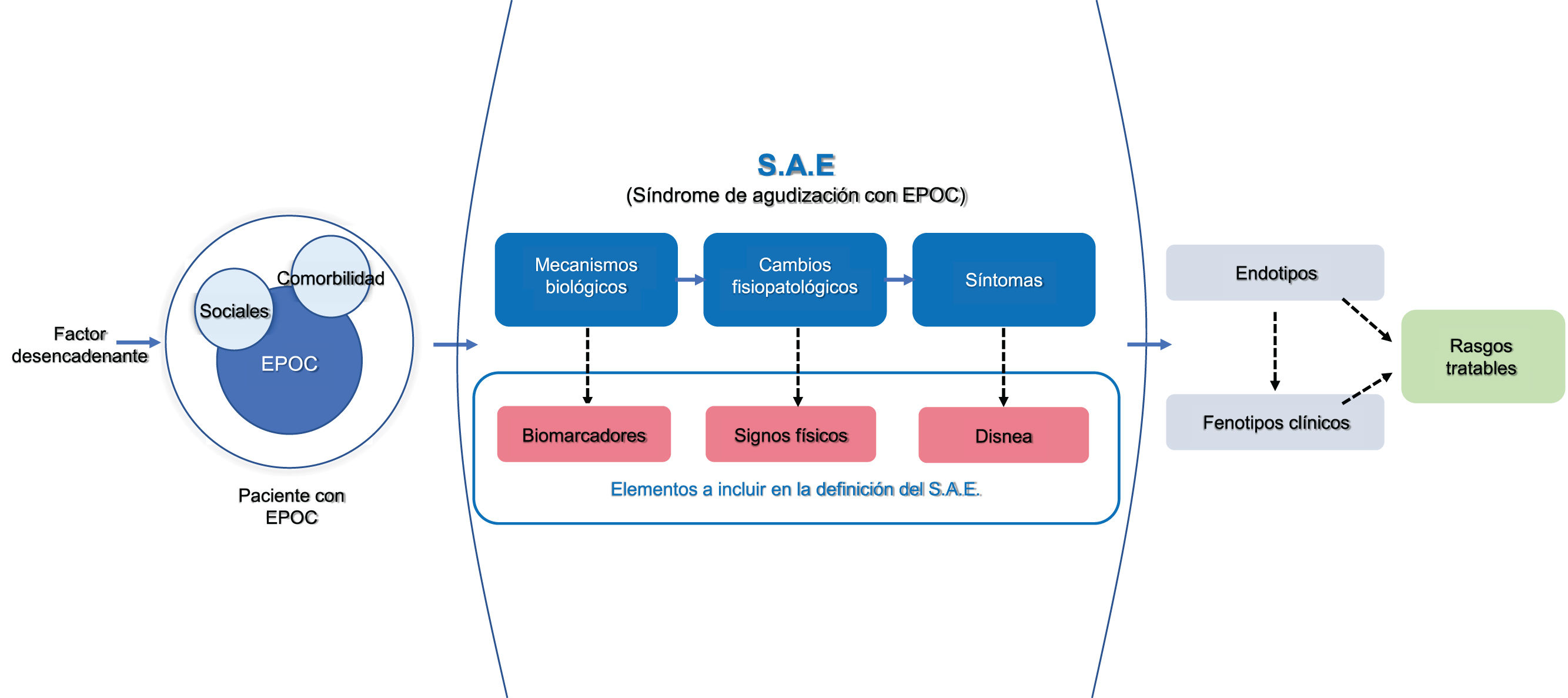
Un buen modelo de referencia lo encontramos en la enfermedad coronaria aguda, cuya definición actual se basa en 3 parámetros esenciales: 1) considerar un enfoque sindrómico (síndrome coronario agudo); 2) con un síntoma guía (dolor torácico); y 3) unos parámetros objetivos con sustrato biológico (alteraciones electrocardiográficas y biomarcadores)13. Plantear un enfoque sindrómico, dentro de lo que podríamos denominar el síndrome de agudización en la EPOC (SAE), permitiría englobar a todas aquellas otras enfermedades que pueden producir síntomas similares y cuya diferenciación hemos visto que resulta muy compleja. La ventaja de esta aproximación es la de considerar endotipos o fenotipos clínicos diferenciados y/o combinados, que potencialmente puedan tener distintos desenlaces y aproximaciones terapéuticas específicas (fig. 1).
El esquema muestra el concepto del SAE. La presencia de un factor desencadenante sobre un paciente con EPOC (con sus condicionantes sociales y su comorbilidad) provoca la aparición de un síndrome de un SAE, donde el empeoramiento de la disnea es el exponente final de diversos mecanismos biológicos y fisiopatológicos. Consecuencia de la heterogeneidad del cuadro se pueden expresar distintos endotipos biológicos y varias presentaciones fenotípicas susceptibles de recibir tratamientos específicos.
El agravamiento de la disnea emerge como el síntoma guía del SAE. La limitación espiratoria al flujo aéreo y la hiperinsuflación dinámica se han invocado como los mecanismos fisiopatológicos principales, aunque las alteraciones cardiovasculares, musculares o psicosociales también pueden participar14. La frecuencia respiratoria, la cardíaca y/o el intercambio de gases también se modifican como expresión objetiva de los cambios fisiopatológicos subyacentes, por lo que su análisis puede ser de ayuda.
Finalmente, necesitamos incorporar biomarcadores vinculados a la alteración biológica subyacente, que ayuden a reconocer la agudización, categorizarla o guiar su tratamiento. Se han realizado diversos intentos de buscar el biomarcador de referencia para el diagnóstico, con escasos resultados15. Sin embargo, el empleo simultáneo de distintos biomarcadores puede abrir nuevos caminos. En un análisis multinivel, Noell et al.16, encontraron que el mejor panel de biomarcadores para definir agudización fue la combinación de neutrófilos circulantes, proteína C-reactiva y disnea con un área bajo la curva del 0,97. La eosinofilia periférica, la procalcitonina, el dímero D o biomarcadores cardiovasculares como la troponina o la fracción N-terminal del péptido natriurético neural (NT-pro-BNP), son algunos ejemplos de otros biomarcadores que pueden ser de gran ayuda para identificar rasgos que permitan personalizar el tratamiento17, aunque ninguno de ellos ha demostrado ser suficientemente específico de la enfermedad. Por el contrario, algunos mediadores de origen alveolar, como la proteína surfactante D, podrían ser de utilidad durante la agudización de la EPOC18.
En definitiva, un cuarto de siglo después de la recomendación de la ATS, necesitamos cambiar el paradigma y redefinir la agudización incorporando elementos que ayuden a mejorar la especificidad del cuadro, sin perder sensibilidad. La aproximación sindrómica puede cubrir mejor la heterogeneidad del cuadro. La disnea emerge como el síntoma guía. No obstante, dado su carácter subjetivo sería deseable incluir algunos parámetros objetivos vinculados a la fisiopatología del episodio y también biomarcadores que ayudasen a perfilar el endotipo subyacente. Únicamente si somos capaces de mejorar la especificidad del cuadro, podremos profundizar en el conocimiento de sus mecanismos biológicos, personalizar los tratamientos y aminorar en última instancia las consecuencias negativas que generan estos episodios.
Conflicto de interesesJuan José Soler-Cataluña ha recibido honorarios como ponente de AstraZeneca, Boehringer Ingelheim, Bial, Ferrer, Laboratorio Esteve, Menarini, Mundipharma, Novartis, Rovi y TEVA; honorarios de consultoría de AirLiquide, AstraZeneca, Boehringer Ingelheim, Chiesi, Ferrer, GlaxoSmithKline, Laboratorios Esteve, Mundipharma y Novartis, y ayudas para la investigación de GlaxoSmithKline, Chesi y Boehringer Ingelheim.
Cristina Miralles Saavedra declara no tener ningún conflicto de intereses.