Los fármacos nebulizados son de gran utilidad en el tratamiento de las agudizaciones de la EPOC. El gas propulsor más utilizado es aire comprimido, que suele combinarse con oxigenoterapia por vía nasal en pacientes con insuficiencia respiratoria. Este método pretende evitar los riesgos inherentes a la inhalación de fracciones inspiratorias de oxígeno (FIO2) elevadas.
ObjetivoAnalizar experimentalmente las FIO2 reales obtenidas mediante el dispositivo mencionado.
MétodoLos voluntarios respiraron con diversos patrones (basal, jadeo y respiración profunda) por vías nasal u oral y a flujos de oxígeno de 0–4l/min. Seguidamente, repitieron los patrones basal y de jadeo con nebulización de suero salino impulsada por aire comprimido (8l/min) y flujos de oxígeno nasales de 0,2,4,6 y 8l/min. La FIO2 se determinó en regiones retronasal (RN) y retrofaríngea (RF).
ResultadosDurante la respiración sin nebulización simultánea y O2 a 4l/min, la FIO2 alcanzó valores medios de 0,42–0,71 (RN) y 0,29–0,38 (RF) para los 3 patrones analizados. Durante la nebulización con salino y en respiración tranquila, los valores medios de FIO2 fueron de 0,39 (RN) y 0,27 (RF) para O2 a 2l/min, 0,47 (RN) y 0,34 (RF) para 4l/min, 0,58 (RN) y 0,38 (RF) para 6l/min y 0,68 (RN) y 0,50 (RF) para 8l/min. Cifras similares se alcanzaron con patrón de jadeo.
ConclusiónLas FIO2 obtenidas mediante el sistema estándar de nebulización con aire comprimido y oxigenoterapia simultánea son relativamente elevadas y pudieran suponer un riesgo para los pacientes con EPOC exacerbada.
Nebulised drugs are very useful in COPD exacerbations. The most frequently used propellant is compressed air, which is commonly administered together with nasal oxygen in those patients with respiratory failure. The purpose of this approach is to avoid the risks inherent in breathing high inspiratory oxygen fractions (FIO2).
AimTo analyze the actual FIO2 obtained with such a common method under experimental conditions.
MethodsVolunteers breathed using different patterns (quiet breathing, panting and deep breathing), through either the nose or the mouth, with oxygen flows of 0 vs. 4l/min. Then, they repeated quiet breathing and panting patterns, with nebulization of saline propelled by compressed air (8l/min) and oxygen flows of 0, 2, 4, 6 and 8l/min. The FIO2 was simultaneously determined both in retronasal (RN) and retropharyngeal (RF) areas.
ResultsDuring breathing without simultaneous nebulization and oxygen flow of 4l/min, FIO2 reached mean values of 0.42–0.71 (RN) and 0.29–0.38 (RF) for the three ventilatory patterns analyzed. With nebulisations during quiet breathing, mean FIO2 values were 0.39 (RN) and 0.27 (RF) for 2l/min O2 flow, 0.47 (RN), 0.34 (RF) for 4l/min, 0.58 (RN), 0.38 (RF) for 6l/min, and 0.68 (RN) and 0.50 (RF) for 8l/min. Similar results were obtained with the panting pattern.
ConclusionThe FIO2 obtained using the conventional nebulization system (propulsion with compressed air and simultaneous nasal oxygen therapy) are relatively high, and therefore, might involve risks for COPD patients during exacerbations.
Los fármacos broncodilatadores constituyen la base del tratamiento farmacológico en diversas enfermedades respiratorias obstructivas, como el asma y la EPOC1,2. Su administración habitual se realiza mediante diversos dispositivos de inhalación. Sin embargo, y sobre todo en las exacerbaciones de la EPOC, se utilizan con frecuencia las nebulizaciones1,3–8. Habitualmente estas últimas se realizan mediante propulsión de aire comprimido a través de unas cazoletas cerradas y con difusor que actúan de depósito del broncodilatador. La mezcla resultante llega al paciente por una mascarilla convencional nasobucal o a través de una boquilla. Dado que la mayoría de enfermos agudizados precisan además de un suplemento de oxígeno durante el procedimiento, este se realiza habitualmente a través de lentillas/gafas nasales cuyo flujo debiera regularse en función, cuanto menos, de la saturación en sangre de dicho gas (oxímetría). El uso del oxígeno como propulsor de la nebulización se ha desaconsejado por implicar elevadas fraciones inspiratorias (FIO2) que podrían llegar a ser peligrosas para el paciente6,9. Por otra parte, la alternativa de colocar un sistema Venturi en una posición posterior a la cazoleta de nebulización no permite asegurar una adecuada propulsión del fármaco. Finalmente, la disponibilidad de diferentes mezclas gaseosas para poder individualizar el tratamiento resulta poco eficiente, sobre todo en el medio hospitalario actual donde los gases proceden en general de reservorios centralizados, con sistemas de distribución a los puntos de tratamiento.
Sin embargo, la observación clínica repetida de que pacientes que llegan a urgencias con agudización de su EPOC, pero estado ventilatorio conservado, se deterioran dramáticamente tras las nebulizaciones (aparición o incremento de la hipercapnia y acidosis respiratoria) (observaciones no publicadas), nos hizo sospechar que se podría estar produciendo una inducción de hipoventilación por inhalación de FIO2 relativamente alta. Se sabe desde hace décadas que existe un subgrupo variable de pacientes que hipoventilan y retienen CO2 ante la inhalación de concentraciones relativamente altas de oxígeno. La causa fundamental de dicha hipoventilación parece ser la depresión en la respuesta central aunque también se producen cambios deletéreos en el espacio muerto alveolar que han sido atribuidos a la eventual broncodilatación debida a la propia hipercapnia10. Sin embargo, son escasos los estudios que han evaluado la incidencia de la depresión respiratoria inducida por la combinación de nebulizaciones farmacológicas y oxigenoterapia11–15. En el mismo sentido, no hemos hallado ningún trabajo que analice experimentalmente la concentración de oxígeno alcanzada con el dispositivo estándar utilizado para suministrar dicha combinación. Por tanto, el presente estudio fue diseñado para evaluar cuáles son las FIO2 reales que se suministran a los sujetos durante el procedimiento estándar de nebulización combinado con oxigenoterapia. Dado que existe un riesgo no desdeñable para los pacientes, el estudio se ha realizado en voluntarios sanos.
MétodosLos voluntarios eran sujetos varones, de entre 45–55 años, no fumadores y sin antecedentes respiratorios o cardiovasculares. El estudio fue aprobado por el comité de ética de nuestra institución y los voluntarios firmaron el correspondiente consentimiento informado.
ProcedimientoTras colocación de 2 sondas, una retronasal y la otra retrofaríngea, para toma de muestras de aire inspirado, se procedió a analizar la FIO2 a diversos flujos de aire y patrones ventilatorios (tabla 1). En concreto se realizaron maniobras con 3 patrones diferentes (respiración tranquila, alta frecuencia con bajo volumen corriente o panting y baja frecuencia con volumen corriente elevado), con respiración nasal y con respiración bucal, y tanto respirando aire ambiente como a un flujo nasal de oxígeno suplementario de 4l/min. Seguidamente se procedió a añadir un flujo de aire continuo por la cazoleta de nebulización (8l/min) rellenada con suero salino isotónico. En esta ocasión, los voluntarios respiraron siempre por la boca tanto en respiración tranquila como en ventilación de jadeo y se procedió a suplementar con flujos progresivos de oxígeno por vía nasal (0, 2, 4, 6 y 8l/min). En total se analizaron 22 situaciones ventilatorias diferentes y se recogieron un total de 7 registros válidos en cada situación.
Situaciones ventilatorias analizadas en el estudio
| 1. Respiración tranquila y nasal, aire ambiente. Sin nebulización |
| 2. Respiración tranquila y bucal, aire ambiente. Sin nebulización |
| 3. Respiración tranquila y nasal, O2 cánulas nasales 4l/min. Sin nebulización |
| 4. Respiración tranquila y bucal, O2 cánulas nasales 4l/min. Sin nebulización |
| 5. Respiración rápida y superficial, nasal, aire ambiente. Sin nebulización |
| 6. Respiración rápida y superficial, bucal, aire ambiente. Sin nebulización |
| 7. Respiración rápida y superficial, nasal, O2 cánulas nasales 4l/min. Sin nebulización |
| 8. Respiración rápida y superficial, bucal, O2 cánulas nasales 4l/min. Sin nebulización |
| 9. Respiración lenta y profunda, nasal, aire ambiente. Sin nebulización |
| 10. Respiración lenta y profunda, bucal, aire ambiente. Sin nebulización |
| 11. Respiración lenta y profunda, nasal, O2 cánulas nasales 4l/min. Sin nebulización |
| 12. Respiración lenta y profunda, bucal, O2 cánulas nasales 4l/min. Sin nebulización |
| 13. Respiración tranquila nasobucal libre, con nebulización de suero salino (8l/min), aire ambiente |
| 14. Respiración tranquila nasobucal libre, con nebulización de suero salino (8l/min), O2 cánulas 2l/min |
| 15. Respiración tranquila nasobucal libre, con nebulización de suero salino (8l/min), O2 cánulas 4l/min |
| 16. Respiración tranquila nasobucal libre, con nebulización de suero salino (8l/min), O2 cánulas 6l/min |
| 17. Respiración tranquila nasobucal libre, con nebulización de suero salino (8l/min), O2 cánulas 8l/min |
| 18. Respiración rápida y superficial, nasobucal libre, con nebulización de suero salino (8l/min), aire ambiente |
| 19. Respiración rápida y superficial, nasobucal libre, con nebulización de suero salino (8l/min), O2 cánulas 2l/min |
| 20. Respiración rápida y superficial, nasobucal libre, con nebulización de suero salino (8l/min), O2 cánulas 4l/min |
| 21. Respiración rápida y superficial, nasobucal libre, con nebulización de suero salino (8l/min), O2 cánulas 6l/min |
| 22. Respiración rápida y superficial, nasobucal libre, con nebulización de suero salino (8l/min), O2 cánulas 8l/min |
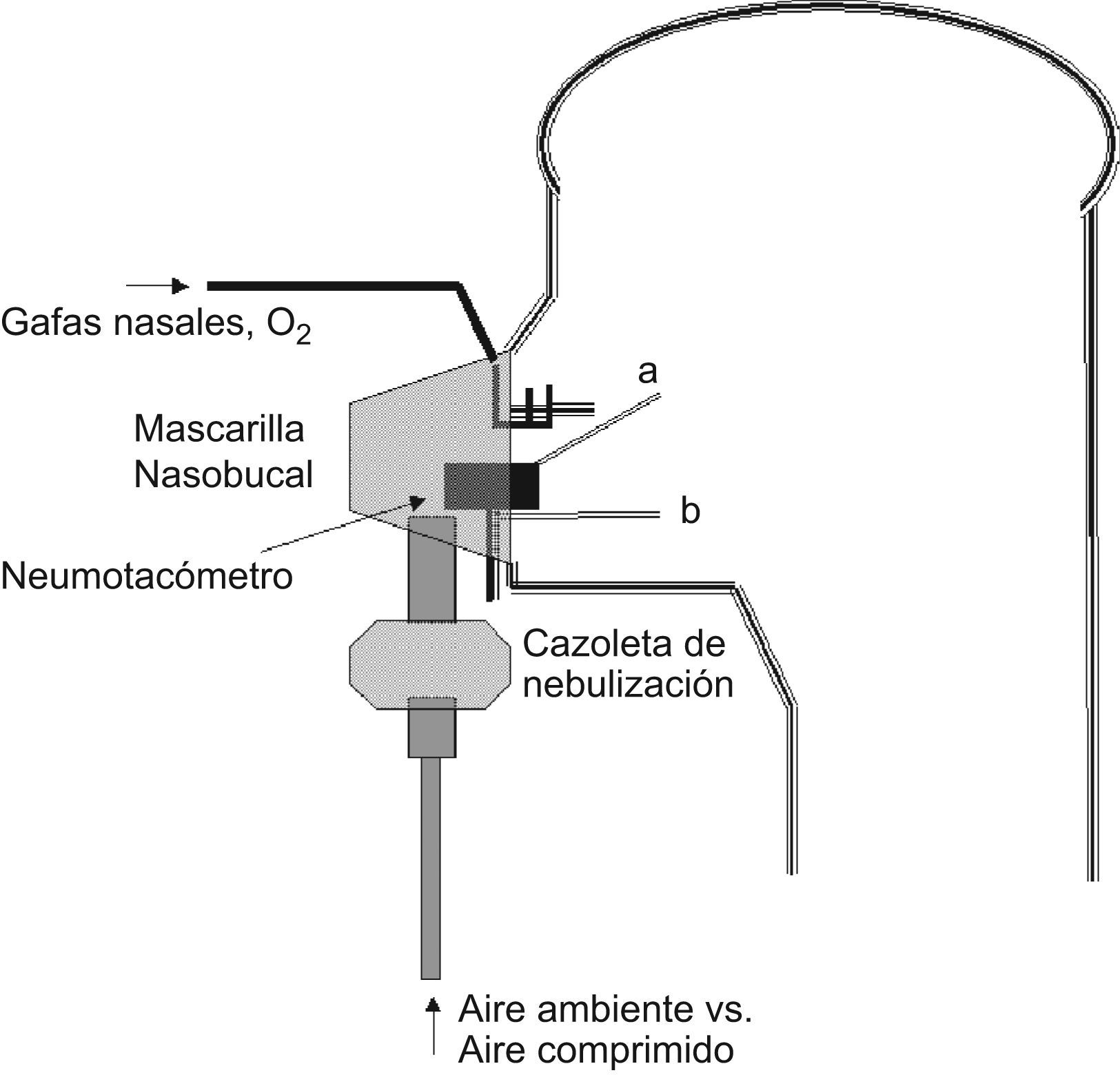
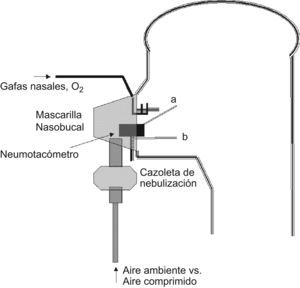
En la figura 1 aparece el esquema del dispositivo utilizado para reproducir la situación de nebulización con aire comprimido y oxigenoterapia con gafas nasales así como la localización de las sondas para la toma de muestras y análisis de la FIO2. Brevemente, el dispositivo constaba de una mascarilla nasobucal con ajuste almohadillado para prevenir las fugas y dos orificios para la entrada de la oxigenoterapia y salida de las señales fisiológicas. Estos orificios se hallaban sellados con silicona. La mascarilla se hallaba conectada a la cazoleta de nebulización y ésta a su vez, a la tubuladura portadora del flujo aéreo propulsor.
En las situaciones que implicaban respiración por la boca, los sujetos respiraron a través de una boquilla conectada a un transductor de flujo (TSD117/SS11LA Biopac Systems, Goleta, CA, EEUU), previamente calibrado. Tras la conversión en volumen, este procedimiento permitió el análisis del patrón ventilatorio en las diferentes modalidades de respiración bucal. Para los diferentes variables del patrón [FR, frecuencia respiratoria; VT, volumen corriente o «tidal»; VE, volumen minuto respiratorio (inspiratorio); TI, tiempo inspiratorio; TTOT, tiempo total del ciclo respiratorio] se han utilizado los valores medios de al menos 15 respiraciones en cada situación, descartando el tiempo de estabilización hasta alcanzar un estado estable (steady state). Las variables compuestas VT/TI y TI/TTOT se han calculado a partir de las obtenidas directamente del registro. La señal de flujo no fue recogida en las modalidades de respiración nasal. A su vez, la FIO2 se determinó mediante un analizador paramétrico (toma AFT20 y módulo O2100C, ambos de Biopac) conectado a las sondas de obtención de muestra. Se ha tomado como valor de la FIO2 en cada caso su valor medio en esa fase de la ventilación, nuevamente en al menos 15 respiraciones. Finalmente, la saturación de oxígeno se monitorizó con un oxímetro (sonda-transductor TSD123 y amplificador OXY100C, Biopac). Todas las señales se recogieron en un polígrafo digital (MP100 Data Acquisition System, Biopac), para su posterior análisis (programa AcqKnowledge ACK100W, Biopac).
Cuando ello ha sido posible se ha calculado la FIO2 predicha como resultante de la mezcla entre el volumen de aire inspirado y el suplemento de oxígeno suministrado por las lentillas. En el caso de la respiración libre, el cálculo ha tenido en cuenta el aire inspirado real, derivado del patrón ventilatorio. En el caso de las nebulizaciones a 8l/min, este ha sido el flujo aéreo considerado en el cálculo.
Análisis estadísticoLa estadística descriptiva se expresa como media±DE. Las comparaciones entre las diversas situaciones se han realizado mediante un análisis de la varianza para medidas repetidas. Se ha considerado significativo un valor de p<0,05.
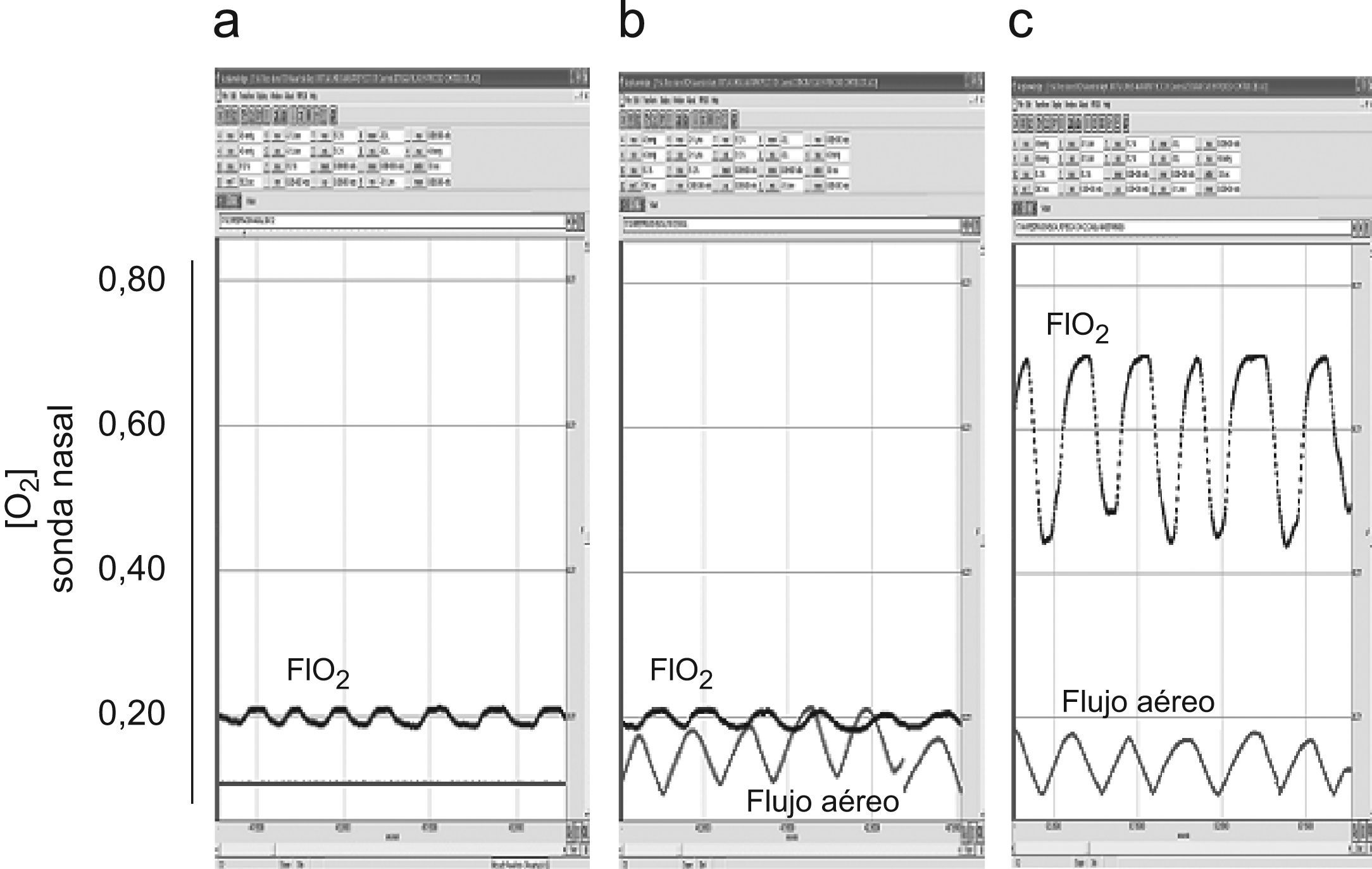
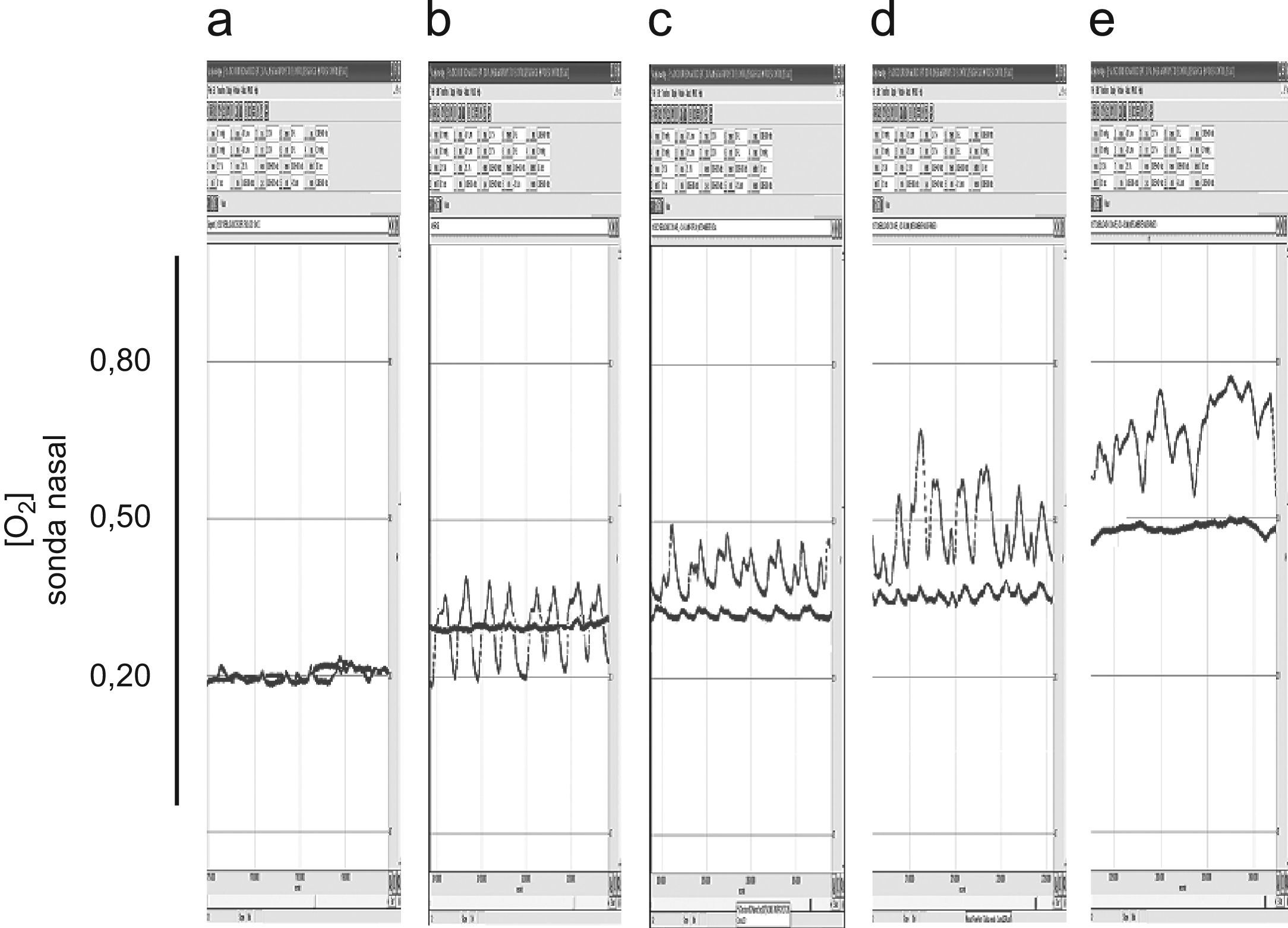
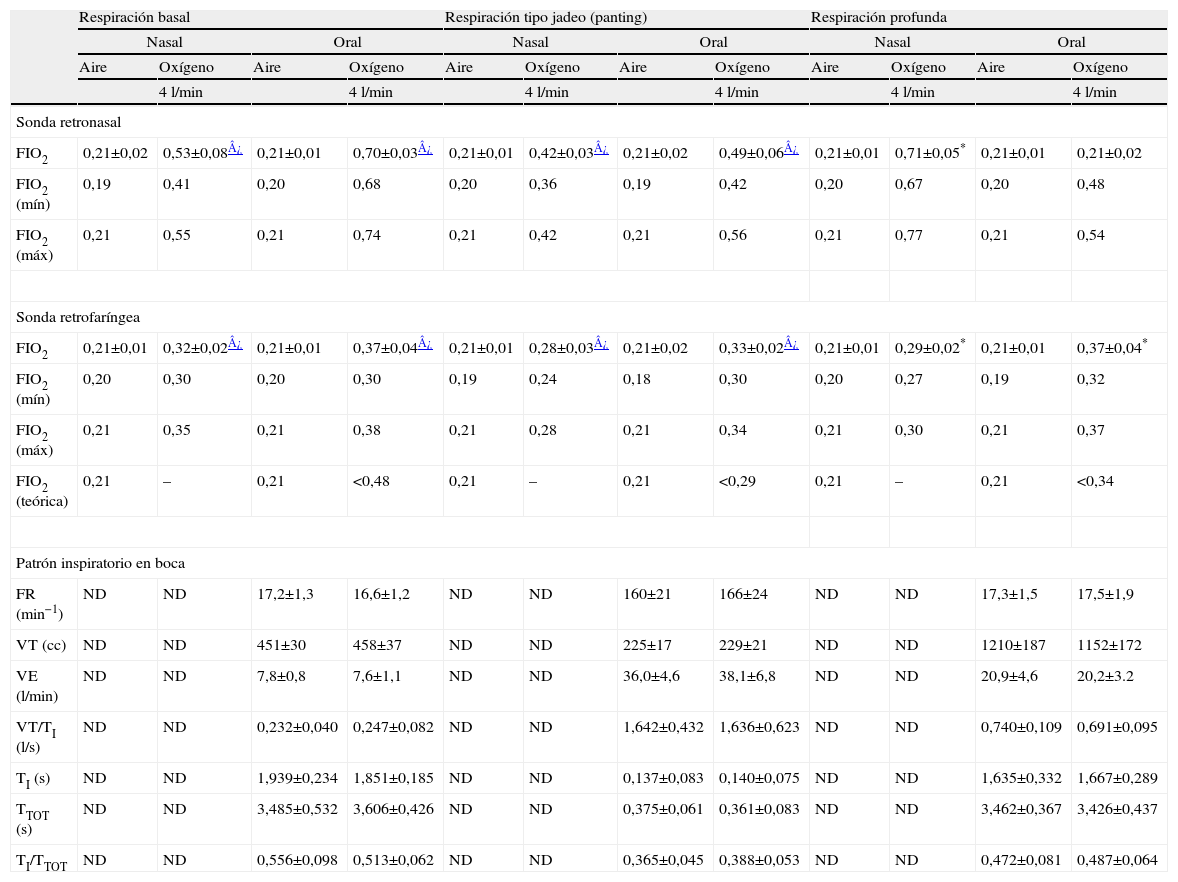
ResultadosToma libre de aire inspirado (nebulización inactiva)Los valores correspondientes a los registros realizados con el dispositivo de nebulización pero sin flujo de aire adicional (alternativamente vías nasal u oral) a diferentes patrones ventilatorios, con y sin suplemento de oxígeno, aparecen en la tabla 2. Dicho suplemento fue de 4l/min en todos los casos siempre suministrado por lentillas nasales convencionales. Como era de esperar, y respirando aire ambiente, las sondas retronasal y retrofaríngea mostraron siempre concentraciones inspiratorias de oxígeno de 0,21 con ligeros descensos espiratorios debidos a la mezcla con el aire espirado (fig. 2). Ya con el suplemento de oxígeno, la sonda retronasal mostró valores superiores a la retrofaríngea tanto en respiración nasal como oral y tanto en respiración tranquila (basal) como en las 2 modalidades de hiperventilación (jadeo y profunda). Estos valores alcanzaron tanto en respiración basal como en profunda unos niveles cercanos al 70% de oxígeno (fig. 2), siendo algo inferiores en el patrón de jadeo (fig. 3). Por otra parte, los valores de la FIO2 medida eran en general ligeramente superiores a los calculados teóricos sobre todo en el compartimento retronasal.
FIO2 obtenidas con el dispositivo de nebulización, toma libre de aire inspirado y suplemento nasal de oxígeno a 4l/min a diferentes patrones respiratorios voluntarios
| Respiración basal | Respiración tipo jadeo (panting) | Respiración profunda | ||||||||||
| Nasal | Oral | Nasal | Oral | Nasal | Oral | |||||||
| Aire | Oxígeno | Aire | Oxígeno | Aire | Oxígeno | Aire | Oxígeno | Aire | Oxígeno | Aire | Oxígeno | |
| 4l/min | 4l/min | 4l/min | 4l/min | 4l/min | 4l/min | |||||||
| Sonda retronasal | ||||||||||||
| FIO2 | 0,21±0,02 | 0,53±0,08¿ | 0,21±0,01 | 0,70±0,03¿ | 0,21±0,01 | 0,42±0,03¿ | 0,21±0,02 | 0,49±0,06¿ | 0,21±0,01 | 0,71±0,05* | 0,21±0,01 | 0,21±0,02 |
| FIO2 (mín) | 0,19 | 0,41 | 0,20 | 0,68 | 0,20 | 0,36 | 0,19 | 0,42 | 0,20 | 0,67 | 0,20 | 0,48 |
| FIO2 (máx) | 0,21 | 0,55 | 0,21 | 0,74 | 0,21 | 0,42 | 0,21 | 0,56 | 0,21 | 0,77 | 0,21 | 0,54 |
| Sonda retrofaríngea | ||||||||||||
| FIO2 | 0,21±0,01 | 0,32±0,02¿ | 0,21±0,01 | 0,37±0,04¿ | 0,21±0,01 | 0,28±0,03¿ | 0,21±0,02 | 0,33±0,02¿ | 0,21±0,01 | 0,29±0,02* | 0,21±0,01 | 0,37±0,04* |
| FIO2 (mín) | 0,20 | 0,30 | 0,20 | 0,30 | 0,19 | 0,24 | 0,18 | 0,30 | 0,20 | 0,27 | 0,19 | 0,32 |
| FIO2 (máx) | 0,21 | 0,35 | 0,21 | 0,38 | 0,21 | 0,28 | 0,21 | 0,34 | 0,21 | 0,30 | 0,21 | 0,37 |
| FIO2 (teórica) | 0,21 | – | 0,21 | <0,48 | 0,21 | – | 0,21 | <0,29 | 0,21 | – | 0,21 | <0,34 |
| Patrón inspiratorio en boca | ||||||||||||
| FR (min−1) | ND | ND | 17,2±1,3 | 16,6±1,2 | ND | ND | 160±21 | 166±24 | ND | ND | 17,3±1,5 | 17,5±1,9 |
| VT (cc) | ND | ND | 451±30 | 458±37 | ND | ND | 225±17 | 229±21 | ND | ND | 1210±187 | 1152±172 |
| VE (l/min) | ND | ND | 7,8±0,8 | 7,6±1,1 | ND | ND | 36,0±4,6 | 38,1±6,8 | ND | ND | 20,9±4,6 | 20,2±3.2 |
| VT/TI (l/s) | ND | ND | 0,232±0,040 | 0,247±0,082 | ND | ND | 1,642±0,432 | 1,636±0,623 | ND | ND | 0,740±0,109 | 0,691±0,095 |
| TI (s) | ND | ND | 1,939±0,234 | 1,851±0,185 | ND | ND | 0,137±0,083 | 0,140±0,075 | ND | ND | 1,635±0,332 | 1,667±0,289 |
| TTOT (s) | ND | ND | 3,485±0,532 | 3,606±0,426 | ND | ND | 0,375±0,061 | 0,361±0,083 | ND | ND | 3,462±0,367 | 3,426±0,437 |
| TI/TTOT | ND | ND | 0,556±0,098 | 0,513±0,062 | ND | ND | 0,365±0,045 | 0,388±0,053 | ND | ND | 0,472±0,081 | 0,487±0,064 |
ND: no disponible; VE: volumen minuto respiratorio (inspiratorio); VT: volumen corriente o «tidal »; TI: tiempo inspiratorio; TTOT: tiempo total del ciclo respiratorio.
FIO2 teórica: FIO2 resultante de la mezcla del volumen de aire inspirado espontáneamente (en boca)+el flujo total de oxígeno aportado por las lentillas. El uso de la expresión «< FIO2» asume la probable existencia de pérdidas del segundo componente en el volumen inspirado real.
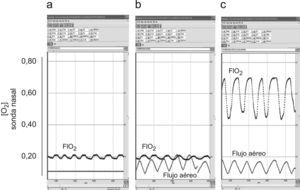
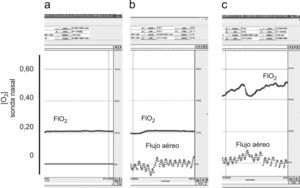
Registros representativos de flujo aéreo oral y concentración de oxígeno (O2) (sonda retronasal) en respiración tranquila. a) Respiración nasal (no existe recogida de señal de flujo), aire ambiente. b) Respiración bucal, aire ambiente. c) Respiración bucal, oxígeno a 4l/min. Las oscilaciones de los valores en la concentración de oxígeno se relacionan con el ciclo respiratorio, correspondiendo la FIO2 a los picos de la curva.
Registros representativos de flujo aéreo oral y concentración de oxígeno (O2) (sonda retronasal) en respiración de tipo jadeo: a) Respiración nasal (no existe recogida de señal de flujo), aire ambiente. b) Respiración bucal, aire ambiente. c) Respiración bucal, oxígeno a 4l/min. Se han agrandado los registros en relación a la magnitud tiempo para poder apreciar mejor el flujo a altas frecuencias ventilatorias.
El patrón respiratorio basal obtenido con la respiración bucal se hallaba dentro de la normalidad y era similar respirando solo aire ambiente o con la mezcla derivada del suplemento de oxígeno en las tres situaciones ventilatorias estudiadas.
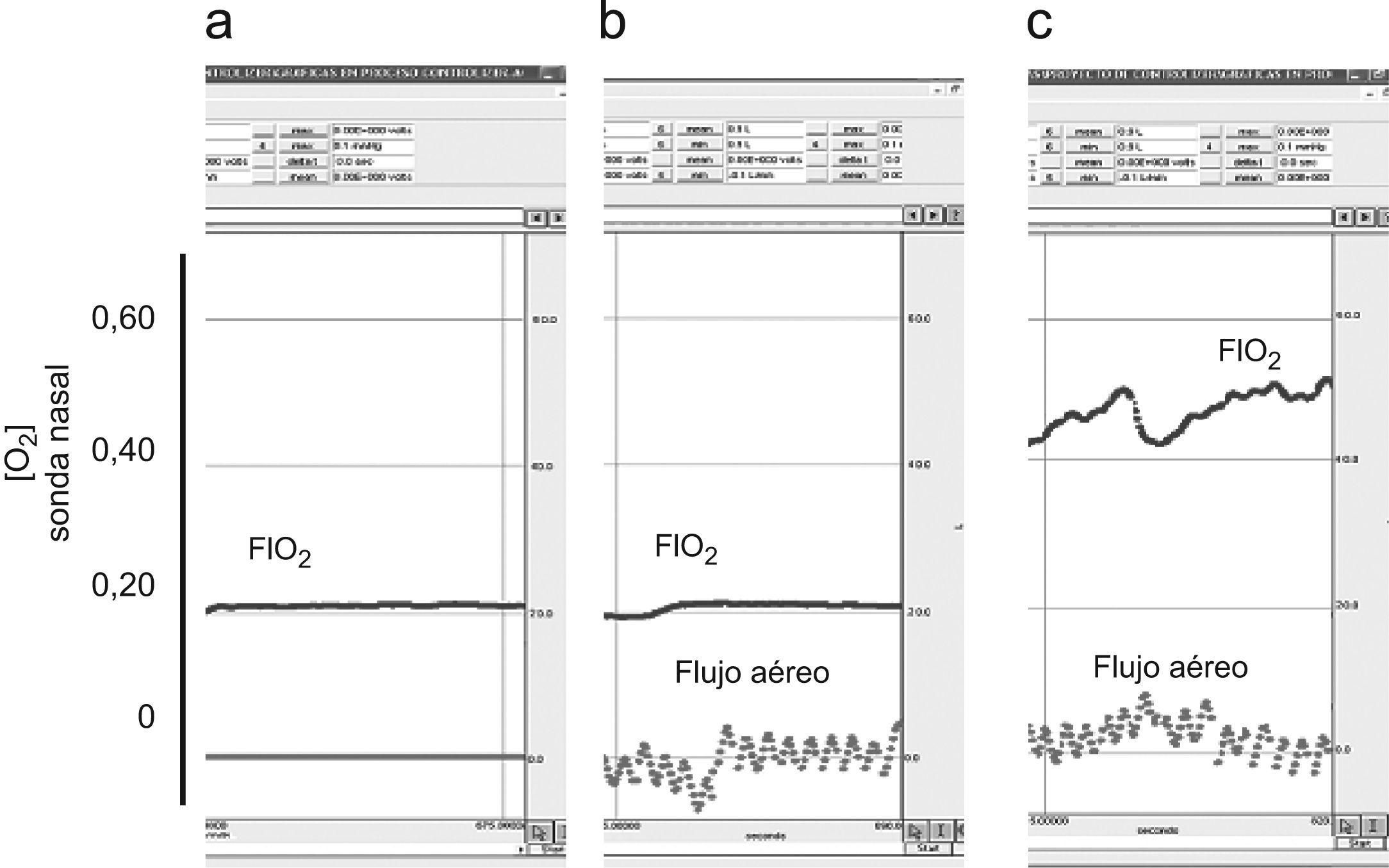
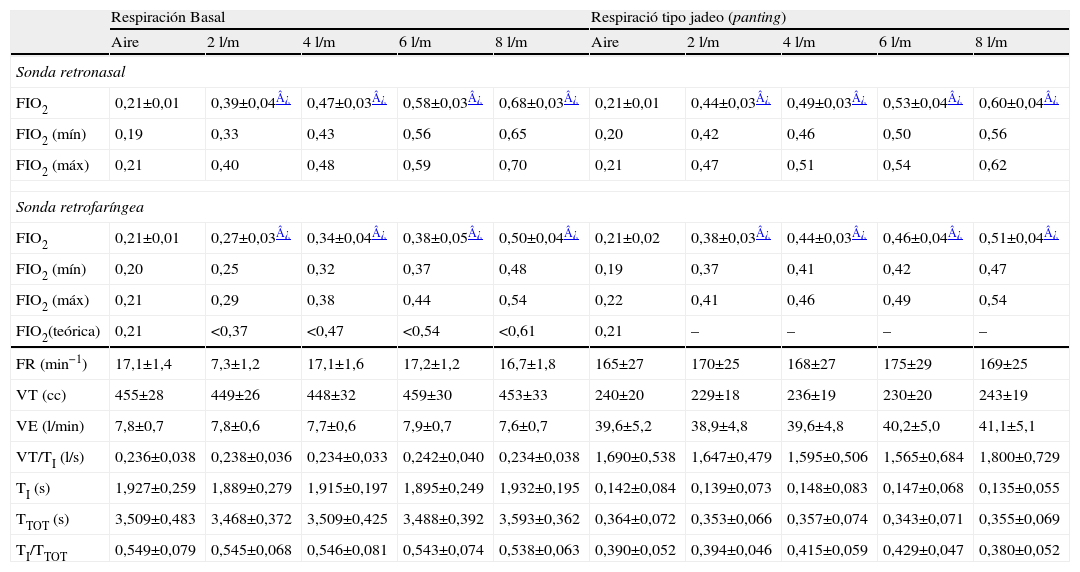
Nebulizaciones con aire comprimidoEn el registro realizado durante las nebulizaciones con aire comprimido, las sondas registraron concentraciones progresivas de oxígeno a medida que aumentaba el flujo de ese gas por las lentillas (tabla 3 y fig. 4). También en esta ocasión, los valores registrados fueron superiores con la sonda retronasal. El patrón de hiperventilación tipo jadeo no modificó sustancialmente los valores medidos de FIO2 respecto de la respiración tranquila basal. Por otra parte, los patrones ventilatorios en boca fueron similares a los obtenidos durante la inhalación con aire ambiente.
FIO2 obtenidas durante las nebulizaciones a 8l/min de aire comprimido a diferentes flujos suplementarios de oxígeno
| Respiración Basal | Respiració tipo jadeo (panting) | |||||||||
| Aire | 2l/m | 4l/m | 6l/m | 8l/m | Aire | 2l/m | 4l/m | 6l/m | 8l/m | |
| Sonda retronasal | ||||||||||
| FIO2 | 0,21±0,01 | 0,39±0,04¿ | 0,47±0,03¿ | 0,58±0,03¿ | 0,68±0,03¿ | 0,21±0,01 | 0,44±0,03¿ | 0,49±0,03¿ | 0,53±0,04¿ | 0,60±0,04¿ |
| FIO2 (mín) | 0,19 | 0,33 | 0,43 | 0,56 | 0,65 | 0,20 | 0,42 | 0,46 | 0,50 | 0,56 |
| FIO2 (máx) | 0,21 | 0,40 | 0,48 | 0,59 | 0,70 | 0,21 | 0,47 | 0,51 | 0,54 | 0,62 |
| Sonda retrofaríngea | ||||||||||
| FIO2 | 0,21±0,01 | 0,27±0,03¿ | 0,34±0,04¿ | 0,38±0,05¿ | 0,50±0,04¿ | 0,21±0,02 | 0,38±0,03¿ | 0,44±0,03¿ | 0,46±0,04¿ | 0,51±0,04¿ |
| FIO2 (mín) | 0,20 | 0,25 | 0,32 | 0,37 | 0,48 | 0,19 | 0,37 | 0,41 | 0,42 | 0,47 |
| FIO2 (máx) | 0,21 | 0,29 | 0,38 | 0,44 | 0,54 | 0,22 | 0,41 | 0,46 | 0,49 | 0,54 |
| FIO2(teórica) | 0,21 | <0,37 | <0,47 | <0,54 | <0,61 | 0,21 | – | – | – | – |
| FR (min−1) | 17,1±1,4 | 7,3±1,2 | 17,1±1,6 | 17,2±1,2 | 16,7±1,8 | 165±27 | 170±25 | 168±27 | 175±29 | 169±25 |
| VT (cc) | 455±28 | 449±26 | 448±32 | 459±30 | 453±33 | 240±20 | 229±18 | 236±19 | 230±20 | 243±19 |
| VE (l/min) | 7,8±0,7 | 7,8±0,6 | 7,7±0,6 | 7,9±0,7 | 7,6±0,7 | 39,6±5,2 | 38,9±4,8 | 39,6±4,8 | 40,2±5,0 | 41,1±5,1 |
| VT/TI (l/s) | 0,236±0,038 | 0,238±0,036 | 0,234±0,033 | 0,242±0,040 | 0,234±0,038 | 1,690±0,538 | 1,647±0,479 | 1,595±0,506 | 1,565±0,684 | 1,800±0,729 |
| TI (s) | 1,927±0,259 | 1,889±0,279 | 1,915±0,197 | 1,895±0,249 | 1,932±0,195 | 0,142±0,084 | 0,139±0,073 | 0,148±0,083 | 0,147±0,068 | 0,135±0,055 |
| TTOT (s) | 3,509±0,483 | 3,468±0,372 | 3,509±0,425 | 3,488±0,392 | 3,593±0,362 | 0,364±0,072 | 0,353±0,066 | 0,357±0,074 | 0,343±0,071 | 0,355±0,069 |
| TI/TTOT | 0,549±0,079 | 0,545±0,068 | 0,546±0,081 | 0,543±0,074 | 0,538±0,063 | 0,390±0,052 | 0,394±0,046 | 0,415±0,059 | 0,429±0,047 | 0,380±0,052 |
ND: no disponible; TI: tiempo inspiratorio; TTOT: tiempo total del ciclo respiratorio; VE: volumen minuto respiratorio (inspiratorio); VT: volumen corriente o «tidal».
FIO2 teórica: FIO2 resultante de la mezcla del flujo de aire nebulizado+el flujo total de oxígeno aportado por las lentillas. El uso de la expresión «< FIO2» asume la probable existencia de pérdidas del segundo componente en el volumen inspirado real.
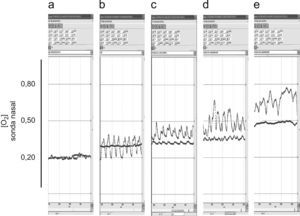
Registros durante las nebulizaciones con aire comprimido (8l/min), en respiración tranquila y a diferentes flujos nasales de oxígeno. a) Sin oxígeno. b) A 2l/min. c) A 4l/min. d) A 6l/min. e) A 8l/min. Con excepción de a), donde ambos registros se superponen, los trazados superiores corresponden a la sonda retronasal, mientras que los inferiores proceden de la sonda retrofaríngea.
El hallazgo más notable del presente trabajo es la verificación de que la técnica más utilizada para administrar nebulizaciones farmacológicas a pacientes respiratorios que además precisan de oxígeno suplementario no asegura unas fracciones inspiratorias controladas de este último gas. Es más, dichas concentraciones alcanzan en ocasiones niveles que podrían tener consecuencias clínicas importantes si fueran aplicadas a pacientes con enfermedades obstructivas crónicas. Sorprendentemente, no hemos hallado ningún trabajo previo en que se analicen experimentalmente las concentraciones reales de oxígeno que reciben los sujetos sometidos a nebulizaciones con técnica estándar.
La terapia de los pacientes respiratorios con un transtorno obstructivo implica diversos elementos, entre los que destacan los broncodilatadores y la oxigenoterapia. Los primeros permiten mejorar el flujo aéreo al incrementar el calibre de las vías respiratorias por diversos mecanismos. Su vía de utilización más frecuente es la inhalada, pero los resultados pueden mejorarse mediante su administración por nebulización del fármaco7,8. A su vez, un suministro de oxígeno suplementario permite corregir algunas de las consecuencias de la hipoxemia grave tanto a nivel tisular como del sistema cardiovascular. En determinadas situaciones como la exacerbación grave de la EPOC, es frecuente utilizar conjuntamente ambos tratamientos (broncodilatadores en nebulización y suplementos de oxígeno)6,11–17.
Por otra parte, tradicionalmente se recomienda el uso de fracciones respiratorias de oxígeno controladas y no excesivamente altas para prevenir la potencial aparición de hipoventilación1,7. Este trastorno se ha atribuido sobre todo a la depresión de las áreas neuronales que controlan la respiración que dejarían de percibir el estímulo hipóxico que la potencia. Esto sería relevante sobre todo en pacientes hipercápnicos cuyos receptores se hallan ya habituados a unas concentraciones relativamente elevadas de PaCO2, y por tanto responden mal a cambios ulteriores en la concentración de ese gas18. En estos enfermos y solo la eventual presencia de hipoxia mantendrá un adecuado estímulo ventilatorio18,19. De ahí la importancia de no anularlo totalmente mediante una oxigenoterapia excesiva.
Sin embargo, la observación de que un cierto porcentaje de pacientes con enfermedades obstructivas crónicas toleran relativamente bien la administración de concentraciones relativamente elevadas de oxígeno ha llevado a una cierta tolerancia en el uso de este gas. De hecho, la variabilidad en las respuestas a la hipoxia y la hipercapnia no solo es interindividual, entre los diferentes enfermos, sino también intraindividuo con diferencias entre las situaciones de estabilidad y exacerbación20–27. Sin embargo, diversas revisiones confirman el peligro que puede implicar una corrección excesiva de la hipoxia en muchos pacientes con enfermedades respiratorias crónicas28–30.
Por otra parte y ante la variabilidad de resultados, se ha profundizado en los mecanismos por los que la utilización de FIO2 elevadas induce hipercapnia y acidosis respiratoria en algunos enfermos. Así, se ha confirmado que éstos muestran una reducción en su ventilación por pérdida del estímulo hipóxico10. Esta reducción puede alcanzar un 20% de la ventilación basal. Pero además se ha observado un incremento en el espacio muerto31, en concreto en su fracción alveolar10,32, probablemente como consecuencia de la propia hipercapnia y su eventual acción sobre el calibre bronquial10. Un punto a destacar es el de que las reducciones en la ventilación inducidas por la hiperoxia se observan sobre todo en pacientes con exacerbación10 que precisamente son los más susceptibles de recibir nebulizaciones con fármacos y son menores o se hallan ausentes en enfermos estables21,26. Es interesante señalar que las modificaciones en la respuesta ventilatoria aunque de pequeña cuantía y escasa relevancia clínica, se hallarían también presentes en aproximadamente la mitad de los pacientes que realizan oxigenoterapia domiciliaria convencional con FIO2 relativamente bajas33.
Por otra parte, es frecuente observar el deterioro que experimentan en las primeras horas de su ingreso en urgencias un número no despreciable de pacientes respiratorios. Algunos de estos enfermos se caracterizan por un estado inicial relativamente conservado a nivel clínico y gasométrico, pero muestran un deterioro posterior con aparición de hipercapnia progresiva y acidosis respiratoria. Una posibilidad es que estos enfermos estén recibiendo una concentración de oxígeno mayor de la recomendada como parece suceder habitualmente en países de nuestro entorno29 a pesar de las recomendaciones de no superar una FIO2 del 0,24–0,28. Esto es especialmente evidente en los departamentos de urgencias y se ha demostrado que tiene un impacto directo en el deterioro posterior de los pacientes29,30.
Otra posibilidad complementaria que puede explicar el deterioro de los enfermos con exacerbación es la frecuente terapia simultánea con oxigenoterapia y nebulizaciones de fármacos broncodilatadores. Como es sabido, este último tratamiento se realiza mediante mascarilla, propulsando el fármaco ya diluido con un gas medicinal o con aire. Conocedores de los riesgos que implica el uso de oxígeno para esta función, se suele utilizar el aire comprimido. El problema aparece cuando el paciente precisa además de suplementos de oxígeno por presentar insuficiencia respiratoria. En general, la solución más extendida es la aplicación de un flujo continuo de oxígeno, utilizando unas lentillas/gafas nasales que se sitúan en el interior de la mascarilla que recibe la nebulización con aire. El flujo de dichas lentillas debería mantenerse en niveles que aseguren una saturación de oxígeno aceptable pero no excesiva. En general, se recomienda que cualquier terapia que incluya oxígeno en pacientes con EPOC mantenga unos niveles de saturación entre el 85–92% para evitar los riesgos respectivos de hipoxemia y de hipercapnia/acidosis34,35. Sin embargo, y como ya se ha mencionado, dichos niveles de saturación son frecuentemente sobrepasados sobre todo en los servicios de urgencias29,30,35,36. También con demasiada frecuencia, la terapia doble (nebulización con aire más oxígeno suplementario) se realiza sin monitorización oximétrica. Finalmente, cabe recordar que la SEPAR recomienda un flujo de oxígeno nasal de tan solo 2l/min durante la terapia nebulizada16.
Finalmente, existe otra posibilidad para explicar el deterioro gasométrico (fundamentalmente la hipoxemia) en pacientes que están recibiendo el tratamiento inicial de su exacerbación. Se trata de los conocidos efectos de los beta-agonistas sobre el gasto cardíaco, que al aumentar, puede conllevar un aumento de la perfusión a unidades alveolares de reducido cociente ventilaciónperfusión (VA/Q)37. Sin embargo, este efecto deletéreo se ha descrito fundamentalmente tras la administración del fármaco por vía endovenosa en el asma bronquial, y parece menor por vía inhalada37. En el caso concreto de las nebulizaciones en pacientes con EPOC exacerbada, el efecto del betaagonista sobre las relaciones VA/Q sería muy limitado38. Además, en todos estos casos y debido a los otros factores que influyen positivamente en la PaO2, el impacto final en los gases arteriales parece reducido37,38; aunque ciertamente, no sería descartable.
La observación clínica del deterioro gasométrico que se observaba en un porcentaje importante de pacientes nos hizo sospechar que el nivel de FIO2 habitualmente utilizado durante las nebulizaciones era superior al esperado y motivó el diseño del presente estudio. En él, y bajo condiciones controladas, se ha analizado cuál es el nivel real de suministro de oxígeno con el dispositivo de nebulización y a diferentes flujos (tanto de aire como de oxígeno). En la primera fase del estudio, se permitió a los sujetos utilizar diferentes patrones ventilatorios y una toma libre de aire inspirado. Bajo dichas circunstancias, los niveles de FIO2 medidos fueron relativamente elevados, alcanzando en ocasiones valores cercanos al 0,70. Dichos valores, no obstante requieren una serie de matizaciones. En general, sus oscilaciones inspiratorias fueron muy discretas con valores superiores en la sonda retronasal respecto de la retrofaríngea. Esto parece lógico ya que la primera de dichas localizaciones se hallaba muy cercana a la fuente permanente de oxígeno y es posible que no se hubiera producido todavía una mezcla apropiada de este gas con el resto del aire inspirado. El mismo motivo parece explicar la diferencia más acusada entre ambas sondas observada bajo respiración bucal frente a la nasal sobre todo en respiración tranquila y profunda. Finalmente, los valores entre la FIO2 teórica calculada y la realmente medida fueron de índole menor en todos los casos. En resumen, los valores de FIO2 real bajo respiración libre resultan elevados aunque no serían muy alarmantes si se asume que solo son reflejados realmente por la sonda retrofaríngea.
Lamentablemente, esta situación empeora sustancialmente ante condiciones mucho más similares a las de los pacientes que reciben nebulización en las que los flujos de aire y oxígeno pueden llegar a ser muy superiores. Cuando los voluntarios del estudio fueron sometidos a dichas circunstancias, ambas sondas registraron FIO2 elevadas. Lo que es más importante, la sonda retrofaríngea alcanzó valores del 40–50% de oxígeno con flujos de dicho gas que incluían los más habituales en la clínica para este tipo de pacientes durante las nebulizaciones.
Confirmada la administración de FIO2 relativamente elevadas con los sistemas tradicionales de nebulización combinada con oxigenoterapia, se hace necesario un estudio clínico, aleatorizado y controlado sobre la situación real en los pacientes con agudización de su EPOC. Aunque hasta la fecha se han publicado algunos trabajos11–15, todos ellos presentan importantes problemas metodológicos17.
Limitaciones del estudioUna de las potenciales limitaciones del estudio es la posibilidad de que bajo determinadas circunstancias (como la hiperventilación con nebulización simultánea) se hubiera producido un cierto rebreathing ya que el alto VE exigido en esa circunstancia no podía ser adecuadamente mantenido por el flujo combinado del oxígeno y aire suministrados. En todo caso, eso hubiera resultado en la infaestimación de la FIO2 que aún así resultó ser elevada. También es posible que, como en todo estudio del patrón ventilatorio, este pueda haberse visto artefactualmente afectado por el sistema de medición. Sin embargo, en el presente estudio se escogió la medición por neumotacómetro por ser más exacta que las estimaciones indirectas y se aseguró que la mascarilla se hallaba razonablemente ajustada en todo momento.
Otra eventual limitación del estudio es que se ha realizado en voluntarios sanos y no en pacientes por lo cual no es posible una extrapolación directa a situaciones clínicas reales. Sin embargo, pensamos que la primera aproximación al problema de la oxigenoterapia durante las nebulizaciones implicaba la verificación de la FIO2 real que recibe el individuo. El estudio de las consecuencias de una fracción excesivamente elevada de oxígeno sobre los pacientes se halla ya suficientemente analizada en la literatura y no nos pareció ético ni necesario exponer una vez más a los pacientes a dichas condiciones experimentales.
Finalmente, debemos reconocer que es posible que los resultados del presente estudio no sean del todo extrapolables a otros dispositivos similares. Sin embargo, aunque dichos dispositivos difieran morfológicamente en algunos detalles, sus elementos esenciales: el flujo de oxígeno como propulsor y la cazoleta con el fármaco son comunes a la mayoría de ellos. Dicho de otro modo, nuestros resultados no serían directamente extrapolables cuantitativamente, pero sus consecuencias cualitativas y riesgos potenciales serían probablemente muy similares.
En resumen, el presente trabajo pretende ser una llamada de atención desde la fisiología hacia la clínica diaria sobre el tema del uso de oxígeno suplementario durante las nebulizaciones. Dicho uso pudiera entrañar peligros para el paciente sobre todo si no se tienen en cuenta la FIO2 y el nivel resultante de oxigenación así como las respuestas ventilatoria y/o sanguínea que éstos pueden inducir. En consecuencia, creemos que deberían investigarse dispositivos seguros que permitan controlar la FIO2 en el curso de tratamientos con nebulización de fármacos.