La diabetes relacionada con la fibrosis quística (DRFQ) es un factor determinante del empeoramiento de la función pulmonar y del incremento de mortalidad. El tratamiento con insulina mejora esta situación.
Se presenta el caso de un paciente diagnosticado de fibrosis quística (FQ) a los 16 años. Al cabo de dos años presentó un deterioro rápido de la función pulmonar, cumpliendo meses después criterios de trasplante pulmonar; concomitantemente, fue diagnosticado de DRFQ e inició insulinoterapia. En el seguimiento se evaluaron la función pulmonar por espirometría, el estado nutricional (índice de masa corporal) y el control metabólico (HbA1c) cada 3 meses. Tras iniciar insulinoterapia, obtuvo un buen control metabólico y mejoría progresiva espirométrica y del estado nutricional. A los 4 meses ya no cumplía criterios de trasplante pulmonar, situación que se mantiene a los 8 años.
El largo seguimiento documenta un efecto beneficioso rápido y prolongado del buen control metabólico de la DRFQ sobre el deterioro respiratorio en FQ.
Cystic fibrosis related diabetes (CFRD) is a strong determinant for lung function decline and increased mortality. Insulin treatment of CFRD is reportedly beneficial for this situation. We report on the long-term impact of insulin treatment of CFRD on pulmonary function and nutritional status in a CF male patient since diagnosis of diabetes.
We report the case of a patient diagnosed with CF at the age of 16. Two years later, he experienced a rapidly evolving decrease in pulmonary function, some months later criteria were met warranting lung transplantation. Concomitantly, he was diagnosed with CFRD and insulin therapy was started. Lung function (spirometry), nutritional status (body mass index) and metabolic control (HbA1c) were determined every 3 months. After the introduction of insulin treatment, pulmonary function and nutritional status progressively improved and good glycemic control was achieved. The significant and sustained improvement in pulmonary function allowed for the patient's withdrawal from the lung transplantation program within 4 months, a situation which has been maintained until now, 8 years later.
The long follow-up of our patient documents the rapid and prolonged beneficial effect of proper metabolic control of CFRD on the respiratory deterioration in CF.
La alteración de la función pulmonar es el principal factor responsable de la alta mortalidad de los pacientes con fibrosis quística (FQ). En las últimas décadas, el tratamiento especializado de la FQ ha aumentado significativamente su esperanza de vida1, y así la supervivencia media actual es superior a los 30 años. El trasplante pulmonar es la única terapia disponible en los estadios finales de la enfermedad pulmonar2. Al aumentar la supervivencia en la FQ, cada vez más pacientes tienen la posibilidad de desarrollar complicaciones extrapulmonares. La diabetes relacionada con la FQ (DRFQ) es la comorbilidad más frecuente y constituye a la vez un marcador de peor pronóstico y mayor mortalidad3,4. La prevalencia de la DRFQ aumenta con la edad3,5,6 y su aparición suele ir precedida de alteraciones moderadas del metabolismo hidrocarbonado; se ha comunicado el empeoramiento de la función pulmonar y del estado nutritivo años antes de su diagnóstico3,7-9. El tratamiento de la DRFQ con insulina parece mejorar el estado respiratorio y nutritivo de estos pacientes5,10,11. Son escasos los estudios sobre la duración de este efecto beneficioso. En pacientes con FQ que precisan trasplante pulmonar la prevalencia la DRFQ es del 28,6%12. Presentamos el efecto beneficioso y prolongado de la insulinoterapia en la función pulmonar y en el estado nutricional en un varón con FQ desde el diagnóstico de la DRFQ, momento que coincide con la indicación de trasplante pulmonar.
Paciente y métodosCaso clínicoVarón diagnosticado de FQ a los 16 años de edad por infecciones broncopulmonares de repetición y dos test de sudor patológicos (95 y 86 mEq/l ión cloruro). Desde esta edad presentó infección broncopulmonar crónica por Staphylococcus aureus sensible a meticilina y Pseudomonas aeruginosa sensible a ciprofloxacino, aminoglucósidos, colistimetato de sodio y a la mayoría de los betalactámicos antipseudomonas. La tomografía axial computarizada de alta resolución mostraba la presencia de bronquiectasias difusas, de predominio en lóbulos superiores. Al diagnóstico de la FQ tenía una capacidad vital forzada (FVC) de 4.600ml (106%) y un volumen espiratorio máximo en el primer segundo de la espiración forzada (FEV1) de 3.600ml (101%). Un año después se le diagnosticó aspergilosis broncopulmonar alérgica (ABPA) y fue tratado con corticoesteroides orales durante 6 meses, junto con azitromicina de mantenimiento (500mg administrados 3 veces a la semana), con resolución del brote de ABPA. Al tercer año del diagnóstico de FQ la función pulmonar y el estado nutricional empeoraron drásticamente. El paciente presentó numerosas exacerbaciones pulmonares que requirieron varios ciclos de antibióticos orales e intravenosos, respondiendo cada vez peor a ellos y sin que en ningún momento controlasen el deterioro funcional; finalmente requirió oxigenoterapia domiciliaria. También recibió dosis moderadas de corticosteroides orales (16mg/día de metilprednisolona) en un intento de controlar la inflamación pulmonar e intentar frenar el deterioro respiratorio. A los 19 años fue derivado a la unidad de trasplante pulmonar de nuestro centro debido al rápido y progresivo deterioro respiratorio, con un FEV1 del 30% del valor predicho y la necesidad de oxigenoterapia continua; en ese momento estaba en tratamiento con 20mg/48h de metilprednisolona (0,2mg/kg/día). Como parte del protocolo inicial de estudio del trasplante se evaluó el metabolismo hidrocarbonado mediante sobrecarga oral de glucosa, estudio que evidenció la existencia de DFRQ13. No presentaba sintomatología cardinal ni tenía antecedentes familiares de diabetes. Se inició tratamiento con insulina en régimen de múltiples dosis tras realizar educación diabetológica. La función pancreática exocrina siempre permaneció conservada, sin requerir terapia sustitutiva.
MétodosFunción pulmonarSe evaluó mediante espirometría forzada, cada 3-4 meses, expresando la FVC y el FEV1 como porcentaje del valor predicho para edad, raza, sexo, peso y talla. El estado nutricional fue estimado por medio del índice de masa corporal [IMC=peso (kg)/talla2 (m)] relacionado con la edad y el sexo. Los criterios de trasplante pulmonar utilizados fueron los definidos por Prados et al.14 y Liou et al.15.
Estudio y control de la DRFQPara el diagnóstico de la alteración hidrocarbonada se realizó una sobrecarga oral de glucosa en ayunas (con administración de 75g de glucosa) utilizando los criterios de la American Diabetes Association13. El tratamiento de la DRFQ se inició en régimen de múltiples dosis con insulina regular (Actrapid®) antes del desayuno, de la comida y de la cena, e insulina NPH (Insulatard®) en la comida y la cena, ajustando las dosis según las glucemias capilares realizadas (antes y 2h tras las ingestas y nocturnas) y en función de las raciones de hidratos de carbono ingeridas. Para la valoración del control de la DRFQ se determinó la hemoglobina glicosilada (HbA1c) cada 3 meses (HPLC Menarini; valor normal, 5,3±0,3%).
Estudio molecularAnálisis de ADN realizado con método ElucigeneTM CF29v.2 (Tepnel Diagnostics Ltd, Oxfordshire, Gran Bretaña). Se identificaron las mutaciones del508F y R553X en heterocigosis compuesta, confirmadas mediante secuenciación directa de los productos de la reacción en cadena de la polimerasa de los exones correspondientes del gen CFTR (cystic fibrosis transmembrane conductance regulator).
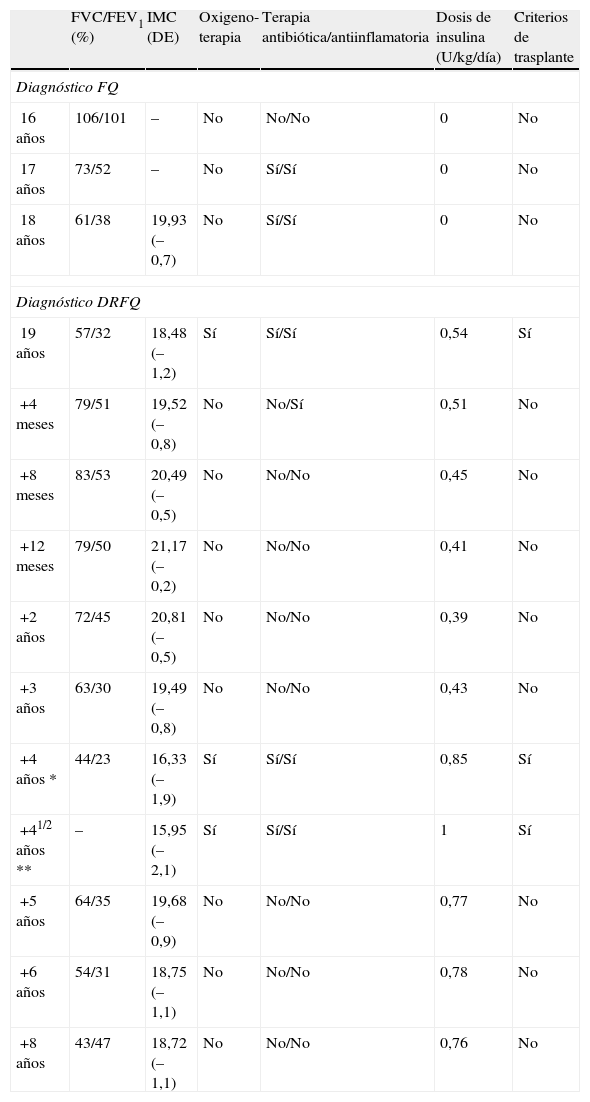
ResultadosTras el inicio del tratamiento con insulina se constató una mejoría progresiva de la función pulmonar y del estado nutricional (tabla 1), de manera que a los 4 meses el paciente ya no cumplía criterios de trasplante pulmonar. La dosis de corticoides pudo disminuirse paulatinamente hasta su suspensión a los 5 meses del inicio de la insulinoterapia, sin que el paciente presentara exacerbaciones pulmonares durante el descenso. También se pudo suspender la oxigenoterapia domiciliaria y los parámetros espirométricos mejoraron hasta los niveles previos al diagnóstico de la DRFQ (tabla 1). A los 10 meses, el paciente realizaba ejercicio físico con regularidad.
Evolución de la función pulmonar y del estado nutricional
| FVC/FEV1 (%) | IMC (DE) | Oxigeno-terapia | Terapia antibiótica/antiinflamatoria | Dosis de insulina (U/kg/día) | Criterios de trasplante | |
| Diagnóstico FQ | ||||||
| 16 años | 106/101 | – | No | No/No | 0 | No |
| 17 años | 73/52 | – | No | Sí/Sí | 0 | No |
| 18 años | 61/38 | 19,93 (–0,7) | No | Sí/Sí | 0 | No |
| Diagnóstico DRFQ | ||||||
| 19 años | 57/32 | 18,48 (–1,2) | Sí | Sí/Sí | 0,54 | Sí |
| +4 meses | 79/51 | 19,52 (–0,8) | No | No/Sí | 0,51 | No |
| +8 meses | 83/53 | 20,49 (–0,5) | No | No/No | 0,45 | No |
| +12 meses | 79/50 | 21,17 (–0,2) | No | No/No | 0,41 | No |
| +2 años | 72/45 | 20,81 (–0,5) | No | No/No | 0,39 | No |
| +3 años | 63/30 | 19,49 (–0,8) | No | No/No | 0,43 | No |
| +4 años * | 44/23 | 16,33 (–1,9) | Sí | Sí/Sí | 0,85 | Sí |
| +41/2 años ** | – | 15,95 (–2,1) | Sí | Sí/Sí | 1 | Sí |
| +5 años | 64/35 | 19,68 (–0,9) | No | No/No | 0,77 | No |
| +6 años | 54/31 | 18,75 (–1,1) | No | No/No | 0,78 | No |
| +8 años | 43/47 | 18,72 (–1,1) | No | No/No | 0,76 | No |
FQ: fibrosis quística; DRFQ: diabetes relacionada con la fibrosis quística; FVC: capacidad vital forzada; FEV1: volumen espiratorio máximo en el primer segundo de la espiración forzada (FVC y FEV1 expresados en % del valor predicho); IMC (DE): índice de masa corporal expresado en kg/m2 y desviación estándar; U: unidades.
*, ** Exacerbaciones pulmonares.
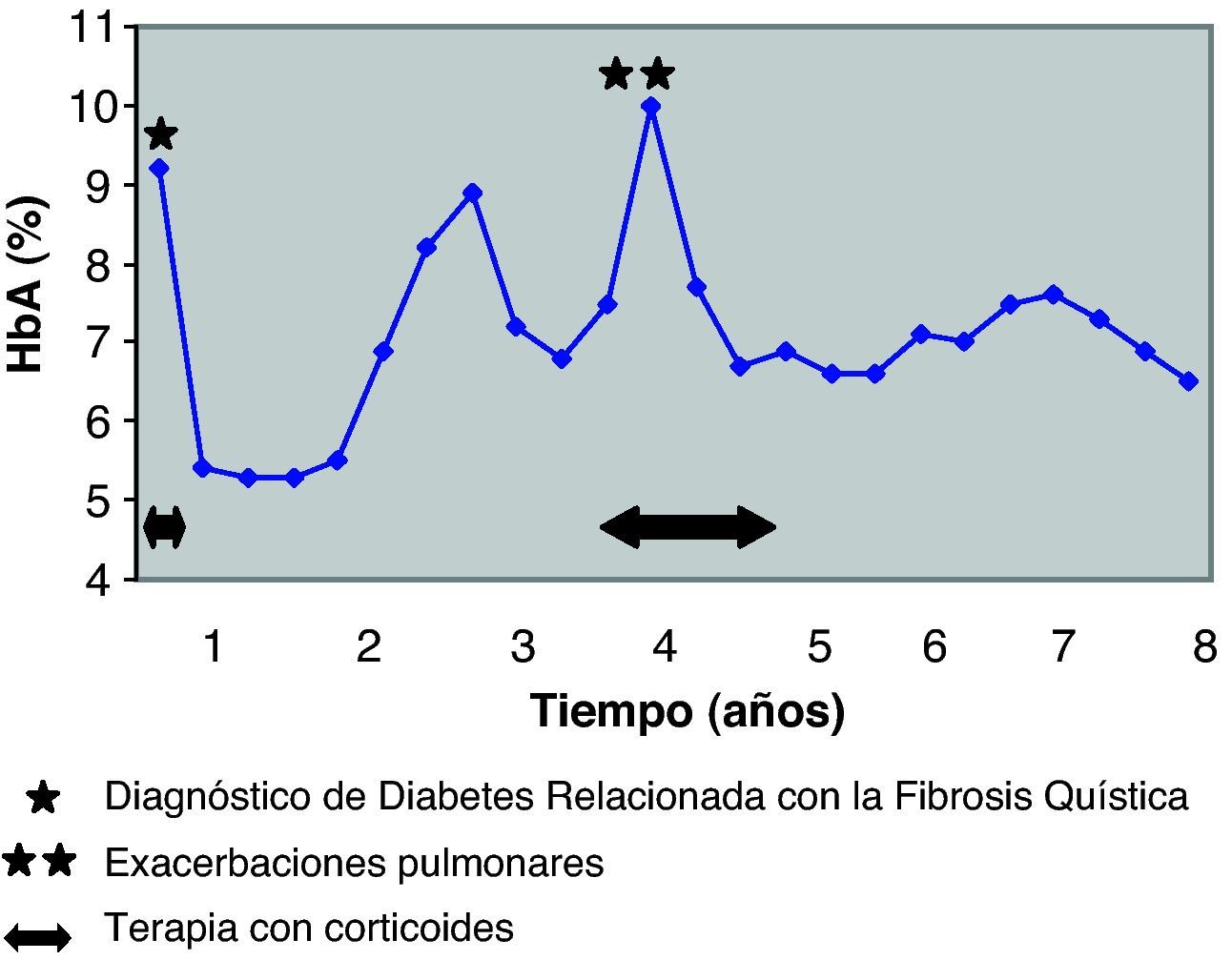
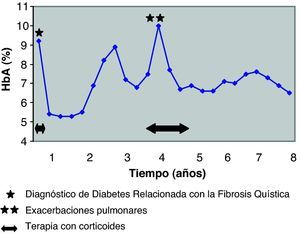
A los 4 años del diagnóstico de la diabetes, el paciente tuvo otro brote de ABPA y precisó corticoterapia oral durante 18 meses (dosis iniciales de 1,2mg/kg/día y posteriormente 0,2mg/kg/día). Como consecuencia de la inmunosupresión ocasionada por los esteroides, presentó dos exacerbaciones pulmonares, por lo que durante esas fechas la función pulmonar y el control metabólico empeoraron (tabla 1, fig. 1). Una vez controlados dichos procesos, todos los parámetros mejoraron. Desde entonces no ha vuelto a necesitar tratamiento antibiótico ni corticoideo.
El control de la diabetes fue bueno desde el inicio de la terapia, con una dosis inicial de insulina de 0,5 U/kg/día y niveles adecuados de HbA1c (fig. 1). Este control se alteró coincidiendo con las exacerbaciones pulmonares y fue preciso aumentar la dosis de insulina hasta 0,85-1 U/kg/día. Posteriormente el paciente recuperó un buen control glucémico, con una dosis media de insulina de 0,7 U/kg/día.
En la actualidad, con 27 años de edad, la DRFQ se controla con la administración de 3 dosis de insulina regular antes de las 3 principales comidas, junto con 2 dosis de análogo de insulina de acción retardada detemir (Levemir®) antes del desayuno y de la cena (dosis total 0,7 U/kg/día). El control metabólico es muy bueno (HbA1c de 6,5%), sin presentar ninguna complicación diabética. Ocho años tras el diagnóstico de DRFQ el paciente no cumple criterios de trasplante pulmonar, mantiene una FVC de 2,08 l (43%) y un FEV1 de 1,0 l (47%), no precisa oxigenoterapia y tiene una buena calidad de vida.
DiscusiónVarios estudios han enfatizado el efecto beneficioso de la insulina en pacientes con DRFQ sobre la función pulmonar, adscrito no sólo a su efecto normoglucemiante, sino también al propio efecto anabólico de la insulina16. El déficit de insulina incrementa el riesgo de infección pulmonar, empeora el estado nutritivo y lleva a una disminución de la masa muscular intercostal y diafragmática, factores todos ellos que contribuyen al empeoramiento de la función pulmonar en pacientes con FQ17. Por ello, muy recientemente la Sociedad Americana de Diabetes, la Fundación Americana de Fibrosis Quística y la Sociedad Americana de Pediatría han publicado una nueva Guía-Consenso sobre el cribado y tratamiento de las alteraciones hidrocarbonadas en la FQ, con el objetivo de fomentar una actuación lo más precoz posible para proteger la función pulmonar y el estado nutritivo de estos pacientes13. La Guía indica que en pacientes con FQ el cribado debe realizarse anualmente desde los 10 años de edad mediante una sobrecarga oral de glucosa. El acuerdo más innovador es la utilización precoz de la insulina, incluso en la DRFQ sin hiperglucemia en ayunas. También se apunta que el uso de insulina puede ser muy positivo ya en fases previas de la alteración hidrocarbonada, antes del diagnóstico de diabetes. Otro posicionamiento de este Consenso es la no utilidad de antidiabéticos orales en estos pacientes con FQ. Los cambios dietéticos y el ejercicio físico tienen un papel secundario en la DRFQ, donde la dieta no debe tener restricciones y el ejercicio se debe adaptar a las posibilidades de cada paciente.
En nuestro paciente, el buen control de la DRFQ parece haber jugado un papel positivo en la mejoría de su función pulmonar. Un dato que debe tenerse en cuenta en este caso es que dicho beneficio le permitió dejar de cumplir criterios de trasplante pulmonar; en los 8 años siguientes y hasta la actualidad se ha mantenido fuera de la indicación de trasplante, con excepción de un periodo limitado de 6 meses, el cuarto año tras el diagnóstico de DRFQ, coincidiendo con el brote de ABPA y las exacerbaciones pulmonares.
La DRFQ afecta al 12-35% de la población con FQ, y su prevalencia aumenta con la edad6,10. El trasplante pulmonar es la única terapia para controlar definitivamente el estadio final de la enfermedad pulmonar en la FQ, aunque tiene una alta mortalidad18 y existen criterios estrictos para la selección de los candidatos14,15. Nuestro paciente presentaba factores que se asocian más con el desarrollo de DRFQ como son la edad, el uso de corticoterapia sistémica y un genotipo de riesgo (las mutaciones R553X y del508F)3,7. Por otro lado, tenía dos factores predictivos de enfermedad pulmonar «menos grave»: el diagnóstico tardío de FQ y la suficiencia pancreática exocrina (que suele existir en pacientes con mutaciones de FQ menos graves y sin diabetes). Sin embargo, estos factores no le protegieron de un deterioro rápido de su función pulmonar. Se ha demostrado un empeoramiento de la función pulmonar meses e incluso años antes del diagnóstico de la DRFQ7,8,11, dato comprobado en todos los grupos de edad19.
Aunque en este paciente el brote de ABPA que padeció antes del diagnóstico de la DRFQ podría considerarse factor de riesgo para el brusco deterioro respiratorio, la buena respuesta del paciente al tratamiento esteroideo, evidenciada por el descenso significativo de los valores de la IgE total sérica, hace poco probable que la ABPA sea la causante principal del deterioro pulmonar que experimentó el paciente. La ausencia de importantes efectos secundarios de la corticoterapia, como miopatía, hacen pensar que la corticoterapia tampoco fue un factor de riesgo importante que justificara el rápido deterioro pulmonar del paciente. Además, los esteroides orales, por su potente acción antiinflamatoria, en ocasiones son utilizados en las fases avanzadas de esta enfermedad en un intento de frenar el deterioro respiratorio, a pesar de sus posibles efectos secundarios, como el aumento del número de exacerbaciones pulmonares y la hiperglucemia. Por otro lado, en este paciente las exacerbaciones pulmonares respondieron positivamente a la antibioterapia, pero no así el deterioro funcional. La coincidencia en el tiempo del diagnóstico de la DRFQ y el inicio de la insulinoterapia con la marcada mejoría de la función pulmonar convierten a la diabetes en el principal factor candidato causal del grave deterioro funcional respiratorio, y a la insulina en el principal factor candidato causal de la marcada y mantenida recuperación clínica del paciente. En este sentido, estudios previos han demostrado una mejoría significativa de la función pulmonar durante el tratamiento con insulina en pacientes con DRFQ5,10,11,17. La necesidad de mantener el tratamiento insulínico para conseguir un buen control metabólico un vez superadas las exacerbaciones pulmonares confirma el diagnóstico de diabetes, excluyendo al tratamiento corticoideo como único causante de las hiperglucemias iniciales, más aún cuando la dosis de metilprednisolona era baja en el momento del diagnóstico de la DRFQ. Aunque no existen estudios prospectivos sobre la duración del efecto beneficioso de la insulina en la FQ, los resultados de los parámetros clínicos en la evolución de nuestro paciente apoyan la idea de que, al menos en algunos pacientes con FQ, la insulinoterapia mejora de forma mantenida la enfermedad pulmonar20.
Se ha estudiado la correlación genotipo-fenotipo en la FQ para la mayoría de las características clínicas de la enfermedad, y no se ha encontrado una correlación directa significativa21,22. Nuestro paciente posee las dos mutaciones más frecuentes del gen CFTR asociadas con diabetes en la FQ (del508F y R553X). La alta prevalencia de este genotipo en la FQ va en contra de una relación causal con la evolución excepcional que aquí presentamos. Es más, en una amplia cohorte internacional de 399 pacientes con FQ la combinación genotípica del508F/R553X no se ha correlacionado con una mala evolución de la enfermedad pulmonar21. Así, es posible que otros genes diferentes al CFTR puedan influir en la evolución pulmonar de los pacientes con FQ23,24.
En conclusión, la evolución clínica de nuestro paciente apoya lo ya descrito sobre el papel que la insulina y el buen control metabólico de la DRFQ pueden tener sobre la función pulmonar y el estado nutricional de estos pacientes. Esto sustenta la necesidad de realizar cribados regulares de las alteraciones del metabolismo hidrocarbonado en los pacientes con FQ que experimenten un empeoramiento de la función pulmonar de causa no aclarada, ya que el tratamiento precoz de la DFRQ con insulina puede tener un impacto positivo.