La afectación muscular del paciente crítico está presente en la mayoría de pacientes que ingresan en el servicio de medicina intensiva (SMI). La alteración, en particular, del músculo diafragmático, inicialmente englobada en esta categoría, se ha diferenciado en los últimos años y se ha demostrado la existencia de una disfunción muscular propia de los pacientes sometidos a ventilación mecánica. En este subgrupo de pacientes encontramos una disfunción muscular que aparece de manera precoz después del inicio de la ventilación mecánica y que se relaciona principalmente con el uso de modalidades control, la presencia de sepsis y/o de fracaso multiorgánico. Aunque se desconoce la etiología concreta que desencadena el proceso, el músculo presenta procesos de estrés oxidativo y alteración mitocondrial que provocan un desequilibrio en la síntesis proteica, con el resultado de atrofia y alteración de la contractilidad y, como consecuencia, una menor funcionalidad. No fue, de hecho, hasta 2004 cuando Vassilakopoulos et al. describieron el término «disfunción diafragmática asociada a ventilación mecánica», que, junto a la lesión por sobredistensión pulmonar y por barotrauma, representan un reto en el día a día de los pacientes ventilados.
La disfunción diafragmática tiene influencia en el pronóstico, retardando la extubación, aumentando la estancia hospitalaria y afectando la calidad de vida de estos pacientes en los años siguientes al alta hospitalaria. La ecografía, como técnica no invasiva y accesible en la mayoría de unidades, podría ser de utilidad en el diagnóstico precoz para iniciar, de forma avanzada, la rehabilitación e influir positivamente en el pronóstico de estos enfermos.
Muscle involvement is found in most critical patients admitted to the intensive care unit (ICU). Diaphragmatic muscle alteration, initially included in this category, has been differentiated in recent years, and a specific type of muscular dysfunction has been shown to occur in patients undergoing mechanical ventilation. We found this muscle dysfunction to appear in this subgroup of patients shortly after the start of mechanical ventilation, observing it to be mainly associated with certain control modes, and also with sepsis and/or multi-organ failure. Although the specific etiology of process is unknown, the muscle presents oxidative stress and mitochondrial changes. These cause changes in protein turnover, resulting in atrophy and impaired contractility, and leading to impaired functionality. The term ‘ventilator-induced diaphragm dysfunction’ was first coined by Vassilakopoulos et al. in 2004, and this phenomenon, along with injury cause by over-distention of the lung and barotrauma, represents a challenge in the daily life of ventilated patients.
Diaphragmatic dysfunction affects prognosis by delaying extubation, prolonging hospital stay, and impairing the quality of life of these patients in the years following hospital discharge. Ultrasound, a non-invasive technique that is readily available in most ICUs, could be used to diagnose this condition promptly, thus preventing delays in starting rehabilitation and positively influencing prognosis in these patients.
La ventilación mecánica (VM) ha sido utilizada a lo largo de la historia como una herramienta fundamental en el tratamiento de los pacientes con insuficiencia respiratoria, lo que ha permitido una mejoría en su pronóstico. Casi el 40% de los pacientes ventilados mecánicamente presentarán dificultades en la desconexión de la VM, que pueden ser de causa multifactorial. Un retraso en la desconexión puede implicar un aumento de la estancia en los servicios de medicina intensiva (SMI), así como un peor pronóstico1-3 y un aumento de la mortalidad de casi el 12% respecto a los pacientes que no la presentan4.
Es en las últimas décadas cuando se ha centrado la atención en el estudio de la disfunción diafragmática inducida por la ventilación (DDIV)5 como una complicación más de la VM. Este término hace referencia a la disfunción diafragmática que se produce de forma precoz tras la instauración de la VM6. La existencia de DDIV empeora el pronóstico y se asocia a un fracaso en la extubación, con un aumento de los días de VM7-12 y de la mortalidad13-16. No obstante, en la actualidad no se realiza una monitorización rutinaria de la función diafragmática en muchas unidades, por lo que cabe pensar que esta entidad se encuentra sistemáticamente infradiagnosticada17.
Disfunción diafragmática inducida por la ventilación mecánicaAunque la debilidad de la musculatura respiratoria se podría incluir dentro de la afectación muscular global del paciente crítico, en la última década se ha desarrollado el concepto de DDIV18. Este término se refiere a la disfunción de la musculatura diafragmática secundaria al efecto negativo de la propia VM y que puede ocurrir, en paralelo o no, con la afectación del resto de musculatura.
Estudios previos habían descrito que la completa inactividad diafragmática que se producía en los pacientes ventilados con modalidades controladas producía una pérdida rápida y progresiva de la función diafragmática19,20. Sin embargo, fue Vassilakopoulos quien, por primera vez en 2004, acuñó el término DDIV18. La DDIV se define como un descenso progresivo de la fuerza muscular diafragmática que ocurre de forma precoz tras el inicio de la VM8,21. La importancia clínica de la DDIV radica en su pronta aparición y afecta hasta a un 65% de los pacientes ventilados7.
Fisiopatología de la disfunción diafragmática inducida por la ventilaciónSon varios los estudios que han demostrado que la utilización de modalidades de VM controlada (VMC), donde el esfuerzo inspiratorio no proviene del paciente y no se realiza una contracción activa del diafragma, producen en menos de 24h una disfunción contráctil y atrofia diafragmática tanto en animales de experimentación como en humanos20,22,23. El músculo atrófico presenta una pérdida de fuerza y una menor excursión diafragmática debida a la disminución del área de sección transversal de las fibras musculares, que se traduce en una menor capacidad inspiratoria7,24. A continuación se exponen los fundamentos fisiopatológicos que se asocian a la DDIV.
Atrofia diafragmáticaLa atrofia diafragmática inducida por la VMC ocurre de manera extremadamente rápida22. En animales de experimentación, en las primeras 12-18h de VMC ya se puede evidenciar una atrofia diafragmática significativa, sin observarse signos de atrofia periférica25. Por tanto, la atrofia diafragmática inducida por la VM es significativamente mayor a la atrofia por desuso que se produce en la musculatura esquelética22. El grupo de Levine encontró hallazgos similares en pacientes ventilados con VMC entre las 18 y las 69h, y demostraron una reducción significativa (en torno a un 53-57% con respecto a voluntarios sanos) tanto de las fibras tipo1 como tipo2 en la sección transversal de biopsias diafragmáticas23.
Cambios en la ultraestructura de las fibras muscularesLa VMC da lugar a alteraciones tiempo-dependientes en la ultraestructura de las fibras musculares diafragmáticas19,26,27. Inicialmente aparecen áreas con miofibrillas anormales por desorganización miofibrilar y alteraciones en las líneas Z19. Posteriormente aparecerán áreas de regeneración de fibras musculares sin signos de inflamación27. Y finalmente, si la VM se prolonga en el tiempo (más de 3días) se producirá un aumento de vacuolas lipídicas citoplasmáticas probablemente en relación con un proceso autofágico27-29.
Disfunción contráctilEl grupo de Le Bourdelles fue el primero en describir, en 1994, mediante un modelo animal, la aparición de una disfunción contráctil diafragmática tras 48h del inicio de VMC30. La VM prolongada promueve una disminución de la fuerza diafragmática progresiva y tiempo-dependiente20. Al igual que ocurre con la atrofia, 12h de VMC son suficientes para evidenciar una reducción en la fuerza diafragmática31,32. Varios estudios han demostrado que el pico de presión inspiratoria máxima es menor en pacientes sometidos a VM de forma prolongada comparado con controles18.
Alteraciones en el recambio proteicoLa atrofia y la disfunción diafragmática que se producen con relación al uso de VMC ocurren de forma primaria debido a un descenso en la síntesis proteica y a un aumento de la proteólisis23,33. La síntesis proteica del diafragma puede disminuir un 30% después de solo 6h de VM33. Por otra parte, el aumento de la proteólisis se encuentra en relación con la activación de vías de proteasas (calpaína, caspasa-3 y sistema ubiquitín-proteasoma), vías de apoptosis y activación de autofagia34,35. Hooijman et al. analizaron la actividad de la vía de la ubiquitín-proteasoma en muestras de biopsia diafragmática de pacientes ventilados durante cirugía torácica. En estos pacientes, en los que existía un aumento significativo de esta vía, se demostró un descenso de aproximadamente un 25% de la sección transversal de las fibras musculares diafragmáticas, tanto lentas como rápidas, y un descenso de su fuerza contráctil36,37.
Aumento del estrés oxidativoDurante la VMC se producen alteraciones en la morfología mitocondrial que provocan alteraciones de su función y exceso de creación de especies reactivas de oxígeno (ROS). Se observa un aumento del estrés oxidativo a nivel diafragmático, que funciona como desencadenante de la activación de las vías de la calpaína y caspasa-3 a este nivel34,38,39. En pacientes donantes en muerte encefálica se ha confirmado la aparición muy precoz (18h) de una reducción del diámetro de las fibras musculares diafragmáticas con la evidencia de fenómenos de estrés oxidativo y activación de proteasas a nivel diafragmático23. Por otra parte, la VM prolongada da lugar a una disminución de la capacidad antioxidante en el diafragma, reflejada por el descenso de los niveles de glutatión, CuZn superóxido dismutasa y de la actividad glutatión peroxidasa40.
Efecto de la patología crítica sobre la función diafragmáticaAunque se conocen las consecuencias de la disfunción diafragmática debido a la VM en modalidad control, las vías que provocan su aparición son aún desconocidas. La inactividad diafragmática induce la aparición de atrofia diafragmática de manera progresiva y tiempo-dependiente6,25. Sin embargo, existen otros factores cuya presencia aumenta el riesgo de desarrollo de DDIV y de que la afectación diafragmática sea más importante. La sepsis y el fallo multiorgánico son los factores que se han asociado de una forma más robusta, con un mayor grado de disfunción diafragmática en los pacientes sépticos que en los pacientes con shock de otra etiología7. La situación proinflamatoria que existe en estas patologías puede dar lugar a una reducción en la síntesis proteica, así como a un incremento en la proteólisis, pudiendo desencadenar por sí misma una pérdida de masa muscular aguda9,41.
Factores concomitantes y el tratamiento con fármacos (corticoides o relajantes musculares, por ejemplo) pueden exacerbar la DDIV. Sobre los relajantes musculares, existen 2 estudios realizados en ratones que confirman que el uso de rocuronio exacerba la disfunción contráctil inducida por la VM42,43. Con respecto al efecto de los corticoides sobre la función diafragmática, existen datos contradictorios. En el estudio de Sassoon et al. se encontró una asociación entre la administración de metilprednisolona a altas dosis y el descenso de la fuerza inspiratoria en un modelo experimental44. Sin embargo, el grupo de Maes demostró que la administración de una única dosis de corticoesteroides disminuía el efecto deletéreo producido por la VM42. Datos experimentales han relacionado la presencia de hiperglucemia con el descenso de la fuerza diafragmática, en relación con un aumento de los procesos de estrés oxidativo45.
Modalidades de ventilación mecánica invasiva y disfunción diafragmática inducida por la ventilaciónLas alteraciones diafragmáticas de la DDIV, secundarias a la ventilación en modalidad controlada, se han evidenciado en modelos animales y humanos y son de aparición muy precoz8,23,26,33,46,47. Esta modalidad, en la que el diafragma se encuentra totalmente inactivo, puede producir una mayor atrofia y disfunción contráctil, con el consiguiente descenso de la fuerza diafragmática. A diferencia de las modalidades de VMC, en la VM no controlada el paciente debe realizar esfuerzo inspiratorio. Esta acción podría, como sugieren varios autores, prevenir el efecto deletéreo de la ventilación en modalidad control. En el estudio de Doering et al. se evidenciaba que el uso de forma prolongada de niveles altos de presión en modalidades de presión soporte, producía también atrofia y disfunción contráctil48. Por el contrario, Futier et al. sugieren que la VM asistida y la presión soporte reducirían la proteólisis e incrementarían la síntesis proteica a nivel diafragmático49. Asimismo, en el estudio de Gayan-Ramírez et al. se refuerza la idea de que la inactividad del diafragma es el principal factor que promueve la DDIV, con la demostración que periodos cortos de respiración espontánea durante la VMC retardaban los efectos de la VMC sobre el diafragma50. Los cambios en la configuración diafragmática podrían prevenirse manteniendo los niveles de esfuerzo inspiratorio proporcionados por la presión soporte51.
Ventilación mecánica no invasiva y oxigenoterapia de alto flujoExiste solo un estudio que evalúa la funcionalidad diafragmática después del inicio de la VM no invasiva. En él se concluye que existe un descenso de la fuerza generada por el diafragma tras el inicio de esta y que se relaciona con niveles elevados de presión soporte52. La VMNI ejerce una presión positiva, con un cierto grado de aplanamiento y estiramiento muscular, que podría ser el origen de la disfunción.
La oxigenoterapia de alto flujo aporta hasta 60l/min de gas con la FIO2 correspondiente, que genera niveles bajos de presión positiva y cambios en el patrón ventilatorio, con aumento del volumen circulante53 pero sin que existan, hasta el momento, estudios que analicen su repercusión sobre la función diafragmática. Sin embargo, mediante este sistema de soporte respiratorio el paciente mantiene en todo momento la completa activación diafragmática, por lo que sus consecuencias deberían ser escasas.
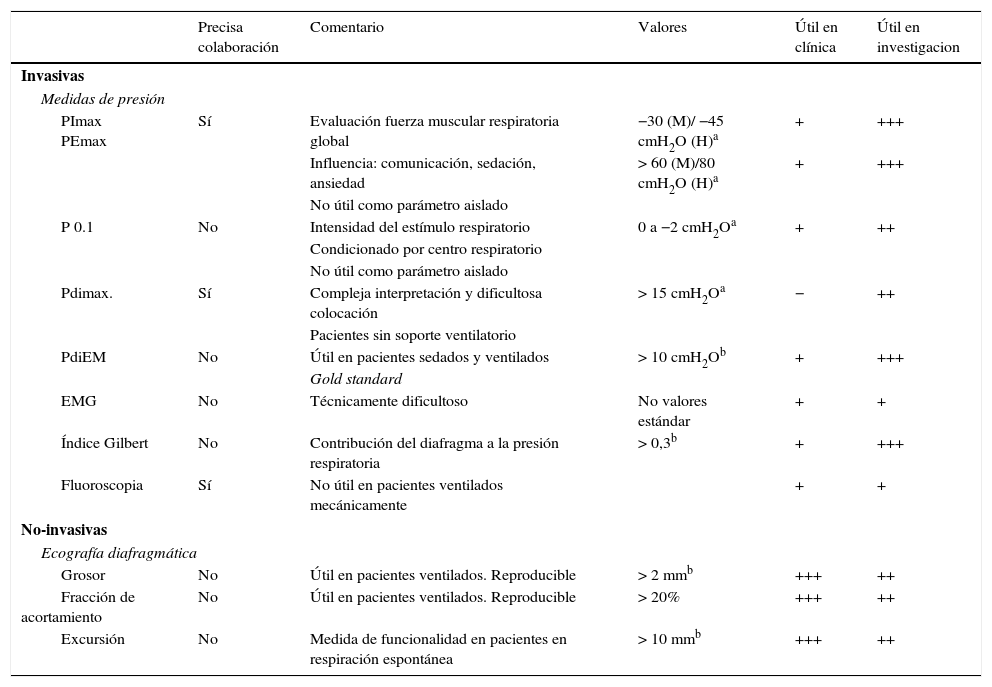
Diagnóstico y monitorizaciónEn muy pocos SMI se realiza una monitorización rutinaria de la función de la musculatura respiratoria, bien por infraestimación de su importancia, bien por las dificultades técnicas para llevarla a cabo17. El diagnóstico de DDIV es inicialmente de sospecha en los pacientes ventilados mecánicamente en los que se han solucionado los factores intercurrentes, pero que presentan dificultad en la retirada de la VM. En el caso de la DDIV no se ha encontrado relación entre la exploración clínica y el grado de disfunción diafragmática54, por lo que las exploraciones complementarias son obligadas para el diagnóstico (tabla 1). A continuación se detallan algunos de los métodos diagnósticos que reflejan mejor la contribución del diafragma a la respiración, unos útiles solo en investigación y otros aplicables en la práctica clínica.
Pruebas para la evaluación de la función diafragmática en pacientes en ventilación mecánica
| Precisa colaboración | Comentario | Valores | Útil en clínica | Útil en investigacion | |
|---|---|---|---|---|---|
| Invasivas | |||||
| Medidas de presión | |||||
| PImax PEmax | Sí | Evaluación fuerza muscular respiratoria global | −30 (M)/ −45 cmH2O (H)a | + | +++ |
| Influencia: comunicación, sedación, ansiedad | > 60 (M)/80 cmH2O (H)a | + | +++ | ||
| No útil como parámetro aislado | |||||
| P 0.1 | No | Intensidad del estímulo respiratorio | 0 a −2 cmH2Oa | + | ++ |
| Condicionado por centro respiratorio | |||||
| No útil como parámetro aislado | |||||
| Pdimax. | Sí | Compleja interpretación y dificultosa colocación | > 15 cmH2Oa | − | ++ |
| Pacientes sin soporte ventilatorio | |||||
| PdiEM | No | Útil en pacientes sedados y ventilados | > 10 cmH2Ob | + | +++ |
| Gold standard | |||||
| EMG | No | Técnicamente dificultoso | No valores estándar | + | + |
| Índice Gilbert | No | Contribución del diafragma a la presión respiratoria | > 0,3b | + | +++ |
| Fluoroscopia | Sí | No útil en pacientes ventilados mecánicamente | + | + | |
| No-invasivas | |||||
| Ecografía diafragmática | |||||
| Grosor | No | Útil en pacientes ventilados. Reproducible | > 2 mmb | +++ | ++ |
| Fracción de acortamiento | No | Útil en pacientes ventilados. Reproducible | > 20% | +++ | ++ |
| Excursión | No | Medida de funcionalidad en pacientes en respiración espontánea | > 10 mmb | +++ | ++ |
PdiEM: presión transdiafragmática por estimulación magnética del nervio frénico; Pdimax: presión transdiafragmática máxima; PEmax: presión espiratoria máxima; PImax: presión inspiratoria máxima.
La presión esofágica es un buen estimador de la presión pleural55,56. Si además de la presión esofágica disponemos de la presión gástrica, podemos calcular la presión transdiafragmática (Pdi), que no es más que la diferencia entre la presión pleural y la abdominal, la cual permite un cálculo específico de la fuerza diafragmática7,13,57,58. El gold standard en los pacientes que no pueden colaborar en el estudio es el cálculo de la Pdi a través de la estimulación magnética cervical del nervio frénico8,54,59. Sin embargo, su principal limitación reside en que es una técnica invasiva y no disponible en la mayoría de SMI.
Desde el inicio de la VM se puede detectar un descenso de la Pdi59. Dicho descenso aumenta de forma logarítmica con los días de VM8. Por otra parte, en el estudio de Demoule et al.7 se evidenció que valores de Pdi menores de 11cmH2O en el primer día de ingreso en el SMI condicionaban un peor pronóstico, una mortalidad elevada (49%) y un aumento en los días de VM7,14.
El cálculo del índice de Gilbert a través de la Pdi (ΔPresión gástrica/ΔPdi) durante una inspiración normal evalúa la generación de presión durante una respiración de reposo, reflejo de la fuerza generada por el diafragma60. Watson y colaboradores, mediante ecografía diafragmática y Pdi en pacientes sometidos a cirugía cardiotorácica, encontraron buena correlación entre valores bajos de excursión diafragmática e índices de Gilbert bajos61.
P0.1La P0.1 mide la presión negativa generada por el paciente contra una vía aérea artificial en los 100 primeros milisegundos de un esfuerzo inspiratorio, siendo un reflejo del impulso neuromuscular transmitido por el nervio frénico62. Aunque tiene limitaciones, es una medida de estímulo central y es un indicador de función diafragmática63,64. Esta medida ha sido incorporada en los respiradores artificiales, lo que la ha convertido en una variante clínica accesible a pie de cama65.
UltrasonografíaLa necesidad de un diagnóstico precoz y de una técnica accesible y no invasiva justifica el empleo creciente de la ecografía para la evaluación y seguimiento de la función diafragmática y del esfuerzo inspiratorio66. Sus limitaciones residen en la variabilidad inter e intraobservador y en la posibilidad de aplicar el estudio dinámico (excursión diafragmática) solo en pacientes sin VM67-70. Por otra parte, son varios los estudios que han demostrado buena precisión y reproducibilidad de los ultrasonidos en la valoración de la función diafragmática, tanto en voluntarios sanos como en pacientes críticos52,69.
El grosor diafragmático (como signo de atrofia), la fracción de acortamiento y el estudio de la movilidad diafragmática (como signo de actividad diafragmática) son los parámetros más evaluados por ecografía.
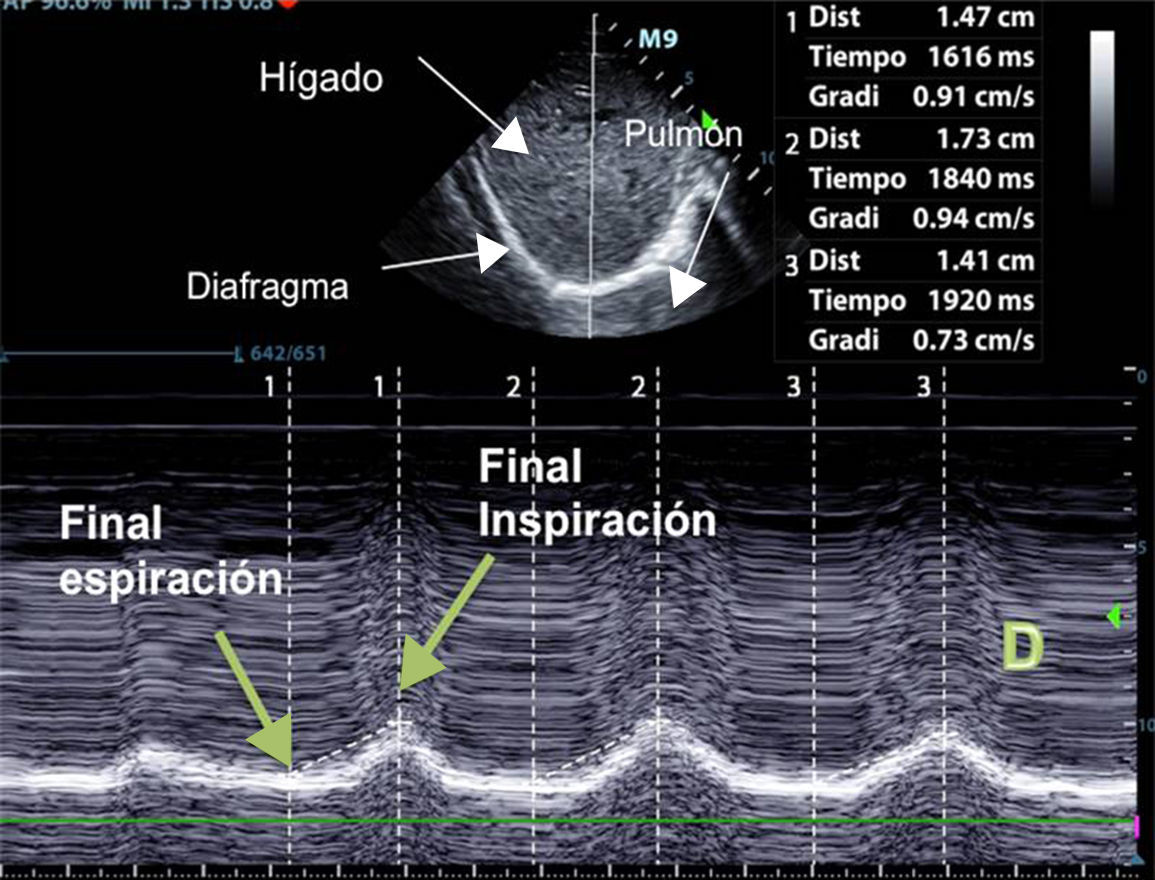
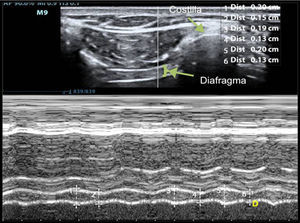
Excursión diafragmáticaPara valorar el desplazamiento diafragmático debemos utilizar una sonda de 3,5-5MHz, que se posicionará debajo de la parrilla costal a nivel de la línea medioclavicular, dirigiendo el haz de ultrasonidos perpendicular al tercio posterior de dicho hemidiafragma. Durante la inspiración, el diafragma normal se desplaza de forma caudal y, por tanto, se acercará al transductor (fig. 1).
Los valores normales en pacientes no ventilados sanos son diferentes para hombres y mujeres (18±3 y 16±3mm, respectivamente)69, siendo similares a valores basales encontrados en pacientes ventilados mecánicamente71. Se define disfunción diafragmática como una excursión menor de 10mm o una excursión negativa (o movimiento paradójico). Estos valores serían también buenos predictores de un fracaso en la desconexión del paciente72.
Grosor diafragmáticoEl grosor del diafragma depende de la masa muscular, y esta se correlaciona con la capacidad vital forzada73. La disminución del grosor diafragmático se asocia al descenso de amplitud valorada por electromiografía y puede indicar la presencia de atrofia23,74.
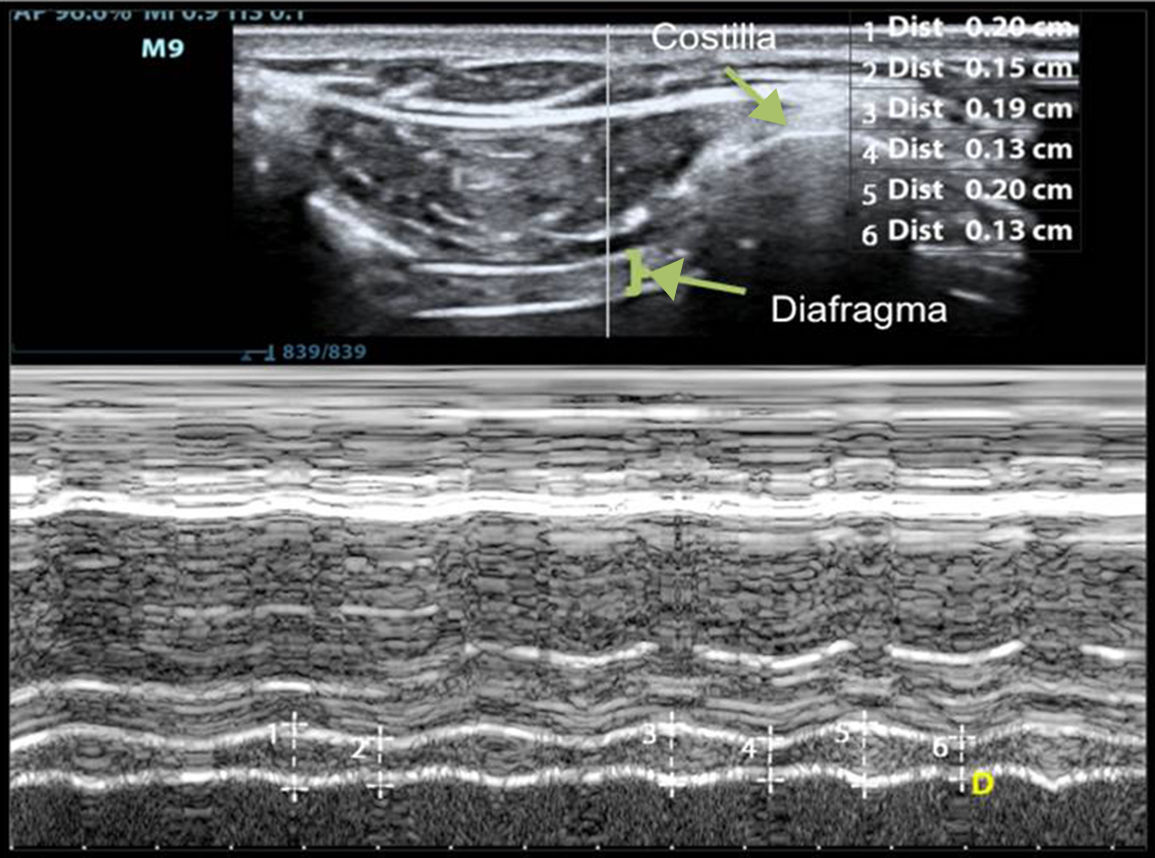
El grosor diafragmático es cuantificable de forma sencilla por ultrasonografía, siendo el hemidiafragma derecho, a través de su ventana hepática, más accesible que el izquierdo51. Para medir el grosor utilizaremos una sonda de 10-12MHz, colocándola de manera perpendicular sobre el 9.°-10.° espacio intercostal en la línea axilar anterior, para observar parte de la zona de aposición del diafragma con la caja torácica. En esta área, el diafragma se observa como 3 capas de distintas densidades dispuestas paralelamente (pleura, diafragma y peritoneo)51,70. El grosor diafragmático se mide mediante la realización de un modo M o con la imagen 2D durante una espiración no forzada (fig. 2). El grosor diafragmático normal en pacientes ventilados es de 2,4±0,8mm, indicando atrofia valores por debajo de 2 mm51. Se consideran valores normales ratios de 1,8, aceptándose como límite inferior ratios de 1,268.
Medición de la variación del grosor diafragmático mediante modo-M a nivel de hemidiafragma derecho. El diafragma se visualiza como 3 líneas paralelas: 2 hiperecogénicas con una central hipoecogénica y de mayor grosor. El número 1 representa el grosor inspiratorio y el número 2, el grosor espiratorio. La fracción de acortamiento diafragmático es la diferencia entre el grosor inspiratorio y el grosor espiratorio.
La variación del grosor diafragmático puede calcularse usando un modo M mediante la fórmula que se muestra en la figura 3. La variación del grosor diafragmático puede utilizarse como un indicador de la capacidad diafragmática para generar presión52,75. Una variación <20% podría ser considerada como un predictor de fracaso de la desconexión de la VM54, con una mejor predicción que el uso del índice de Tobin76.
El grupo de Grosu encontró un descenso diario del 6% del grosor diafragmático dentro de las primeras 48h de ventilación mediante modalidades asistidas67. En el estudio de Schepens et al., donde la mayoría de pacientes recibían ventilación en modalidad control, este valor fue del 10,9%71. Aunque no se encontró una asociación directa entre el grosor y la ventilación en modalidad control, los datos anteriormente mencionados muestran un mayor descenso del grosor en los pacientes principalmente ventilados con modalidad controlada.
En pacientes sometidos a VM, al contrario que la excursión diafragmática, el cambio de grosor diafragmático reflejaría realmente la contracción diafragmática activa. Así lo demuestra el estudio del grupo de Goligher, el cual no observa variaciones del mismo en pacientes relajados y sí en voluntarios sanos y pacientes sometidos a distintos métodos de VM74. En pacientes no ventilados la variación del grosor ha demostrado estar relacionada de forma directa con los volúmenes pulmonares70,77,78 y con la presión inspiratoria máxima79 y, por lo tanto, supondría una medición indirecta de la actividad contráctil y de la carga de trabajo del diafragma.
Marcadores analíticosEn análisis de sangre no se ha hallado relación entre la aparición de atrofia de la musculatura respiratoria y un aumento en las cifras de enzimas de origen muscular como la creatincinasa ni la mioglobina9. Un aumento de la proteína esquelética troponinai podría ser, en un futuro, utilizado como un marcador de lesión muscular diafragmática80-82.
ConclusionesLa disfunción diafragmática del paciente ventilado mecánicamente es una patología todavía desconocida e infradiagnosticada. Aparece de forma prematura desde el inicio de la VM, está asociada a factores de riesgo como la sepsis y el fallo multiorgánico, y afecta a un porcentaje elevado de pacientes, siendo motivo de fracaso de la extubación.
Son necesarios futuros estudios para determinar los procesos iniciales que desencadenan el inicio de la alteración proteica y para el desarrollo de técnicas no invasivas y accesibles en la cabecera del paciente que permitan establecer un diagnóstico temprano, con un papel cada vez más importante para la ultrasonografía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Sra. Marta Gas, del Servicio de Medicina Intensiva del Hospital del Mar de Barcelona, por su predisposición y amable colaboración.