Evaluar los resultados de la tomografía computarizada (TC) de tórax en pacientes con antracofibrosis bronquial aislada demostrada broncoscópica y anatomopatológicamente.
MetodologíaSe incluyó en el estudio a un total de 58 pacientes con antracofibrosis bronquial aislada (29 mujeres; media de edad, 70 años). El diagnóstico de antracofibrosis bronquial se estableció en función de las observaciones broncoscópicas y anatomopatológicas en todos los pacientes. Los diversos aspectos observados en la TC torácica fueron revisados retrospectivamente por 2 radiólogos torácicos, que tomaron las decisiones por consenso.
ResultadosResaltamos el engrosamiento del tejido blando peribronquial central (n=37, 63,8%) como un hallazgo importante en las exploraciones de imagen, que causa estenosis (n=37, 63,8%) u obstrucción bronquial (n=11, 19%). Se observaron múltiples estenosis bronquiales con afectación simultánea de 2, 3 y 5 bronquios en 12 (21%), 9 (15%) y 2 (3,4%) pacientes, respectivamente. Se detectaron atelectasias segmentarias y colapsos lobulares y multilobulares. Estas observaciones se realizaron sobre todo en el pulmón derecho, con un predominio del lóbulo medio derecho. Se observaron también patrones de atenuación en mosaico, nódulos parenquimatosos diseminados, patrones nodulares y ganglios linfáticos calcificados o no calcificados.
ConclusionesEn la TC de tórax, la antracofibrosis bronquial aislada se observa en forma de engrosamiento de tejido blando peribronquial, estenosis u obstrucción bronquiales, atelectasia segmentaria o colapso lobular o multilobular. Estas observaciones fueron más frecuentes en el lado derecho, con múltiples bronquios afectados de manera simultánea en algunos pacientes.
To evaluate the chest computed tomography (CT) findings of patients with isolated bronchial anthracofibrosis confirmed by bronchoscopy and histopathology.
MethodologyFifty-eight patients with isolated bronchial anthracofibrosis (29 females; mean age, 70 years) were enrolled in this study. The diagnosis of bronchial anthracofibrosis was made based on both bronchoscopy and pathology findings in all patients. The various chest CT images were retrospectively reviewed by two chest radiologists who reached decisions in consensus.
ResultsCentral peribronchial soft tissue thickening (n=37, 63.8%) causing bronchial narrowing (n=37, 63.8%) or obstruction (n=11, 19%) was identified as an important finding on imaging. Multiple bronchial stenoses with concurrent involvement of 2, 3, and 5 bronchi were seen in 12 (21%), 9 (15%), and 2 (3.4%) patients, respectively. Segmental atelectasis and lobar or multilobar collapse were detected. These findings mostly occurred in the right lung, predominantly in the right middle lobe. Mosaic attenuation patterns, scattered parenchymal nodules, nodular patterns, and calcified or non-calcified lymph nodes were also observed.
ConclusionsOn chest CT, isolated bronchial anthracofibrosis appeared as peribronchial soft tissue thickening, bronchial narrowing or obstruction, segmental atelectasis, and lobar or multilobar collapse. The findings were more common in the right side, with simultaneous involvement of multiple bronchi in some patients.
La antracosis es la pigmentación negra de la mucosa bronquial visible en la broncoscopia o identificada en el examen histológico y es característico que esté relacionada con la presencia de neumoconiosis o una exposición intensa a partículas atmosféricas de carbono u hollín. Chung et al. describieron con el término «antracofibrosis» la pigmentación oscura de la capa mucosa de los bronquios, que daba lugar a un estrechamiento o estenosis bronquial1.
Dada la prevalencia de la antracofibrosis en los pacientes ancianos y la existencia de algunas similitudes en los signos observados en las exploraciones de imagen con los producidos por el cáncer de pulmón, su diferenciación puede llegar a ser bastante difícil. Además, la asociación causal entre la antracofibrosis y la tuberculosis es una cuestión que continúa suscitando controversia, y los signos de una y otra en las exploraciones de imagen pueden interferir entre sí1,2. Así pues, el conocimiento de la antracofibrosis sin ninguna enfermedad acompañante puede poner de manifiesto las características que tiene esta enfermedad pulmonar poco conocida en las exploraciones de imagen.
Los autores han utilizado el término «‘antracofibrosis bronquial aislada» para designar los tatuajes oscuros bronquiales que se observan en el examen broncoscópico y la pigmentación negra existente en el interior de los macrófagos de la mucosa bronquial en los pacientes en los que la evaluación pulmonar para la identificación de tuberculosis, neoplasia o cualquiera otra patología pulmonar manifiesta ha sido negativa. En el presente estudio, hemos intentado determinar y describir las características que tiene en la tomografía computarizada (TC) la «antracofibrosis bronquial aislada» demostrada broncoscópica y anatomopatológicamente.
MetodologíaEste estudio retrospectivo fue aprobado por el comité de ética del centro y se le eximió de la exigencia de obtención de un consentimiento informado.
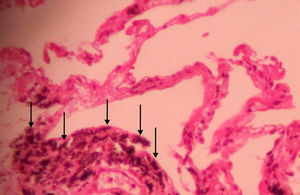
Sujetos del estudioIdentificamos a 111 pacientes consecutivos con pigmentación negra bronquial y una estenosis u obstrucción bronquiales en el examen broncoscópico y una pigmentación antracótica bronquial en el examen histológico de las muestras de biopsia bronquial (fig. 1) entre enero del 2007 y marzo del 2013. De ellos, 11 casos fueron excluidos del estudio; 7 pacientes con neoplasias malignas, según lo indicado por la biopsia pulmonar transtorácica (n=2) o transbronquial (n=4), o la biopsia pleural (n=1), 3 con una neumonía intersticial ordinaria, y un minero del carbón con antecedentes de antracosilicotuberculosis. Se excluyó, asimismo, a los pacientes con antecedentes médicos, signos anatomopatológicos de tuberculosis, con o sin signos radiológicos atribuibles a la tuberculosis pulmonar, así como a los que presentaban resultados positivos en los exámenes de frotis de esputo, cultivo o pruebas de amplificación de ácido nucleico de Mycobacterium tuberculosis. Además, se excluyó del estudio a los pacientes con una prueba de Mantoux positiva. Con ello, 25 pacientes con tuberculosis activa coexistente y 17 con antecedentes de tuberculosis previa fueron excluidos también del estudio. Así pues, realizamos un examen retrospectivo de las exploraciones de imagen de los 58 pacientes restantes; en todos ellos se disponía de una TC de tórax obtenida en un plazo de 0-30 días (media, 7 días) respecto al momento de obtención de la muestra broncoscópica. Se recogió, además, información de cada paciente sobre los síntomas de presentación y los antecedentes de tabaquismo y exposición a polvo o biomasa, a través de una revisión de las historias clínicas.
Obtención de imágenesTodas las exploraciones de imagen se realizaron con un escáner de 4 hileras de detectores (LightSpeed QX/I/; GE Medical Systems, Milwaukee, EE. UU.) y se obtuvieron imágenes de TC helicoidales sin contraste, con una colimación de 5mm, con un factor de paso de 3, en intervalos de imagen de 5mm, a 120kV y 160mAs. Todas las exploraciones se realizaron de los vértices pulmonares hacia las bases y todas las imágenes fueron revisadas con el empleo de ventanas apropiadas para el mediastino (anchura de ventana, 300-450 unidades Hounsfield (HU); altura de ventana, 30-50 HU) y para el parénquima pulmonar (anchura de ventana, 1.000-1.500 HU; altura de ventana, –600 a –700 HU).
Examen de las imágenesLas imágenes fueron examinadas y evaluadas mediante consenso por 2 radiólogos que tenían, cada uno, más de 8 años de experiencia en la interpretación de la TC de tórax.
En el análisis de la TC se incluyó el engrosamiento de tejido blando peribronquial central, el manguito peribronquial intraparenquimatoso, la estenosis u obstrucción bronquiales, las atelectasias, el colapso, el agrandamiento de ganglios linfáticos, la consolidación, los nódulos, el patrón nodular, el patrón de atenuación en mosaico, la banda parenquimatosa, el patrón reticular, el derrame o engrosamiento pleurales, y cualquier otro signo visible en las imágenes, así como la distribución de las lesiones identificadas.
El engrosamiento de tejido blando peribronquial central se definió como un engrosamiento de la pared peribronquial con atenuación de tejido blando a ambos lados del bronquio en las imágenes axiales, mientras que el manguito peribronquial intraparenquimatoso se definió como un aumento del grosor de la pared bronquial a partir del nivel segmentario en adelante. Se registraron los ganglios linfáticos peribronquiales y mediastínicos visibles, calcificados y no calcificados, y los que tenían un diámetro superior a 10mm en el eje corto se consideraron adenopatías. Se evaluó también y se registró el efecto de presión sobre la vía aérea adyacente producido por ganglios linfáticos calcificados. La atelectasia, el colapso, la consolidación, los nódulos, el patrón nodular, las bronquiectasias, la banda parenquimatosa, el patrón de atenuación en mosaico y el patrón reticular se definieron según las recomendaciones del Comité de Nomenclatura de la Fleischner Society3.
ResultadosLos participantes en el presente estudio fueron 58 pacientes con una media de edad de 70 años (rango, 29-95 años) y sin predominio de un determinado sexo (29 varones y 29 mujeres). Todos los pacientes presentaban tos y/o disnea, pero no había signos anatomopatológicos de bronquitis crónica. Doce pacientes (20,7%) eran fumadores activos; los demás no eran fumadores activos ni pasivos. Ninguno de los pacientes tenía antecedentes de exposición a biomasa ni a polvo de origen laboral conocido; sin embargo, todos los pacientes han vivido en una ciudad de un gran número de habitantes. Los diferentes signos de TC hallados en nuestros pacientes con antracofibrosis bronquial aislada se resumen en la tabla 1.
Resultados de la TC en 58 pacientes con antracofibrosis bronquial aislada
| Número | Porcentaje | |
|---|---|---|
| Engrosamiento de tejido blando peribronquial central | 37 | 63,8 |
| Manguito peribronquial intraparenquimatoso | 36 | 62,0 |
| Estenosis bronquial | 37 | 63,8 |
| Obstrucción bronquial | 11 | 19,0 |
| Colapso lobular | 13 | 22,4 |
| Atelectasia segmentaria | 27 | 46,6 |
| Adenopatía mediastínica | 6 | 10,3 |
| Adenopatía peribronquial | 13 | 22,4 |
| GL calcificado con efecto de presión | 21 | 36,2 |
| Consolidación | 32 | 55,2 |
| Nódulo pulmonar solitario | 11 | 19,0 |
| Nódulos pulmonares múltiples | 8 | 31,0 |
| Patrón nodular | 27 | 46,6 |
| Bronquiectasias | 24 | 41,3 |
| Banda parenquimatosa | 31 | 53,4 |
| Patrón de atenuación en mosaico | 21 | 36,2 |
| Derrame pleural | 17 | 29,3 |
| Engrosamiento pleural | 14 | 24,1 |
| Patrón reticular | 13 | 22,4 |
GL: ganglio linfático.
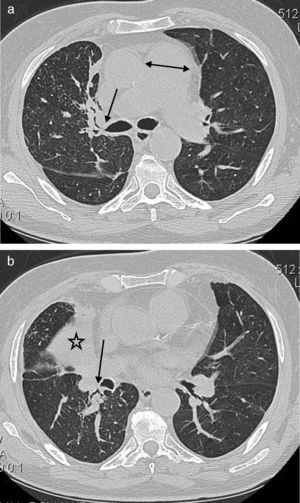
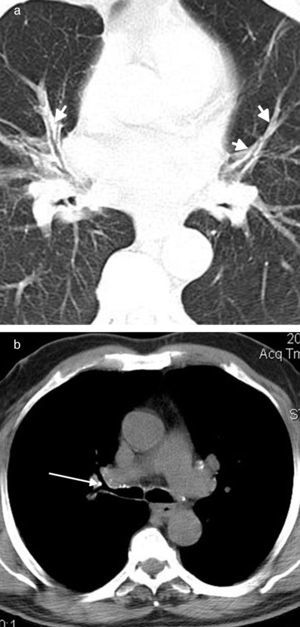
Se observó un engrosamiento de tejido blando peribronquial central (fig. 2) en 37 (63,8%) casos. Ello afectaba predominantemente al lado derecho (lóbulo superior derecho [LSD], n=14; lóbulo superior izquierdo [LSI], n=9; lóbulo medio derecho [LMD], n=23; língula, n=7; lóbulo inferior derecho [LID], n=19; lóbulo inferior izquierdo [LII], n=10). El manguito de infiltración peribronquial intraparenquimatoso (fig. 3 a) se observó en 36 (62%) pacientes, con una mayor tendencia a afectar al lado derecho (LSD, n=12; LSI, n=11; LMD, n=24; língula, n=14; LID, n=27; LII, n=18). El engrosamiento de tejido blando peribronquial central y el manguito de infiltración peribronquial intraparenquimatoso fueron más frecuentes en los bronquios del LMD y LID, respectivamente.
Un varón de 64 años de edad con tos y disnea. a) Imagen de TC a nivel del tronco de la arteria pulmonar que muestra un engrosamiento de tejido blando peribronquial central (flecha) y estenosis del bronquio del LSD. Se observa también el agrandamiento del tronco de la arteria pulmonar (doble punta de flecha). b) TC de tórax con ventana temporal que muestra el colapso del LMD (estrella), así como un engrosamiento del tejido blando peribronquial del LID (flecha) con obliteración del bronquio del segmento apical del lóbulo inferior derecho.
Un varón de 58 años de edad con tos y disnea. a) TC con ventana pulmonar en la que se aprecian múltiples manguitos peribronquiales intraparenquimatosos bilaterales (flechas). b) TC de tórax en la que se aprecia un ganglio linfático calcificado segmentario del lado derecho con un efecto de presión sobre el bronquio adyacente (flecha).
La estenosis y la obstrucción se observaron en 37 (63,8%) y en 11 (19%) pacientes, respectivamente. Se observaron estenosis bronquiales múltiples en 23 (39,7%) pacientes (2 bronquios, n=12; 3 bronquios, n=9; 5 bronquios, n=2). La estenosis bronquial fue más prevalente en los lóbulos derechos que en los contralaterales (LSD, n=16; LSI, n=6; LMD, n=21; língula, n=7; LID, n=14; LII, n=10).
De igual modo, la obstrucción bronquial se observó con mayor frecuencia en el lado derecho (LSD, n=3; LSI, n=1; LMD, n=7). No se detectó obstrucción bronquial en la língula, ni en los lóbulos inferiores derecho o izquierdo. Tiene interés señalar que el bronquio del LMD fue el más comúnmente afectado por la antracofibrosis, con estenosis u obstrucción.
Las afectaciones bronquiales mencionadas causaron un colapso lobular en 13 (22,4%) pacientes; en 2 pacientes hubo un colapso de 2 lóbulos diferentes. Se observó una atelectasia segmentaria en 27 (46,6%) casos y se detectó una afectación de múltiples segmentos en 3 pacientes.
Se detectaron ganglios mediastínicos y peribronquiales visibles en 56 (96,5%) y en 46 (79,3%) pacientes, respectivamente; 47 y 39 de ellos, respectivamente, presentaban ganglios linfáticos calcificados. Seis (10,3%) y 13 (22,4%) pacientes, respectivamente, tenían adenopatías mediastínicas y peribronquiales, con un diámetro de eje corto superior a los 10 mm. Se detectó un efecto de presión sobre los bronquios adyacentes por parte de ganglios linfáticos calcificados en 21 (36,2%) casos (fig. 3 b).
Treinta y dos (55,2%) pacientes presentaron una consolidación, que afectaba sobre todo a los lóbulos medio derecho (n=14), inferior derecho (n=13) e inferior izquierdo (n=13); de entre ellos, 12 pacientes tenían consolidaciones multilobulares. Se detectaron nódulos pulmonares solitarios o múltiples en 11 (19%) y 18 (31%) pacientes, respectivamente, y se observó un patrón nodular en 27 (46,6%) pacientes. Esto último correspondía a innumerables opacidades redondas pequeñas, con una distribución diseminada que eran discretas y tenían un diámetro de entre 2 y 10 mm.
Además, se observaron bronquiectasias en 24 (41,3%) pacientes, siendo el nódulo de la língula el lugar de afectación más frecuente (n=9), y 9 (15,5%) pacientes tenían bronquiectasias en múltiples lóbulos pulmonares. Otros signos observados fueron las bandas parenquimatosas (n=31, 53,4%), el patrón de atenuación en mosaico (n=21, 36,2%), el derrame pleural (n=17, 29,3%), el engrosamiento pleural (n=14, 24,1%) y el patrón reticular (n=13, 22,4%).
DiscusiónHasta donde conocen los autores, el presente estudio es el primero que describe los resultados de la TC en pacientes con antracofibrosis bronquial demostrada tanto broncoscópica como anatomopatológicamente, sin enfermedades pulmonares acompañantes; estas últimas podrían haber interferido por sus propias manifestaciones. Después de excluir a los pacientes con tuberculosis activa y/o antigua, neoplasias, enfermedades pulmonares asociadas al tabaco o bronquitis crónica, describimos las manifestaciones que se aprecian en la TC de la denominada antracofibrosis bronquial aislada. Este estudio aporta una evidencia indicativa de que la antracofibrosis bronquial aislada puede tener algunos signos asociados en las exploraciones de imagen, o incluso en ausencia de una enfermedad pulmonar coexistente.
El término «antracofibrosis» fue introducido por primera vez en 1997 para indicar una pigmentación antracótica bronquial y la presencia de estenosis u obliteración bronquial asociadas en 28 pacientes1. La etiología de la antracofibrosis ha sido objeto de una investigación continuada. Dos estudios que se han centrado en la correlación entre la antracofibrosis y la tuberculosis han descrito lo siguiente.
Kim et al. describieron una estrecha relación entre la tuberculosis y la antracofibrosis después de evaluar las características de las exploraciones de imagen en 54 pacientes con antracofibrosis; 32 pacientes con antecedentes de tuberculosis4. Esta hipótesis fue sugerida partiendo de 3 evidencias; la asociación de la tuberculosis pulmonar activa o antigua con la antracofibrosis, la formación de pigmento antracótico negro durante el tratamiento antituberculoso y los signos de imagen similares de la tuberculosis y la antracofibrosis. Se observaron estenosis bronquiales o atelectasias en la mayor parte de los pacientes, siendo el bronquio del LMD el más comúnmente afectado.
Por otro lado, el papel causal de la tuberculosis en la antracofibrosis y, por consiguiente, el empleo de un tratamiento antituberculoso empírico en los pacientes con antracofibrosis fueron puestos en duda por Park et al.5. Estos autores evaluaron a 43 pacientes con antracofibrosis y 32 pacientes con tuberculosis endobronquial que presentaron estenosis bronquiales según lo indicado por las imágenes de TC; sin embargo, no excluyeron a los pacientes con antecedentes de una tuberculosis antigua de su grupo de casos de antracofibrosis. Siete de 43 pacientes con antracofibrosis tenían o bien una tuberculosis pulmonar activa, o bien una pleuritis tuberculosa activa. Los autores observaron que, a diferencia de la tuberculosis endobronquial, la antracofibrosis era más frecuente en los pacientes ancianos. Las adenopatías peribronquiales y mediastínicas, la afectación de más lóbulos pulmonares, la afectación pulmonar bilateral y la estenosis de cualquiera de los lóbulos del pulmón derecho fueron significativamente más frecuentes en la antracofibrosis que en la tuberculosis endobronquial. Se observó también que los pacientes con tuberculosis endobronquial mostraban una estenosis luminal continua en los bronquios principales y lobulares; en cambio, el bronquio principal tendía a no estar afectado en los pacientes con antracofibrosis. Las diferencias mencionadas entre la antracofibrosis y la tuberculosis endobronquial en lo relativo a sus manifestaciones en la TC indicaron que la tuberculosis puede no ser un factor causal en la antracofibrosis.
Por lo que se refiere a la controversia antes mencionada respecto a la relación entre la antracofibrosis y la tuberculosis en la literatura, así como en algunos de los signos de imagen bien descritos en relación con la afectación bronquial que se da en la tuberculosis, como por ejemplo el patrón de atenuación en mosaico, el patrón de árbol en gemación y las bronquiectasias, nosotros excluimos de nuestro estudio a los pacientes con una tuberculosis activa o con antecedentes de tuberculosis previa, con objeto de evaluar mejor los signos radiológicos de la antracofibrosis bronquial.
Se ha indicado también que la exposición a biomasa es una de las etiologías de la antracofibrosis6-8. Kim et al. estudiaron a 333 pacientes con antracofibrosis y observaron que todos ellos tenían antecedentes de exposición al humo de biomasa y presentaban las manifestaciones clínicas de una enfermedad obstructiva de las vías aéreas7. Esta prevalencia elevada de la exposición previa a biomasa no se ha descrito en ningún otro caso en la literatura. De igual modo, en nuestro estudio, todos los pacientes negaron toda exposición previa a biomasa; sin embargo, la razón de esta diferencia no está clara.
A pesar de que ha habido algunas sugerencias de una toxicidad del polvo mineral mixto como factor contribuyente a la antracofibrosis9, un estudio llevado a cabo por Mirsadraee y Saeedi reveló una ausencia de diferencias en la prevalencia de la exposición al polvo, al comparar a 41 pacientes con las placas simples de antracosis con 22 casos de antracofibrosis10. De igual modo, en nuestros pacientes no se identificaron antecedentes conocidos de exposición laboral al polvo.
Se han llevado a cabo otros varios estudios para esclarecer la etiología de la antracofibrosis y algunos de ellos han mostrado las manifestaciones de la antracofibrosis en las exploraciones de imagen; sin embargo, no se excluyó a los pacientes con otras enfermedades pulmonares simultáneas11-20.
En nuestro estudio, la antracofibrosis bronquial aislada se produjo predominantemente en pacientes ancianos con una media de edad de 70 años y sin predilección por ninguno de los 2 sexos. Los resultados de nuestro estudio indican que la ocupación de las vías aéreas por depósitos antracóticos, incluso en ausencia de una tuberculosis manifiesta o de otras enfermedades pulmonares, puede producir un engrosamiento de tejido blando peribronquial central o un manguito de infiltración peribronquial intraparenquimatoso, y si es lo suficientemente intensa, esto podría conducir a una estenosis u obliteración bronquial y, por consiguiente, a la formación de atelectasias subsegmentarias, segmentarias o lobulares. Aunque los signos antes descritos observados en la antracofibrosis bronquial se solapan, al menos en parte, con los del cáncer de pulmón, en especial en los pacientes ancianos, los múltiples lugares de afectación, con un predominio del bronquio del LMD, pueden aumentar la probabilidad de que se trate de una antracofibrosis, en especial cuando estos signos se acompañan de pigmentaciones negras bronquiales que se visualizan en la broncoscopia.
Nuestro estudio tiene varias limitaciones. En primer lugar, fue un estudio observacional retrospectivo, basado en una muestra de población en estudio relativamente pequeña. Sin embargo, dada la relativa excepcionalidad de esta entidad, puede considerarse que una evaluación prospectiva en una serie amplia no es aplicable desde un punto de vista práctico. En segundo lugar, no se ocultaron a los radiólogos los resultados broncoscópicos y anatomopatológicos obtenidos en los pacientes, y esto podría haber sesgado los resultados de este estudio. Además, la correlación broncoscópica-radiológica del grado, la localización y la gravedad de la estenosis bronquial con el seguimiento clínico y de imagen puede requerir una investigación adicional. En tercer lugar, la exposición a biomasa o a polvo se evaluó a partir de la historia clínica de los pacientes, y no pudo descartarse la posibilidad de una exposición no conocida. Además, al tratarse de un análisis retrospectivo, a algunos de los pacientes podría no habérseles preguntado específicamente por los antecedentes de exposición a biomasa o a polvo. En cuarto lugar, el grosor de corte de 5mm que se utilizó en este estudio puede ser excesivo para detectar anomalías bronquiales sutiles, y una colimación y grosor de corte más finos pueden permitir la observación de una frecuencia diferente de signos. En quinto lugar, 17 casos con antecedentes de tuberculosis previa fueron excluidos del estudio, pero es posible que no sea apropiado basarse en los antecedentes de tuberculosis previa, sobre todo cuando el diseño del estudio era retrospectivo. Además, la tuberculosis podría haber aparecido más tarde en el curso de la enfermedad, y el presente estudio no puede indicar una ausencia de relación entre la tuberculosis y la antracofibrosis; sin embargo, este no era el objetivo del estudio. Por el contrario, el objetivo era determinar si la antracofibrosis de por sí podía producir algún signo en las exploraciones de imagen.
En conclusión, a pesar de la controversia persistente respecto a la etiología de los depósitos antracóticos en la mucosa, estos pueden causar una estenosis u obstrucción bronquiales incluso en ausencia de una enfermedad pulmonar asociada en el momento del diagnóstico; así pues, los neumólogos y los radiólogos deben conocer los signos de la antracofibrosis bronquial aislada en las técnicas de imagen como posible causa de estenosis u obstrucción bronquiales, la mayor parte de las veces con un patrón de afectación múltiple y bilateral. Además, el conocimiento de los demás signos descritos, como los ganglios linfáticos hiliares o mediastínicos calcificados y no calcificados, con un efecto de presión sobre bronquios adyacentes, será útil para llegar a un diagnóstico correcto.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses.
Ninguno.