En los últimos años se ha descrito un incremento de los aislamientos respiratorios de Exophiala dermatitidis en pacientes con fibrosis quística (FQ). Presentamos un caso de FQ con infección bronquial crónica por E. dermatitidis.
Se trata de una paciente de 21 años con diagnóstico de FQ desde los 3 meses de edad con genotipo F508del/3849+1G>A. En la tomografía computarizada de tórax se identificaban múltiples bronquiectasias cilíndricas, quísticas y arrosariadas en ambos pulmones. En la espirometría mostraba una obstrucción pulmonar moderada-grave con un volumen espiratorio forzado en el primer segundo (FEV1) de 1.680ml (53% del predicho). Presentaba insuficiencia pancreática e infección bronquial intermitente por Staphylococcus aureus sensible a meticilina, Pseudomonas aeruginosa y Achromobacter xylosoxidans. La paciente había sufrido descenso de la función pulmonar, y en la microbiología de esputo en los últimos años únicamente se aislaba E. dermatitidis. Ante el deterioro clínico y la ausencia de crecimiento bacteriano se realizó una broncoscopia con broncoaspirado (BAS) y lavado broncoalveolar (LBA). La siembra se realizó de forma cuantitativa en medios selectivos, en agar Sabouraud y en agar sangre, los cuales se incubaron durante 5 días. Para la identificación de los distintos patógenos se utilizó espectrometría de masas MALDI-TOF. Tanto en el LBA como en el BAS, creció E. dermatitidis, y se testó sensibilidad antibiótica con anfotericina B y voriconazol mediante el método de Etest®, obteniéndose unos valores de CMI de 0,1 y 0,023, respectivamente. Se inició tratamiento con voriconazol vía oral 300mg/12h, pero por efectos adversos (alucinaciones y alteración del perfil hepático) se bajó la dosis hasta la máxima tolerable a 100mg/12h. Durante el seguimiento ha presentado importante mejoría clínica y descenso de las exacerbaciones, aunque ha persistido el aislamiento del hongo.
En pacientes FQ la prevalencia de la levadura E. dermatitidis varía entre el 2 al 15%1. Esto puede ser debido a la falta de estandarización de los procedimientos de detección en las muestras de esputo. E. dermatitidis es un hongo oportunista de crecimiento lento, no es ubicuo, por lo que no suele ser un contaminante frecuente en los laboratorios de microbiología. Especialmente se aísla en pacientes con FQ por lo que el aislamiento en un paciente no-FQ ha de llevar a sospecharla2.
Fue descrito por primera vez en 19903, y desde entonces se han ido publicando algunos casos. En 2010 se describió el primer caso de esputo pigmentado cuyos flecos negros se atribuyeron a las hifas del hongo4. En 2017, Grenouillet et al. publicaron 2 casos de pacientes con bronquiectasias persistentes y colonización crónica por E. dermatitidis, que llevó al diagnóstico de FQ2.
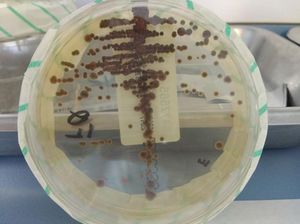
Para el diagnóstico definitivo de este hongo, es imprescindible realizar cultivos de la muestra en agar Sabouraud, incubando a temperatura ambiente o a 30°C, y obtener repetidos aislamientos. Los cultivos deben observarse durante 3-4 semanas, aunque normalmente se detectan colonias en menos de 7 días5. Las colonias son pequeñas al principio, y con el tiempo aumentan de tamaño y adquieren un color negro oliváceo intenso o marrón oscuro característico (fig. 1). Sin embargo, el aislamiento en ocasiones es complicado, y el uso de medios de cultivo apropiados como agar eritritol-cloranfenicol (ECA) puede aumentar su tasa de recuperación6. Las técnicas moleculares (LAMP o hibridación reversa) pueden ser alternativas potentes a los medios de cultivos, aumentando su porcentaje de detección en muestras de esputo6.
En pacientes con FQ el aislamiento de E. dermatitidis de forma crónica o intermitente, generalmente se presenta sin ninguna repercusión clínica, aunque hay casos como el de una niña con FQ que presentó síntomas de disnea debido a una neumonía por E. dermatitidis7. Así mismo, existen 2 estudios prospectivos sobre una cohorte sueca de 98 pacientes con FQ de más de 12 años de edad, en donde E. dermatitidis o niveles séricos elevados de IgG contra E. dermatitidis se asociaron con insuficiencia pancreática, colonización más frecuente por micobacterias no tuberculosas, aumento de los marcadores inflamatorios, requerimientos de tratamiento antibiótico vía intravenosa con mayor frecuencia y FEV1 más bajo8. Aunque el impacto clínico de este patógeno es aún una cuestión pendiente de investigación, su presencia en las vías respiratorias debe ser objeto de vigilancia ya que actualmente se considera un patógeno oportunista emergente en la FQ9.