A lo largo de la pandemia son numerosos los originales de calidad publicados que abordan la infección por SARS-CoV-2 y sin embargo, aún nos queda mucho que aprender sobre su fisiopatología. De ahí que sea imprescindible aprovechar las áreas de conocimiento multidisciplinar para reflexionar sobre una enfermedad en la que la observación clínica prima sobre los estudios de diagnóstico por imagen habituales que, en la mayoría de ocasiones, han resultado insuficientes para el estudio de una enfermedad cuyo órgano diana es el pequeño vaso. Hemos abandonado el término neumonía por COVID-19 para asumir que nos encontramos ante una afectación multisistémica. Durante muchos meses estuvimos enquistados en el concepto de estado tromboinflamatorio e hipercoagulabilidad pero, finalmente, la noción de «daño endotelial» se ha impuesto. A modo de índice nos centraremos en el área más estudiada en la COVID-19, el pulmón, interpretando lo que allí acontece con los conceptos indisolubles de coagulopatía y plexo vascular, y como idea emergente «la desregulación del tono vascular» para poder resolver algún interrogante más de los que aún nos planteamos.
En el pulmónLa presencia de microtrombos en arterias de calibre inferior a 1mm son hallazgos frecuentes (86%) en las necropsias pulmonares1, cuyo mecanismo se relaciona con la endoteliopatía covídica, resultado de la infección directa de las células endoteliales por SARS-CoV-2, que predispone a la trombosis, altera el tonovascular, el equilibrio redox y las reacciones inflamatorias agudas y crónicas que afectan a la pared vascular2. La insuficiencia respiratoria grave está presente en<5% de pacientes con COVID-19, en los que con frecuencia coexisten múltiples mecanismos patogénicos (alteración de la V/Q, de la difusión, efecto shunt e incremento del espacio muerto) que dificultan el manejo terapeútico y ensombrecen el pronóstico. Las alteraciones del tronconcéfalo y los centros respiratorios se describen en la fisiopatología del SARS-CoV-23 y podrían ser responsables también de la discordancia entre la sensación disneica y el trabajo respiratorio observado en nuestros pacientes.
Coagulopatía, plexo vascular y membrana alveolocapilarLa coagulopatía asociada a la infección por SARS-CoV-2 se caracteriza por D-dímeros muy elevados, sin cambios reseñables en el resto de parámetros de hemostasia, lo cual se relaciona con diferentes complicaciones trombóticas y severidad de la enfermedad4. A día de hoy se estima que la incidencia global de TEP en estos pacientes es de un 17%, siendo mayor en aquellos que presentan una clínica más severa, donde se estima que la trombosis de pequeño vaso se relaciona con la gravedad de los síntomas5.
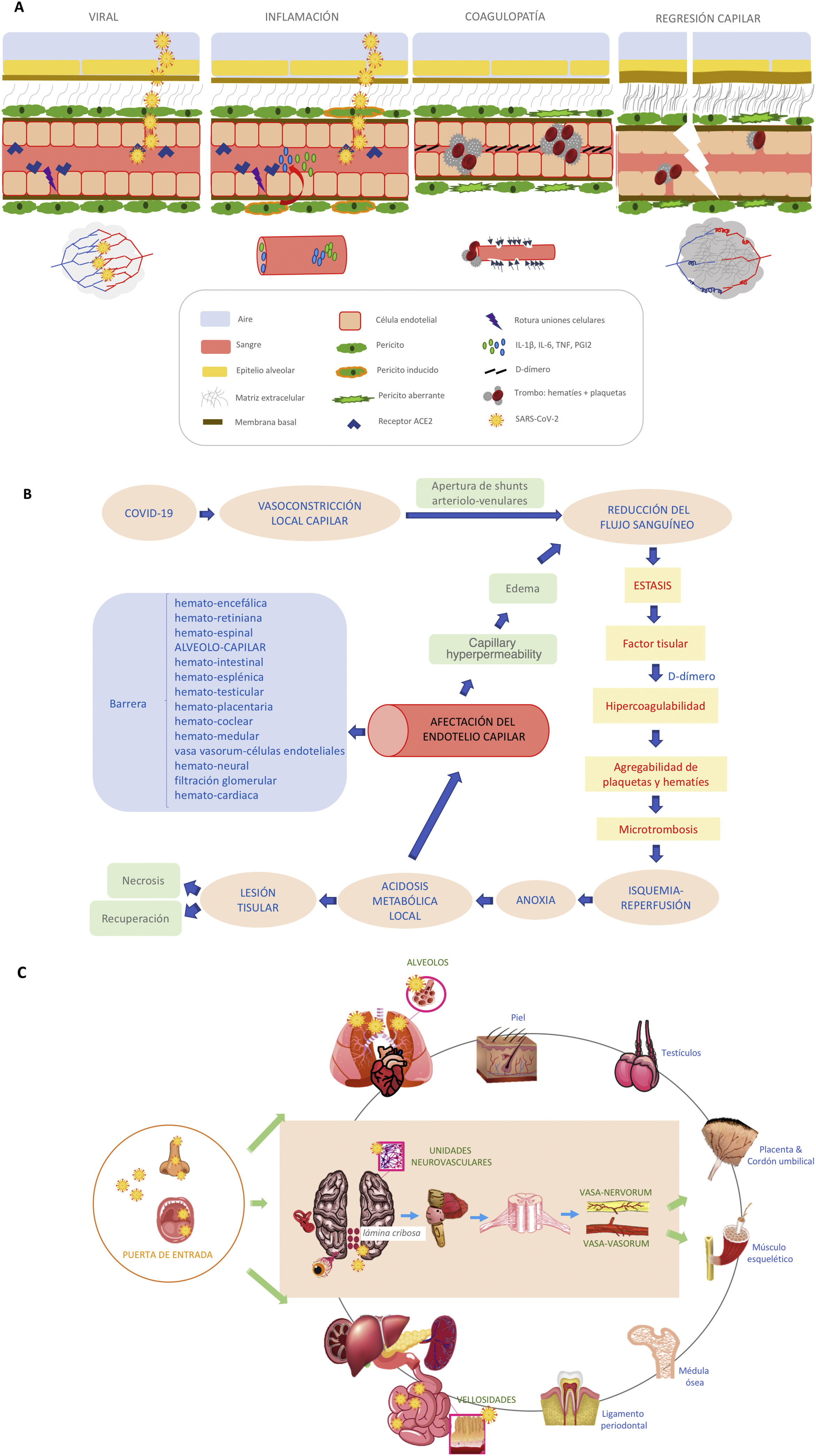
La célula endotelial se encarga de mantener la función barrera y la integridad vascular, así como prevenir la inflamación, limitando su interacción con células inmunes y plaquetas. Los pericitos son células derivadas de la célula madre mesenquimal, y junto con la célula endotelial crean el plexo vascular funcional a nivel capilar2. El pericito es responsable de la constricción capilar de larga duración en los procesos de isquemia-reperfusión y su disfunción ocasiona regresión capilar. En pacientes con «diabesidad» (obesidad y diabetes tipo 2), al presentar un aumento del estrés oxidativo con niveles intracelulares elevados de especies reactivas de oxígeno (ROS), se promueve la producción de citocinas proinflamatorias (IL-1β, IL-6 y TNF) y PGI2, y esto induce la apoptosis de células endoteliales6, lo que se traduce en un peor precondicionamiento isquémico para afrontar la infección. Algunos autores han argumentado que la disfunción endotelial es el resultado de la infección directa del virus que se une al receptor de la enzima convertidora de angiotensina (ECA-II), el cual se expresa en gran cantidad en las células endoteliales y neumocitos. Esta unión provoca una pérdida de actividad de los receptores ECA-II, una disminución en la inactivación de la angiotensina ii y en la conversión a angiotensina i. Esto se traduce en un aumento de la angiotensina iique provoca vasoconstricción, así como en una disminución de los niveles de la angiotensina i, suprimiéndose la producción del óxido nítrico, con incremento de la adhesión de leucocitos y plaquetas7 (fig. 1A). Asimismo la infección por el SARS-CoV-2 provoca una activación de la expresión del factor tisular, no solo en la célula endotelial, si no en la superficie de macrófagos y monocitos, iniciando así la cascada de la coagulación. Todo ello genera vasoconstricción, agregación plaquetaria y microtrombosis (fig. 1B), como se ha visto en recientes estudios posmorten, donde se objetivaba daño vascular a nivel capilar con abudantes microtrombos8, sobre todo en pacientes con afectación severa de la enfermedad. Los pericitos comparten una membrana basal con las células endoteliales en el capilar pulmonar distal, donde se realiza el intercambio de gases. La ruptura del diálogo entre pericitos y células endoteliales interrumpe la homeostasis alveolocapilar, dando como resultado un estado proinflamatorio y procoagulante que acarrea la pérdida de pericitos, dejando una red vascular inmadura que conducirá a fugas de aire en los alveolos y a formación de trombos en los capilares6,9,10(fig. 1A). Estos hechos, junto a la vasculitis, son responsables del síndrome respiratorio agudo severo, con una predisposición mayor a sufrir complicaciones severas aquellos pacientes con diabesidad. La angiografía pulmonar con TCMD y mapa yodo muestra en estos pacientes áreas coetáneas de neumonía inflamatoria, hipoperfusión y trombosis de los vasos distales, difícilmente distinguibles con otras herramientas diagnósticas11. Se han encontrado microtrombos, no solo en los pulmones, sino también en el corazón, los riñones y el hígado en pacientes con COVID-1912, lo que respalda la presencia de microangiopatía trombótica generalizada en estos pacientes, por lo que no debemos perder de vista que la disfunción endotelial es un importante precursor de posteriores eventos cardiovasculares.
Desregulación del tono vascularAlonso et al. describen por primera vez el fenómeno de Raynaud multisistémico, incluido el Raynaud pulmonar en los pacientes afectados por la COVID-1913. Posteriormente, Natatello et al. describen alteraciones en la capilaroscopia de los pacientes con COVID-1914. Estos hallazgos en relación con la alteración del tono vascular sugieren que la pulsioximetría podría aportar datos erróneos de medición, y como consecuencia un mal manejo de los pacientes en planta, con administraciones superfluas de oxígeno a zonas escasamente perfundidas, con dudas sobre si este proceder ayuda o daña aún más los alveolos de nuestro paciente. Es obvio que el lecho de la microvasculatura es más sensible al fenómeno de Raynaud por cuestión de diámetro. Son crecientes los estudios con potentes agentes vasodilatadores en la COVID-19 asociado a la terapia estándar de corticoides y anticoagulación, con ensayos clínicos en curso que incluyen la administración de inhibidores de la IPDE5 a pacientes dismetabólicos que sufren la enfermedad15.
La disfunción del pericito ocasiona regresión capilar claramente asociada con enfermedades como la diabetes mellitus, la isquemia/infarto, la hipertensión, la insuficiencia cardiaca, enfermedades neurodegenerativas, enfermedades infecciosas (p. e. sepsis) y cáncer10. La COVID-19 sumaría sin duda una más a este largo repertorio. Pero la regulación del tono vascular es una materia compleja porque involucra no solo mediadores derivados del endotelio, si no también mecanismos neurogénicos centrales y periféricos, incluidos los que acontecen a nivel de la barrera alveolocapilar y otras barreras de nuestra economía (fig. 1C). Aunque algunas de estas ideas puedan resultar imperfectas, creemos que siguen planteando interrogantes para seguir avanzando en el conocimiento de esta enfermedad. La naturaleza de esta disfunción capilar sigue sin estar bien entendida, y son necesarios más estudios en investigación translacional que aporten transparencia.