Analizar las características clinicorradiológicas y del líquido pleural (LP) de los pacientes con derrame pleural tuberculoso (DPT).
MétodosAnálisis retrospectivo de los DPT atendidos en nuestro centro durante los últimos 23años.
ResultadosSe estudiaron 320 pacientes con DPT (70% varones; mediana de edad 33años). En el 36% de los casos se identificó Mycobacterium tuberculosis en esputo o LP mediante examen microscópico, cultivos en medios sólidos y líquidos, o amplificación de ácidos nucleicos. El mayor porcentaje de identificaciones microbiológicas se relacionó con una co-infección por el virus de la inmunodeficiencia humana (VIH) (OR: 3,27) y con la presencia en LP de unas proteínas <4g/dl (OR: 3,53), neutrófilos >60% (OR: 3,23) o glucosa <40mg/dl (OR: 3,17). Una adenosina desaminasa pleural <35U/l se asoció con DPT que ocupaban <1/2 del hemitórax (OR: 6,36) y con niveles de lactato deshidrogenasa <500U/l (OR: 8,09) en LP. Las opacidades pulmonares radiológicas (30%) fueron más comunes si el DPT no alcanzaba la mitad del hemitórax (OR: 2,73), era bilateral (OR: 4,48) o los pacientes tenían mayor edad (OR: 1,02). Los factores predictores de mortalidad fueron: una co-infección VIH (OR: 24), proteínas en LP <5g/dl (OR: 10) y una mayor edad (OR: 1,05).
ConclusionesLos pacientes con DPT co-infectados por VIH o que presentan concentraciones bajas de proteínas en LP tienen mayor frecuencia de aislamientos microbiológicos y fallecimientos. Asimismo, los pacientes de mayor edad muestran más opacidades pulmonares y mortalidad.
To analyze the clinical and radiological characteristics and features of pleural fluid (PF) in patients with tuberculous pleural effusion (TPE).
MethodsRetrospective analysis of TPEs treated in our clinic over the last 23years.
ResultsWe included 320 patients with TPE (70% men; median age 33years). Mycobacterium tuberculosis was identified in the sputum or PF of 36% of the patients by microscopic examination, solid and liquid media cultures, or nucleic acid amplification tests. The greatest percentage of positive microbiological findings were associated with human immunodeficiency virus (HIV) co-infection (OR: 3.27), and with the presence in PF of proteins <4g/dL (OR: 3.53), neutrophils >60% (OR: 3.23), and glucose <40mg/dL (OR: 3.17). Pleural adenosine deaminase <35U/L was associated with TPEs that occupied less than half of the hemithorax (OR: 6.36) and with PF lactate dehydrogenase levels <500U/L (OR: 8.09). Radiological pulmonary opacities (30%) were more common in TPE occupying less than half of the hemithorax (OR: 2.73), in bilateral TPE (OR: 4.48), and in older patients (OR: 1.02). Factors predicting mortality were: HIV co-infection (OR: 24), proteins in PF <5g/dL (OR: 10), and greater age (OR: 1.05).
ConclusionsPatients with TPE and HIV co-infection and those with lower concentrations of proteins in PF had higher rates of positive microbiological results and death. Moreover, older patients had more pulmonary opacities and a higher incidence of death.
La tuberculosis es una causa frecuente de derrame pleural (DP); la cuarta en una serie 3.077 pacientes consecutivos sometidos a una toracocentesis diagnóstica en nuestro centro1. Sin embargo, en cerca de dos terceras partes de los casos se establece un diagnóstico de derrame pleural tuberculoso (DPT) probable, basándose en las características bioquímicas del líquido pleural (LP) (exudado linfocitario con adenosina desaminasa [ADA] ≥35U/l) junto a la exclusión de otras causas potenciales de DP2. En Cataluña, la incidencia de tuberculosis ha descendido en los últimos años desde 48,3/100.000 habitantes en 1994 hasta 14,4/100.000 habitantes en 20153. De los casos con localización extrapulmonar exclusiva notificados en 2015, la afectación pleural fue la segunda en frecuencia (25%) después de la linfática (42%)3.
Las pruebas microbiológicas que confirman el diagnóstico de DPT son frecuentemente negativas. En dos series españolas, los cultivos de esputo y LP en medios de Löwenstein-Jensen mostraron una sensibilidad del 41 y del 36%, respectivamente4,5. Las técnicas de amplificación de ácidos nucleicos o reacción en cadena de la polimerasa (PCR), prometedoras por su rapidez y alta especificidad, carecen de suficiente sensibilidad. De este modo, en un metaanálisis de 24 estudios, una técnica automatizada de PCR (Xpert®-MTB/RIF) en LP presentó una sensibilidad del 23% cuando se aplicó a pacientes con DPT probable6.
El objetivo de este estudio fue analizar en una serie amplia de DPT las variables asociadas con: 1)una mayor frecuencia de aislamientos microbiológicos en LP o esputo; 2)un nivel de ADA pleural <35U/l; 3)la presencia de opacidades pulmonares en la radiografía de tórax, y 4)el fallecimiento del paciente.
Material y métodosEn 1994 se creó en nuestro hospital una base de datos en la que se han introducido prospectivamente las características clínicas de todos los pacientes adultos consecutivos que se han sometido a una toracocentesis diagnóstica, independientemente del servicio médico que los atendió. Para este estudio se analizaron retrospectivamente los DPT incluidos en dicha base desde enero de 1994 hasta septiembre de 2017. Nuestro centro es un hospital de referencia con 440 camas que da cobertura sanitaria a 450.000 personas. El protocolo de estudio fue aprobado por el comité ético local (CEIC-1868).
Se recogieron variables demográficas (sexo y edad), clínicas (fiebre y duración de la misma, serología del virus de la inmunodeficiencia humana [VIH], prueba de la tuberculina, mortalidad durante la fase de tratamiento), radiológicas (tamaño, localización y loculaciones del DP, y opacidades pulmonares en una radiografía de tórax), microbiológicas (tinciones de auramina o Ziehl-Neelsen, cultivos en medios sólidos y líquidos, y técnicas de PCR, en muestras de esputo y LP) y bioquímicas del LP (recuento leucocitario total y diferencial, recuento de hematíes, niveles de proteínas, glucosa, pH, lactato deshidrogenasa [LDH] y ADA). Cuando se realizó más de una toracentesis en un mismo paciente, se consideraron solo los resultados de la primera.
Análisis microbiológicosEn las muestras de esputo y LP se realizaron tinciones de auramina o Ziehl-Neelsen y cultivos de micobacterias en medios sólidos (Löwenstein-Jensen) y líquidos (Middlebrook líquido 7H9 modificado con suplemento OADC y PANTA). La PCR sobre esputo o LP se realizó con técnicas manuales hasta septiembre de 2010, seguidas de la prueba Xpert® MTB/RIF hasta marzo de 20127 y, posteriormente, del método FluoroType MTB® (Hain Lifescience).
Análisis de líquido pleuralLas muestras de LP se recogieron en dos tubos estériles de 5ml que contenían heparina, para análisis bioquímicos y microbiológicos, respectivamente. Los análisis bioquímicos se realizaron inmediatamente después de la toracocentesis en analizadores Hitachi (711 y 911 o Hitachi Modular DP, Roche Diagnostic, Mannheim, Alemania) hasta agosto de 2013; posteriormente se utilizó un analizador AU5800 de Beckmann Coulter (Brea, CA, EE.UU.). Ambos hacen uso de métodos estandarizados espectrofotométricos. Los límites superiores de la normalidad de la LDH sérica fueron 480 y 370U/l con los primeros y segundos autoanalizadores, respectivamente. Sin embargo, todos los valores de LDH se corrigieron con referencia al método más reciente. El pH se analizó en una máquina de gasometría arterial y la ADA se midió con métodos cinéticos automatizados. El recuento celular del LP se efectuó manualmente en una cámara Thoma hasta febrero de 2012 y, posteriormente, con contadores automáticos (Sysmex XN-2000 y Sysmex XN-350; Roche Diagnostic, Mannheim, Alemania).
Datos radiológicosLas radiografías de tórax se revisaron por un experto en radiología torácica (MP). Se consideró que un DPT era pequeño si ocupaba menos de la mitad del hemitórax; grande si ocupaba la mitad o más, sin llegar a opacificar completamente el hemitórax; situación esta última en la que el DPT se definió como masivo. El DPT loculado era aquel que presentaba compartimentalización, con forma convexa hacia el parénquima pulmonar o sin localización en una zona declive. Se definió opacidad pulmonar como la lesión del parénquima pulmonar producida por enfermedad del espacio aéreo o intersticial, incluyendo la cavitación o caverna (quiste mayor de 1cm dentro del parénquima pulmonar) o las lesiones fibrosas residuales8. Dado que solo el 30% de los pacientes disponían de una tomografía computadorizada torácica, realizada además con equipos de diferente calidad durante el periodo de estudio, se optó por no valorar esta exploración.
Criterios diagnósticosEl diagnóstico de DPT se consideró confirmado cuando se aisló bacilo tuberculoso en esputo, LP o biopsia pleural, o se demostraron granulomas en esta última. El diagnóstico fue probable en pacientes que cumplían las siguientes condiciones: a)cuadro clínico compatible con DPT; b)presencia de un exudado pleural con concentraciones de ADA ≥35U/l; c)resolución del DP con tratamiento antituberculoso, y d)exclusión razonable de otras causas potenciales del DP durante un seguimiento clínico de al menos un año. La demostración de bacilo tuberculoso en una muestra de LP o esputo mediante examen microscópico, cultivo o técnica de PCR definió un aislamiento microbiológico positivo.
Análisis estadísticoLas variables cuantitativas se expresaron como medianas (cuartiles 25% y 75%) y las cualitativas como números absolutos y proporciones. Las comparaciones entre grupos para las variables cuantitativas y cualitativas se realizaron con las pruebas de Mann-Whitney y de Fisher, respectivamente. El área bajo la curva de eficacia diagnóstica ayudó a elegir el mejor punto de corte de las variables continuas (neutrófilos, proteínas, LDH y glucosa en LP) capaz de predecir un aislamiento microbiológico positivo o una ADA inferior al punto de corte diagnóstico de tuberculosis. Se desarrollaron modelos de regresión logística para buscar los factores asociados con la presencia de aislamientos microbiológicos, ADA pleural <35U/l (punto de corte utilizado en nuestro centro)9, opacidades radiológicas pulmonares o fallecimiento. Se incluyeron en los análisis multivariantes las variables que resultaron significativas en el análisis bivariante y, posteriormente, se utilizó el análisis de regresión logística por pasos con el método de exclusión secuencial Wald. La significación estadística se estableció con un valor de p<0,05. Los cálculos se realizaron con el paquete estadístico SPSS versión 24.0 (Chicago, IL, EE.UU.).
ResultadosSe analizaron 320 pacientes con DPT, cuya mediana de edad era de 33 (25-45) años, y de los que 244 (70%) eran varones y 96 (30%) mujeres. Se consideraron tuberculosis confirmadas 131 (41%) y probables 189 (59%). Tenían una co-infección VIH el 9% de los pacientes y una prueba de la tuberculina positiva el 78% (tabla 1). Los sujetos con prueba de la tuberculina positiva tuvieron una mediana de edad significativamente superior que aquellos con resultados negativos (37 vs 30 años, p=0,03). La fiebre estuvo presente en el 74% de los casos, durante una mediana de 7 (0-15) días previos a la toracocentesis. Fallecieron 14 pacientes mientras recibían tratamiento antituberculoso; la mayoría (64%) en los 2 primeros meses.
Características principales de la población con derrame pleural tuberculoso
| Datos generales | n (%) o mediana (cuartiles 25%-75%) | |||
|---|---|---|---|---|
| Edad, años | 33 (25-45) | |||
| Sexo, varón | 244 (70) | |||
| Presencia de fiebre | 234/317 (74) | |||
| Infección VIH | 27/290 (9) | |||
| Prueba de la tuberculina+ | 191/246 (78) | |||
| Datos microbiológicos | 1.ª muestra | 2.ª muestra (1.ª negativa) | 3.ª muestra (1.ª y 2.ª negativas) | Total |
| Tinción auramina/ZN esputo+ | 26/219 (12) | 1/139 (0,7) | 3/92 (3) | 36/225 (16)a |
| Cultivo esputo+ | 46/211 (22) | 8/115 (7) | 1/71 (1,4) | 66/228 (29)b |
| PCR esputo+ | 3/11 (27) | − | − | − |
| Tinción auramina/ZN LP+ | 8/274 (3) | 0/12 | 8/274 (3) | |
| Cultivo LP+ | 51/296 (17) | 1/10 (10) | − | 52/296 (18) |
| PCR LP+ | 11/54 (20)c | − | − | − |
| Cualquier aislamiento+ | − | − | − | 115/320 (36) |
| Datos de la radiografía de tórax | ||||
| Localización del DP | ||||
| Bilateral | 12/316 (4) | |||
| Derecha | 163/316 (51) | |||
| Izquierda | 141/316 (45) | |||
| Tamaño del DPd | ||||
| Pequeño | 188/305 (62) | |||
| Grande | 104/305 (34) | |||
| Masivo | 13/305 (4) | |||
| DP loculadod | 136/267 (51) | |||
| Opacidad pulmonard | ||||
| Ipsilateral | 58/81 (72) | |||
| Contralateral | 10/81 (12) | |||
| Bilateral | 13/81 (16) | |||
| Cualquier localización | 81/267 (30) | |||
| Datos evolutivos | ||||
| Curación | 259/320 (81) | |||
| Tratamiento activo | 15/320 (5) | |||
| Fallecimiento | 14/320 (4) | |||
| Pérdida de seguimiento | 32/320 (10) | |||
DP: derrame pleural; LP: líquido pleural; PCR: reacción en cadena de la polimerasa; VIH: virus de la inmunodeficiencia humana; ZN: Ziehl-Neelsen; +: positivo/a.
Seis pacientes tuvieron una tinción ZN positiva sin conocerse el orden de la muestra, por lo que solo se tuvieron en cuenta en la última columna. Si un paciente tenía una primera muestra positiva no se consideró el resultado de muestras sucesivas del mismo espécimen.
Globalmente, se consiguió un aislamiento microbiológico en 115 (36%) pacientes (tabla 1). Adicionalmente, 16 (84%) de los 19 pacientes que se sometieron a una biopsia pleural cerrada se diagnosticaron mediante la demostración de granulomas. En 4 (57%) de las 7 biopsias pleurales que se cultivaron se aisló bacilo tuberculoso. Los cultivos de esputo y de LP fueron positivos en el 29 y el 18% de los casos, respectivamente. Los pacientes co-infectados por VIH presentaron más aislamientos microbiológicos (56% vs 33%, p=0,02) a expensas de los cultivos de esputo (50% vs 27%, p=0,03), pero no del LP (29% vs 17%, p=0,13). Solo en 23 pacientes se dispuso de datos sobre sensibilidad a fármacos contra la tuberculosis: siete tenían resistencia aislada a pirazinamida, y uno, multirresistencia (isoniacida, rifampicina, pirazinamida y etambutol).
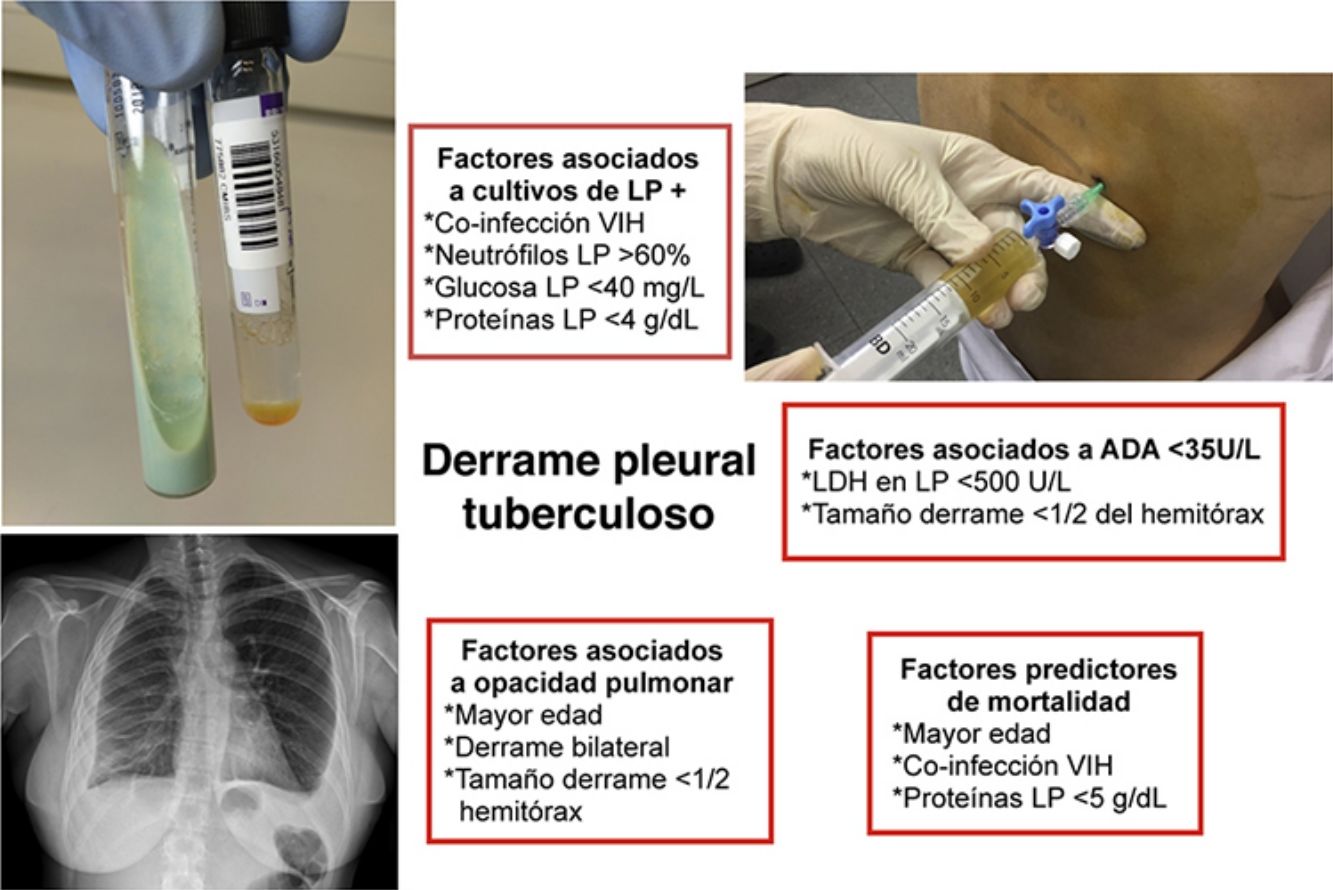
En un análisis multivariante, los factores relacionados con un mayor porcentaje de aislamientos microbiológicos fueron (tabla 2): una co-infección por VIH (OR: 3,27) y la presencia en LP de unas proteínas <4g/dl (OR: 3,53), neutrófilos >60% (OR: 3,23) o glucosa <40mg/dl (OR: 3,17).
Factores que influyen en la positividad de un aislamiento microbiológico en el derrame pleural tuberculoso
| Aislamiento positivo, n=115 (36%) | No aislamiento, n=205 (64%) | pa | OR (IC 95%)b | pb | |
|---|---|---|---|---|---|
| Edad, años | 36 (27-46) | 31 (25-44) | 0,03 | NS | NS |
| Co-infección VIH | 15/102 (15) | 12/188 (6) | 0,02 | 3,27 (1,42-7,5) | 0,01 |
| Prueba de la tuberculina positiva | 55/79 (70) | 136/167 (81) | 0,04 | NS | NS |
| Hematíes LP > 10.000/μl | 22/109 (20) | 20/203 (10) | 0,01 | NS | NS |
| Neutrófilos LP > 60% | 18/107 (17) | 9/196 (5) | <0,01 | 3,23 (1,28-8,14) | 0,01 |
| Glucosa LP <40 mg/dl | 22/111 (20) | 12/205 (6) | <0,01 | 3,17 (1,27-7,93) | 0,01 |
| Proteínas LP <4 g/dl | 17/111 (15) | 9/205 (4) | <0,01 | 3,53 (1,26-9,89) | 0,02 |
| LDH LP > 1000 U/l | 44/107 (41) | 51/204 (25) | <0,01 | NS | NS |
| Opacidad pulmonar en radiografía simple | 36/95 (38) | 45/172 (26) | 0,05 | NS | NS |
Las variables se expresan como mediana (cuartiles 25-75) o n (%), según corresponda.
LDH: lactato deshidrogenasa; LP: líquido pleural; NS: no significativo; OR: odds ratio; VIH: virus de la inmunodeficiencia humana.
Todos los DPT correspondieron a exudados según los criterios de Light10; el 10% (31/303) eran de predominio neutrofílico (>50% de neutrófilos), mientras que el 53% (159/303) mostraba más de un 90% de linfocitos en el recuento leucocitario diferencial. En 5 (36%) de 14 pacientes con un DPT neutrofílico una segunda toracocentesis mostró un predominio linfocitario, si bien en todos los casos descendió el valor absoluto y el porcentaje de neutrófilos del LP. El 25% tenían una glucosa del LP <60mg/dl y el 9% un pH<7,20. Las proteínas del LP eran >5g/dl en el 70% de los casos. Una ADA pleural ≥35U/l caracterizó al 93% (294/315) de los DPT. Los pacientes con ADA <35U/l tendieron a presentar una edad superior (mediana 36 vs 33años), aunque la diferencia no alcanzó significación estadística.
En un análisis multivariante, la ADA pleural <35U/l se relacionó con un tamaño del DPT <1/2 del hemitórax y unos niveles de LDH pleural <500U/l (tabla 3).
Factores relacionados con un nivel de ADA pleural <35 U/l en el derrame tuberculoso
| ADA<35 U/L, n=21 (7%) | ADA≥ 35U/L, n=294 (93%) | pa | OR: (IC95%)b | pb | |
|---|---|---|---|---|---|
| Edad, años | 36 (31-46) | 33 (25-45) | 0,18 | NS | NS |
| Glucosa LP >80 mg/dl | 15 (71) | 132 (45) | 0,02 | NS | NS |
| Proteínas LP <5 g/dl | 12 (57) | 81 (28) | <0,01 | NS | NS |
| LDH LP <500 U/l | 15 (71) | 78 (27) | <0,01 | 8,09 (2,69-24,35) | <0,01 |
| pH LP > 7,40 | 14/18 (78) | 103/269 (38) | <0,01 | NS | NS |
| Tamaño DP <1/2 hemitórax | 16/19 (84) | 168/282 (60) | 0,05 | 6,36 (1,38-29,3) | 0,02 |
Las variables se expresan como mediana (cuartiles 25-75) o n (%), según corresponda.
ADA: adenosina desaminasa; DP: derrame pleural; LDH: lactato deshidrogenasa; LP: líquido pleural; NS: no significativo; OR: odds ratio.
Los datos radiológicos más relevantes se exponen en la tabla 1. El DPT fue unilateral en el 96% de los casos, loculado en el 51% y ocupó menos de la mitad del hemitórax en el 62% (porcentaje este último que aumentó hasta el 88% en pacientes co-infectados por VIH). De 267 pacientes evaluables, se observó una opacidad pulmonar asociada en 81 (30%), incluyendo lesiones fibrosas residuales en 18, diseminación broncógena en 8 y cavernas en 4 de ellos. La mayoría de estas opacidades (68%) se localizaron en bases pulmonares, 17% en lóbulos superiores, 5% en el lóbulo medio derecho y 10% en múltiples lóbulos. La mediana de edad de los pacientes con lesiones en lóbulos superiores fue similar a la de aquellos con afectación de lóbulos inferiores (35 vs 38años, p=0,10).
Como se observa en la tabla 4, los pacientes con una opacidad pulmonar tuvieron una edad superior (38 vs 31años, p=0,01) y mayor porcentaje de cultivos positivos de esputo (45% vs 20%, p<0,01). Sin embargo, no hubo diferencias en el porcentaje de cultivos positivos de LP (13% vs 17%, p=0,44). La opacidad pulmonar se asoció con DP pequeños (<1/2 del hemitórax) y bilaterales; únicas variables que junto con la edad fueron significativas en un análisis multivariante.
Factores que se asocian con la presencia de una opacidad pulmonar en la radiografía simple de tórax de pacientes con derrame pleural tuberculoso
| Infiltrado pulmonar, n=81 (30%) | No infiltrado pulmonar, n=186 (70%) | pa | OR (IC 95%)b | pb | |
|---|---|---|---|---|---|
| Edad, años | 38 (28-52) | 31 (25-41) | 0,01 | 1,02 (1-1,03) | 0,02 |
| Temperatura > 38°C | 51/81 (63) | 145/186 (78) | 0,01 | NS | NS |
| Hematíes LP > 10.000/μl | 18/80 (23) | 19/182 (10) | 0,01 | NS | NS |
| Cultivo de esputo positivo | 26/58 (45) | 28/140 (20) | <0,01 | NS | NS |
| Cultivo de LP positivo | 10/75 (13) | 30/174 (17) | 0,44 | NS | NS |
| Cualquier aislamiento microbiológico | 36/81 (44) | 59/186 (32) | 0,05 | NS | NS |
| DP bilateral | 7/81 (9) | 3/185 (2) | 0,01 | 4,48 (1,11-18,1) | 0,04 |
| Tamaño DP <1/2 hemitórax | 62/80 (78) | 96/182 (53) | <0,01 | 2,73 (1,48-5,05) | 0,01 |
Las variables se expresan como mediana (cuartiles 25-75) o n (%), según corresponda.
DP: derrame pleural; LP: líquido pleural; NS: no significativo; OR: odds ratio.
Los pacientes con DPT loculado tuvieron con mayor frecuencia un LP con glucosa <60mg/dl (35% vs 20%, p=0,01) o pH<7,20 (13% vs 4%, p=0,01). Sin embargo, no mostraron un mayor porcentaje de aislamientos microbiológicos (36% vs 35%).
Datos pronósticosLos predictores de fallecimiento fueron (tabla 5): co-infección por VIH (OR: 24), proteínas en LP <5g/dl (OR: 10) y una edad más avanzada (OR: 1,05); considerada esta última variable como continua. Conviene resaltar que 3 de los 4 pacientes co-infectados por el VIH que fallecieron lo hicieron antes del año 2000; el sujeto restante falleció en 2013 tras el diagnóstico simultáneo de DPT e infección VIH, antes de poder recibir terapia antirretroviral.
Factores predictores de fallecimiento en el derrame pleural tuberculoso
| Fallecimiento, n=14 (6%) | Curación, n=235 (94%) | pa | OR (IC95%)b | pb | |
|---|---|---|---|---|---|
| Edad, años | 58 (39-77) | 32 (25-44) | <0,01 | 1,05 (1-1,09) | 0,04 |
| Co-infección VIH | 4/9 (44) | 20/218 (9) | <0,01 | 24,44 (3,44-173,72) | <0,01 |
| Fiebre | 6/14 (43) | 177/235 (75) | 0,01 | NS | NS |
| Prueba de la tuberculina positiva | 2/8 (25) | 148/183 (81) | <0,01 | NS | NS |
| Proteínas LP <5 g/dl | 12/14 (86) | 65/233 (28) | <0,01 | 9,63 (1,6-57,83) | 0,01 |
| Opacidad pulmonar en radiografía simple | 9/13 (69) | 58/212 (27) | <0,01 | NS | NS |
| DP bilateral | 3/13 (23) | 7/234 (3) | <0,01 | NS | NS |
Las variables se expresan como mediana (cuartiles 25-75) o n (%), según corresponda.
DP: derrame pleural; LP: líquido pleural; NS: no significativo; OR: odds ratio; VIH: virus de la inmunodeficiencia humana.
Este estudio describe las principales características clínicas, microbiológicas, radiológicas y del LP de una serie amplia de DPT, así como los factores que se asocian con la mayor rentabilidad de los análisis microbiológicos y menor de la ADA, la presencia de opacidades radiológicas pulmonares o la mortalidad.
Se ha reportado que el empleo de medios de cultivo líquidos incrementa notablemente el porcentaje de aislamientos micobacterianos en el DPT11,12. Sin embargo, a pesar de utilizar medios sólidos y líquidos, solo obtuvimos un 18% de cultivos positivos del LP; una cifra muy inferior al 63% descrito por Ruan et al.12 pero similar a la de otros estudios13. Estas discrepancias se podrían justificar por factores como el volumen de LP procesado (de 4ml14 a 50ml15, según las series), el tipo de medio líquido utilizado, la realización de un segundo cultivo16, la inoculación del LP en las botellas de cultivo a pie de cama11,14,17,18 o en el laboratorio, o el porcentaje de co-infectados por VIH (que en algún estudio alcanzó el 80%)17. Concretamente, en nuestra serie solo se procesaron 5ml de LP, que se inocularon en los medios de cultivo específicos una vez llegada la muestra al laboratorio; rara vez se realizaron cultivos seriados del LP (3%) y la población co-infectada por VIH fue significativamente inferior a la de otros estudios.
En el presente estudio, los factores asociados con el aislamiento de Mycobacterium tuberculosis fueron la co-infección VIH y la presencia, en LP, de unas proteínas <4g/dl, neutrófilos >60% o glucosa <40mg/dl. La mayor frecuencia de aislamientos micobacterianos en sujetos co-infectados por VIH es bien conocida17,19. En una serie de 174 DPT, los cultivos del LP fueron positivos en el 64% de los co-infectados por VIH, frente al 30% del resto19. Probablemente la alteración del sistema inmunitario de estos pacientes favorece una mayor carga bacilífera en el LP. Otras series han investigado la relación entre las características bioquímicas y microbiológicas del LP en sujetos con DPT12,15,20. De este modo, se han relacionado con un mayor porcentaje de aislamientos micobacterianos el predominio de neutrófilos12,15,20 y las concentraciones bajas de glucosa15,20 y proteínas en LP12. Los neutrófilos predominan en una etapa precoz de la infección pleural tuberculosa, en la que todavía no se ha desarrollado una inmunidad activa contra el bacilo21. Los niveles bajos de glucosa en LP se han asociado a DPT neutrofílicos22 (en nuestra serie, el 45% de los DPT neutrofílicos tenían glucosa <40mg/dl, frente al 6% de los DPT linfocitarios; datos no mostrados) y, consecuentemente, a cultivos frecuentemente positivos. Por otra parte, un DPT con proteínas bajas puede reflejar hipoproteinemia secundaria a malnutrición y, por tanto, una inmunidad alterada23.
Respecto a la determinación de ADA pleural, se han propuesto puntos de corte diferentes para identificar DPT, en función de la edad del paciente24,25. Tay y Tee24 propusieron utilizar una ADA de 72UI/l en ≤55años y de 26UI/l en >55años para mantener una sensibilidad diagnóstica del 95% en ambas situaciones. El punto de corte de 55años correspondió a la mediana de edad de la población de estudio. Sin embargo, en nuestra serie solo el 15% de sujetos fueron mayores de 55años. Este hecho puede haber influido en la falta de asociación entre edad y valores de ADA. La correlación positiva entre LDH y ADA en LP ya se describió en una serie de 80DPT (r=0,47, p<0,001)24. El aumento de LDH en LP indica inflamación26. Probablemente, un mayor grado de inflamación aumenta la activación de linfocitos y, por tanto, la producción de ADA.
El DPT se acompañó de una opacidad pulmonar radiológica en el 30% de las ocasiones; una cifra similar a la reportada en estudios previos (15-27%)1. Paradójicamente, este hallazgo no se relacionó con una mayor frecuencia de cultivos de esputo positivos en el análisis multivariante (aunque sí en el univariante), en concordancia con series anteriores15,27. En la tuberculosis pulmonar el mayor porcentaje de cultivos de esputo positivos se observa en pacientes con opacidades de lóbulos superiores o cavitaciones28,29, hallazgos que solo estuvieron presentes en el 17% y en el 1,5% de los pacientes de nuestro estudio. En nuestra serie hubo más opacidades pulmonares en DPT pequeños, probablemente porque es más fácil la valoración del parénquima pulmonar en estas situaciones. El hecho de que en los DPT bilaterales se encontrara una mayor proporción de opacidades pulmonares podría deberse a que estos podrían representar una enfermedad más diseminada.
La mortalidad del DPT fue del 6%, ligeramente inferior a la de otros estudios (7-8%)20,30. La edad y la comorbilidad (incluyendo la co-infección VIH) son superiores entre los sujetos con DPT que fallecen20. Sin embargo, en este estudio la mortalidad de los pacientes VIH se concentró en la época en que la terapia antirretroviral de alta eficacia no se había desarrollado plenamente, por lo que la vigencia de este factor pronóstico en el DPT es cuestionable. De hecho, en un estudio prospectivo de 196 pacientes con DPT llevado a cabo en Camerún entre 2007 y 2010 no se encontraron diferencias pronósticas entre aquellos con y sin co-infección por el VIH31. Por otro lado, los bajos niveles de proteínas en LP pueden reflejar hipoproteinemia y malnutrición, que son factores de mal pronóstico en la tuberculosis pulmonar32,33.
La principal limitación del estudio es su diseño retrospectivo, con la consiguiente pérdida de datos. Por ejemplo, no se utilizó la prueba de la tuberculina en el 23% de los casos; no se realizaron cultivos de esputo y de LP en el 29 y el 8%, respectivamente, y no se aplicaron técnicas de PCR en el 83%. Otra limitación potencial es la inclusión de un porcentaje significativo de DPT probables, si bien los criterios utilizados para definirlos están ampliamente aceptados en la literatura. La razón estriba en el escaso número de biopsias pleurales cerradas que se realizan en nuestro centro y la procedencia de la mayoría de los sujetos del estudio de un servicio de Medicina Interna. Finalmente, las relaciones encontradas entre diversas variables podrían ser válidas solo bajo las condiciones del estudio. Así, además de la mejoría sustancial en el pronóstico actual de la infección VIH, la prevalencia de opacidades pulmonares en el DPT es muy superior en la tomografía computarizada que en la radiografía simple2,34, si bien la primera no está indicada de forma rutinaria en el contexto de una tuberculosis pleural.
En resumen, factores como la co-infección por VIH o las concentraciones bajas de proteínas en el LP se asocian con un mayor porcentaje de aislamientos microbiológicos y de mortalidad. Asimismo, los pacientes de mayor edad muestran más opacidades radiológicas pulmonares y mortalidad. Finalmente, los DPT más pequeños se acompañan de niveles más bajos de ADA pleural y de más opacidades pulmonares. Estos resultados requieren confirmación en estudios prospectivos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses