La cabergolina es un fármaco sintético dopaminérgico, que se utiliza en el tratamiento de la enfermedad de Parkinson y que rara vez produce efectos adversos pleuropulmonares, los cuales se manifiestan como engrosamiento o derrame pleurales, neumonitis intersticial, infiltrados pulmonares o fibrosis. Presentamos un caso excepcional en un varón de 79 años con enfermedad de Parkinson, tratado con cabergolina durante un año, que presentó un derrame pleural y grave hipertensión pulmonar, que desaparecieron a los 10 meses de la retirada de este fármaco.
Cabergoline is a synthetic dopamine agonist used to treat Parkinson disease. The drug occasionally induces pleuropulmonary adverse effects, which manifest as pleural thickening or effusion, interstitial pneumonitis, pulmonary infiltrates, or fibrosis. We report a rare case of pleural effusion and severe pulmonary hypertension in a 79-year-old man with Parkinson disease who had been treated with cabergoline for 1 year. The symptoms disappeared 10 months after the drug was discontinued.
La enfermedad de Parkinson es una entidad clínica de causa desconocida, insidiosa y progresiva, que se caracteriza por el temblor, la rigidez muscular, la lentitud de movimientos y la alteración de la marcha o los reflejos posturales1. Afecta a 1–5 personas por cada 100 habitantes, su incidencia anual es de aproximadamente 20 casos por 100.000 habitantes y constituye la segunda enfermedad neurodegenerativa más frecuente después de la enfermedad de Alzheimer1,2. Su tratamiento es médico y debe continuarse durante toda la vida del paciente. Los principales fármacos utilizados en su manejo son los anticolinérgicos, la amantadina y la L-DOPA u otros fármacos dopaminérgicos1,3. Estos últimos son medicamentos alternativos de primera línea con una eficacia similar y entre ellos figuran la bromocriptina, la pergolida y la cabergolina. Sus efectos secundarios más frecuentes son los vómitos, las náuseas y la hipotensión ortostática, junto a otros trastornos neurológicos o discinesias, insomnio, alucinaciones y confusión3. Mucho más raros son el vasoespasmo coronario, la afectación valvular cardíaca, la fibrosis pulmonar o el derrame pleural, que en ningún caso se han diagnosticado junto a hipertensión pulmonar, como ocurrió en el que a continuación presentamos3–5.
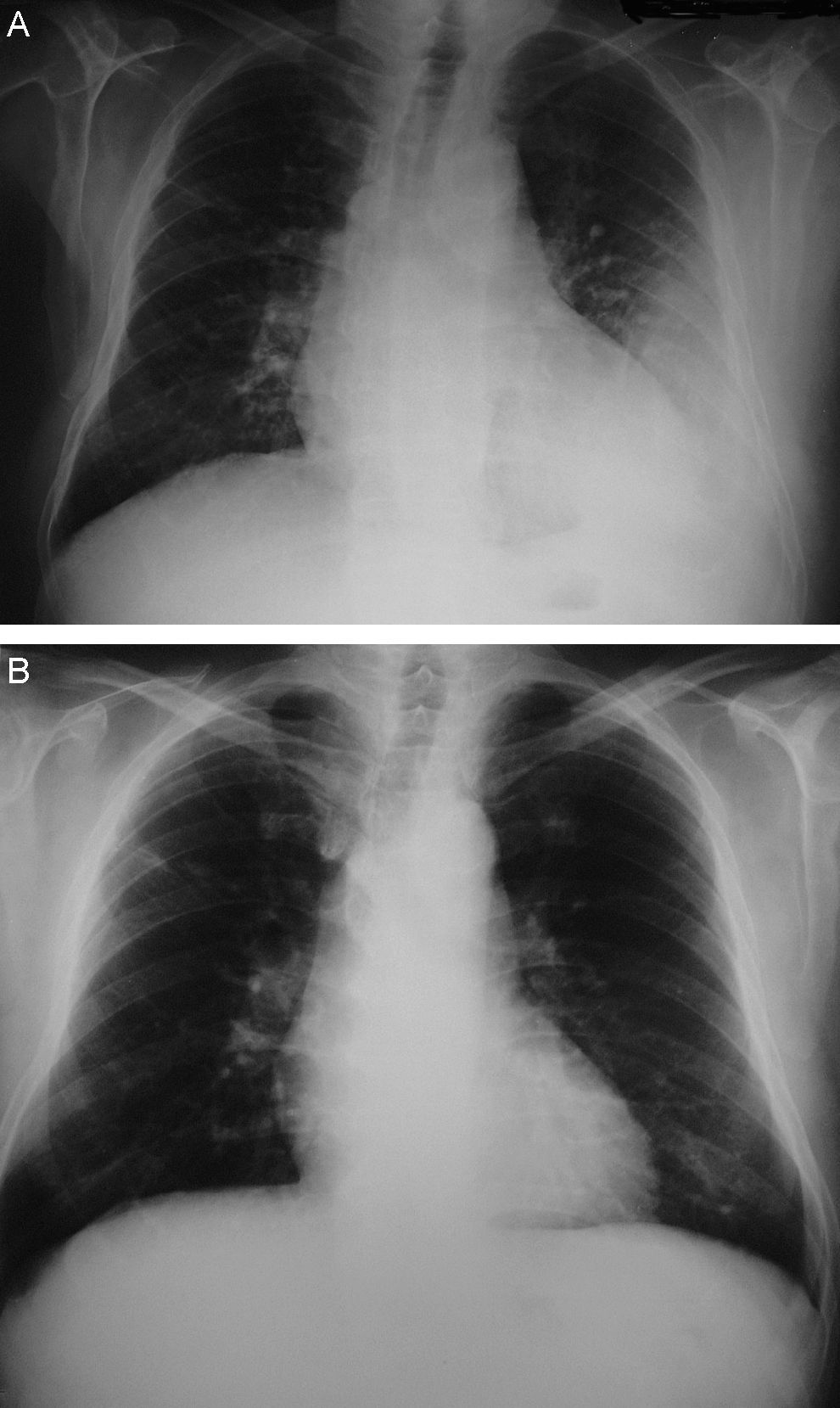
Observación clínicaVarón de 79 años, sin hábitos tóxicos ni alergias, diagnosticado de enfermedad de Parkinson en tratamiento oral con levodopa (250mg/día), hidrocloruro de metilfenidato (20mg/día), rasagilina (1mg/día) y, en los últimos 12 meses, cabergolina (2mg/día). Treinta días antes de su ingreso presentó un cuadro catarral persistente con tos, expectoración mucosa y aumento progresivo de la disnea, sin dolor torácico, síndrome constitucional ni fiebre. Tras seguir tratamiento con levofloxacino oral no experimentó mejoría, de modo que se le realizó una radiografía que evidenció un derrame pleural izquierdo sin pérdida de volumen ni condensaciones (fig. 1A). La exploración física descartó signos de insuficiencia cardíaca, trombosis venosa o adenopatías palpables. En la auscultación cardíaca se detectó un soplo sistólico sin tercer ruido ni alteraciones del ritmo, y en la respiratoria se observó una semiología de derrame pleural izquierdo sin estertores ni signos de broncoespasmo.
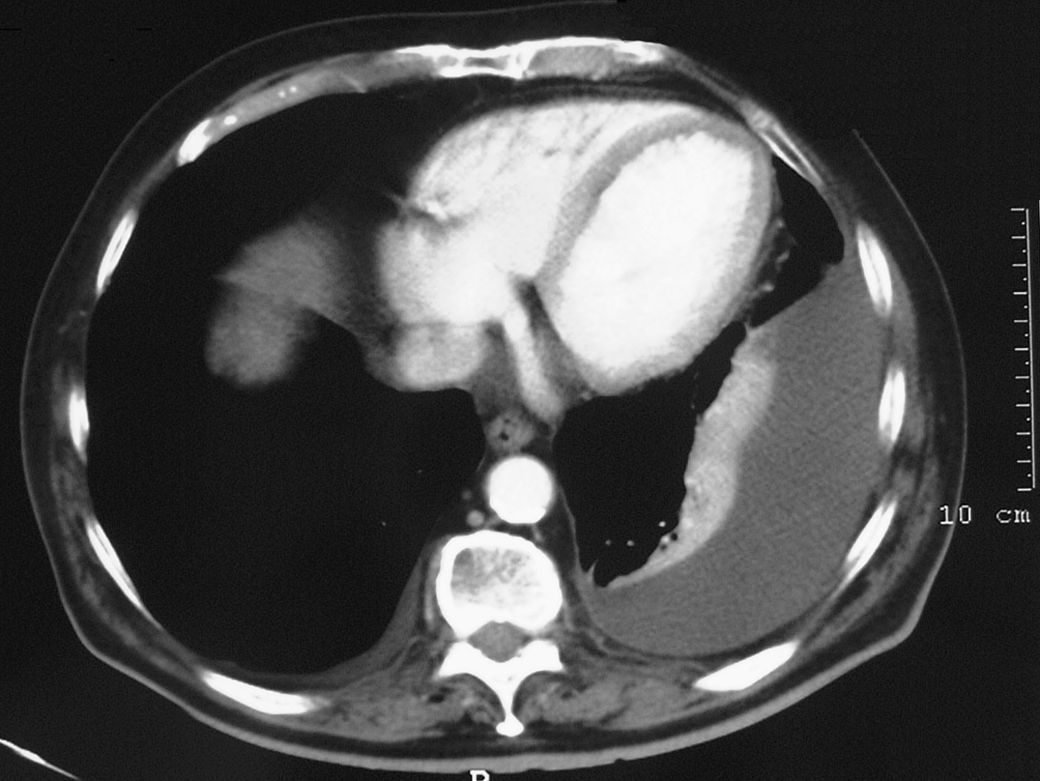
Los estudios de laboratorio (coagulación, dímero D, troponinas, hormonas tiroideas, antígeno carcinoembrionario, marcadores de colagenosis, serología de los virus de la inmunodeficiencia humana y de la hepatitis C, y sedimento de orina) fueron normales. Los resultados de la gasometría arterial basal fueron los siguientes: pH de 7,43, presión arterial de oxígeno de 75mmHg y presión arterial de anhídrido carbónico de 39mmHg. El Doppler de las extremidades inferiores y la gammagrafía pulmonar de ventilación-perfusión descartaron que el paciente presentara enfermedad tromboembólica. La prueba de la tuberculina y 3 baciloscopias de esputo fueron negativas. La tomografía computarizada confirmó el derrame izquierdo, sin engrosamiento pleural y con una mínima cantidad de líquido derecho (fig. 2), aumento de tamaño de las arterias pulmonares y adenopatías mediastínicas bilaterales menores de 1cm, sin signos de afectación parenquimatosa. En la toracocentesis se obtuvo un líquido transparente indicativo de trasudado (pH: 7,46; glucosa: 113mg/dl; lactatodeshidrogenasa: 98U/l; cociente pleuroplasmático de lactatodeshidrogenasa de 0,4 y de proteínas de 0,3; colesterol: 19mg/dl; adenosindesaminasa: 12U/l; 120leucocitos/μl con un 65% de linfocitos). La citología, la baciloscopia, los cultivos de 3 muestras de líquido y la biopsia pleural percutánea con aguja de Abrams descartaron la presencia de granulomas o de células atípicas. La broncoscopia no demostró alteraciones endobronquiales significativas, y la citología, el cultivo y la baciloscopia del broncoaspirado fueron negativos. El electrocardiograma mostraba ritmo sinusal con bloqueo completo de la rama derecha y complejo S1Q3T3. Posteriormente se realizó un ecocardiograma que confirmó la presencia de intensa insuficiencia tricuspídea, dilatación del ventrículo derecho e hipertensión pulmonar (presión arterial pulmonar estimada de 80mmHg), con insuficiencia mitral ligera-moderada, ventrículo izquierdo normal y fracción de eyección del 51%, sin derrame pericárdico.
Ante estos hallazgos se procedió a retirar únicamente la cabergolina, se inició fisioterapia respiratoria y se instauró tratamiento diurético para obtener un equilibrio hídrico negativo. A los 2 meses, una radiografía de control confirmó la clara disminución del derrame pleural y se retiraron los diuréticos. A los 10 meses el paciente se encontraba asintomático y no se observó derrame pleural en la radiografía (fig. 1B). En el ecocardiograma de control ya no se apreciaba la dilatación de las cavidades derechas, la insuficiencia tricuspídea era mínima, la presión pulmonar era de 32 mmHg y la insuficiencia mitral, ligera.
DiscusiónAlgunos de los fármacos más prescritos por los neurólogos, como la carbamacepina, las hidantoínas o los antidepresivos, pueden producir toxicidad pulmonar, sobre todo en forma de neumonitis asociada o no a eosinofilia, edema pulmonar no cardiogénico o reacciones por hipersensibilidad5,6. Esta posibilidad es menos frecuente y conocida en el grupo de las ergolinas, como la bromocriptina o la cabergolina7. La cabergolina es un fármaco sintético dopaminérgico de larga duración, que se utiliza en el tratamiento de la enfermedad de Parkinson, la hiperprolactinemia o la acromegalia, y que rara vez produce efectos adversos pleuropulmonares4,7,8. No se conoce bien la patogenia de estos efectos, que potencialmente son reversibles y entre los que figuran el engrosamiento o derrame pleurales y la posibilidad de desarrollar una neumonitis intersticial, infiltrados o una fibrosis pulmonar9–11. La afectación pleural es más frecuente que la parenquimatosa, y en la literatura médica revisada (MEDLINE, 1966–2007) no hemos encontrado ningún caso con hipertensión pulmonar grave atribuible a la cabergolina o a otros fármacos dopaminérgicos de la misma familia utilizados en el tratamiento de la enfermedad de Parkinson.
La mayoría de los derrames pleurales asociados a los agonistas dopaminérgicos son exudados linfocitarios y ocasionalmente eosinofílicos12,13. En estos pacientes, el efecto agonista sobre los receptores de la serotonina estimularía la actividad de los fibroblastos y la posterior fibrosis de los órganos o tejidos afectados, que revertiría al retirar el fármaco12,14. En nuestro caso, los resultados del ecocardiograma, la afectación pleural bilateral y la confirmación de un trasudado sin engrosamiento pleural no apuntaban a una afectación pleural directa ni a una cardiopatía valvular o isquémica, como se ha descrito en otros pacientes9,15. El mecanismo por el que la cabergolina produciría la hipertensión pulmonar no está claro, pero es probable que en algunos pacientes pueda ser similar al de los anorexígenos como la fenfluramina, con unos complejos efectos biológicos celulares que afectan a la producción, liberación y metabolismo de la serotonina o sus metabolitos16. El incremento progresivo de la presión pulmonar aumentaría las presiones hidrostáticas y dificultaría la reabsorción del líquido pleural, lo cual facilitaría su acumulación en forma de trasudado sin una lesión pleural directa13,17.
La mayoría de los efectos adversos pleuropulmonares de la cabergolina tienen un buen pronóstico y son reversibles tras retirar el fármaco, como ocurrió en nuestro paciente, aunque se han descrito casos de persistencia o progresión cuando existe fibrosis7,9,10. Esta posibilidad y la creciente descripción de efectos adversos pleuropulmonares obligan a recomendar el seguimiento de estos pacientes, así como a considerar posibles alternativas a la cabergolina en aquéllos con un riesgo mayor por presentar alguna enfermedad cardiopulmonar.