Introducción
En los últimos años hemos asistido a un espectacular resurgimiento del interés por la enfermedad pulmonar obstructiva crónica (EPOC). Este interés, motivado en gran medida por los avances realizados en el conocimiento etiopatogénico de la enfermedad y por la aparición de nuevos fármacos, se ha visto reflejado en la aparición de numerosas normativas y guías clínicas encaminadas a mejorar su diagnóstico y tratamiento1-9. Sin embargo, por los estudios epidemiológicos sabemos que la EPOC se encuentra infradiagnosticada y, por tanto, con frecuencia los pacientes no reciben ningún tratamiento, incluso en fases avanzadas del proceso10. Más aún, en numerosas ocasiones los diagnósticos se establecen de forma incorrecta y también con gran frecuencia los pacientes realizan tratamientos inadecuados11,12. La causa de esta situación hay que buscarla en el desconocimiento de las guías de tratamiento, pero las controversias suscitadas en torno a la mayor o menor eficacia de los diferentes fármacos, que se reflejan en las guías, pueden también desempeñar un papel al respecto.
Patogenia y tratamiento farmacológico en la EPOC
La definición más reciente de EPOC, recogida en el documento ERS-ATS9, establece que se trata de una enfermedad prevenible y tratable caracterizada por la presencia de obstrucción no totalmente reversible al flujo aéreo. Esta obstrucción, generalmente progresiva, es el resultado de una reacción inflamatoria anómala en respuesta a la exposición de un agente nocivo, habitualmente el humo del tabaco. La alteración fisiológica representada por la obstrucción al flujo aéreo va a dar lugar a las manifestaciones clínicas de la enfermedad, que son la disnea y la limitación al ejercicio. Aunque se trata de un proceso crónico, se ve complicado por la aparición de exacerbaciones que complican su evolución y contribuyen al deterioro de la calidad de vida de los pacientes, a la aparición de la insuficiencia respiratoria y la mortalidad ligada a la enfermedad.
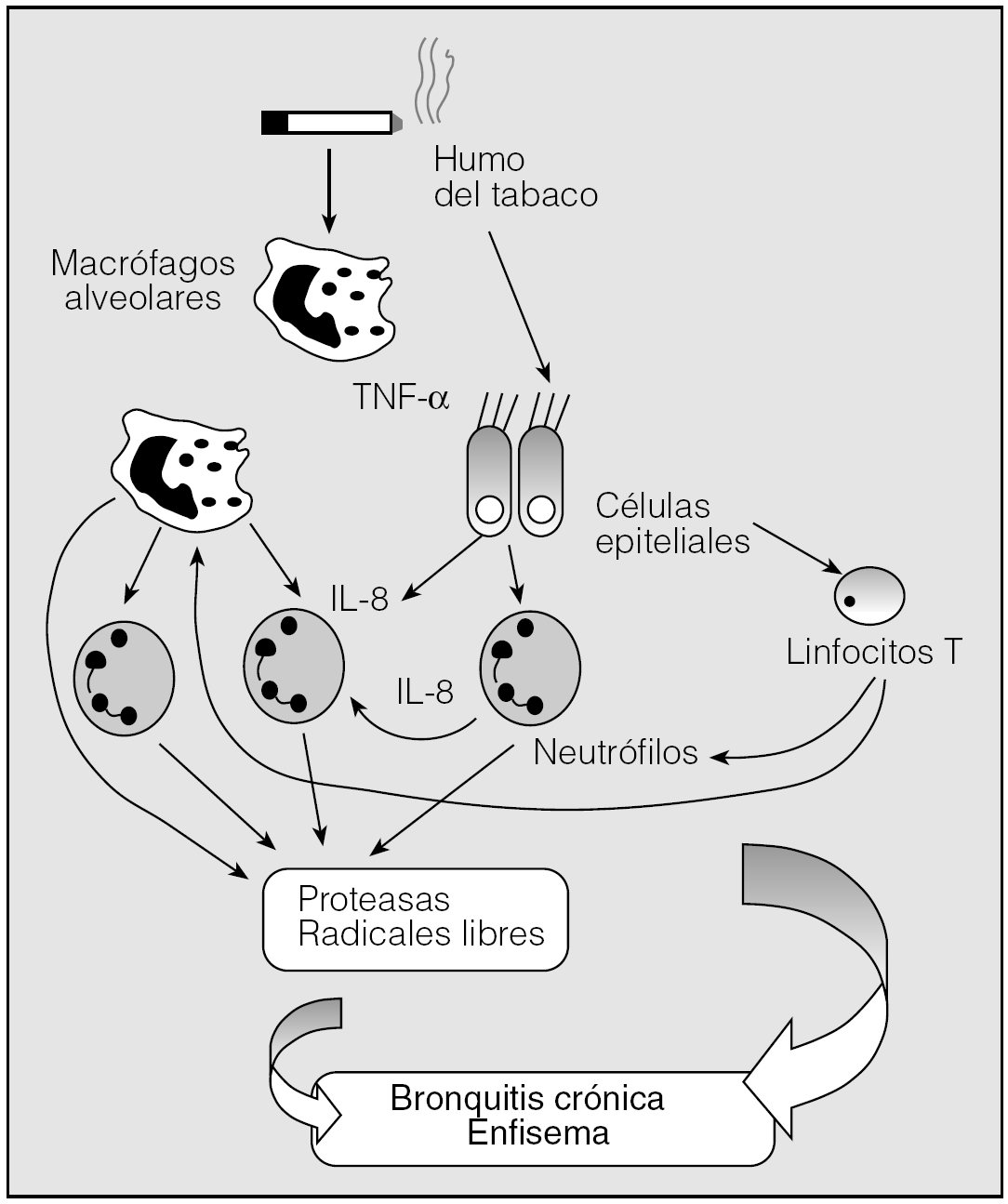
En el proceso inflamatorio característico de la EPOC se encuentran implicados numerosos agentes tanto celulares como humorales (fig. 1). El esquema patogénico de la EPOC se inicia con la activación de los macrófagos alveolares y la inducción de una lesión epitelial por parte del humo del tabaco. Como consecuencia de ello, se produce la liberación de mediadores de la inflamación, fundamentalmente el factor de necrosis tumoral alfa (TNF-α) y la interleucina 8 (IL-8), que dan lugar a la activación de neutrófilos y macrófagos. Las células epiteliales liberan también sustancias con capacidad antigénica sobre los linfocitos T. La ulterior liberación de mediadores y proteasas por neutrófilos, macrófagos y linfocitos T perpetúan el proceso inflamatorio y conducen a los cambios estructurales de remodelado y destrucción pulmonar responsables de la alteración fisiológica. Además de IL-8 y TNF-α, están implicadas otras citocinas en el proceso inflamatorio que caracteriza a la EPOC, como la IL-13 o el interferón-γ. Junto a éstas, los radicales libres presentes en el humo del tabaco o liberados por los macrófagos generan una lesión pulmonar por estrés oxidativo, que se suma a la inferida por las elastasas y metaloproteinasas implicadas en el proceso13,14.
Fig. 1. Patogenia inflamatoria de la enfermedad pulmonar obstructiva crónica (EPOC): el humo de tabaco pone en marcha el proceso por lesión epitelial y activación macrofágica. (Modificado de Cosío Piqueras14.)
La inflamación y el ulterior remodelado de la vía respiratoria, la destrucción del parénquima pulmonar, junto con la disfunción del músculo liso de la vía respiratoria pequeña y el incremento del tono colinérgico basal van a dar lugar a la obstrucción al flujo aéreo y a la dishomogeneidad de la ventilación. Las consecuencias clínicas serán la aparición de disnea y limitación al ejercicio, crónicas pero agravadas durante las fases de exacerbación. De forma paralela, el tratamiento de la enfermedad debería ir encaminado a prevenir la enfermedad, controlar la reacción inflamatoria anómala, revertir la obstrucción al flujo aéreo y tratar la sintomatología.
La prevención de la enfermedad puede llevarse a cabo suprimiendo el desencadenante, o bien actuando sobre los determinantes genéticos de la respuesta inflamatoria anómala. Aunque esto último sería la solución ideal, ello implicaría conocer en profundidad dichos determinantes, lo que no es posible de momento. Por tanto, el tratamiento farmacológico preventivo se relaciona directamente con el control del tabaquismo, un aspecto que escapa del objetivo de esta revisión.
El segundo paso en esta secuencia del tratamiento debería ser el control o la supresión de la respuesta inflamatoria, una vez que ésta se ha puesto en marcha. El tratamiento antiinflamatorio de la EPOC se apoya en el empleo de los corticoides inhalados. En diferentes etapas de su desarrollo se encuentran otras moléculas antiinflamatorias (p. ej., inhibidores de fosfodiesterasa 4)15 o los remodeladores tisulares (p. ej., ácido retinoico); tampoco se ha esclarecido el papel que puede ejercer el uso de inhibidores enzimáticos y antioxidantes16,17.
Los corticoides inhalados ocupan un papel destacado en el manejo de la enfermedad estable, con indicaciones muy precisas, pero no hay evidencias que justifiquen su uso en todos los estadios de la enfermedad. Incluso su escasa eficacia a la hora de reducir los diversos tipos celulares y mediadores inflamatorios ha motivado que algunos autores consideren que el proceso inflamatorio característico de la EPOC es resistente a los corticoides18. En cuanto a los resultados clínicos, 7 estudios aleatorizados y controlados con placebo19-25, 2 de ellos24,25 en combinación con agonistas β2, han analizado su eficacia en el tratamiento de pacientes con EPOC estable. En ninguno de ellos se ha demostrado una mejoría en las pruebas de función pulmonar ni modificaciones en la progresión de la enfermedad, aunque en 2 de ellos20,22 los pacientes que presentaban una mayor gravedad inicial sí mostraban una mejor evolución. Se ha podido constatar que, sobre todo en los pacientes con enfermedad grave y exacerbaciones frecuentes, se produce una mejoría en la sintomatología y en la calidad de vida, así como una reducción en el número de exacerbaciones21-26.
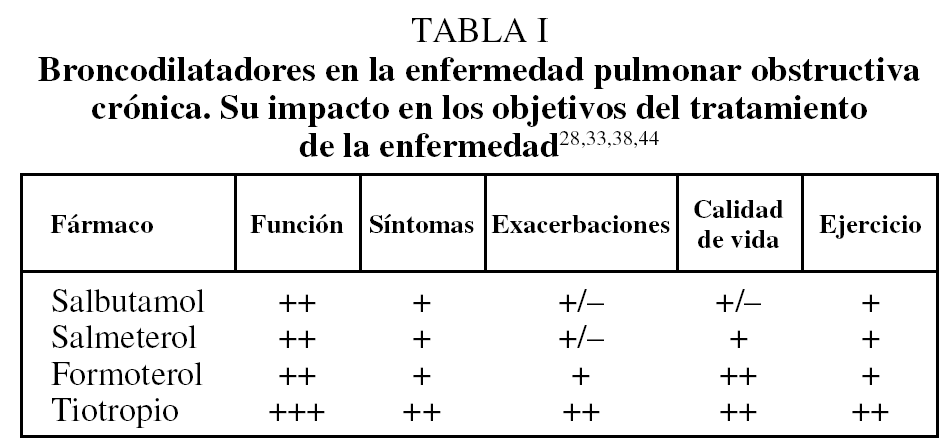
El tratamiento de la obstrucción y sus consecuencias clínicas, la disnea, la limitación al ejercicio y la pérdida de calidad de vida, justifican la utilización de los fármacos broncodilatadores, aunque éstos también estén asociados con mecanismos de acción adicionales, como la actividad antiinflamatoria e inmunomoduladora27. Disponemos de 3 grupos de sustancias broncodilatadoras: agonistas β2, anticolinérgicos y derivados de las xantinas. La utilización regular de los agonistas β2 de acción corta se asocia con una mejoría en las pruebas de función pulmonar inmediata a la administración del fármaco, disminuye la sensación cotidiana de disnea y, aunque el número de estudios en que esto se ha evaluado es reducido, tambien incide de forma positiva en la calidad de vida, la tolerancia al ejercicio o las exacerbaciones28,29. En cuanto a los agonistas β2 de acción prolongada, algunos estudios aleatorizados, controlados con placebo, han mostrado su eficacia en la mejoría de la sintomatología y la calidad de vida8,30. Además, al menos 2 estudios llevados a cabo con formoterol31,32 y 1 con salmeterol25 han mostrado que su uso se asocia con una disminución de las exacerbaciones. Por último, en un estudio de reciente publicación la utilización de salmeterol ha demostrado mejorar la tolerancia al ejercicio33. Los resultados obtenidos con agonistas β2 son superiores a los que se observan con anticolinérgicos de acción corta o con teofilinas.
El uso de anticolinérgicos de acción corta ha mostrado mejorar las pruebas de función pulmonar y hay algunos estudios que ponen de manifiesto que su utilización regular se asocia a un incremento de la tolerancia al ejercicio8,29. Sin embargo, hay resultados contradictorios en relación con los efectos sobre la sintomatología y la calidad de vida8,31,32. Dos grandes estudios aleatorizados, controlados con placebo, han demostrado la eficacia de tiotropio, un anticolinérgico de acción prolongada34,35. Además de mejorar las pruebas de función pulmonar, su utilización se asocia con una disminución en la sensación de disnea, una mejoría en la calidad de vida y una reducción del número de exacerbaciones. Estos resultados también se han observado en estudios controlados con ipratropio y salmeterol36,37. Finalmente, un reciente estudio ha puesto de manifiesto la capacidad de este fármaco para mejorar la tolerancia al ejercicio38.
En cuanto al uso de las teofilinas, una revisión de los estudios disponibles controlados con placebo, llevada a cabo por la Cochrane Library, ha mostrado su eficacia como fármaco broncodilatador39. Además, en un estudio más reciente el empleo de teofilinas también se asoció con una mejoría en la calidad de vida y en el número de exacerbaciones32. Sin embargo, la eficacia de las teofilinas es inferior a la de los broncodilatadores agonistas β2 y anticolinérgicos y, por otra parte, sus importantes efectos adversos determinan un estrecho margen de dosificación de estas sustancias.
Se han publicado numerosos estudios con el objetivo de valorar los resultados obtenidos con la utilización asociada de los diferentes broncodilatadores, así como con la de éstos y los corticoides inhalados. La utilización de agonistas β2 y anticolinérgicos ha mostrado mayor eficacia que el uso individual de cada uno de ellos, tanto respecto a los cambios en las pruebas de función pulmonar como a la disnea y la calidad de vida40. Además, los resultados son mejores cuando se asocian agonistas β2 de larga duración que agonistas β2 de acción corta41. Del mismo modo, la asociación de teofilinas con agonistas β2 o con anticolinérgicos es más eficaz que el uso aislado de cada una de los fármacos42,43. En cuanto a la combinación de agonistas β2 de acción prolongada y corticoides inhalados, 2 estudios a largo plazo han mostrado su eficacia al disminuir el número de exacerbaciones y mejorar la calidad de vida, con resultados que superan los obtenidos por los corticoides inhalados, más significativos en los pacientes que presentan altas tasas de exacerbación24,25.
El último aspecto que cabe considerar en el tratamiento farmacológico de la EPOC estable es el que hace referencia a la prevención de las exacerbaciones. Aparte de la vacunación antigripal y la antineumocócica, incluidas ya en todas las recomendaciones de tratamiento pero fuera del alcance de esta revisión, como ya se ha mencionado, actualmente hay evidencias para indicar que los corticoides inhalados y el tiotropio consiguen disminuir la tasa de exacerbaciones anuales en los pacientes con EPOC.
En resumen, a pesar del carácter inflamatorio de la EPOC, los corticoides inhalados no modifican la evolución de la enfermedad ni mejoran las pruebas de función pulmonar, si bien su uso se asocia con una mejor calidad de vida y una disminución del número de exacerbaciones. Todos los fármacos broncodilatadores mejoran de manera inmediata las pruebas de función pulmonar, aunque no reducen la tasa de disminución del volumen espiratorio forzado en el primer segundo (FEV1), si bien algunos datos relacionados con tiotropio apuntan dicha posibilidad. Los broncodilatadores de acción prolongada consiguen mejores resultados en los síntomas y la calidad de vida, además de asociarse con una disminución del número de exacerbaciones. Además, aunque los agonistas β2 de acción corta incrementan la tolerancia al ejercicio, los últimos estudios publicados también muestran resultados más consistentes con los broncodilatadores de acción prolongada, fundamentalmente con tiotropio44 (tabla I).
Recomendaciones actuales de tratamiento
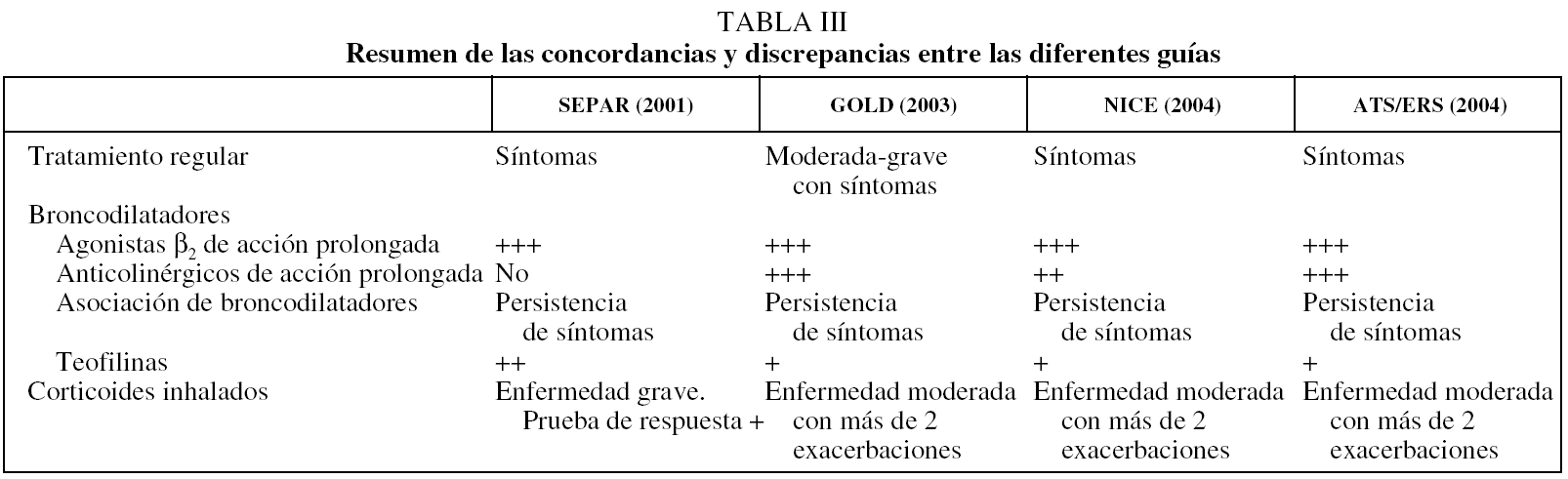
Durante la última década las normativas han ido experimentando modificaciones motivadas por la aparición de nuevos fármacos y los resultados relacionados con su aplicación. Las diferencias entre las normativas, en numerosas ocasiones, están determinadas por la fecha en que fueron formuladas, y aunque hay también factores de índole geográfica en virtud de los cuales se preconiza más el uso de uno u otro fármaco, éstos son mucho menos relevantes. Así, las guías ERS, ATS y BTS muestran escasas diferencias, excepto que en la guía ATS se recomienda comenzar la terapia regular con un anticolinérgico, mientras que en la ERS y la BTS se recomienda de forma indistinta la utilización de anticolinérgicos o agonistas β2. Las 3 guías aconsejan utilizar teofilinas sólo si la terapia inhalada combinada es insuficiente para controlar la sintomatología y en ningún caso se hace mención a los corticoides inhalados.
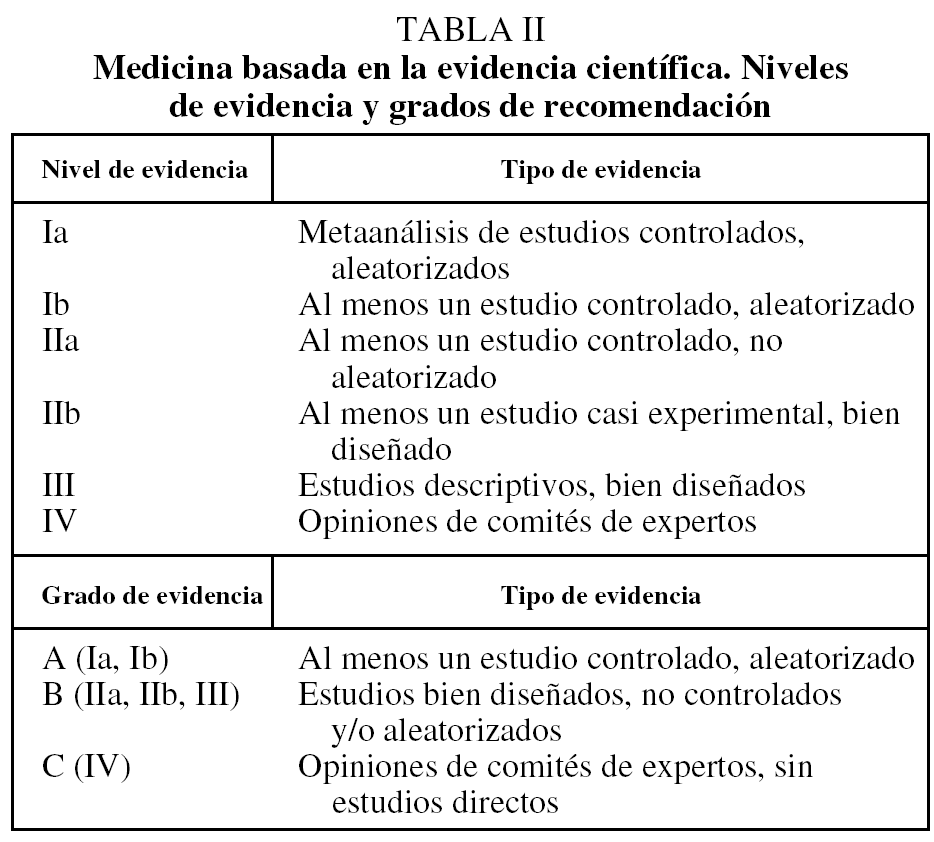
Los resultados obtenidos con la utilización de broncodilatadores de acción prolongada en primer lugar, y con el uso de corticoides inhalados posteriormente si no en los cambios en las pruebas de función pulmonar sí en la calidad de vida y las exacerbaciones, han sido determinantes para la elaboración de nuevas normativas. Junto a esto, la aparición del Global Iniciative for Obstructive Lung Disease (GOLD), en 2001, ha marcado un punto de inflexión en el desarrollo de estos documentos, por el hecho de que las recomendaciones se establecen de acuerdo con los grados de evidencia científica (tabla II). Esta metodología, seguida por las normativas posteriores, contribuye a minimizar la variabilidad entre ellas y facilita el análisis de sus diferencias, de manera que en nuestro medio lo limita a las normativas SEPAR 20014, GOLD 20037, NICE 20048 y ATS/ERS 20049.
Las normativas consideradas establecen que el tratamiento de la EPOC debe llevarse a cabo de forma escalonada, de acuerdo con la gravedad de la enfermedad y la sintomatología referida por el paciente. De la misma manera, en todas las normativas los broncodilatadores son la base fundamental del tratamiento, mientras que los corticoides inhalados se reservan para situaciones específicas. Algunos aspectos permanecen por dilucidar, como el momento en que se introduce el tratamiento farmacológico y la indicación de las distintas asociaciones que no están totalmente definidas en las normativas o varían según cuál de ellas consideremos, lo que posibilita distintas formas de manejo de los pacientes en función del protocolo seguido.
Inicio del tratamiento
Actualmente no hay evidencias de que el tratamiento farmacológico consiga frenar la progresión de la EPOC, por lo que en los pacientes con enfermedad leve todas las normativas recomiendan el uso de broncodilatadores de acción corta a demanda, iniciándose el tratamiento regular con broncodilatadores de acción prolongada cuando el paciente presenta disnea de forma habitual. Aunque la normativa GOLD7 hace mención específica a los pacientes que presentan una enfermedad moderada o grave con disnea, puesto que la indicación es la disnea, los que tienen una enfermedad leve sintomática deben ser tratados de forma regular, y así lo recoge la normativa SEPAR4 y la ERS/ATS9. Actualmente hay estudios clínicos en marcha encaminados a demostrar el impacto de algunas formas de tratamiento en la progresión y la supervivencia de la enfermedad45. Estos resultados podrían incidir en un cambio de las recomendaciones relativas al inicio del tratamiento.
Utilización de broncodilatadores
La evidencia científica actual ha motivado que todas las normativas publicadas a partir del año 2001, incluida la de la SEPAR, recomienden la utilización de broncodilatadores de acción prolongada. Como se ha mencionado en el apartado anterior, los agonistas β2 de acción prolongada se han mostrado superiores a los anticolinérgicos de acción corta, y lo mismo puede decirse del tiotropio. En cuanto a qué tipo de broncodilatador de acción prolongada se debe usar, aunque el tiotropio ha mostrado un mayor efecto sobre los parámetros de función pulmonar que el conseguido con los agonistas β2 de acción prolongada, no hay suficientes datos para establecer diferencias claras en cuanto a la mejoría en la disnea, la calidad de vida, el ejercicio o las exacerbaciones. En este aspecto hay alguna diferencia entre las normativas. Ni GOLD ni ATS/ERS se definen sobre la conveniencia de iniciar el tratamiento con un anticolinérgico o un agonista β2 pero, en cambio, en la guía NICE se establece la necesidad de tener en cuenta los estudios de costes económicos que favorecerían la utilización de agonistas β2 de acción prolongada. Por otra parte, la normativa SEPAR, al haber sido elaborada con anterioridad a la publicación de los estudios de tiotropio, no considera el empleo de este fármaco. Todas las normativas recomiendan la asociación de broncodilatadores en los casos en que no se consigue controlar los síntomas con monoterapia. Tanto GOLD como ATS/ERS recomiendan la combinación de broncodilatadores de acción prolongada pero, de acuerdo con las razones de costes ya mencionadas, la guía NICE contempla la posibilidad de asociar un agonista β2 de acción prolongada y un anticolinérgico de corta acción. Debido a su elevada toxicidad y a su menor efectividad, las teofilinas quedan relegadas a los pacientes cuya afección no se puede controlar con la asociación de los otros 2 tipos de broncodilatadores más los corticoides inhalados. Sin embargo, la normativa SEPAR, probablemente por el momento en que fue elaborada, mantiene la indicación de las teofilinas como fármacos de tercera elección, por encima de los corticoides inhalados.
Indicación de corticoides inhalados
El uso de los corticoides inhalados es otro de los aspectos importantes en los que encontramos diferencias significativas entre la normativa SEPAR y las guías GOLD, NICE y ATS/ERS. La normativa SEPAR sólo considera la utilización de corticoides inhalados en los pacientes con una enfermedad grave en quienes la asociación de broncodilatadores, incluidas las teofilinas, no consiga un adecuado control de los síntomas y, en estas situaciones, la indicación definitiva requiere un período de evaluación inicial en el que se demuestre que el tratamiento con corticoides, ya sea por vía inhalada u oral, se asocia con una mejoría clara de los pacientes. Por el contrario, el documento GOLD establece la indicación de los corticoides inhalados para los pacientes con una enfermedad moderada que desarrollen 2 o más exacerbaciones al año, y la misma indicación mantienen las guías NICE y ATS/ERS. La guía GOLD especifica, además, la conveniencia de utilizar el corticoide inhalado y el broncodilatador en el mismo dispositivo, siempre que sea necesario asociarlos.
Combinaciones de broncodilatadores frente a combinación de broncodilatadores y corticoides
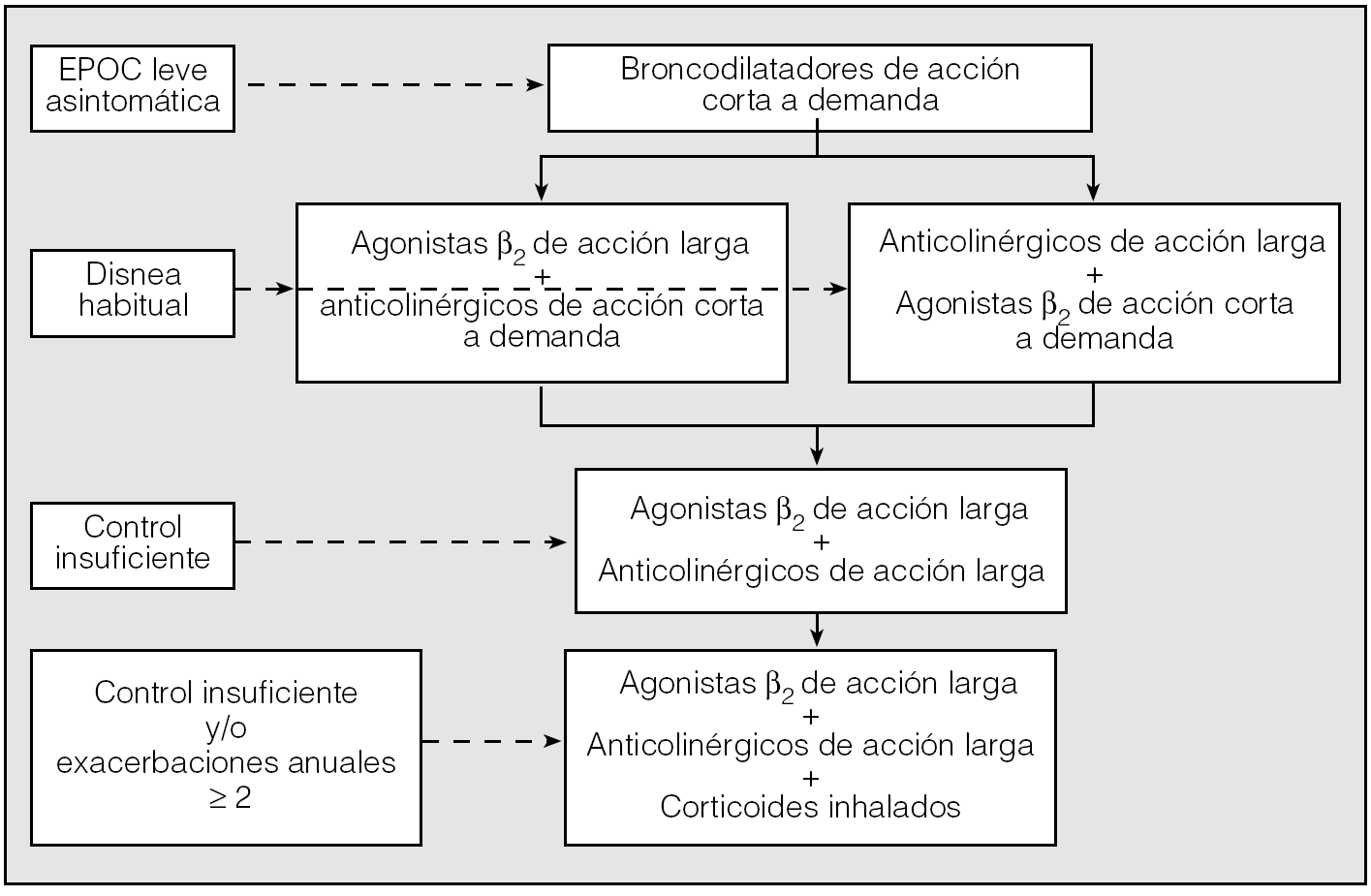
Ya se ha mencionado que, actualmente, los broncodilatadores se consideran la piedra angular en el tratamiento de la EPOC, mientras que los corticoides se reservan para las situaciones señaladas de pacientes con exacerbaciones frecuentes. Sin embargo, tanto la asociación de broncodilatadores como la de broncodilatadores y corticoides ha mostrado su efectividad en la reducción de las exacerbaciones y en la mejoría de la calidad de vida. Por otra parte, aun sin establecerlo de forma clara, la guía ATS/ERS señala la posibilidad de utilizar cualquiera de las 2 asociaciones, de forma indistinta, cuando los pacientes no se controlan adecuadamente con un broncodilatador. No hay estudios que comparen ambos tipos de asociaciones y permitan establecer con evidencia de grado A cuál de ellas es preferible utilizar como primera elección. Por otra parte, de acuerdo con los resultados observados con las asociaciones de agonistas β2 de acción prolongada y anticolinérgicos de acción corta, se puede establecer que la combinación de broncodilatadores de acción prolongada es la pauta recomendada cuando la monoterapia no consigue resultados suficientes. En la figura 2 se resume la pauta de elección propuesta como resultado de la convergencia de las diferentes recomendaciones.
Fig. 2. Propuesta de tratamiento escalonado de la enfermedad pulmonar obstructiva crónica (EPOC) basado en criterios convergentes de las actuales normativas. (Modificado de Tashkin y Cooper44.)
Conclusiones
Las guías y recomendaciones para el manejo de la EPOC han permitido, sin duda, mejorar el tratamiento de los pacientes. No obstante, las normativas no deben contemplarse como una herramienta inamovible sino que han de estar en continua evolución. Si bien la aplicación de una metodología basada en la evidencia científica atenúa la posibilidad de discrepancias entre las distintas normativas vigentes, la rapidez en el desarrollo de nuevos fármacos propicia que se observen algunas diferencias que podrían llegar a crear una situación de confusión. En nuestro medio, la enorme difusión que ha tenido el documento de consenso GOLD y, más recientemente, la guía ATS/ERS no resta importancia a la que ha de tener la normativa SEPAR. Por tanto, resultan significativas las diferencias de tratamiento entre esta normativa y los otros 2 documentos. Mientras que está totalmente establecido que los broncodilatadores de acción prolongada son la base para el tratamiento de la EPOC, la normativa SEPAR utiliza criterios diferentes para el uso de corticoides inhalados y no contempla el papel de los anticolinérgicos de acción prolongada. Puesto que estas discrepancias están sobre todo determinadas por la rapidez con la que se producen los avances en el tratamiento de la enfermedad, es aconsejable una revisión periódica de las normativas que permita su actualización y minimice las diferencias entre ellas. Ya al margen de las diferencias entre los distintos documentos, incluso sin considerar los fármacos que se hallan en fase de desarrollo, la investigación actualmente en marcha sobre el impacto de algunos fármacos en la progresión de la enfermedad, el número de exacerbaciones y la supervivencia pueden determinar la aparición de cambios fundamentales en la estrategia de tratamiento en un futuro próximo.
Correspondencia: Dra. P. de Lucas Ramos.
Servicio de Neumología. Hospital General Universitario Gregorio Marañón.
Dr. Esquerdo, 46. 28007 Madrid. España.
Correo electrónico: plucasr.hgugm@salud.madrid.org