Determinar la morbimortalidad y supervivencia de los procedimientos broncoangioplásticos extendidos a más de un lóbulo en comparación con las técnicas broncoangioplásticas simples.
Pacientes y métodosEntre septiembre de 2005 y mayo de 2010, 535 pacientes diagnosticados de carcinoma broncogénico que cumplían criterios de operabilidad clínica, oncológica y funcional fueron tratados en nuestra unidad. Los tumores centrales(n=95) no resecables mediante lobectomía simple fueron programados para técnicas broncoangioplásticas y en caso de imposibilidad, neumonectomía.
ResultadosSe realizaron 58 (11%) procedimientos, 46 lobectomías broncoangioplásticas simple (LBS) y 12 extendidas (LBE). En el grupo de LBS (bronquiales 32 [70%], reconstrucción broncovascular 7 [15%] y vascular sola 7 [15%]). En el grupo de LBE, 8 (66,7%) fueron reconstrucciones bronquiales y 4 (33,3%) broncovasculares. El tipo de resección más frecuente es el lóbulo superior derecho (LSD)+segmento 6 en 5 (41%) casos, seguido del LSD+lóbulo medio. La mortalidad fue de en 2 (3%) casos en el grupo LBS. La morbilidad ocurrió en el 34% LSB y en el 33% LBE (p>0,05). Quince pacientes recibieron tratamiento quimiorradioterápico neoadjuvante, por cN2 confirmado histológicamente, sin embargo no se detectó mayor número de complicaciones significativamente (p>0,05). No se detectaron factores de riesgo respecto a ninguna variable estudiada que afectaran a las LBE respecto a las LBS (p>0,05). En ambos grupos, los pacientes con mayor morbilidad fueron pN1, localización en lóbulo superior izquierdo y con reconstrucción vascular asociada (p<0,05). La supervivencia global a los 5 años fue 61,6% LBS (61%) y LBE (68,9%) sin diferencia entre ambos grupos (p>0,05).
ConclusionesLas LBE son procedimientos técnicamente más demandantes pero no aumentan la morbimortalidad respecto a las técnicas broncoangioplásticas simples con una supervivencia similar.
To determine the morbidity, mortality and survival of sleeve lobectomy procedures compared to simple broncho-angioplasty procedures.
Patients and methodsA total of 535 patients diagnosed with bronchogenic cancer between September 2005 and May 2010 who fulfilled the criteria of clinical, oncological and functional operability were treated in our unit. Unresectable central tumours (n=95) using simple lobectomy were scheduled for broncho-angioplasty techniques and a pneumonectomy in those where this was impossible.
ResultsA total of 58 (11%) were performed, 46 simple broncho-angioplastic lobectomies (SBAL) and 12 extended broncho-angioplastic lobectomies (EBAL). In the SBAL group there were 32 bronchial (70%) and 7 (15%) bronchovascular reconstructions and only vascular (15%). In the EBAL group, 8 (66.7%) were bronchial and 4 (33.3%) were bronchovascular reconstructions. The most common type of resection was the right upper lobe (RUL)+segment 6 in five (41%) cases, followed by RUL+middle lobe. There were 2 (3%) deaths in the SBAL group. There was 34% morbidity in the SBAL and 33% in the EBAL group (P>0.05). Fifteen patients received neoadjuvant chemo-radiotherapy treatment, due to histologically confirmed cN2; however, the number of complications was not significantly higher. No risk factors were detected in any variable studied that would affect EBAL compared to the SBAL group (P>0.05). The patients in both groups with a higher morbidity were pN1, located in the left upper lobe and associated with vascular reconstruction (P<0.05). The overall survival at 5 years was 61.6%, SBAL (61%) and EBAL (68.9%) with no differences between groups (P>0.05).
ConclusionsEBALs are technically more demanding procedures, but do not increase the morbidity or mortality compared to simple broncho-angioplasty techniques, and with a similar survival.
La mortalidad relacionada con la cirugía de resección pulmonar en pacientes con carcinoma broncogénico depende directamente del procedimiento y por extensión, de la realización o no de neumonectomía. La mortalidad tras neumonectomía en pacientes que funcionalmente se estima que toleraran el procedimiento, está comprendida entre un 9-17%1,2. Este porcentaje puede ser mayor en determinadas condiciones como quimio-radioterapia previa3, limitada función pulmonar, pacientes añosos y por tanto, la tendencia actual es la selección del candidato para neumonectomía en relación con factores de riesgo identificados4. Así mismo, la mayor extirpación de parénquima pulmonar está relacionada con un empeoramiento a largo plazo de la calidad de vida posterior5,6 y un mayor número de efectos secundarios del tratamiento adyuvante. Las técnicas de reconstrucción broncoangioplásticas han sido desarrolladas para ofrecer tratamiento quirúrgico en tumores centrales consiguiendo preservar parénquima pulmonar obviando la realización de una neumonectomía7-10. Estas técnicas están indicadas en todos los pacientes en que oncológicamente sea factible, independientemente de funcionalidad respiratoria, ganglios interlobales afectados, edad u otros factores. En pacientes septuagenarios u octogenarios y en pacientes con pruebas respiratorias límites es esencialmente donde estas técnicas suelen tener un papel irrenunciable, realizándose en estos pacientes las técnicas de resección broncoangioplástica de más de un lóbulo o extendidas, si las técnicas simples no fueran factibles oncológicamente para evitar las complicaciones propias de la neumonectomía11,12.
El objetivo de este estudio es describir la morbimortalidad de los procedimientos broncoangioplásticos extendidos a más de un lóbulo. Así mismo, describir la supervivencia de estos procedimientos comparándola con los procedimientos broncoangioplásticos simples.
Pacientes y métodosEntre septiembre de 2005 y mayo de 2010, 535 pacientes fueron diagnosticados de carcinoma broncogénico no células pequeñas (CB), que cumplían criterios de operabilidad clínica, oncológica y funcional, fueron tratados en nuestra unidad. Este estudio se centró principalmente en CB central con dudosa resecabilidad mediante lobectomía simple y especialmente en los pacientes con técnicas de resección broncoangioplásticas con extirpación de más de un lóbulo. Todos los pacientes fueron evaluados oncológica13 y funcionalmente14 por el Comité Oncológico Multidisciplinar de nuestro centro, según las guías clínicas de la European Society Thoracic Surgeons. Preoperatoriamente se realizó un TAC torácico con contraste y un 18-FDGPET-TC para estadificación clínica de todos los pacientes15 siguiendo la clasificación TNM 1997 y posteriormente se re-estadificaron mediante la nueva propuesta de estadificación de la IASCL16. En caso de sospecha de afectación mediastínica ganglionar cN2 se realizó confirmación histopatológica mediante la exploración más conveniente y menos invasiva, en cada caso (EBUS, EUS-FNA, mediastinoscopia o extendida). En caso de confirmarse la afectación mediastínica se les realizó tratamiento neoadjuvante y se reevaluó posteriormente mediante técnicas de imagen (TAC torácico y 18-FDGPET-TC) para su rescate quirúrgico.
La elección de la técnica quirúrgica se basó en la preservación del máximo de parénquima pulmonar siempre que se considerara óptima oncológicamente. En el caso de no poder realizar técnicas de preservación pulmonar por razones oncológicas, por mala calidad de remanente pulmonar, o por extrema tensión en las anastomosis, se realizo neumonectomía si el paciente toleraba funcionalmente el procedimiento. Los pacientes fueron informados de los riesgos de la intervención y los diferentes procedimientos posibles y el consentimiento informado fue obtenido en todos los casos.
Técnica quirúrgicaA todos los pacientes se les realizó una broncoscopia previa a la intervención en quirófano para evaluar in situ la posibilidad de realización de técnicas broncoangioplásticas por el equipo quirúrgico. Se inició la lobectomía según técnica quirúrgica habitual, hasta conseguir una exposición correcta del bronquio y de la arteria pulmonar si era posible. En ese momento se decidió sobre el tipo de resección quirúrgica más adecuada para cada paciente individualmente. Una vez considerada la opción de la técnica broncoangioplástica, se aisló el tumor pulmonar y se realizó la desconexión de las estructuras del lóbulo tanto vasculares como aéreas, para posteriormente preparar la reconstrucción. Se realizó una sección circunferencial del bronquio o de la arteria pulmonar o de ambos, permitiendo crear el suficiente margen con la lesión mediante bisturí frío. La manipulación bronquial fue cuidadosa, intentando mantener el aporte sanguíneo y preservando las arterias bronquiales, evitando la electrocoagulación en tejidos circundantes. Los márgenes resecados fueron evaluados intraoperatoriamente para asegurar una resección completa (R0); en caso de R1 o dudas de la viabilidad del remanente pulmonar o de la vitalidad de los tejidos perianastomóticos(exceso de tensión, ausencia de flujo evidente, etc.) se completó la neumonectomía. La anastomosis bronquial se realizó mediante sutura continua de 4-0 polydioxanona (PDS, Ethicon Inc, Somerville, NJ) iniciándola en la unión membrano-cartilaginosa en la cara mediastínica del bronquio hasta la mitad del anillo cartilaginoso17. El resto de anastomosis se realizó mediante puntos sueltos de 4-0 polydioxanona en X, que se anudaron al finalizar la anastomosis. Todos los puntos fueron anudados en el exterior del bronquio. Se evitó la realización de suturas telescópadas y las discrepancias se solucionaron mediante la correcta colocación de los puntos y una técnica quirúrgica cuidadosa. La torsión bronquial se evitó mediante el cuidado en la técnica9. Posteriormente se comprobó la estanqueidad de las suturas bajo agua en todos los casos mediante una presión en vía aérea de al menos 30 mmHg. La anastomosis arterial se realizó mediante sutura continua de 5-0 Prolene (Ethicon) tras heparinización sistémica (3.000-5.000 UI de heparina sódica) y local. La reperfusión del lóbulo preservado se realizó lentamente evitando el desclampaje brusco, iniciando la reperfusión a menos de 20 mmHg de presión y una vez que éste estaba reexpandido siempre que esto fuera posible. Las suturas no se recubrieron de forma sistemática mediante flaps intercostales o grasa pericárdica. No se administró ni antibióticos inhalados profilácticos ni otros fármacos como corticoides o expectorantes. Para minimizar la tensión en la anastomosis se liberó sistemáticamente el ligamento pulmonar, y en caso de ser necesario, se realizó una incisión pericárdica alrededor de las venas pulmonares.
Se comprobó la idoneidad de la sutura bronquial con broncoscopio flexible una vez comprobada la estanqueidad intraoperatoriamente y se realizó una limpieza de secreciones. Se intentó la extubación en todos los pacientes en quirófano. El postoperatorio inmediato se realizó en la Unidad de Cuidados Intermedios durante las siguientes 24 horas y posteriormente en ausencia de complicaciones se trasladaron a la sala de hospitalización de la Unidad de Cirugía Torácica. En caso de fuga aérea persistente, hemoptisis o cualquier signo clínico sospechoso de dehiscencia de sutura se realizó fibrobroncoscopia flexible inmediatamente, y en ausencia de sintomatología se indicó esta exploración antes del alta.
La analgesia postoperatoria fue mediante catéter epidural que se colocó previa intervención quirúrgica y con el paciente despierto a nivel T7-T10. Una hora antes de finalizar la cirugía se administró un bolus de ropivacaína peridural al 2% (5ml) y se inició una perfusión peridural continua en modo PCA de ropivacaína al 0,14% más fentanilo 2μg/ml (ritmo de perfusión de 4-8ml/h con la posibilidad de autoadministrarse suplementos de 2ml cada 30 minutos) En todos los casos se pautó analgesia complementaria vía sistémica dexketoprofeno 50mg/8h/iv pautado y paracetamol 1g/8h/iv si EVA > 3 en reposo. Antes de retirar el catéter se administra un bolus de metadona (4-6mg) y se continúa con la analgesia pautada complementaria intravenosa. Se insistió en la realización de fisioterapia respiratoria para evitar la retención de esputo y complicaciones respiratorias.
El seguimiento endoscópico de la anastomosis se llevó a cabo al mes, tres meses y posteriormente se realizó seguimiento mediante imagen, siguiendo el protocolo de seguimiento oncológico de la ACCP18.
El análisis estadístico se llevó a cabo mediante el programa SPSS v.11 (SPSS Inc., Chicago, IL, USA). Las variables cuantitativas fueron comparadas mediante el test estadistico χ2 o test exacto de Fisher cuando apropiado con un nivel de significación de p<0,05. El analisis bivariante se realizó primero con el objetivo de identificar factores de riesgo para su inclusión en un modelo de riesgo proporcional de Cox. Los resultados se expresaron como riesgo relativo estimado con su intervalo de confianza 95%. La supervivencia esperada fue calculada mediante las tablas de supervivencia con Kaplan-Meier y log rank para comparación de curvas.
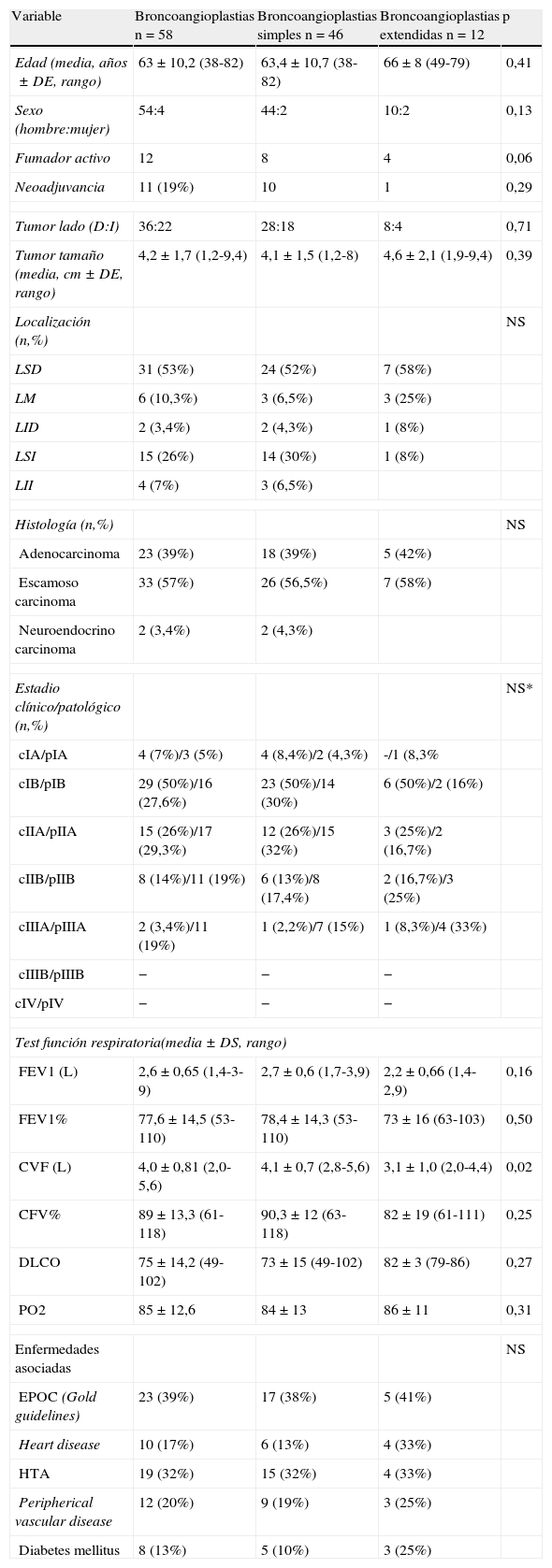
ResultadosEn estos 535 pacientes, 95 pacientes presentaron un CBNCP central. En aquellos no resecables por lobectomía simple, bien por afectación directa del tumor o por afectación N1 se realizaron 58 (11%) lobectomías broncoangioplásticas y 22 (4%) neumonectomías. Entre las lobectomías broncoangioplásticas se realizaron 12 lobectomías broncoangioplásticas extendidas (LBE) a más de un lóbulo y 46 lobectomías broncoangioplásticas simples (LBS). Las características de ambos grupos se recogen en la tabla 1.
Características de la serie de pacientes con técnicas broncoangioplásticas.
| Variable | Broncoangioplastias n=58 | Broncoangioplastias simples n=46 | Broncoangioplastias extendidas n=12 | p |
| Edad (media, años±DE, rango) | 63±10,2 (38-82) | 63,4±10,7 (38-82) | 66±8 (49-79) | 0,41 |
| Sexo (hombre:mujer) | 54:4 | 44:2 | 10:2 | 0,13 |
| Fumador activo | 12 | 8 | 4 | 0,06 |
| Neoadjuvancia | 11 (19%) | 10 | 1 | 0,29 |
| Tumor lado (D:I) | 36:22 | 28:18 | 8:4 | 0,71 |
| Tumor tamaño (media, cm±DE, rango) | 4,2±1,7 (1,2-9,4) | 4,1±1,5 (1,2-8) | 4,6±2,1 (1,9-9,4) | 0,39 |
| Localización (n,%) | NS | |||
| LSD | 31 (53%) | 24 (52%) | 7 (58%) | |
| LM | 6 (10,3%) | 3 (6,5%) | 3 (25%) | |
| LID | 2 (3,4%) | 2 (4,3%) | 1 (8%) | |
| LSI | 15 (26%) | 14 (30%) | 1 (8%) | |
| LII | 4 (7%) | 3 (6,5%) | ||
| Histología (n,%) | NS | |||
| Adenocarcinoma | 23 (39%) | 18 (39%) | 5 (42%) | |
| Escamoso carcinoma | 33 (57%) | 26 (56,5%) | 7 (58%) | |
| Neuroendocrino carcinoma | 2 (3,4%) | 2 (4,3%) | ||
| Estadio clínico/patológico (n,%) | NS* | |||
| cIA/pIA | 4 (7%)/3 (5%) | 4 (8,4%)/2 (4,3%) | -/1 (8,3% | |
| cIB/pIB | 29 (50%)/16 (27,6%) | 23 (50%)/14 (30%) | 6 (50%)/2 (16%) | |
| cIIA/pIIA | 15 (26%)/17 (29,3%) | 12 (26%)/15 (32%) | 3 (25%)/2 (16,7%) | |
| cIIB/pIIB | 8 (14%)/11 (19%) | 6 (13%)/8 (17,4%) | 2 (16,7%)/3 (25%) | |
| cIIIA/pIIIA | 2 (3,4%)/11 (19%) | 1 (2,2%)/7 (15%) | 1 (8,3%)/4 (33%) | |
| cIIIB/pIIIB | − | − | − | |
| cIV/pIV | − | − | − | |
| Test función respiratoria(media±DS, rango) | ||||
| FEV1 (L) | 2,6±0,65 (1,4-3-9) | 2,7±0,6 (1,7-3,9) | 2,2±0,66 (1,4-2,9) | 0,16 |
| FEV1% | 77,6±14,5 (53-110) | 78,4±14,3 (53-110) | 73±16 (63-103) | 0,50 |
| CVF (L) | 4,0±0,81 (2,0-5,6) | 4,1±0,7 (2,8-5,6) | 3,1±1,0 (2,0-4,4) | 0,02 |
| CFV% | 89±13,3 (61-118) | 90,3±12 (63-118) | 82±19 (61-111) | 0,25 |
| DLCO | 75±14,2 (49-102) | 73±15 (49-102) | 82±3 (79-86) | 0,27 |
| PO2 | 85±12,6 | 84±13 | 86±11 | 0,31 |
| Enfermedades asociadas | NS | |||
| EPOC (Gold guidelines) | 23 (39%) | 17 (38%) | 5 (41%) | |
| Heart disease | 10 (17%) | 6 (13%) | 4 (33%) | |
| HTA | 19 (32%) | 15 (32%) | 4 (33%) | |
| Peripherical vascular disease | 12 (20%) | 9 (19%) | 3 (25%) | |
| Diabetes mellitus | 8 (13%) | 5 (10%) | 3 (25%) | |
En el grupo de LBS, las técnicas más frecuentes fueron bronquiales 32 (70%), reconstrucción broncovascular 7 (15%) y vascular sola 7 (15%). Por localización, el más frecuente fue el lóbulo superior derecho 24 (52%), seguido del LSI (tabla 1).
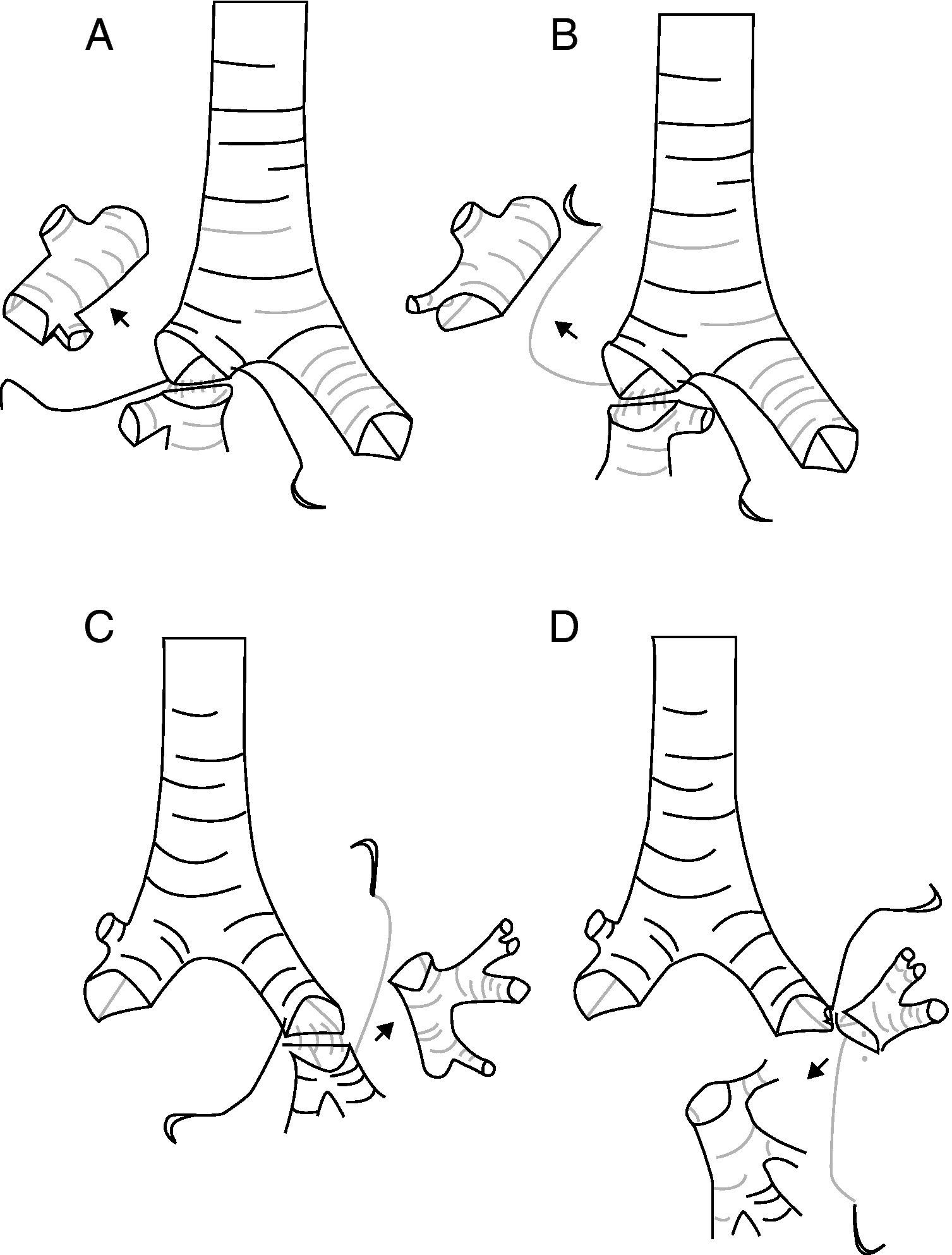
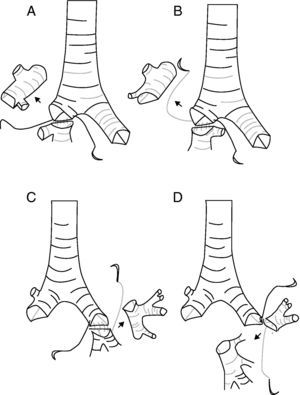
En el grupo de LBE, 8 (66,7%) fueron reconstrucciones bronquiales y 4 (33,3%) broncovasculares. El tipo de resección más frecuente (fig. 1) es la lobectomía superior derecha (LSD)+segmento 6 en 5 (41%) casos seguido del LSD+lóbulo medio (LM) (tabla 2). Solo en 9 (15%) casos las resecciones broncoplásticas fueron necesarias por pN1, y de estos sólo 2 fueron LBE.
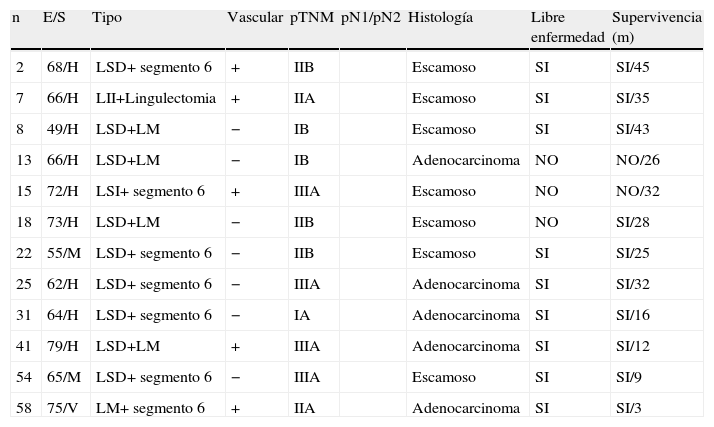
Características de los pacientes con broncoangioplastias extendidas.
| n | E/S | Tipo | Vascular | pTNM | pN1/pN2 | Histología | Libre enfermedad | Supervivencia (m) |
| 2 | 68/H | LSD+ segmento 6 | + | IIB | Escamoso | SI | SI/45 | |
| 7 | 66/H | LII+Lingulectomia | + | IIA | Escamoso | SI | SI/35 | |
| 8 | 49/H | LSD+LM | − | IB | Escamoso | SI | SI/43 | |
| 13 | 66/H | LSD+LM | − | IB | Adenocarcinoma | NO | NO/26 | |
| 15 | 72/H | LSI+ segmento 6 | + | IIIA | Escamoso | NO | NO/32 | |
| 18 | 73/H | LSD+LM | − | IIB | Escamoso | NO | SI/28 | |
| 22 | 55/M | LSD+ segmento 6 | − | IIB | Escamoso | SI | SI/25 | |
| 25 | 62/H | LSD+ segmento 6 | − | IIIA | Adenocarcinoma | SI | SI/32 | |
| 31 | 64/H | LSD+ segmento 6 | − | IA | Adenocarcinoma | SI | SI/16 | |
| 41 | 79/H | LSD+LM | + | IIIA | Adenocarcinoma | SI | SI/12 | |
| 54 | 65/M | LSD+ segmento 6 | − | IIIA | Escamoso | SI | SI/9 | |
| 58 | 75/V | LM+ segmento 6 | + | IIA | Adenocarcinoma | SI | SI/3 |
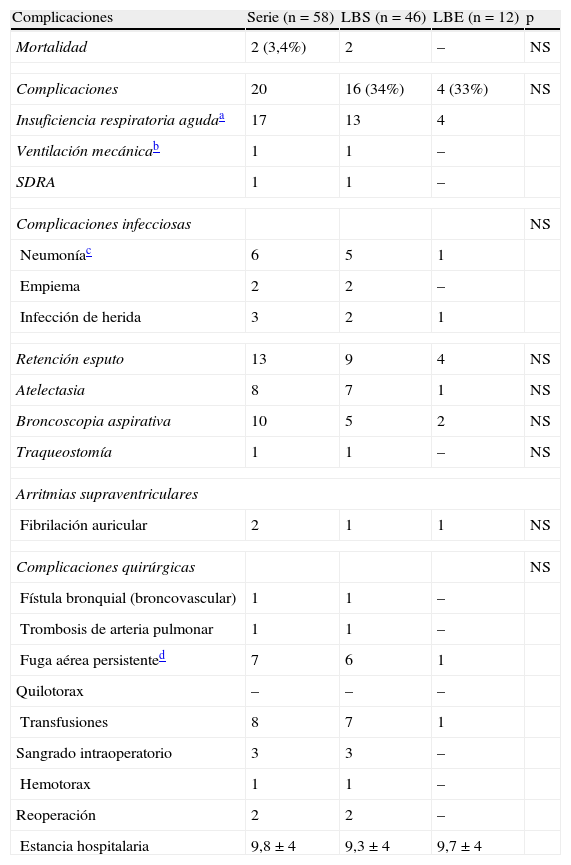
La mortalidad ocurrió en el grupo LBS en dos casos 2 (1,7%) (fístula bronco-arterial y síndrome distress respiratorio del adulto). Las morbilidad fue similar en ambos grupos (p<0,05) y las complicaciones más importantes están descritas en la tabla 3. La complicación más frecuente fue la retención de esputo en 13 (22%) casos.
Complicaciones de ambos grupos broncoangioplástias simples y extendidas.
| Complicaciones | Serie (n=58) | LBS (n=46) | LBE (n=12) | p |
| Mortalidad | 2 (3,4%) | 2 | – | NS |
| Complicaciones | 20 | 16 (34%) | 4 (33%) | NS |
| Insuficiencia respiratoria agudaa | 17 | 13 | 4 | |
| Ventilación mecánicab | 1 | 1 | – | |
| SDRA | 1 | 1 | – | |
| Complicaciones infecciosas | NS | |||
| Neumoníac | 6 | 5 | 1 | |
| Empiema | 2 | 2 | – | |
| Infección de herida | 3 | 2 | 1 | |
| Retención esputo | 13 | 9 | 4 | NS |
| Atelectasia | 8 | 7 | 1 | NS |
| Broncoscopia aspirativa | 10 | 5 | 2 | NS |
| Traqueostomía | 1 | 1 | – | NS |
| Arritmias supraventriculares | ||||
| Fibrilación auricular | 2 | 1 | 1 | NS |
| Complicaciones quirúrgicas | NS | |||
| Fístula bronquial (broncovascular) | 1 | 1 | – | |
| Trombosis de arteria pulmonar | 1 | 1 | – | |
| Fuga aérea persistented | 7 | 6 | 1 | |
| Quilotorax | – | – | – | |
| Transfusiones | 8 | 7 | 1 | |
| Sangrado intraoperatorio | 3 | 3 | – | |
| Hemotorax | 1 | 1 | – | |
| Reoperación | 2 | 2 | – | |
| Estancia hospitalaria | 9,8±4 | 9,3±4 | 9,7±4 | |
Las complicaciones anastomóticas ocurrieron sólo en 1 paciente. No se detectaron complicaciones anastomóticas a largo plazo durante el seguimiento broncoscópico. Se cubrieron las anastomosis 24 (41%) sobre todo si se realizó reconstrucción combinada bronquial y arterial sin diferencias significativas con y sin protección mediante flap (p>0,05).
Se consiguió resección completa (R0) en todos los casos menos en uno, en un borde vascular fue informado postoperatoriamente como R1. Díez (17%) pacientes fueron programados exclusivamente para LBS o LBE, por motivos funcionales o por exceso de riesgo por edad avanzada > 75 años. Quince pacientes recibieron tratamiento quimiorradioterápico neoadyuvante, por cN2 confirmado histológicamente, sin embargo, no se detectó mayor número de complicaciones significativamente (p>0,05).
No existieron factores de riesgo individuales en las variables estudiadas (localización de tumor, histología, reconstrucción doble, tratamiento neoadyuvante, FEV1 bajo) que afectaran a las LBE respecto a las LBS (p>0,05). Sin embargo, en ambos grupos los pacientes con mayor morbilidad fueron pN1, localización en lóbulo superior izquierdo y con reconstrucción vascular asociada (p<0,05), sin embargo no presentaron significativamente mayor mortalidad (p>0,05).
Las recurrencias sistémicas ocurrieron en 16 (27%) pacientes, sin diferencias entre grupos (p>0,05). Sólo un caso de recurrencias local mediastínica apareció en el grupo de LBS. No se detectaron recurrencias en la zona anastomótica, salvo en el caso de R1, en que no se completó neumonectomía debido al excesivo riesgo quirúrgico, completando tratamiento con quimiorradioterapia coadyuvante.
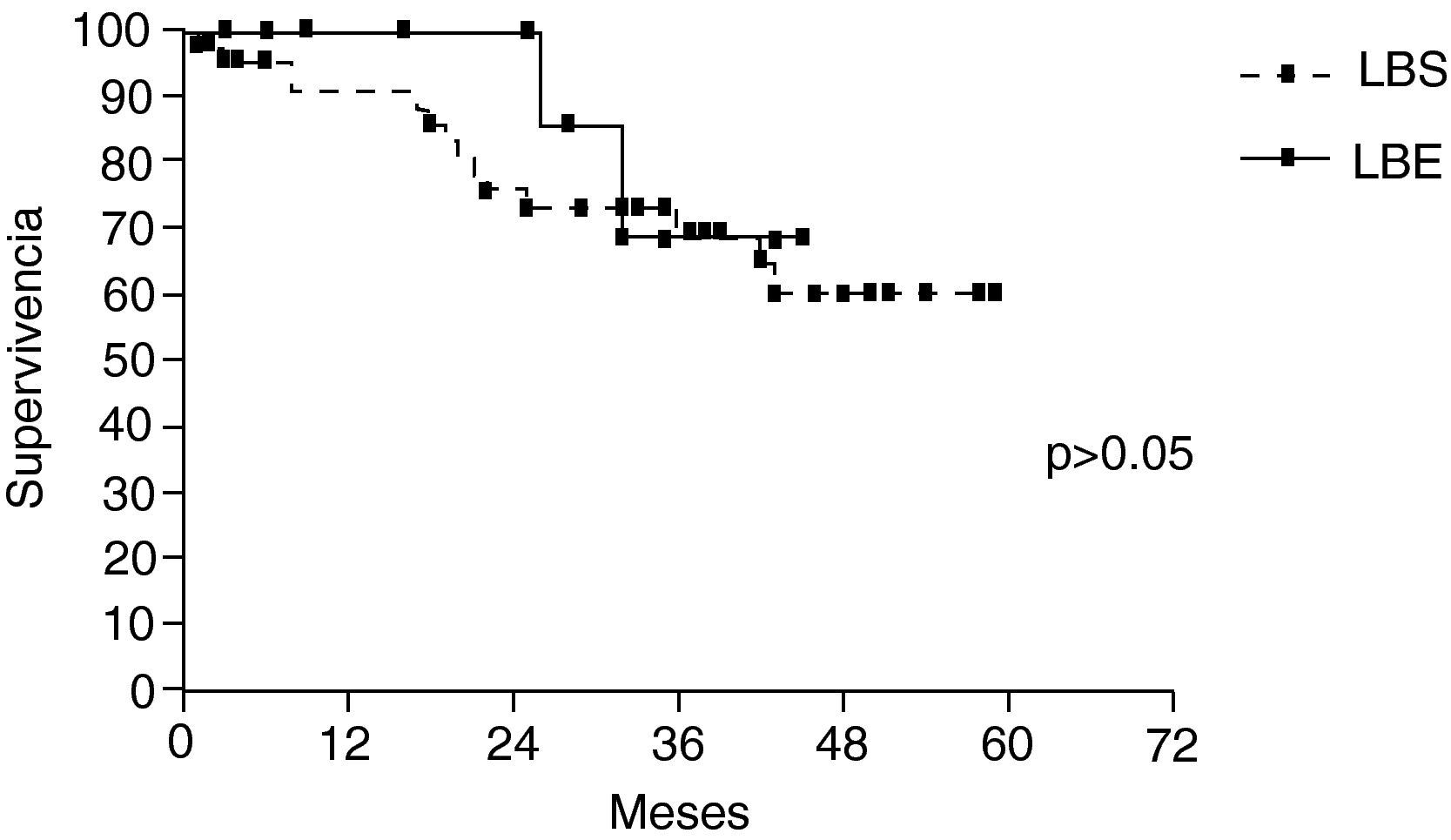
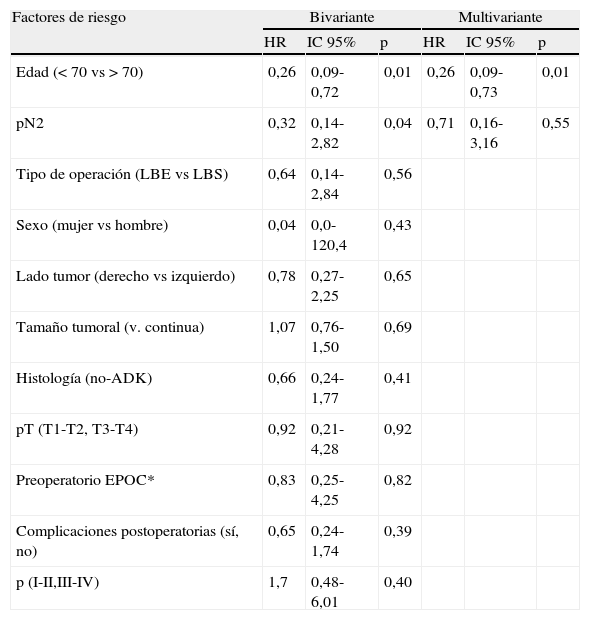
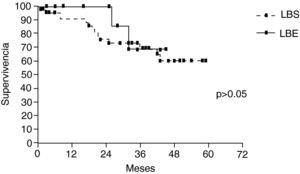
La supervivencia global a los 5 años fue del 61,6%, LBS (61%) y LBE (68,9%) sin diferencia entre ambos grupos (p>0,05) (fig. 2). Los pacientes mayores de 70 años, y pN2, fueron identificados como factores de riesgo en análisis bivariante. En el análisis multivariante solo la edad>70 años afectó negativamente la supervivencia (tabla 4).
Resultados del Cox bivariante y multivariante para supervivencia.
| Factores de riesgo | Bivariante | Multivariante | ||||
| HR | IC 95% | p | HR | IC 95% | p | |
| Edad (< 70 vs>70) | 0,26 | 0,09-0,72 | 0,01 | 0,26 | 0,09-0,73 | 0,01 |
| pN2 | 0,32 | 0,14-2,82 | 0,04 | 0,71 | 0,16-3,16 | 0,55 |
| Tipo de operación (LBE vs LBS) | 0,64 | 0,14-2,84 | 0,56 | |||
| Sexo (mujer vs hombre) | 0,04 | 0,0-120,4 | 0,43 | |||
| Lado tumor (derecho vs izquierdo) | 0,78 | 0,27-2,25 | 0,65 | |||
| Tamaño tumoral (v. continua) | 1,07 | 0,76-1,50 | 0,69 | |||
| Histología (no-ADK) | 0,66 | 0,24-1,77 | 0,41 | |||
| pT (T1-T2, T3-T4) | 0,92 | 0,21-4,28 | 0,92 | |||
| Preoperatorio EPOC* | 0,83 | 0,25-4,25 | 0,82 | |||
| Complicaciones postoperatorias (sí, no) | 0,65 | 0,24-1,74 | 0,39 | |||
| p (I-II,III-IV) | 1,7 | 0,48-6,01 | 0,40 | |||
Las técnicas broncoangioplásticas extendidas son igualmente efectivas en el tratamiento de tumores centrales y no añaden morbimortalidad a las técnicas broncoangioplásticas simples. La supervivencia observada de estas técnicas aseguran un tratamiento oncológico óptimo con ventajas sobre la extirpación masiva del parénquima pulmonar.
Sin embargo, la decisión de realizar una técnica de preservación o una neumonectomía depende de un difícil balance entre calidad de vida posterior y el riesgo de recurrencia de su enfermedad y complicaciones postoperatorias12.
Diversos estudios han comparado la calidad de vida5,19 y supervivencia7,20 de las técnicas de preservación pulmonar y neumonectomías. Parece claro, que la calidad de vida es sensiblemente mejor en pacientes sin neumonectomía5, así mismo son estos pacientes más aptos para tratamientos quimiorradioterápicos coadyuvantes con una tolerancia mayor derivada de esta mejor calidad de vida, con menores efectos secundarios e interrupciones de dicho tratamiento debido de los mismos. En cuanto a la supervivencia existen diversos estudios que consideran la capacidad de control oncológico local similar a la neumonectomía y las técnicas de preservación pulmonar, sin embargo, otros muestran una mejoría de supervivencia en pacientes sin neumonectomía7,20.
La inicial utilidad de las técnicas reconstructivas broncoarteriales se aplicó en pacientes con función respiratoria disminuida, en los que ha demostrado un efecto sobre dicha función mucho más limitada que la neumonectomía21,22, con mejoría de la capacidad respiratoria en un cierto número de pacientes por causas multifactoriales. Entre éstas se pueden destacar: la optimización del tratamiento médico para la EPOC, concomitante en gran número de pacientes23, la hiperinsuflación de el/los lóbulos preservados, la abstención del hábito tabáquico después de la intervención y el posible efecto shunt de los lóbulos extirpados, frecuentemente sin capacidad de intercambio respiratorio21. Por estas razones, y por la propia morbilidad asociada a la neumonectomía este grupo de técnicas son muy aconsejables en pacientes añosos en que la extirpación masiva de parénquima pulmonar6 acarrea un índice de complicaciones postoperatorias1,24 y una pérdida de calidad de vida más acusada25. Es en este grupo de pacientes mayores de 75 años en los cuales pueden tener mayor significación la preservación pulmonar, permitiendo ofrecer un tratamiento curativo a pacientes en los cuales, por sus enfermedades asociadas el tratamiento quimiorradioterápico puede asociar gran morbilidad o estar contraindicado. En nuestra serie, diez pacientes fueron resecados con éxito mediante LBS o LBE, sin posibilidad de realizar neumonectomía por un riesgo de mortalidad precoz inaceptable. Así mismo, 22 (39%) casos de nuestra serie fueron realizados en mayores de 70 años, con un porcentaje similar de LBE y LBS.
El índice de recurrencia de estas técnicas es similar al de las neumonectomías, siendo el principal problema las recurrencias sistémicas8,10,26,27. Similares resultados en LBS y LBE han sido publicados en series con ligeramente mayor experiencia10-12.
La estrategia de evitación de la neumonectomía, es hoy en día comúnmente aceptada incluso en pacientes con función pulmonar normal9 y en pacientes con afectación ganglionar interlobar. Sin embargo, no siempre es fácil en tumores que afectan a más de un lóbulo por infiltración local, por lo que, pequeñas variaciones de estas técnicas pueden ser útiles. Johnston et al describieron por primera vez estas técnicas con resultados interesantes28.
Okada et al describieron una serie de 15 enfermos durante 13 años, representando un 9% de todos los procedimientos broncoplásticos de su experiencia12.
La serie retrospectiva más larga publicada, mostró unos resultados de morbi-mortalidad similares a las LBS11, con una supervivencia similar comparadas con los pacientes que sufrieron una neumonectomía en el mismo período. Las complicaciones anastomóticas, no resultaron elevadas en ninguna serie publicada, como podría esperarse debido a las grandes discrepancias de calibre bronquiales o el menor tamaño de parénquima pulmonar remanente10-12.
La morbilidad es similar en ambos grupos, sin un aumento de los problemas postoperatorios por las técnicas broncoplásticas, sin embargo, las complicaciones relacionadas con estas técnicas suelen ser tan temibles como las aparecidas en la neumonectomía. Estos problemas anastomóticos no están aumentados en presencia de tratamiento de quimiorradioterapia previo, sin embargo, es en estos pacientes, en los que un especial cuidado en la realización de la anastomosis, con cobertura mediante flaps musculares o pericárdicos y el uso de antibióticos inhalados29 debe ser tenido en cuenta.
Sin embargo, la propia experiencia quirúrgica en este grupo de intervenciones, fuerza un sesgo individual: la excesiva tensión, o un remanente pulmonar muy limitado suelen conducir a la neumonectomía. Este sesgo es similar en todos los originales comparando técnicas reconstructivas pulmonares y neumonectomías, o LBS con LBE7,11,17.
Íntimamente relacionado podemos observar la relación de entre neumonectomías y lobectomías broncoangioplásticas, donde en la actualidad se han publicado una disminución dramática de las neumonectomías cuando estas técnicas de reconstrucción se han aplicado agresivamente30. Para esto, es imprescindible disminuir el porcentaje total de LBS o LBE relacionadas con el lóbulo superior derecho, con inclusión de casos en el lado izquierdo a pesar de que su realización implica reconstrucción vascular asociada en gran número de casos. Frecuentemente, con uso de materiales biológicos para la reconstrucción de arteria pulmonar este índice se incrementa con facilidad31. En pacientes con extensa afectación vascular, arterial o venosa, puede considerarse la resección oncológica del tumor en cirugía de banco, seguida del reimplante del lóbulo remanente con reconstrucción bronquial, arterial y venosa. El autotransplante, por lo tanto, se ha comunicado anecdóticamente, sin embargo podría ser una opción quirúrgica para evitar la neumonectomía32.
En definitiva, el uso de técnicas de preservación pulmonar ofrece un conjunto de ventajas con poca menor morbilidad asociada en manos expertas. La consideración de candidatos para estas técnicas debería ser tenida en cuenta, por múltiples razones: mayor tolerancia a los tratamientos multimodales complementarios, posibilidad de recuperar quirúrgicamente a pacientes que dudosamente podrían ser tratados con neumonectomía previa, menor pérdida de capacidad respiratoria21, mejor calidad de vida a largo plazo5 y no menos importante, menor incidencia de complicaciones propias de la neumonectomía como fístula bronquiales o SDRA.
En opinión de los autores, siempre que sea posible, sobre todo en pacientes añosos o con tratamiento neoadyuvante es mejor cualquier técnica broncoplástica que una neumonectomía. Las técnicas broncoplásticas extendidas son seguras, técnicamente más demandantes y necesitan una observación postoperatoria muy cuidadosa, sin embargo plantean inmediatamente y a largo plazo unas ventajas innegables y de gran importancia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.