La hemoptisis masiva es una urgencia médica que implica múltiples retos diagnósticos y terapéuticos. A diferencia de las hemorragias de otros orígenes, una pequeña cantidad de sangre puede rápidamente ocluir la vía aérea ocasionando hipoxemia grave. El manejo inicial debe estabilizar al paciente asegurando la vía aérea y aislando el foco de sangrado para buscar posteriormente el mejor tratamiento etiológico (diferentes técnicas broncoscópicas, embolización…)1. No obstante, se presenta un caso infrecuente y extremo de un paciente con cardiopatía avanzada e hipertensión pulmonar en el que la hipoxemia condujo a un rápido colapso circulatorio y respiratorio que desaconsejaron seguir los protocolos y procedimientos utilizados habitualmente dado el riesgo inminente de parada cardiaca.
Se trata de un varón de 62 años diagnosticado de miocardiopatía hipertrófica e intervenido 5 años antes de miectomía, plastia mitral y prótesis mecánica aórtica. Ingresó en nuestro centro por edema agudo de pulmón, comprobándose prótesis normofuncionante, FEVI del 52%, hipertensión pulmonar y llenado restrictivo. Presentó evolución hacia shock cardiogénico requiriendo intubación orotraqueal, balón de contrapulsación intraaórtico (BCIAo), noradrenalina 0,5μg/kg/min y dobutamina 8μg/kg/min. En las siguientes horas mostró una evolución favorable y se pudo retirar el BCIAo y los fármacos vasoactivos.
Sin embargo, el curso posterior vino marcado por empeoramiento respiratorio con opacidades alveolares en base pulmonar derecha, fiebre y elevación de reactantes de fase aguda pese a la tendencia favorable hemodinámica, ecocardiográfica y de niveles de NtproBNP. Aún sin contar con aislamientos microbiológicos, estos datos, junto con la mejoría bajo antibioterapia empírica de amplio espectro, fundamentaron la sospecha de neumonía asociada a ventilación mecánica en lóbulo inferior derecho. Posteriormente, con el cuadro infeccioso en resolución, el séptimo día de ingreso presentó un cuadro de desaturación brusca hasta el 85% pese a aumentar la FiO2 al 100%. Se auscultaron roncus diseminados con marcada hipoventilación del hemitórax derecho y se aspiraron coágulos de sangre por el tubo orotraqueal. La radiografía de tórax portátil urgente mostró atelectasia del lóbulo inferior derecho con opacidades alveolares del resto del parénquima de forma bilateral. Presentó hipoxemia rápidamente progresiva en los siguientes minutos (PaO2 mínima de 32mmHg) que no remontó mediante ventilación con ambú en decúbito lateral derecho, junto con hipotensión e hiperlactacidemia (lactato 5,1mmol/l) refractarias a la administración de expansores de volumen y vasopresores a dosis crecientes. Dado el riesgo vital inmediato se decidió no realizar una fibrobroncoscopia y desestimar la opción de una intubación orotraqueal selectiva. Por tanto, se priorizó la estabilización respiratoria y circulatoria, mediante canulación ecoguiada, a pie de cama y sin heparina sódica, de ECMO-venovenosa en escasos minutos, colocando cánula aferente 23F a través de vena femoral derecha y cánula eferente 17F vía yugular derecha. Así, existía la posibilidad de añadir posteriormente una cánula arterial para soporte hemodinámico en forma de ECMO-venoarterial si hubiera sido necesario. Tras el implante se normalizó la oxigenación de manera inmediata, con mejoría paulatina de la hemodinámica. Esto permitió, entonces, realizar fibrobroncoscopia diagnóstica que evidenció la presencia sangre fresca en el árbol bronquial izquierdo, con mucosa hiperémica, pero sin lesión subyacente tras su aspiración, y de un molde de material trombótico en el árbol pulmonar derecho siendo imposible su extracción completa. La figura 1 muestra la radiografía de tórax tras el implante en la que se comprueba una adecuada distancia entre las cánulas para evitar fenómenos de recirculación, la desaparición de condensaciones del hemitórax izquierdo con la persistencia de atelectasia pulmonar derecha donde se observa la presencia de un coágulo en la luz bronquial hasta escasos centímetros de la carina.
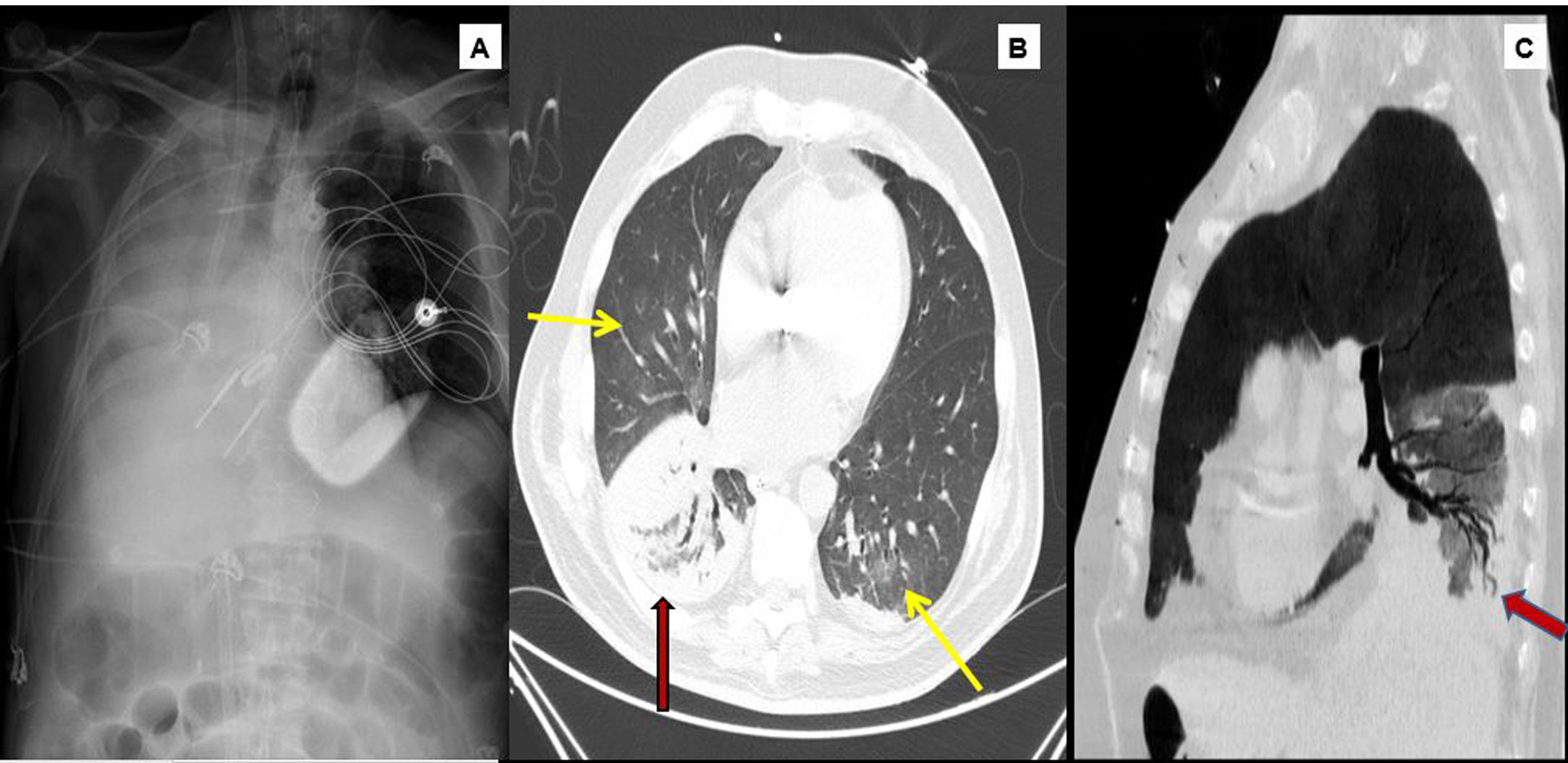
1A) Radiografía de tórax. Atelectasia subtotal del pulmón derecho, cánula de eyección de ECMO en yugular derecha y cánula de succión en vena cava inferior.
Tomografía computarizada con contraste (fase arterial, ventana de pulmón). 1B) Se observan focos de infiltrado en vidrio deslustrado (flechas amarillas) pulmonares bilaterales de predominio central. Consolidación en lóbulo inferior derecho (flecha roja). 1C) Se demuestra la permeabilidad del árbol bronquial en el seno del foco consolidativo.
Se mantuvo soporte con ECMO con flujo de 4l/min y FiO2 para PaO2>60mmHg, bajo ventilación protectora, sin anticoagulación y broncoscopias diarias hasta conseguir extraer el material trombótico en su totalidad. Tras 4 días en ECMO se consiguió reexpansión del pulmón derecho sin nuevos sangrados bronquiales. A continuación, se procedió a prueba de desconexión de ECMO-venovenosa y posterior decanulación. Tras ello se realizó estudio con una tomografía computarizada con contraste en fases arterial y venosa que detectó una imagen de condensación basal derecha sin objetivarse puntos sangrantes en la circulación bronquial, fístulas, cavitaciones u otras lesiones (fig. 2). Se atribuyó finalmente la hemoptisis a sangrado en relación con neumonía en presencia de hipertensión pulmonar y anticoagulación. En las siguientes semanas evolucionó de forma paulatina recibiendo alta el día 69 de ingreso.
En la actualidad se reconocen cada vez más indicaciones de la ECMO. Este tratamiento permite el soporte cardiorrespiratorio en situaciones de gravedad con lo que la causa puede ser buscada y tratada posteriormente. La indicación principal de ECMO-venovenosa es el distrés respiratorio. No obstante, también puede ser de gran impacto en otros escenarios como el estatus asmático, la obstrucción de vía aérea o la hemorragia pulmonar masiva2,3. El rescate con ECMO-venovenosa se menciona de forma tangencial en las revisiones recientes de hemoptisis masiva1. Sin embargo, la ECMO es una herramienta que permite estabilizar la situación previamente a la secuencia habitual de pruebas y terapias. Otros centros han publicado resultados exitosos en contextos similares4–6. La mayor serie es la de Kim et al.7 con 15 implantes de ECMO por obstrucción de vía aérea, 5 de ellos por hemoptisis masiva de diferentes orígenes.
Este caso ilustra además el balance entre riesgo hemorrágico y trombótico, ya que en presencia de hemoptisis con riesgo vital se manejó durante 4 días sin anticoagulación bajo soporte con ECMO-venovenosa a flujos mayores de 4l/min, vigilando estrechamente el funcionamiento de la prótesis. El soporte con ECMO venovenosa sin anticoagulación puede aumentar la incidencia de fenómenos trombóticos, principalmente trombosis venosa profunda, tromboembolismo pulmonar y trombosis de la membrana de oxigenación, aunque esto parece contrarrestarse con el uso de flujos elevados, con los que se reduce el estasis sanguíneo8. Por ello, el soporte con ECMO-venovenosa sin anticoagulación parece cada vez más seguro en pacientes seleccionados9. Esta estrategia ha sido ya descrita en pacientes con traumatismos o sangrado activo, e incluso se ha utilizado en pacientes sin especial riesgo hemorrágico tanto con ECMO-venovenosa9 como bajo ECMO-venoarterial10.
FinanciaciónNo se ha recibido financiación para la realización de este manuscrito.