Conocer la calidad del diagnóstico de enfermedad pulmonar obstructiva crónica (EPOC) en pacientes hospitalizados.
Material y métodosAuditoría multicéntrica transversal de revisión retrospectiva de historias clínicas en pacientes a los que se dio de alta con diagnóstico de EPOC. Se consideró diagnóstico correcto (DxC) de EPOC en los casos donde pudo documentarse la combinación de obstrucción bronquial volumen espiratorio forzado en el primer segundo/capacidad vital forzada (FEV1/FVC<70%) y tabaquismo (>10paquetes/año). En el resto de los casos se consideró diagnóstico deficiente (DxD). Se exigió un DxC en al menos el 60% de los pacientes para considerar una calidad asistencial diagnóstica aceptable. Se registraron los datos demográficos, el tabaquismo, la espirometría, el especialista que daba el alta (neumólogos [N], especialistas en Medicina Interna [EM] y especialistas quirúrgicos [EQ]) y el nivel asistencial (hospitales de baja complejidad [H1], hospitales de intermedia complejidad [H2] y hospitales de alta complejidad [H3]).
ResultadosSe analizaron 840 casos (718hombres y 122 mujeres), edad media (desviación estándar) de 73 (10), procedentes de 10 hospitales (3 H1, 4 H2 y 3 H3). Se obtuvo un DxD en 597 pacientes (71,1%), motivado bien por falta de criterio espirométrico (538 [64%]) o tabáquico (319 [38%]) (p<0,001). Sólo 2 de los 10 hospitales cumplían el criterio de calidad asistencial diagnóstica aceptable. Se observaron diferencias significativas (p<0,0001) al comparar DxC y DxD por nivel asistencial (DxC: el 56,2% en H1, el 29,9% en H2 y el 20,9% en H3) y por especialista (DxC: el 47,6% por N, el 24,6% por EQ y el 17,4% por EM). Un análisis multivariado relacionó DxC con sexo masculino, H1 e informes neumológicos.
Conclusiones1) La calidad asistencial para el diagnóstico de EPOC en hospitales es deficiente y 2) la falta de espirometría es la causa más frecuente de DxD.
To examine the quality of COPD diagnosis in hospitalised patients.
Material and methodsRetrospective multicentre cross-sectional audit review of the clinical histories of patients discharged with a diagnosis of COPD. The diagnosis of COPD was considered correct (DxC) in cases where the combination of a bronchial obstruction (FEV1/FVC<70%) and smoking (>10packets/year) could be documented. In the rest of the cases the diagnosis was considered deficient (DxD). A DxC in at least 60% of patients was required to be considered an acceptable quality health care diagnosis. Demographic data such as, smoking, spirometry, the specialist who discharged the patient (P: Pneumologist; MS: Medical Specialty; CS: Surgical Specialty), and health care level (hospital complexity; low (H1), intermediate (H2) and high (H3)).
ResultsA total of 840 cases were analysed (718 males, 122 females); mean age (SD) 73 (10), from 10 hospitals (3 H1, 4 H2, 3 H3). A DxD was obtained in 597 (71.1%), due to either lack of spirometry (538, 64%) or smoking criteria (319, 38%), (P<0.001). Only two of the ten hospitals complied with the criteria of an acceptable quality health care diagnosis. Significant differences (P<0.0001) were seen on comparing DxC and DxD by health care level (DxC: 56.2% in H1, 29.9% in H2, 20.9% in H3), and by specialist (DxC: 47.6% en P, 24.6% in SP, 17.4% in MS). A multivariate analysis associated DxC with the male sex, H1 and pneumology reports.
Conclusions1. The quality health care for the diagnosis of COPD is deficient. 2. The lack of spirometry is the most common cause of DxD.
Recientes estudios1,2 han puesto de manifiesto que existe un impacto creciente de las enfermedades respiratorias en la salud de la población y, en concreto, se ha resaltado que la morbimortalidad por enfermedad pulmonar obstructiva crónica (EPOC) sigue mostrando un incremento progresivo que refuerza la predicción de que esta enfermedad constituirá en el 2020 la tercera causa de muerte en el mundo3,4. Los estudios de que disponemos en España muestran igualmente tanto una elevada prevalencia de la enfermedad como una importante carga económica y social5,6. Por esto, desde diversas sociedades científicas se ha impulsado el desarrollo de normativas de consenso y guías de práctica clínica con el objetivo de unificar criterios, sintetizar el mayor grado de evidencia disponible y elaborar recomendaciones explícitas para intentar conseguir una práctica clínica de calidad7–11. En concreto, en lo que al diagnóstico de la EPOC se refiere, estas guías y recomendaciones ponen especial énfasis en la importancia del papel del tabaquismo y la espirometría para su diagnóstico y, de hecho, una reciente publicación sobre los estándares de calidad asistencial en la EPOC12 fija en estas 2 variables el indicador clave para el correcto diagnóstico de la enfermedad. Sin embargo, diversos estudios sobre la realidad de la atención sanitaria de pacientes con EPOC muestran que tanto en nuestro país como en otros países desarrollados hay grandes variaciones entre los propios profesionales de la salud en el tratamiento de esta enfermedad13–16, y particularmente resaltan que el número de espirometrías que se realizan para su correcto diagnóstico y seguimiento es aún muy bajo17–19, lo que se acompaña de un elevado porcentaje de pacientes etiquetados erróneamente de EPOC o con un diagnóstico incierto20,21.
Este estudio pretende conocer en qué medida en el entorno hospitalario y en la práctica clínica habitual el diagnóstico de la EPOC se realiza con un criterio de calidad aceptable, y se apoya en la constatación de una espirometría y un hábito tabáquico acordes con este diagnóstico. Asimismo, nos proponemos evaluar las posibles diferencias en el manejo diagnóstico de estos pacientes en función del nivel asistencial y el tipo de especialidad que realiza el diagnóstico en el momento del alta hospitalaria.
Material y métodoSe planificó la realización de una auditoría para revisar el modo en que se establece el diagnóstico de EPOC en el ámbito hospitalario. Para ello se diseñó un estudio multicéntrico y transversal, y se revisó de forma retrospectiva la historia clínica completa, en formato clásico, en papel, de todos los pacientes dados de alta de forma consecutiva en 10 hospitales de la red pública asistencial de la Comunidad de Valencia y en los que figurase el diagnóstico de EPOC en la epicrisis, como diagnóstico principal o como diagnóstico secundario. Se eligieron 2 meses del período invernal (noviembre y diciembre) dado el elevado volumen de ingresos y altas hospitalarias de pacientes con este diagnóstico durante ese período. Se excluyeron los reingresos y aquellos casos donde constase el diagnóstico de EPOC como probable. Todos los hospitales disponían de los recursos analíticos, radiológicos y espirométricos necesarios para el correcto diagnóstico y el tratamiento de pacientes con EPOC.
Se consideró diagnóstico correcto (DxC) de EPOC cuando tras revisar de forma exhaustiva todo el historial médico del paciente, tanto en el ámbito hospitalario como en el ámbito de consultas externas, se pudo constatar en algún momento de su historia clínica un consumo de tabaco superior a los 10paquetes/año y la presencia de al menos una espirometría previa que mostrase una obstrucción bronquial (volumen espiratorio forzado en el primer segundo/capacidad vital forzada [FEV1/FVC]<0,7 prebroncodilatación o posbroncodilatación). En el caso de que faltara alguna de estas premisas, se consideró diagnóstico deficiente (DxD) de EPOC.
De acuerdo con las recientes recomendaciones publicadas en relación con los estándares de calidad asistencial en la EPOC12, se aceptó como criterio de calidad aceptable para el diagnóstico la obtención de un DxC en al menos el 60% de los pacientes, y se consideró en caso contrario un nivel de calidad asistencial deficiente, tanto para cada centro como para la muestra global.
En todos los casos se recogieron las siguientes variables: edad, sexo, historia tabáquica, parámetros espirométricos, especialista que emitía el diagnóstico de EPOC en el momento del alta hospitalaria, que se diferenciaba entre neumólogos (N), otros especialistas en Medicina Interna o especialistas quirúrgicos. Finalmente, se registró el nivel asistencial. A este respecto, se consideraron 3 grupos que se clasificaron de acuerdo con una modificación de la propuesta realizada por el Sistema Nacional de Salud22, que agrupa a los hospitales en 5 grupos, según diferentes variables de dotación, oferta de servicios, actividad, complejidad e intensidad docente. En concreto, esta entidad incluye en el grupo 1 a los hospitales comarcales pequeños con un número de camas comprendido entre 87 (percentil [P] 25) y 214 (P75); en el grupo 2 a los hospitales generales básicos con un número de camas comprendido entre 111 (P25) y 231 (P75); en el grupo 3 se situaron los hospitales de área con un número de camas comprendido entre 365 (P25) y 570 (P75); en el grupo 4 a los grandes hospitales con un número de camas comprendido entre 625 (P25) y 834 (P75) y, finalmente, al grupo 5 correspondieron aquellos grandes hospitales con un número aún superior de camas, complejos hospitalarios y hospitales de referencia. En nuestro estudio, los hospitales de baja complejidad correspondieron al grupo 1 de esta clasificación, y se unificaron los grupos 2 y 3 como hospitales de intermedia complejidad y los grupos 4 y 5 como hospitales de alta complejidad.
Análisis estadísticoTras un estudio descriptivo inicial, se compararon las distintas variables evaluadas en función de la presencia o la ausencia de DxC, y se aplicó para ello la prueba del chi-cuadrado para datos cualitativos o el test t de Student para datos cuantitativos, y se expresaron estos últimos en valores medios y la desviación estándar entre paréntesis. Se estableció como nivel de significación estadística un valor de p≤0,05. Para comparar proporciones en función de los 3 niveles asistenciales, se aplicó la prueba del chi-cuadrado con ajuste de Bonferroni y se realizó un análisis de la variancia de un factor para comparar las medias entre los distintos grupos. Las variables que demostraron diferencias estadísticamente significativas en el análisis univariado previo se incluyeron en un modelo de regresión logística binaria multivariante, donde la variable dependiente fue la presencia o la ausencia de DxC. Las variables con varias categorías se transformaron en variables dummy. La regresión logística se realizó mediante un proceso de selección de variables paso a paso hacia delante. Para el análisis estadístico de los datos se utilizó el programa SPSS para Windows, versión 10 (SPSS Inc; Chicago, IL).
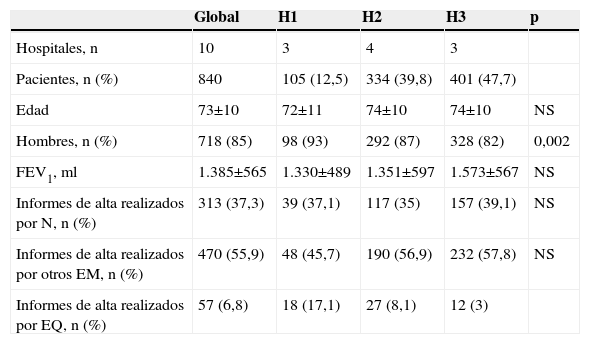
ResultadosSe incluyó a 846 pacientes y se excluyó a 6 de ellos (0,7%). Tres casos por no disponer de historia clínica o estar ésta incompleta y en los otros 3 casos por errores de inclusión. El grupo de 840 casos estudiados estaba formado por 718 hombres (85%) y 122 mujeres (15%) con edad media de 73 años (10) (rango: 29–99). La tabla 1 muestra las características basales de estos pacientes y su procedencia.
Características basales de los pacientes
| Global | H1 | H2 | H3 | p | |
| Hospitales, n | 10 | 3 | 4 | 3 | |
| Pacientes, n (%) | 840 | 105 (12,5) | 334 (39,8) | 401 (47,7) | |
| Edad | 73±10 | 72±11 | 74±10 | 74±10 | NS |
| Hombres, n (%) | 718 (85) | 98 (93) | 292 (87) | 328 (82) | 0,002 |
| FEV1, ml | 1.385±565 | 1.330±489 | 1.351±597 | 1.573±567 | NS |
| Informes de alta realizados por N, n (%) | 313 (37,3) | 39 (37,1) | 117 (35) | 157 (39,1) | NS |
| Informes de alta realizados por otros EM, n (%) | 470 (55,9) | 48 (45,7) | 190 (56,9) | 232 (57,8) | NS |
| Informes de alta realizados por EQ, n (%) | 57 (6,8) | 18 (17,1) | 27 (8,1) | 12 (3) |
EM: especialistas en Medicina Interna; EQ: especialistas quirúrgicos; FEV1: volumen espiratorio forzado en el primer segundo; H1: hospitales de baja complejidad; H2: hospitales de intermedia complejidad; H3: hospitales de alta complejidad; N: neumólogos; NS: sin significación estadística.
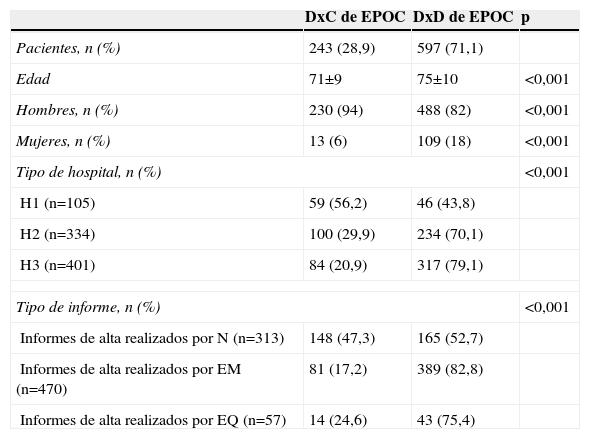
En 383 pacientes se disponía de espirometría basal, mientras que sólo en 235 pacientes se contaba también con una espirometría posbroncodilatación. Se obtuvo un DxC en 243 casos (28,9%) y un DxD en 597 casos (71,1%). Este último se motivó debido a no tener espirometría en 457 pacientes (54,4%) o bien no ser ésta obstructiva en 81 pacientes (9,6%), no constatarse anamnesis tabáquica en 278 pacientes (33,1%) o bien no cumplir el criterio de tabaquismo exigido para el diagnóstico de EPOC en 41 pacientes (4,9%). En 260 pacientes (31%) no se cumplían ni el criterio espirométrico ni el de haber constatado tabaquismo. Los pacientes con DxD mostraban una edad más avanzada (75 años [10] versus 71 años [9] ; p<0,001) y en ellos predominaba el sexo femenino (el 89 frente al 68%; p<0,001) (tabla 2).
Análisis bivariante. Influencia de diversas variables en la calidad del diagnóstico
| DxC de EPOC | DxD de EPOC | p | |
| Pacientes, n (%) | 243 (28,9) | 597 (71,1) | |
| Edad | 71±9 | 75±10 | <0,001 |
| Hombres, n (%) | 230 (94) | 488 (82) | <0,001 |
| Mujeres, n (%) | 13 (6) | 109 (18) | <0,001 |
| Tipo de hospital, n (%) | <0,001 | ||
| H1 (n=105) | 59 (56,2) | 46 (43,8) | |
| H2 (n=334) | 100 (29,9) | 234 (70,1) | |
| H3 (n=401) | 84 (20,9) | 317 (79,1) | |
| Tipo de informe, n (%) | <0,001 | ||
| Informes de alta realizados por N (n=313) | 148 (47,3) | 165 (52,7) | |
| Informes de alta realizados por EM (n=470) | 81 (17,2) | 389 (82,8) | |
| Informes de alta realizados por EQ (n=57) | 14 (24,6) | 43 (75,4) | |
DxC: diagnóstico correcto; DxD: diagnóstico deficiente; EM: especialistas en Medicina Interna; EPOC: enfermedad pulmonar obstructiva crónica; EQ: especialistas quirúrgicos; H1: hospitales de baja complejidad; H2: hospitales de intermedia complejidad; H3: hospitales de alta complejidad; N: neumólogos.
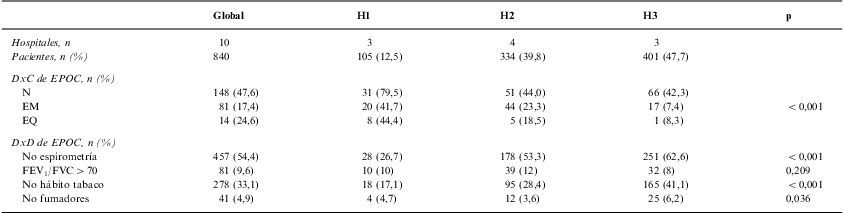
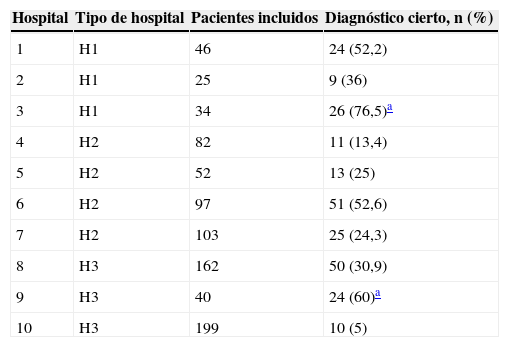
Al comparar la calidad del diagnóstico por nivel asistencial se detectó, como puede verse en la tabla 3, una relación inversa de ésta con el grado de certeza diagnóstica, y se observó, además, que sólo en 2 (20%) de los 10 centros hospitalarios participantes en el estudio se alcanzó el umbral mínimo (60%) de cumplimentación para que el indicador de calidad asistencial referente al diagnóstico se considerase aceptable, según establecen los estándares de calidad asistencial de la EPOC12 (tabla 4).
Diagnóstico correcto y deficiente de enfermedad pulmonar obstructiva crónica en función del nivel asistencial
| Global | H1 | H2 | H3 | p | |
| Hospitales, n | 10 | 3 | 4 | 3 | |
| Pacientes, n (%) | 840 | 105 (12,5) | 334 (39,8) | 401 (47,7) | |
| DxC de EPOC, n (%) | |||||
| N | 148 (47,6) | 31 (79,5) | 51 (44,0) | 66 (42,3) | |
| EM | 81 (17,4) | 20 (41,7) | 44 (23,3) | 17 (7,4) | <0,001 |
| EQ | 14 (24,6) | 8 (44,4) | 5 (18,5) | 1 (8,3) | |
| DxD de EPOC, n (%) | |||||
| No espirometría | 457 (54,4) | 28 (26,7) | 178 (53,3) | 251 (62,6) | <0,001 |
| FEV1/FVC>70 | 81 (9,6) | 10 (10) | 39 (12) | 32 (8) | 0,209 |
| No hábito tabaco | 278 (33,1) | 18 (17,1) | 95 (28,4) | 165 (41,1) | <0,001 |
| No fumadores | 41 (4,9) | 4 (4,7) | 12 (3,6) | 25 (6,2) | 0,036 |
DxC: diagnóstico correcto; DxD: diagnóstico deficiente; EM: especialistas en Medicina Interna; EPOC: enfermedad pulmonar obstructiva crónica; EQ: especialistas quirúrgicos; FEV1/FVC: volumen espiratorio forzado en el primer segundo/capacidad vital forzada; H1: hospitales de baja complejidad; H2: hospitales de intermedia complejidad; H3: hospitales de alta complejidad; N: neumólogos.
Calidad asistencial en el diagnóstico de enfermedad pulmonar obstructiva crónica
| Hospital | Tipo de hospital | Pacientes incluidos | Diagnóstico cierto, n (%) |
| 1 | H1 | 46 | 24 (52,2) |
| 2 | H1 | 25 | 9 (36) |
| 3 | H1 | 34 | 26 (76,5)a |
| 4 | H2 | 82 | 11 (13,4) |
| 5 | H2 | 52 | 13 (25) |
| 6 | H2 | 97 | 51 (52,6) |
| 7 | H2 | 103 | 25 (24,3) |
| 8 | H3 | 162 | 50 (30,9) |
| 9 | H3 | 40 | 24 (60)a |
| 10 | H3 | 199 | 10 (5) |
EPOC: enfermedad pulmonar obstructiva crónica; H1: hospitales de baja complejidad; H2: hospitales de intermedia complejidad; H3: hospitales de alta complejidad.
Se detectaron también diferencias significativas en relación con el médico que daba el alta, y el mayor porcentaje de DxC fue para los N (47,3%), seguido de los especialistas quirúrgicos (24,6%) y los especialistas en Medicina Interna (17,2%) (p<0,001). De nuevo, la falta de criterio espirométrico era más frecuente que la de tabaquismo como causa de DxD, pero para ambos criterios se observaban diferencias significativas (p<0,001) entre los diversos especialistas. Al analizar estos datos en función del nivel asistencial, comprobamos que continuaba siendo el grupo de N el que ofrecía mejores resultados en todos los niveles hospitalarios y que también eran los hospitales de baja complejidad los que conseguían el mayor porcentaje de diagnóstico aceptable en todos los grupos de especialistas estudiados (p<0,001 [tabla 3]).
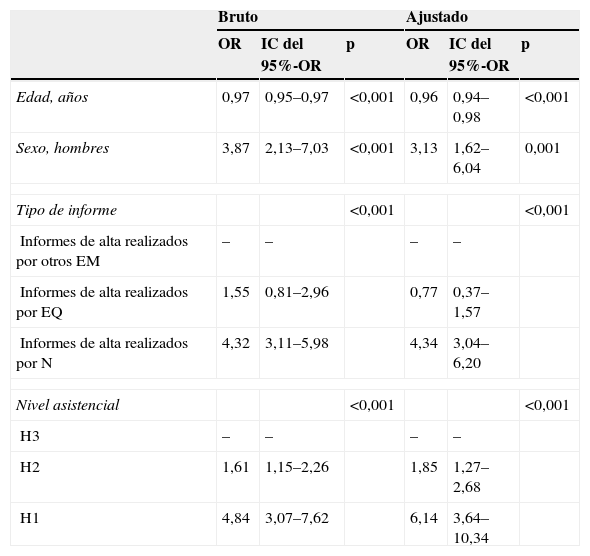
La tabla 5 recoge los resultados del análisis multivariado y muestra que la probabilidad de tener un DxC se triplica en el caso de ser el paciente con EPOC un hombre, se cuadriplica si el informe lo realiza un N y se incrementa 6 veces si procede de un hospital pequeño.
Influencia de diversas variables en la calidad del diagnóstico
| Bruto | Ajustado | |||||
| OR | IC del 95%-OR | p | OR | IC del 95%-OR | p | |
| Edad, años | 0,97 | 0,95–0,97 | <0,001 | 0,96 | 0,94–0,98 | <0,001 |
| Sexo, hombres | 3,87 | 2,13–7,03 | <0,001 | 3,13 | 1,62–6,04 | 0,001 |
| Tipo de informe | <0,001 | <0,001 | ||||
| Informes de alta realizados por otros EM | – | – | – | – | ||
| Informes de alta realizados por EQ | 1,55 | 0,81–2,96 | 0,77 | 0,37–1,57 | ||
| Informes de alta realizados por N | 4,32 | 3,11–5,98 | 4,34 | 3,04–6,20 | ||
| Nivel asistencial | <0,001 | <0,001 | ||||
| H3 | – | – | – | – | ||
| H2 | 1,61 | 1,15–2,26 | 1,85 | 1,27–2,68 | ||
| H1 | 4,84 | 3,07–7,62 | 6,14 | 3,64–10,34 | ||
Análisis bruto y ajustado.
EM: especialistas en Medicina Interna; EQ: especialistas quirúrgicos; H1: hospitales de baja complejidad; H2: hospitales de intermedia complejidad; H3: hospitales de alta complejidad; IC: intervalo de confianza; N: neumólogos; OR: odds ratio.
Este estudio pone de manifiesto que el diagnóstico de EPOC en el entorno hospitalario no cumple el estándar mínimo de calidad asistencial aceptable. Sólo en 2 hospitales se alcanzó un nivel de cumplimiento superior al 60%, que permitía considerar un grado de calidad aceptable para el diagnóstico de la EPOC. En el resto, la calidad del diagnóstico de la EPOC es deficiente, y la falta de criterio espirométrico con mayor frecuencia que la de tabaquismo es el motivo de esta deficiencia diagnóstica. Estos hallazgos son más llamativos para las mujeres, que sólo presentan un DxC en el 11% de los casos. Asimismo, se constata que existen amplias diferencias en el manejo diagnóstico de esta enfermedad entre los diversos especialistas y los niveles asistenciales. Los N y los hospitales pequeños diagnostican la EPOC con mayor certeza que el resto de especialistas u hospitales, pero aun así el porcentaje de DxC de EPOC se sitúa sólo en torno al 50%. El umbral de aceptabilidad del estándar de calidad asistencial relativo al diagnóstico sólo se alcanza en hospitales pequeños y en informes emitidos por N.
Ciertamente, nuestros datos muestran una cifra menor de DxC de EPOC que la comunicada por otros autores, que presentan cifras de fiabilidad diagnóstica del 63 (13), el 36 (20) o el 50% (21), por ejemplo. Sin embargo, cabe resaltar que en nuestro caso, se exigía como criterio de certeza diagnóstica la concurrencia de ambas variables (tabaquismo y obstrucción bronquial), mientras que en otros estudios sólo se tenía en consideración la concordancia del diagnóstico de EPOC con la detección de obstrucción bronquial, lo que podría explicar, en parte, la discrepancia observada con nuestros datos. Otro aspecto por tener en cuenta son las diferencias propias en los diseños de los estudios. En nuestro caso, se realizó un estudio retrospectivo, dado que se trataba de auditar sobre una muestra de pacientes dados de alta hospitalaria, desde cualquier especialidad, en qué medida el diagnóstico de EPOC especificado en el informe de alta se correspondía con la observación en la historia clínica de un DxC de la enfermedad. Por el contrario, los estudios previamente mencionados tenían un desarrollo prospectivo y, en ellos, se trataba de confirmar la validez del diagnóstico clínico de EPOC mediante la realización de una espirometría. Asimismo, también hay que mencionar la variabilidad en el criterio espirométrico elegido para confirmar la obstrucción bronquial. Mientras que en los estudios más recientes se utilizó la relación FEV1/FVC posbroncodilatación inferior al 70%20,21, en el estudio de De Miguel et al13, previo a la publicación de la normativa Global Initiative for Chronic Obstructive Lung Disease (GOLD)8, se utilizó la relación FEV1/FVC basal. En nuestro caso, dado que se trataba de un estudio retrospectivo de revisión de historias clínicas, en las que se podían encontrar espirometrías antiguas y, por tanto, previas a las recientes recomendaciones de considerar la obstrucción bronquial tras la prueba broncodilatadora como criterio espirométrico para el diagnóstico de EPOC6–11, se optó por aceptar como válida la obstrucción bronquial diagnosticada tanto por espirometría basal como por posbroncodilatación. Se trataba, en nuestra opinión, de no invalidar un correcto diagnóstico de EPOC realizado en un momento de la historia del paciente, previo a las recomendaciones actuales. Pero, pese a esta posición favorable que podía sobrestimar el grado de certeza del diagnóstico de la EPOC, los contundentes resultados obtenidos de nuestro trabajo no invalidan la decepcionante conclusión respecto a la deficiente calidad asistencial hospitalaria para establecer el diagnóstico de EPOC. No obstante, esperamos con interés los resultados de un amplio y ambicioso estudio que se está desarrollando en la actualidad: el estudio AUDIPOC, cuyo objetivo es auditar el manejo hospitalario de la exacerbación de la EPOC en todo el territorio español, y que seguramente ampliará y aclarará algunos de los aspectos aquí comentados.
Un sesgo potencial de nuestro estudio cabría atribuirlo a la posibilidad de que en algunos pacientes se hubiera establecido un DxC de EPOC en atención primaria. Sin embargo, los datos de la literatura médica son contundentes en constatar la escasa e inadecuada utilización de los espirómetros en atención primaria13–15,17,21, y nuestro país no difiere de esta valoración negativa13,17,23. Así, en un reciente trabajo realizado en Navarra23, se concluyó que pese a disponer de espirómetros, éstos estaban infrautilizados, no se seguían las recomendaciones para su adecuada utilización, los profesionales que realizaban la espirometría no habían recibido formación al respecto y en el 40% de los casos los diagnósticos funcionales realizados eran erróneos. No se ha publicado ningún estudio similar de la Comunidad de Valencia, pero ésta es también la tónica en las áreas sanitarias que corresponden a los hospitales que participaron en este estudio; de modo que este aspecto difícilmente puede haber sesgado nuestros resultados.
Uno de los hallazgos ciertamente sorprendente de nuestro trabajo es que se constata claramente una mayor proporción de DxC en los hospitales pequeños, y llama la atención el hecho de que exista una relación inversa entre el grado de certeza diagnóstica y el nivel asistencial. Sin embargo, cuando se analiza la calidad de los cuidados administrados al paciente con EPOC en relación con el tipo de hospital y la disponibilidad de recursos, a diferencia de los datos de nuestro estudio, los hospitales más pequeños tienen los peores indicadores de calidad asistencial e incluso de mortalidad, y ello, según los autores24–26, se relaciona con un menor número de médicos (OR: 1,5), un menor número de pacientes atendidos por N (OR: 1,8) y otros aspectos organizativos del centro y de disponibilidad de recursos. En nuestro estudio, aun en los hospitales más pequeños, se disponía de N, pero desafortunadamente no se recogieron otras variables de gestión o calidad asistencial que nos hubieran permitido profundizar en el análisis de este paradójico hallazgo que, sin duda, debería estimular la realización de otros estudios con un diseño enfocado a esclarecer estos aspectos.
Nuestro trabajo pone también de manifiesto la existencia de diferencias en la calidad del diagnóstico de la EPOC en función del sexo, con una mayor tendencia al DxD en las mujeres. Pese a la limitación que supone el tamaño relativamente pequeño de mujeres en nuestra muestra, este mayor incumplimiento de los estándares de calidad asistencial en este grupo contribuye a reforzar el hecho ya constatado en la literatura médica de que existen sesgos y diferencias importantes en el manejo de la EPOC en función del sexo, tanto en lo que concierne a la vertiente diagnóstica27,28 como al tratamiento y el pronóstico29,30.
En resumen, nuestro estudio contribuye a poner de manifiesto que, incluso en el entorno hospitalario, el diagnóstico de la EPOC no se realiza con criterios de calidad aceptable. Sólo en un tercio de los pacientes se emite un diagnóstico de certeza, que en tal caso se asocia de forma significativa e independiente con el proceder de un hospital pequeño (7 veces), con la realización por parte de un N (2,7 veces) así como con la menor edad del paciente y el sexo masculino (doble probabilidad de certeza). Estos datos resultan aún más alarmantes si se tiene en consideración que la anamnesis tabáquica debería realizarse en cualquier historia clínica y que la espirometría es una técnica accesible, barata, sencilla de realizar, no iatrogénica y con perspectivas actuales de poderse realizar con criterios de calidad, incluso desde la propia cabecera del paciente, gracias a las amplias posibilidades electrónicas e informáticas de la tecnología actual31,32. Resulta, pues, descorazonador constatar que en dos tercios de los pacientes con EPOC dados de alta por diversos especialistas, o incluso en el 47% de los pacientes dados de alta por N, no sea posible sustentar este diagnóstico en una adecuada anamnesis tabáquica y un sencillo trazado espirométrico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Anexo. Grupo EPOC de la Sociedad Valenciana de Neumología (por orden de aportación)Concha Pellicer Císcar, Hospital Francesc de Borja, Gandía. Juan José Soler Cataluña, Hospital de Requena, Valencia. Ada Luz Andreu Rodríguez, Hospital San Juan, Alicante. Josefa Bueso Fabra, Hospital General, Castellón. Alberto Herrejón Silvestre, Hospital Dr. Peset, Valencia. Eva Martínez Moragón, Hospital de Sagunto. Margarita Marín Royo, Hospital General, Castellón. José Antonio Pérez Fernández, Hospital Arnau de Villanova, Valencia. Cruz González Villaescusa, Hospital Clínico, Valencia. Khaled Bdeir Egnayem, Hospital de la Magdalena, Castellón. Esther Pastor Esplá y Eusebi Chiner Vives, Hospital de San Juan, Alicante. José Pascual Cortés y Patricia García Sidro, Hospital de la Plana, Castellón. Carmen Aguar Benito, Hospital General, Castellón. Estrella Fernández Fabrellas, Hospital de Sagunto.