EPOCONSUL es la primera auditoría nacional que analiza la atención sanitaria de la EPOC en consultas de neumología en España. El objetivo principal fue determinar, en un análisis retrospectivo, la distribución de los niveles de riesgo de la EPOC según GesEPOC 2017 y evaluar las actuaciones clínicas según las nuevas recomendaciones.
Material y métodosEs una auditoría clínica de diseño trasversal, con reclutamiento de casos consecutivos de EPOC durante un año. Se evaluó el nivel de riesgo y el fenotipo clínico según GesEPOC 2017 y su relación con las intervenciones clínicas realizadas.
ResultadosEl nivel de alto riesgo fue más frecuente (79,8 versus 20,2%; p < 0,001) y se caracterizó por un mayor nivel de gravedad medido por los índices BODE y BODEx, además de por mayor comorbilidad. El fenotipo clínico más frecuente fue el no agudizador. La opción más utilizada en el bajo riesgo fue la monoterapia broncodilatadora (en un 34,8%) y la triple terapia en el alto riesgo (en un 53,7%). En el alto riesgo fue más frecuente la caracterización por fenotipos (57,6 versus 52%; p = 0,014) y la realización de pruebas de función respiratoria: volúmenes pulmonares (47,7 versus 35,8%; p < 0,001), test de difusión (51,4 versus 42,1%; p < 0,001) y test de marcha (37,8 versus 15,8%; p < 0,001).
ConclusionesLa mayoría de los pacientes atendidos en las consultas de neumología fueron de alto riesgo y con fenotipo clínico no agudizador. La práctica clínica realizada fue diferente según el nivel de riesgo y mayoritariamente acorde con las recomendaciones de GesEPOC, aunque con importantes áreas de mejora.
EPOCONSUL is the first national audit to analyze medical care for COPD in pulmonology departments in Spain. The main objective was to perform a retrospective analysis to determine the distribution of GesEPOC 2017 COPD risk levels and to evaluate clinical activity according to the new recommendations.
Material and methodsThis is a cross-sectional clinical audit in which consecutive COPD cases were recruited over one year. The study evaluated risk and clinical phenotype according to GesEPOC 2017, and their correlation with the clinical interventions employed.
ResultsThe most common risk category was high risk (79.8% versus 20.2%; p < 0.001), characterized by a higher level of severity on BODE and BODEx indexes, and a higher comorbidity burden. The most common phenotype was non-exacerbator. The most commonly used treatment in low-risk patients was bronchodilator monotherapy (34.8%) and triple therapy in high-risk patients (53.7%). High risk was most frequently characterized by phenotype (57.6% versus 52%; p = 0.014) and pulmonary function test results: lung volume (47.7% versus 35.8%; p < 0.001), lung diffusion (51.4% versus 42.1%; p < 0.001) and walk test (37.8% versus 15.8%; p < 0.001).
ConclusionsMost patients treated in pulmonology departments were high-risk and non-exacerbator phenotype. Clinical interventions differed according to risk level and mainly followed GesEPOC recommendations, although there is significant room for improvement.
La EPOC es una enfermedad crónica y compleja que requiere una aproximación integral y una valoración multidimensional que incluya la evaluación del riesgo. En los últimos años, como alternativa al FEV1, se han propuesto diferentes escalas multidimensionales, como el BODE o BODEx1-3, que han demostrado ser superiores como factor pronóstico de futuras complicaciones, pero cuya utilización en la práctica clínica se ha constatado muy escasa4,5.
Recientemente, con base en las evidencias científicas y en el consenso de expertos, en las actualizaciones de las guías de práctica clínica para el manejo de la EPOC se han establecido diferentes propuestas en la valoración de la enfermedad con el fin de ofrecer una medicina personalizada6-8.
La nueva edición de la Guía Española de la EPOC (GesEPOC), atendiendo a la necesidad de avanzar en la categorización de los pacientes como herramienta que permita simplificar la estratificación de riesgo y, a la vez, adecuar los niveles de intervención tanto diagnóstica como terapéutica, propone una nueva clasificación en 2niveles de riesgo, bajo y alto, de tal forma que en los pacientes de bajo riesgo la gestión de la atención médica se simplifica, mientras que en el los de riesgo alto se recomienda una mayor precisión diagnóstica y un plan terapéutico más personalizado. Sin embargo, aunque esta nueva forma de categorizar a los pacientes cuenta con el respaldo de la literatura médica, hasta el momento no se ha publicado ningún análisis sobre las implicaciones de su aplicación en la práctica clínica diaria.
El estudio EPOCONSUL es la primera auditoría nacional que analiza la atención sanitaria de la EPOC en consultas de neumología en España6. En análisis previos, EPOCONSUL confirmó un alto nivel de implementación de la GesEPOC en su versión de 20129, de manera que el 46,3% de las historias clínicas auditadas incluían la clasificación del fenotipo según GesEPOC, aunque con una considerable variación entre los centros hospitalarios en la adhesión a las recomendaciones de buena práctica clínica6.
El presente trabajo utiliza la base de datos de EPOCONSUL con el objetivo de realizar un análisis retrospectivo de la distribución de los niveles de riesgo y fenotipos clínicos de la EPOC según la GesEPOC 2017 y de evaluar si la atención médica se adecuaba a las actuales recomendaciones de la GesEPOC 2017, a tenor del nivel de riesgo.
MetodologíaLa metodología del estudio EPOCONSUL ya ha sido extensamente descrita6. De forma breve, EPOCONSUL es una auditoría clínica promovida por la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) que fue diseñada para evaluar la práctica clínica, así como los factores clínicos y de organización relacionados con el tipo de atención dispensada a los pacientes con EPOC en las consultas de neumología en España. Es un estudio observacional trasversal, con reclutamiento prospectivo (de mayo de 2014 a mayo de 2015). Participaron un total de 59 centros (33,7% de los potencialmente elegibles) de 16 de las 17 comunidades autónomas españolas (excepto La Rioja). La mayoría eran hospitales universitarios (83,1%) y con 20 o más camas de asistencia neumológica (83,7%). La información recogida fue de naturaleza histórica para los datos clínicos (historia clínica y documentos relacionados) y concurrente para los datos de recursos hospitalarios. Se recogieron 46 variables relacionadas con los centros hospitalarios y 153 del paciente, que se agruparon en 3 grupos: 1) de recursos disponibles y organización del trabajo; 2) de características del paciente y 3) de modelos de práctica clínica: actuaciones realizadas durante el seguimiento y en la última visita auditada.
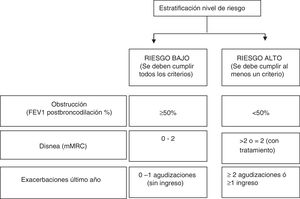
Para establecer los grupos de riesgo en el análisis retrospectivo, el nivel de riesgo fue definido acorde con los nuevos criterios de la GesEPOC8, con base en datos funcionales (porcentaje de FEV1 tras broncodilatación) y clínicos (grado de disnea e historial de agudizaciones), que se describen en la figura 1. El fenotipo clínico de la EPOC también se categorizó según la GesEPOC, utilizando el siguiente algoritmo: 1) los pacientes con 0 o 1 agudización y ninguna hospitalización por agudización en el año previo se clasificaron como no agudizadores; 2) los pacientes que tuvieron al menos 2 agudizaciones o una hospitalización en el año previo, con tos y expectoración crónica, se identificaron como agudizadores con bronquitis crónica; 3) los pacientes que tuvieron al menos 2 agudizaciones o una hospitalización en el año previo sin tos ni expectoración crónica, con datos clínicos/radiológicos o funcionales de enfisema se clasificaron como agudizadores con enfisema y 4) los pacientes con un diagnóstico concomitante de asma bronquial o pacientes con EPOC que tuvieran clínica sugestiva de asma y una prueba broncodilatadora positiva mayor o igual que el 15% se identificaron como fenotipo mixto asma-EPOC (ACO).
El protocolo (C.I. 14/030-E) fue aprobado por el Comité Ético de Investigación Clínica del Hospital Clínico San Carlos (Madrid, España), que certificó que cumplía los preceptos éticos formulados en la Declaración de Helsinki sobre principios éticos para las investigaciones médicas y salvaguarda de la confidencialidad de los pacientes participantes. En cada uno de los centros participantes, el Comité Ético local aprobó el protocolo y dio su conformidad para realizarlo. La necesidad del consentimiento informado fue eximida debido a la naturaleza no intervencionista del estudio, a la anonimización de los datos y a la necesidad de mantener el cegamiento para evaluar el funcionamiento clínico. Esta circunstancia fue explicada en el protocolo y los comités éticos aprobaron este procedimiento. Para evitar cambios en la práctica clínica habitual y mantener el cegamiento en la evaluación del funcionamiento clínico, tampoco se informó al personal médico de la realización de la auditoría.
Análisis estadísticoEl análisis estadístico se realizó mediante el paquete estadístico IBM SPSS Statistics (IBM Corporation, Armonk, Nueva York, EE. UU.) versión 23.0. Las variables cuantitativas se expresaron con la media y desviación estándar (DE), o mediana y rango intercuartílico para las variables continuas que presentan asimetría. Las variables cualitativas se describieron con la frecuencia absoluta y relativa (porcentaje). Para la comparación de variables cualitativas entre los grupos de alto y bajo riesgo se utilizó el test de chi cuadrado. La comparación de las variables cuantitativas entre los 2grupos de riesgo se realizó mediante el test t de Student para las variables simétricas, o mediante el test no paramétrico U de Mann-Whitney para las variables asimétricas. Se ajustó un modelo de regresión logística con el objetivo de identificar los factores clínicos y epidemiológicos que se asociaban de manera independiente con el nivel de riesgo. Se introdujeron en el modelo todas aquellas variables estadísticamente significativas en el modelo univariable. En todos los contrastes de hipótesis se rechazó la hipótesis nula con un error de tipo I o error α menor que 0,05.
ResultadosParticiparon 59 de los 175 hospitales públicos del Sistema Nacional de Salud con consulta de neumología, según el registro del Ministerio de Sanidad del 2012. La población de referencia estimada para el estudio de EPOCONSUL fue 18.104.350 individuos, que representaban el 39% de la población española. Los centros e investigadores participantes se describen en el anexo A.
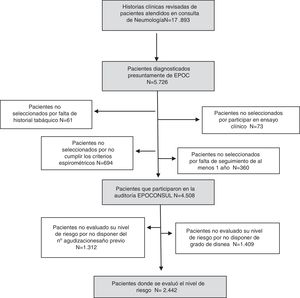
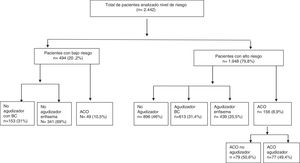
De un total de 17.893 historias clínicas de pacientes atendidos en consulta de neumología que se evaluaron durante el periodo de estudio, 4.508 pacientes con diagnóstico de EPOC se auditaron por cumplir los criterios de aceptación. En 2.442 pacientes se analizó su nivel de riesgo, al disponer de todos los criterios para definir dicho nivel según la GesEPOC. El proceso de muestreo se describe con un diagrama de flujo STROBE10 en la figura 2.
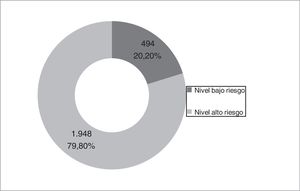
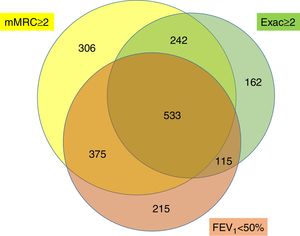
Distribución de los niveles de riesgo y sus características demográficas y clínicasDe la cohorte estudiada, 1.948 (79,8%) pacientes se clasificaron como de alto riesgo y 494 (20,2%) pacientes con un bajo nivel de riesgo (fig. 3). En la tabla 1 se muestra la distribución de los criterios que definen a los pacientes con un nivel de alto de riesgo. En el 27,4% de los pacientes de alto riesgo, estaban presentes los 3criterios y en un 35,1% se cumplía un único criterio. El criterio de alto riesgo más frecuente fue el grado de disnea ≥2 MRC-m, que fue el único criterio encontrado en un 15,7% de los pacientes de alto riesgo. En la figura 4 se muestra un diagrama de Venn proporcional de los criterios que definen el nivel de alto riesgo.
Distribución de los pacientes de alto riesgo según el número de criterios y los criterios que definen su nivel de alto riesgo
| N.° de criterios encontrados | Pacientes con un nivel alto de riesgo (n = 1.948) n (%) |
|---|---|
| Un solo criterio | 683 (35,1) |
| Solo grado de disnea≥2 (MRC-m) | 306 (15,7) |
| Solo FEV1<50% predicho | 215 (11) |
| Solo ≥ 2 agudizaciones o ≥ 1 hospitalización | 162 (8,3) |
| Dos criterios | 732 (37,6) |
| Grado de disnea ≥2 (MRC-m) y FEV1 < 50% | 375 (19,3) |
| Grado disnea ≥2 (MRC-m) y 2 agudizaciones o ≥ 1 hospitalización | 242 (12,4) |
| FEV1<50% y ≥2 agudizaciones o ≥1 hospitalización | 115 (5,9) |
| Tres criterios | 533 (27,4) |
FEV1: porcentaje del FEV1 posbroncodilatación predicho; MRC-m: Medical Research Council modificado.
Las características demográficas y clínicas por nivel de riesgo se muestran en la tabla 2. Se observan diferencias estadísticamente significativas en todas las variables, salvo el sexo y la clínica sugestiva de asma bronquial. Los pacientes con alto riesgo se caracterizaban por tener una mayor edad y comorbilidad evaluada por el índice de Charlson, que se identificaron en el modelo multivariante (tabla 3) como factores asociados de forma independiente. Además, los pacientes con alto riesgo presentaban un nivel de gravedad mayor evaluado por los índices BODE y BODEx.
Características clínicas según el nivel de riesgo acorde a GesEPOC
| Características | Total (n = 2.442) | Alto riesgo (n = 1.948) | Bajo riesgo (n = 494) | p |
|---|---|---|---|---|
| Edad, media (DE) | 2.442 | 70,37 (9,37) | 67,99 (10,20) | <0,001 |
| Edad, n (%) | 2.442 | <0,001 | ||
| Mayor 55 años | 1.819 (93,4) | 429 (86,8) | ||
| Menor o igual 55 años | 129 (6,6) | 65 (13,2) | ||
| Sexo (mujer), n (%) | 2.442 | 441 (13,5) | 64 (13) | 0,777 |
| IMC, m (DE) | 2.436 | 27,76 (5,40) | 28,77 (5,08) | <0,001 |
| Tabaquismo activo, n (%) | 2.442 | 405 (20,8) | 150 (30,4) | <0,001 |
| IPA, mediana (P25-75) | 2.442 | 50 (36-75) | 40 (30-60) | <0,001 |
| Charlson ≥3, n (%) | 2.442 | 915(47) | 194 (39,3) | 0,001 |
| Grado de disnea (MRC-m), n (%) | 2.442 | <0,001 | ||
| Grado 0 | 54 (2,8) | 100 (20,2) | ||
| Grado 1 | 438 (22,5) | 394 (79,4) | ||
| Grado 2 | 877 (45) | 0 | ||
| Grado 3 | 493 (25,3) | 0 | ||
| Grado 4 | 86 (4,4) | 0 | ||
| Tos crónica, n (%) | 2.442 | 1001 (51,4) | 153 (31) | <0,001 |
| Colonización, n (%) | 2.442 | 170 (8,7) | 9 (1,8) | <0,001 |
| Clínica sugestiva de asma, n (%) | 2.442 | 669 (34,3) | 165 (33,4) | 0,693 |
| N° agudizaciones año previo, n(%) | 2.442 | <0,001 | ||
| 0 | 600 (30,8) | 370 (74,9) | ||
| 1 | 575 (29,5) | 124 (25,1) | ||
| ≥2 | 773 (39,7) | |||
| N° hospitalizaciones por agudización grave año previo,n(%) | 2.442 | |||
| 0 | 1248 (64.1) | 494 (100) | ||
| ≥1 | 700 (35.9) | 0 | ||
| FEV1posbr %,m (DE) | 2.442 | 46,06 (16,59) | 66.77 (11.60) | <0,001 |
| FEV1 posbd %, n(%) | 2.442 | <0,001 | ||
| ≥50% | 710 (36.4) | 494 (100) | ||
| <50% | 1238 (63.6) | 0 | ||
| BODE índice, m (DE) | 518 | 4.21 (1.83) | 1.60 (1.31) | <0,001 |
| BODEx índice, m (DE) | 2.436 | 3,35 (1,67) | 0,50 (0,52) | <0,001 |
| BODEx, n(%) | 2.436 | <0,001 | ||
| 0-2 | 701 (36,1) | 492 (100) | ||
| 3-4 | 772 (39,7) | |||
| 5-6 | 379 (19,5) | |||
| 7-9 | 92 (4,7) | |||
| Tratamiento, n (%) | 2.408 | <0,001 | ||
| Monoterapia | 125 (6,5) | 167(34,8) | ||
| LAMA+LABA | 477 (24,7) | 126 (26,3) | ||
| LABA+CSI | 138 (7,2) | 50 (10,4) | ||
| LAMA+LABA+CSI | 1035 (53,7) | 132 (27,5) | ||
| Cuádruple | 153 (7,9) | 5 (1) | ||
| Oxigenoterapia domiciliaria continua, n (%) | 2.442 | 624 (32) | 20 (4) | <0,001 |
| VMD, n (%) | 2.442 | 171 (8,8) | 29 (5,9) | 0,035 |
| Programa de rehabilitación respiratoria, n (%) | 2.442 | 257 (13,2) | 13 (2,6) | <0,001 |
ACO: asma-EPOC overlap; BODE: índice de masa corporal, obstrucción al flujo aéreo, disnea y capacidad de ejercicio; BODEx: índice de masa corporal, obstrucción al flujo aéreo, disnea y exacerbaciones graves; Cuádruple: antimuscarínico de larga duración/β-2 adrenérgico de larga duración/corticosteroide inhalado/otro fármaco: roflumilast o teofilina o antibiótico a largo plazo; FEV1 posbr %: porcentaje del FEV1 posbroncodilatación predicho; IMC: índice de masa corporal; IPA: índice paquetes-año; LABA: β-2 adrenérgico de larga duración; LABA/CSI: β-2 adrenérgico de larga duración/corticosteroide inhalado; LABA/LAMA: β-2 adrenérgico de larga duración/antimuscarínico de larga duración; LAMA: antimuscarínico de larga duración; LAMA/LABA/CSI: antimuscarínico de larga duración /β-2 adrenérgico de larga duración/corticosteroide inhalado; VMD: ventilación mecánica domiciliaria.
Factores asociados al nivel de alto riesgo. Análisis multivariante
| Factores clínicos y epidemiológicos | OR (95%CI) | p |
|---|---|---|
| Edad (años) | ||
| ≤55 años | 1 | |
| >55 años | 1,63 (1,16-2,27) | 0,004 |
| IMC (kg/m2) | 0,96 (0,94-0,98) | <0,001 |
| Tabaquismo activo | ||
| Sí | 0,60 (0,47-0,75) | <0,001 |
| No | 1 | |
| Charlson ≥ 3 | 1,33 (1,08-1,65) | 0,008 |
| Tos crónica | ||
| Sí | 2,24 (1,80-2,79) | <0,001 |
| No | 1 | |
| Colonización | ||
| Sí | 3,17 (1,59-6,33) | 0,001 |
| No | 1 | |
En la figura 5 se describe la distribución de los pacientes según nivel de riesgo y fenotipo clínico, de acuerdo con la GesEPOC. El fenotipo más frecuente en el nivel de alto riesgo fue el no agudizador (46%). El ACO fue el fenotipo menos frecuente (un 10,5% en bajo riesgo y un 8,9% en alto riesgo).
Distribución de los pacientes según el nivel de riesgo y el fenotipo clínico según la GesEPOC.
El fenotipo ACO era definido por tener un diagnóstico de asma bronquial o tener una clínica sugestiva de asma y además una prueba broncodilatadora positiva mayor o igual que el 15%.
ACO: fenotipo mixto asma-EPOC o ACO.
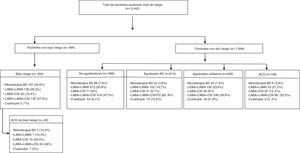
En la figura 6 se muestra la distribución de los tratamientos farmacológicos de la EPOC según el nivel de riesgo y el fenotipo clínico. La opción más utilizada en el bajo riesgo fue la monoterapia broncodilatadora (en un 34,8%) y en el alto riesgo fue la triple terapia (antimuscarínico de larga duración/ß-2 adrenérgico de larga duración/corticosteroides inhalados [LAMA/LABA/CSI]), que estaba presente en un 53,7%.
Tratamiento farmacológico según nivel de riesgo y el fenotipo clínico de la GesEPOC.
ACO: fenotipo mixto asma-EPOC o ACO; BD: broncodilatadora; Cuádruple: antimuscarínico de larga duración/β-2 adrenérgico de larga duración/corticosteroide inhalado/otro fármaco (roflumilast o teofilina o antibiótico a largo plazo); LABA: β-2 adrenérgico de larga duración; LABA/CSI: β-2 adrenérgico de larga duración/corticosteroide inhalado; LABA/LAMA: β-2 adrenérgico de larga duración/antimuscarínico de larga duración; LAMA: antimuscarínico de larga duración; LAMA/LABA/CSI: antimuscarínico de larga duración/β-2 adrenérgico de larga duración/corticosteroide inhalado.
Los recursos ofrecidos en la atención según el nivel de riesgo se describen en la tabla 4. No se encontraron diferencias en el tipo de consulta (general o especializada en EPOC) en la que los pacientes fueron atendidos según su nivel de riesgo. En los pacientes de bajo riesgo, el origen de la consulta fue principalmente la atención primaria (50,1%), y entre los de alto riesgo, un 20,4% procedían del área de hospitalización. La periodicidad de las consultas fue más frecuente en los pacientes con alto riesgo —inferior a 6 meses en un 55,7%— con un tiempo de seguimiento mayor.
Atención médica según el nivel de riesgo
| Total (n = 2.442) | Alto riesgo (n = 1.948) | Bajo riesgo (n = 494) | p | |
|---|---|---|---|---|
| Tipo de consulta de neumología n (%) | 2.442 | 0,155 | ||
| General | 1.337 (68,6) | 356 (72,1) | ||
| Monográfica EPOC | 611 (31,4) | 138 (27,9) | ||
| Procedencia, n (%) | 2.030 | <0,001 | ||
| Área de hospitalización | 365 (22,5) | 48 (11,7) | ||
| Urgencias | 131 (8,1) | 29 (7,1) | ||
| Atención Primaria | 670 (41,3) | 205 (50,1) | ||
| Otras especialidades | 455 (28,1) | 127 (31,1) | ||
| Tiempo de revisión, n (%) | 2.371 | <0,001 | ||
| Menos 6 meses | 1.052 (55,7) | 158 (32,6) | ||
| 6-12 meses | 577 (30,6) | 187 (38,6) | ||
| Más 12 meses | 258 (13,7) | 139 (28,7) | ||
| Se solicitaban pruebas complementarias, n (%) | 2.442 | 1.176 (60,4) | 323 (65,4) | 0,044 |
| Tiempo seguimiento (años), mediana (P25-75) | 2.442 | 4 (3-7) | 3 (2-6) | <0,001 |
Los principales procedimientos diagnósticos realizados durante el seguimiento se describen en la tabla 5. Respecto a las pruebas de valoración funcional, en el nivel de alto riesgo fue más frecuente la medición de los volúmenes pulmonares (47,7 versus 35,8%; p < 0,001), el test de difusión (51,4 versus 42,1%; p < 0,001) y el test de marcha (37,8 versus 15,8%; p < 0,001). Sin embargo, la prueba broncodilatadora se realizó con mayor frecuencia en los pacientes con bajo riesgo (70,6 versus 62,3%; p = 0,001). La realización de la tomografía axial computarizada (TAC) torácica, el análisis de esputo, la valoración de la gravedad por los índices BODE y BODEx fueron más frecuentes en el nivel de alto riesgo.
Procedimientos diagnósticos realizados según el nivel de riesgo
| Alto riesgo (n = 1.948) | Bajo riesgo (n = 494) | p | |
|---|---|---|---|
| Prueba BD | 1.213 (62,3) | 349 (70,6) | 0,001 |
| Gasometría arterial | 1.357 (69,7) | 199 (40,3) | <0,001 |
| Niveles Alfa 1 AT | 468 (24) | 124 (25,1) | 0,328 |
| Cultivo de esputo | 1.046 (53,7) | 137 (27,7) | <0,001 |
| Volúmenes pulmonares | 929 (47,7) | 177 (35,8) | <0,001 |
| Difusión | 1.001 (51,4) | 208 (42,1) | <0,001 |
| Test de marcha 6min | 736 (37,8) | 78 (15,8) | <0,001 |
| Ergometría respiratoria | 85 (4,4) | 7 (1,4) | 0,001 |
| Índice BODE | 466 (23,9) | 52 (10,5) | <0,001 |
| Índice BODEx | 217 (11,1) | 40 (8,1) | 0,027 |
| TAC torácico | 1.216 (62,4) | 226 (45,7) | <0,001 |
Alfa 1 AT: α 1 antitripsina; BODE: índice de masa corporal, obstrucción al flujo aéreo, disnea y capacidad de ejercicio; BODEx: índice de masa corporal, obstrucción al flujo aéreo, disnea y exacerbaciones graves; Prueba BD: prueba broncodilatadora;
TAC: tomografía axial computarizada.
En la tabla 6 se recogen las principales actuaciones clínicas realizadas durante la última consulta auditada de cada paciente. En el nivel alto de riesgo fue más frecuente la caracterización por fenotipos según la GesEPOC (57,6 versus 52%; p = 0,014). También se realizaba con mayor frecuencia la recogida de las comorbilidades (82,4 versus 78,7%; p = 0,037), la revisión de la técnica de inhalación (39,2 versus 32%; p = 0,002), la utilización del cuestionario CAT (28,2 versus 22,1%; p = 0,003) y la vacunación antigripal y antineumocócica.
Actuaciones realizadas según el nivel de riesgo
| Alto riesgo n (%) | Bajo riesgo n (%) | p | |
|---|---|---|---|
| Recoger riesgo GOLD | 534 (27,4) | 169 (34,2) | 0,002 |
| Recoger fenotipo GesEPOC | 1.123 (57,6) | 257 (52) | 0,014 |
| Realizar cuestionario CAT | 550 (28,2) | 109 (22,1) | 0,003 |
| Recoger tratamientos de la EPOC | 1.888 (96,9) | 484 (98) | 0,133 |
| Recoger cumplimiento del tratamiento | 1.001 (51,4) | 264 (53) | 0,222 |
| Recoger efectos secundarios | 661 (33,9) | 142 (28,7) | 0,016 |
| Recoger grado de satisfacción con el dispositivo | 500 (25,7) | 107 (21,7) | 0,036 |
| Revisión técnica inhalatoria | 764 (39,2) | 158 (32) | 0,002 |
| Recoger hábito tabáquico actual | 1.428 (73,3) | 378 (76,5) | 0,08 |
| Recoger comorbilidades | 1.605 (82,4) | 389 (78,7) | 0,037 |
| Recoger nivel de actividad | 1.111 (57) | 275 (55,7) | 0,310 |
| Recomendar vacuna contra la gripe | 1.175 (60,3) | 261 (52,8) | 0,003 |
| Recomendar vacuna contra el neumococo | 758 (38,9) | 104 (21,1) | <0,001 |
| Ofrecer deshabituación tabáquica en fumadores activos | 237 (58,5) | 95 (53,3) | 0,176 |
CAT: COPD assessment test; GOLD: Global Initiative for Chronic Obstructive Lung Disease.
El presente trabajo aporta por primera vez datos sobre la distribución y características clínicas de los pacientes atendidos en las consultas de neumología en España, agrupados según los niveles de riesgo de la EPOC de acuerdo con las actuales directrices de GesEPOC8.
Uno de los aspectos más relevantes que debe incluirse en la valoración del paciente con EPOC es la evaluación del riesgo, que se entiende como la probabilidad de que el paciente pueda presentar exacerbaciones (con o sin ingreso hospitalario), progresión de la enfermedad, futuras complicaciones o mayor consumo de recursos sanitarios. Múltiples estudios nos han demostrado que el FEV1 es un buen predictor de mortalidad y morbilidad11,12. Sin embargo, conviene recordar que otros parámetros predicen la mortalidad de forma independiente de la función, como la disnea13 y las exacerbaciones5,14. Estas 3variables son las consideradas por GesEPOC en la estratificación del riesgo de la EPOC, atendiendo a la necesidad de adecuar los niveles de intervención tanto diagnóstica como terapéutica.
Los resultados de nuestro trabajo ponen de manifiesto que la mayoría de los pacientes con EPOC atendidos en consulta de neumología en España se clasifican como de alto riesgo. Un nivel de alto riesgo que se definió, en un 37,6% de los pacientes, por cumplir 2 criterios y en un 27,4% por tener los 3criterios (grado de disnea, obstrucción al flujo aéreo e historial de agudizaciones). Hay que destacar que el criterio tener un grado de disnea ≥2 MRC-m estaba presente en la mayoría de los pacientes de alto riesgo (en un 74,7%), así como tener un FEV1< 50%, que lo cumplía el 63,6% de los pacientes con alto riesgo. Sin embargo, solo un 35,9% habían sido hospitalizados al menos una vez y solo un 39,7% habían presentado más de una agudización moderada en el año previo. Recientes estudios realizados en las consultas de neumología en España nos confirman que el historial de agudizaciones ≥2 está presente en menos de 1/3 de los pacientes con EPOC, mientras que una disnea ≥2 MRC-m o un FEV1<50% está presente en más de 2/3 de los pacientes15-17.
También hay que mencionar que, en nuestro análisis, tan solo 34 pacientes (1,75% de los de alto riesgo) se clasificaron como de alto riesgo por tener como único criterio una disnea igual a 2 y estar con monoterapia broncodilatadora como tratamiento de mantenimiento, por lo que podrían considerarse infratratados. No obstante, futuros estudios podrán aportar más información para la ponderación de las variables que definen el nivel de riesgo.
En nuestro trabajo, los pacientes con un nivel alto de riesgo tenían una mayor edad y carga de comorbilidad, con una expectoración crónica y una colonización más frecuentes, factores asociados al alto riesgo de forma independiente. Unos hallazgos que están en consonancia con numerosos estudios que han demostrado que la presencia de comorbilidades, de tos con expectoración crónica y de carga bacteriana en la vía aérea se asocian a un mayor riesgo de agudizaciones, peor pronóstico y mayor mortalidad18-21. Con relación a la edad, varios estudios han constatado que se asocia irremediablemente a un aumento de la mortalidad, si bien, en parte, podría ser explicado por la presencia de factores relacionados como el apoyo social, la incapacidad física, la depresión o la calidad de vida22, y que definirían un subgrupo de pacientes de alta complejidad o «frágiles» que, además de tener un elevado riesgo de complicaciones, precisarán una aproximación mucho más individualizada23. El tabaquismo activo fue menos frecuente en el nivel de alto riesgo, lo que podría ser explicado como una consecuencia de su nivel de gravedad.
Con relación al nivel de gravedad medido mediante BODE/BODEx, en nuestro estudio los pacientes con un nivel de alto riesgo eran más graves, con diferencias estadísticamente significativas respecto al bajo riesgo. Todos los pacientes con un nivel de bajo riesgo estaban en el cuartil 1 del BODEx. Unos resultados que apoyan la estratificación del riesgo según GesEPOC como herramienta para la valoración del paciente y la adecuación de los niveles de intervención.
La distribución de los fenotipos clínicos fue similar a la obtenida en otros estudios nacionales e internacionales, en los que el no agudizador es el más frecuente entre los pacientes atendidos en las consultas de neumología15,16,24. Es este un dato que llama la atención, si consideramos que la mayoría de los pacientes tienen una obstrucción grave, pero que podría en parte explicarse como resultado de un tratamiento y seguimiento más intensos. Respecto a la frecuencia del fenotipo ACO, definido por los criterios anteriormente comentados, fue baja (un 10,5% en bajo riesgo o un 8,9% en alto riesgo), en consonancia con estudios previos y con mínimas diferencias según los criterios utilizados16,24-27. No obstante, en nuestro estudio no consideramos la eosinofilia periférica como criterio diagnóstico del ACO, lo que podría estar infraestimando la prevalencia.
Con relación al tratamiento por nivel de riesgo y fenotipos clínicos, cabe destacar que existía un porcentaje alto de pacientes con CSI en ambos niveles de riesgo. En el alto riesgo, la triple terapia fue la combinación más utilizada, presente en un 47,4% de los no agudizadores y que alcanzó su máximo en los agudizadores con bronquitis crónica, con un 60,8%. También se dio en los pacientes con bajo riesgo, pese a que la opción más frecuente fue la monoterapia con un broncodilatador de larga duración, pero hay que reseñar que un 10,4% seguían tratamiento con LABA+CSI y un 27,4% con LABA+LAMA+CSI. Esta sobreutilización de los CSI en el bajo riesgo no puede explicarse por la frecuencia del fenotipo ACO, cuyos criterios solo cumplían un 10,5%. En el futuro, será de interés analizar la frecuencia de ACO según los nuevos criterios de GesEPOC en el nivel de bajo riesgo28 por sus implicaciones en el tratamiento, dado que GesEPOC recomienda en este umbral de riesgo utilizar broncodilatadores solos. También hay que mencionar que tan solo 34 pacientes (1,75% de los de alto riesgo) se clasificaron como de alto riesgo por tener como único criterio una disnea igual a 2 y estar en tratamiento con monoterapia broncodilatadora, por lo que podrían considerarse infratratados.
Numerosos estudios nacionales e internacionales realizados en diferentes niveles asistenciales han evidenciado un elevado uso de CSI en pacientes con EPOC29,30. En España, diferentes estudios30,31 han constatado que un porcentaje superior al 60% de los pacientes con EPOC leve reciben un tratamiento con CSI (solos o en asociación con broncodilatador de larga duración), con frecuencia a dosis altas. Además, en muchas ocasiones, la prescripción de CSI asociados a broncodilatadores se da como primer tratamiento tras el diagnóstico32 y no se adecua a las recomendaciones de buena práctica clínica33. No obstante, en los últimos años, estudios realizados en España que han evaluado el tratamiento según fenotipos clínicos han puesto de manifiesto que el uso de CSI ha disminuido en los pacientes no agudizadores34. Así, el estudio FENEPOC, realizado en 2013 en ambos ámbitos asistenciales en España, nos mostraba que la triple terapia era el tratamiento de mantenimiento en un 28,7% de los no agudizadores, en un 58% en los agudizadores y en un 59,5% en los pacientes con ACO15.
En cuanto a la atención médica y las actuaciones según el nivel de riesgo, hay que destacar que, si bien en el paciente de alto riesgo la periodicidad de las revisiones y el tiempo de seguimiento en consulta fueron mayores, no encontramos diferencias en el tipo de consulta donde fue atendido (general o monográfica de EPOC). Por el contrario, sí existen diferencias en las actuaciones diagnósticas y terapéuticas que se realizaban entre ambos niveles de riesgo, siendo más frecuentes las pruebas específicas en el paciente de alto riesgo, como la medición de los volúmenes pulmonares, la TAC y el test de la marcha; y también son más frecuentes las actuaciones como el fenotipado o la aplicación del cuestionario CAT. Unos datos que están en consonancia con las recomendaciones de GesEPOC, que establece una mayor necesidad de intervenciones diagnósticas o terapéuticas en los pacientes con un nivel alto de riesgo. Sin embargo, pese a estos resultados que nos muestran que en la consulta de neumología se lleva a cabo una práctica clínica en el paciente con EPOC diferente según el nivel de riesgo, hay que destacar que, en ambos niveles de riesgo, existen importantes áreas de mejora en la adhesión a las recomendaciones de buena práctica clínica, y cuya variabilidad solo se explica en una proporción pequeña por variables del paciente. En ambos niveles de riesgo fue muy bajo el cribado del déficit de alfa 1 antitripsina.
Por último, cabe mencionar algunas limitaciones metodológicas que deben ser tenidas en cuenta, como que la selección de los centros para participar en este estudio no fue aleatoria y que se realizó con base en haber participado previamente en auditorías clínicas en EPOC y por su interés en este estudio. También debemos recordar que es un estudio transversal y que, por tanto, no puede evaluar si el nivel de riesgo de exacerbaciones, complicaciones o la mortalidad es diferente entre niveles de riesgo. Además, debemos considerar que existe una limitación intrínseca a cualquier auditoria clínica, y es que, pese a la metodología en la inclusión y la supervisión periódica de la base de datos de nuestro estudio, algunos valores no son recogidos por no estar disponibles. No obstante, pese a estas limitaciones, creemos que la muestra recogida es representativa de la atención médica del paciente con EPOC en la consulta de neumología en España, por su cobertura poblacional con representación en 16 comunidades autónomas.
ConclusiónLa estratificación en niveles de riesgo del paciente con EPOC debe ser considerada un paso clave en el abordaje y evaluación del paciente con EPOC. Las variables que determinan el nivel de riesgo tienen la virtud de ser potencialmente modificables, lo que apoya el interés de planificar intervenciones terapéuticas según el nivel de riesgo, orientadas a revertir sus efectos y, con ello, a mejorar la supervivencia de los pacientes con EPOC.
Los resultados del presente trabajo permitirán aprender sobre las fortalezas y debilidades de nuestra atención sanitaria en relación con el nivel de riesgo definido en la GesEPOC 2017, si bien debemos tener en cuenta las limitaciones intrínsecas a cualquier auditoría clínica y a la selección de los centros.
Por todo ello, son necesarios futuros estudios que evalúen si el nivel de riesgo tiene un impacto sobre resultados clínicamente relevantes, como el riesgo de agudizaciones y la supervivencia, lo que apoyaría futuros cambios en la estrategia diagnóstica y terapéutica de la EPOC.
FinanciaciónLa Sociedad Española de Neumología y Cirugía Torácica (SEPAR) promovió y patrocinó el estudio, con el soporte financiero de Boehringer Ingelheim. Los financiadores no participaron en el diseño del estudio, la recogida de datos, el análisis, la publicación ni en la elaboración de este manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a los investigadores y centros que participaron en el estudio EPOCONSUL (anexo 1) y a Boehringer Ingelheim su colaboración para llevarlo a cabo.
Centros e investigadores participantes (grupo EPOCONSUL):
Andalucía: José Luis Rojas Box, H. de Alta Resolución de Écija, Sevilla. José Domingo García Jiménez, H. de Alta Resolución de Utrera, Sevilla. Adolfo Domenech del Río, Ana Muñoz, H. Carlos Hayas, Málaga. Antonia Soto Venegas, H. San Juan de la Cruz, Úbeda, Jaén. Aurelio Arnedillo Muñoz, H. U. Puerta del Mar, Cádiz. Agustín Valido Morales, H. Virgen de Macarena. Sevilla. José Velasco Garrido, Carlos Rueda Ríos, Macarena Arroyo Varela, H. Virgen de la Victoria. Málaga. Francisco Ortega Ruiz, Eduardo Márquez Martin, Carmen Calero Acuña, H. Virgen del Rocío, Sevilla. Francisco Luis García Gil, H. U. Reina Sofía, Córdoba.
Aragón: Joaquín Carlos Costan Galicia, H. Clínico U. Lozano Blesa, Zaragoza. Ana Boldova Loscertales, H. Royo Villanova, Zaragoza.
Asturias: Cristina Martínez González, Rosirys Guzmán Taveras, H. U. Central de Asturias, Oviedo.
Murcia: Juan Luis de la Torre Álvaro, H. U. Santa Lucía, Cartagena. M. Jesús Avilés Ingles, H. General U. Reina Sofía, Murcia. Rubén Andújar Espinosa, H. U. Virgen de la Arrixaca, Murcia.
Canarias: Juan Manuel Palmero Tejera, Juan Marco Figueira Conçalves, H. U. Nuestra Señora de la Candelaria, Santa Cruz de Tenerife.
Cantabria: Ramón Agüero Balbín, Carlos Amado Diago, Beatriz Abascal Bolado, H. Marqués de Valdecilla, Santander. Juan Luis García Rivero, Marcelle Cohen Escovar, H. de Laredo, Santander.
Castilla La Mancha: Francisco Javier Callejas González, Complejo Hospitalario Universitario de Albacete, Albacete. Ángel Ortega González, H. Nuestra Señora del Prado, Talavera de la Reina, Toledo. Rosario Vargas González, H. Virgen de la Luz, Cuenca. Encarnación López Gabaldón, Raúl Hidalgo Carvajal, H. Virgen de la Salud, Toledo.
Castilla y León: Elena Bollo de Miguel, Silvia Fernández Huerga, Complejo Hospitalario Universitario de León, León. Ana Pueyo Bastida, Complejo Asistencial de Burgos, Burgos. Jesús R. Hernández Hernández, Ruth García García, H. Nuestra Señora de Sonsoles, Ávila. Miguel Barrueco Ferrero, Marco López Zuibizarreta, E. Consuelo Fernández, H. Universitario de Salamanca, Salamanca.
Cataluña: David de la Rosa Carrillo, H. Plató, Barcelona. Jordi Esplugas Abós, Noelia Pablos Mateos, H. Sant Joan de Déu, Martorell. Elena de Miguel Campos, H. Sant Joan de Despí, Barcelona. Pablo Rubinstein, Hospital General de Cataluña, Barcelona. Hernán Abraham Manrique Chávez, H. Sagrat Cor, Barcelona. Miriam Barrecheguren, H. U. Vall d’Hebrón, Barcelona.
Valencia: Carmen Aguar Benito, H. de Arnau de Villanova, Valencia. Pablo Catalán Serra, H. de Requena, Requena. Eusebi Chiner Vives. H. U. de San Juan, Alicante. Juan Antonio Royo Prats. H. General de Castellón, Castellón de la Plana. Cristina Sabater Abad, Esther Verdejo Mengual, H. General Universitario de Valencia, Valencia. Eva Martínez-Moragón, H. Universitario Dr. Peset, Valencia.
Extremadura: Francisca Lourdes Márquez Pérez, H. U. Santa Cristina, Badajoz.
Galicia: Alberto Fernández Villar, Cristina Represas Represas, Ana Priegue Carrera, Complejo Hospitalario de Vigo, Vigo. Marina Blanco Aparicio, Pedro Jorge Marcos Rodríguez, H. U. Juan Canalejo, La Coruña.
Baleares: Federico Gonzalo Fiorentino, M. Magdalena Pan Naranjo, H. Son Espases, Palma de Mallorca. Antonia Fuster Gomila, H. Sant Llatzer, Palma de Mallorca.
Madrid: Germán Peces Barba, Felipe Villar Álvarez, Fundación Jiménez Díaz, Madrid. Carlos José Álvarez Martínez, H. 12 de Octubre, Madrid. Juan Luis Rodríguez Hermosa, J. L. Álvarez Sala-Walther, H. Clínico San Carlos, Madrid. José Andrés García Romero de Tejada, H. U. Infanta Sofía, San Sebastián de los Reyes, Madrid. Javier Jareño, Sergio Campos Téllez, H. Central de la Defensa, Madrid. Raúl Galera Martínez, H. La Paz. Rosa Mar Gómez Punter, Emma Vázquez Espinosa, H. La Princesa, Madrid. Esther Alonso Peces, H. Príncipe de Asturias, Alcalá de Henares, Madrid. Juan Manuel Diez Piña, Raquel Pérez Rojo, H. U. de Móstoles, Madrid. Luis Puente Maestu, Julia García de Pedro, H. U. Gregorio Marañón, Madrid. Soledad Alonso Viteri, H. U. de Torrejón, Torrejón de Ardoz, Madrid.
Navarra: María Hernández Bonaga, Complejo Hospitalario de Navarra, Pamplona.
País Vasco: María Milagros Iriberri Pascual, H. de Cruces, Baracaldo. Myriam Aburto Barrenechea, H. de Galdakano. Sophe García Fuika, Hospital Santiago Apostol, Vitoria. Patricia Sobradillo Ecenarro, Hospital Txagorritx, Basurto.