Durante la última década, el tratamiento del cáncer de pulmón, y en especial el del cáncer de pulmón no microcítico (CPNM), se ha modificado con el desarrollo de nuevas intervenciones dirigidas a mutaciones detectadas en muestras patológicas de CPNM1. Algunos de los genes que pueden analizarse son, entre otros, el receptor del factor de crecimiento epidérmico (EGFR), la cinasa del linfoma anaplásico (ALK) o el proto-oncogén ROS12.
La punción-aspiración transbronquial (PATB) guiada por ultrasonografía endobronquial (USEB) es una técnica mínimamente invasiva y de alto rendimiento diagnóstico, especialmente en lesiones de la vía aérea central. Es una técnica segura, y la Sociedad Respiratoria Europea (European Respiratory Society [ERS]), la Sociedad Torácica Europea (European Thoracic Society [ETS]), la Sociedad Europea de Oncología Médica (European Society of Medical Oncology [ESMO]) y el Colegio Americano de Medicina Torácica (American College of Chest Physician [ACCP]) han apuntado que se emplee este abordaje para el diagnóstico inicial y estadificación del cáncer de pulmón, especialmente el CPNM3,4. El objetivo de este estudio fue identificar la presencia de 3 alteraciones genéticas que se pueden tratar mediante los inhibidores terapéuticos específicos de EGFR, ALK y ROS1, en muestras obtenidas mediante PATB guiada por USEB.
Entre julio de 2014 y junio de 2015 llevamos a cabo un estudio prospectivo y descriptivo de muestras de PATB guiada por USEB de un centro de referencia de Chile. Todos los pacientes firmaron el documento de consentimiento, y el comité de ética de nuestro centro aprobó el protocolo. Los criterios de inclusión fueron los siguientes: a)paciente adulto (>18años) con lesión compatible con cáncer de pulmón en los estudios clínicos y radiológicos y sometido a PATB guiada por USEB (EBUS Olympus® y EBUS Fuji®), y b)cáncer de pulmón confirmado mediante examen anatomopatológico (adenocarcinoma o cáncer no especificado). Si la TAC había mostrado adenopatías de más de 10mm, lesiones pulmonares periféricas de 30mm o más o cualquier lesión pulmonar central, se practicó una USEB mediastínica al paciente. En el momento de practicar la USEB no se disponía de exámenes PET de todos los pacientes. No se excluyó a los pacientes con enfermedad diseminada (USEB practicada con finalidades diagnósticas), pero sí a los menores de 18años y a los que no otorgaron su consentimiento para someterse al procedimiento. Durante la PATB guiada por USEB se obtuvo un mínimo de 4 muestras. Con las muestras citológicas se prepararon bloques celulares y se fijaron con una solución de formol al 10%. Todas las muestras se cubrieron con una solución de parafina y se tiñeron con hematoxilina-eosina. En los casos en los que la morfología de adenocarcinoma o de carcinoma escamoso no era clara, se practicaron tinciones inmunohistoquímicas, como TTF-1/napsina-A, CK 5/6 o p40. Se efectuaron pruebas moleculares secuenciales de la mutación en el EGFR en las muestras mediante las técnicas de secuenciación Sanger (si el recuento de células tumorales era superior a un 30%) o Cobas4800 (una técnica automatizada más cara, que requiere menos ADN tumoral y ofrece resultados más rápidos), dependiendo del volumen de la muestra. En los casos de negatividad de la mutación en EGFR se analizó la presencia de la translocación de ALK mediante hibridación fluorescente in situ (FISH) (ZytoLight® SPEC ALK/EML4 TriCheck™ Probe). Finalmente, para la detección de ROS1 se efectuó una tercera prueba molecular mediante FISH (ZytoLight® SPEC ROS1 Dual Color Break Apart Probe). El objetivo principal fue determinar si las muestras de tejido obtenidas a partir de la USEB eran suficientes para realizar análisis molecular. Definimos la suficiencia de la muestra como la mínima concentración de tumor obtenida mediante PATB guiada por USEB con la que es posible procesar una mutación (porcentaje mínimo del alelo mutado de un 25% por el método Sanger).
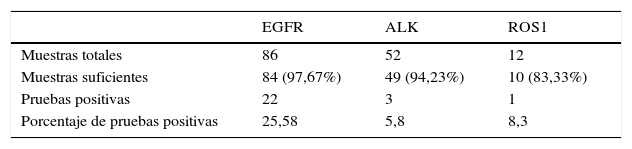
En el estudio participaron 86 pacientes y se practicaron 216 PATB guiadas por USEB. Cuarenta y siete (54,65%) de los 86 participantes eran mujeres, y la edad media de los pacientes fue de 65,70años (rango 37-91) y no hubo ninguna complicación. Se obtuvieron muestras de adenopatías de 60/86 (69,76%) pacientes y muestras de parénquima pulmonar de 26/86 (30,24%). La cantidad de tejido fue suficiente en el 97,67% (84/86) de las muestras para el análisis de la mutación en EGFR, en un 94,23% (49/52 muestras) para el análisis de la translocación de ALK y en un 83,33% (10/12 muestras) para el análisis de la mutación en ROS1.
Las pruebas moleculares fueron positivas en el 30,23% de los casos (26/86 muestras), siendo la mutación más frecuente la del EGFR, presente en 22/86 (25,58%), seguida de la mutación en ROS1, que se observó en 1/12 casos (8,3%) y la mutación de ALK, observada en 3/52 casos (5,76%). En la tabla 1 se presenta un resumen de los resultados.
El perfil genético del EGFR mostró que la mutación más frecuente era una deleción en el exón19 (13 casos de delE746-A750 y 2 de del2235-2249), seguida de la sustitución del aminoácido L858R en el exón21 (4 casos) y la sustitución del aminoácido G719A en la posición 719 del exón 18 (2 casos). Finalmente, en un paciente se identificó una mutación de resistencia adquirida a los inhibidores de la tirosina cinasa (ITC) T790M en el exón 20.
Este estudio es el primero que ha evaluado la eficacia de la PATB guiada por USEB en el cáncer de pulmón y las pruebas de mutación en Sudamérica. Los resultados previos se habían obtenido de muestras posquirúrgicas5.
La PATB guiada por USEB es un método seguro y de alto rendimiento diagnóstico en el cáncer de pulmón. En un ensayo controlado aleatorizado se comparó la estadificación mediastínica mediante este método con el procedimiento habitual, que consiste en estudios de imagen y biopsia quirúrgica. El tiempo hasta la «confirmación» del diagnóstico fue de 2semanas con el nuevo abordaje, frente a 4semanas con el procedimiento habitual6. Asimismo, el número de complicaciones fue inferior y el análisis económico más favorable en el grupo sometido a PATB guiada por USEB.
Varios estudios han evaluado la eficacia de este método diagnóstico en los análisis moleculares del cáncer de pulmón. En un estudio multicéntrico en el que participaron 774 pacientes fue posible analizar el EGFR en un 90% de los pacientes examinados7,8, lo que concuerda con la prevalencia descrita en nuestra serie.
En otro estudio reciente llevado a cabo por Casadio et al.9 se practicaron PATB guiadas por USEB a 306 pacientes consecutivos con cáncer de pulmón en estadios TNMIIIB-IV. Se analizó el EGFR en 195 pacientes, obteniéndose el diagnóstico citológico en el 95,1% de los casos. Se observó mutación en el EGFR en un 16,9%, en ALK en un 3,9% y en KRAS en un 31,6%. Además, para comparar los porcentajes de mutaciones con una serie quirúrgica histórica, se efectuó una prueba de la chi-cuadrado, sin que se observaran diferencias9, lo que concuerda con la prevalencia descrita en nuestra serie.
El perfil genético fue similar a los que se han comunicado en otros países de Sudamérica. De Melo et al.5 analizaron los perfiles de mutaciones de 125 pacientes con adenocarcinoma pulmonar y observaron mutaciones en EGFR en un 21,6%, en ALK en un 4,8% y en KRAS en un 26,4% de los casos. Nuestro estudio es uno de los pocos que han mostrado la utilidad de la PATB guiada por USEB para identificar la mutación en ROS1 y la mutación de resistencia a ITC.
El estudio tuvo algunas limitaciones, puesto que no comparamos los resultados negativos de la USEB con los resultados de la cirugía o la respuesta al tratamiento molecular. En nuestro centro, cada año practicamos una media de 220 procedimientos de PATB guiada por USEB, y diagnosticamos adenocarcinoma pulmonar en aproximadamente un 70% de los casos. Al ser un centro de referencia regional para la práctica de esta técnica no realizamos el seguimiento de algunos pacientes, y se completa el procesamiento de las muestras en el centro que los derivó, y este es el motivo del bajo número de pacientes a los que practicamos análisis de mutación. Debido a que efectuamos pocas pruebas de ROS1, es necesario realizar un estudio con más casos que permita un análisis más completo.
Para concluir, la PATB guiada por USEB es una técnica mínimamente invasiva útil para la obtención de muestras citopatológicas destinadas al análisis de mutaciones moleculares en pacientes con cáncer de pulmón. Estas muestras también se pueden utilizar para evaluar mutaciones de resistencia adquirida.