Presentamos el caso de una mujer de 66 años con disnea con el ejercicio y hemoptisis autolimitada de 2 meses de evolución. No tenía tos, expectoración ni fiebre. No era fumadora ni tenía otros hábitos tóxicos y no refería historia de exposición ambiental ni laboral a tóxicos. No presentaba antecedentes personales de interés y no estaba recibiendo tratamiento previo. La exploración física, incluyendo la auscultación pulmonar, fue normal. Su saturación de oxígeno, medida con pulsioximetría, era del 95% respirando aire ambiente.
Los análisis de sangre mostraron una hemoglobina de 11,2mg/dl, una proteína C reactiva de 168mg/dl y un fibrinógeno de 714mg/dl, sin otras alteraciones hematológicas, bioquímicas, inmunológicas ni urinarias. Las pruebas de función respiratoria mostraron un patrón restrictivo con disminución de la difusión: FEV1 1,55l (71% del tanto por ciento predicho); FVC 1,61l (62%); FEV1/FVC 0,96; capacidad pulmonar total 3,64l (73%); capacidad residual funcional 2,12l (79%); difusión del monóxido de carbono 3,8mmol/min/kPa (52%) y difusión del monóxido de carbono /volumen alveolar 1,38mmol/min/kPa/l (92%).
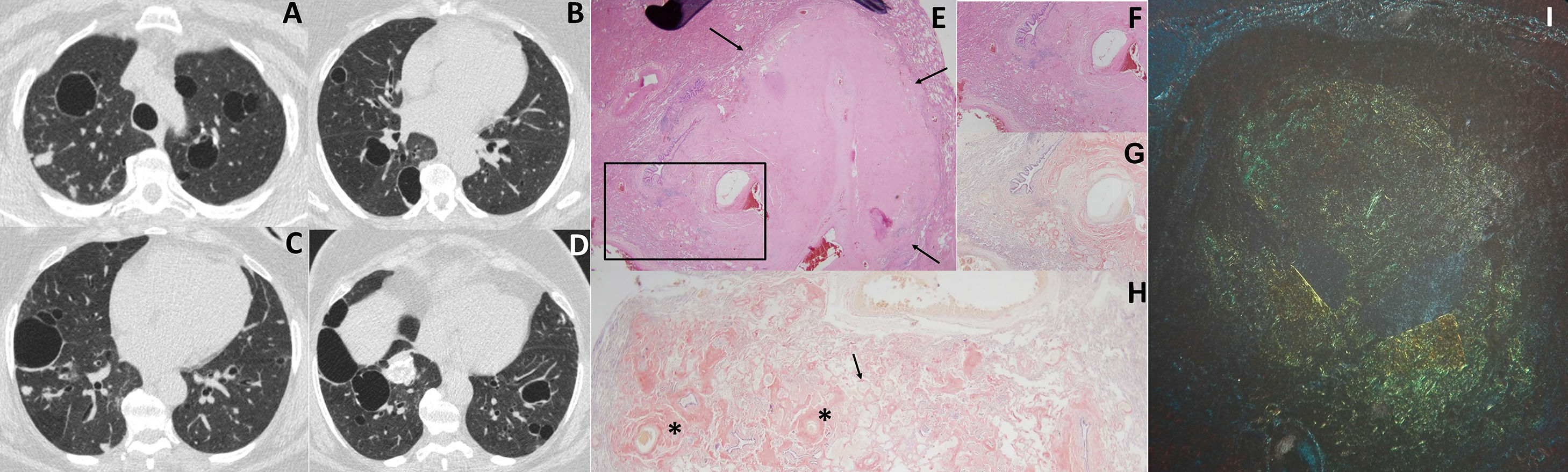
Ante los hallazgos encontrados en la radiografía de tórax, se decidió realizar una TC torácica que mostró la presencia de quistes aéreos de pared fina, bilaterales, y nódulos pulmonares de 5-15mm de diámetro, algunos calcificados (fig. 1). No se apreciaban adenopatías mediastínicas. Mediante una tomografía por emisión de positrones (PET-TC) se comprobó la ausencia de captación de 18FDG, lo que refleja un bajo nivel de metabolismo en las lesiones, poco sugestivo de malignidad.
TC torácica con ventana de pulmón (imágenes A-D) donde se observan quistes aéreos bilaterales y nódulos, algunos de ellos calcificados. Hallazgos histológicos de la biopsia pulmonar (imágenes E-I): E) tinción de hematoxilina-eosina, 2X mostrando áreas seudonodulares (flechas) con tejido con material amorfo; F) recuadro de la muestra E con mayor aumento (4X) donde se observa un tejido amorfo eosinofílico en la pared alveolar, cerca de las paredes de los vasos sanguíneos; G) la misma muestra con tinción de rojo Congo, 4X; H) muestra 2X teñida con rojo Congo donde se visualiza la proteína amiloide en la pared de los vasos sanguíneos (asteriscos) y en la pared alveolar (flecha); I) birrefringencia verde manzana bajo luz polarizada tras tinción con rojo Congo.
Se realizó una broncoscopia en la que no se objetivaron lesiones endobroquiales, con un lavado broncoalveolar con abundantes histiocitos con expresión de CD68. Los cultivos microbiológicos y la citología del lavado fueron negativos.
Ante los resultados obtenidos se programó a la paciente para una biopsia pulmonar por toracoscopia del lóbulo superior derecho. En la histología obtenida se observaron áreas seudonodulares con material eosinofílico amorfo y acelular, que se tiño de rojo con la tinción de rojo Congo y que producía una birrefringencia verde bajo luz polarizada. La paciente fue diagnosticada de amiloidosis pulmonar, con negatividad para amiloide AA, sugestiva de amiloidosis pulmonar primaria (fig. 1).
La paciente fue examinada para identificar una posible enfermedad hematológica o colagenopatía, pero no fue hallada ninguna enfermedad asociada. Por el momento, la paciente no ha requerido tratamiento y permanece estable tras 9 meses de seguimiento.
La amiloidosis comprende un conjunto de enfermedades caracterizadas por el depósito anormal de proteínas fibrilares en la matriz extracelular de varios órganos1. Se diferencian entre sí por el tipo de proteína precursora de la sustancia amiloide; la amiloidosis primaria (AL) es la forma más común (75% de casos), la amiloidosis secundaria (AA), asociada a otras enfermedades y la amiloidosis familiar o hereditaria. La secundaria es la que más comúnmente afecta a los pulmones2.
Existen varios tipos de amiloidosis pulmonar de acuerdo al lugar de depósito de material amiloide. La amiloidosis traqueobronquial es la forma más común, caracterizada por una infiltración de amiloide en la vía aérea causando obstrucción local o difusa de la misma. Menos frecuentes son la forma difusa alvéolo-septal, caracterizada por depósito de amiloide en el intersticio pulmonar, y la forma nodular en la que el amiloide forma nódulos pulmonares llamados amiloidomas. Otras formas de amiloidosis torácica menos frecuentes son la afectación adenopática, laríngea o diafragmática2,3.
La presentación de la amiloidosis pulmonar como quistes aéreos parenquimatosos asociados a nódulos es una rara entidad mixta relacionada con amiloidosis AL y tiende a originarse en mujeres en la sexta década de la vida con una enfermedad del colágeno subyacente4.
La clínica de la amiloidosis pulmonar es inespecífica. Cuando existen síntomas el más típico es la disnea con el ejercicio, seguido de tos, expectoración, hemoptisis y autoescucha de sibilancias5. En una serie de pacientes con amiloidosis pulmonar con quistes solo el 29% de los sujetos estaban asintomáticos al diagnóstico. Hasta un 72% de los pacientes presentaban disnea y un 14% hemoptisis6.
La función pulmonar en estos pacientes es variable. El patrón más común de función pulmonar es normal (42%), seguido de restricción (32%), mientras que solo un 11% de los pacientes tienen una disminución de la difusión del monóxido de carbono6. En ocasiones, la amiloidosis pulmonar localizada en forma de quistes pulmonares se asocia a enfermedades vasculares del tejido conectivo, como el síndrome de Sjögren o, menos frecuentemente, a linfoma MALT7.
La radiografía de tórax es normal en la mitad de los pacientes con amiloidosis quística pulmonar. En la TC torácica se observan múltiples quistes aéreos de pared fina, entre 0,5 y 2cm de diámetro, generalmente bilaterales y simétricos con predominio en las bases pulmonares8. Suelen asociarse a nódulos sólidos o subsólidos pulmonares frecuentemente calcificados8–11. El diagnóstico diferencial radiológico debe incluir la neumonía intersticial linfoide, la histiocitosis X, la linfangioleiomiomatosis, la enfermedad de depósito de cadenas ligeras y el síndrome de Birt-Hogg Dubé12.
El diagnóstico de la amiloidosis pulmonar requiere el examen histológico de las muestras de biopsia pulmonar13. El amiloide aparece en las muestras como un material fibroso amorfo eosinofílico con la tinción de hematoxilina-eosina, que se tiñe de rojo con la tinción de rojo Congo y que muestra una típica birrefringencia verde con el microscopio bajo luz polarizada. Es posible distinguir entre amiloidosis pulmonar primaria y secundaria porque el amiloide AA pierde la birrefringencia asociada a la tinción de rojo Congo después de la oxidación en una solución de permanganato, mientras que el amiloide AL lo retiene. Sin embargo, la tipificación de las amiloidosis se realiza actualmente mediante el estudio inmunohistoquímico, utilizando anticuerpos frente a las cadenas ligeras kappa y lambda de las inmunoglobulinas (amiloidosis AL), la proteína A (amiloidosis AA), la transtirretina y la beta2-inmunoglobulina13.
El tratamiento depende de la gravedad de la enfermedad y abarca desde la observación clínica hasta distintos procedimientos de broncoscopia terapéutica, que incluyen colocación de endoprótesis bronquiales o terapia ablativa con láser YAG (yttrium aluminium garnet), APC (argon plasma coagulation), electrocauterización de alta frecuencia o crioterapia CO2. También se ha aplicado radioterapia o resección quirúrgica14,15.
Como conclusión, este caso clínico ilustra un ejemplo de amiloidosis pulmonar primaria presentándose como enfermedad pulmonar quística asociada a nódulos pulmonares. Los hallazgos en las pruebas de imagen y la sintomatología de estos pacientes no son específicos, lo que hace importante considerar la amiloidosis en el diagnóstico diferencial de hemoptisis autolimitada, junto a infecciones pulmonares, bronquiectasias, vasculitis o neoplasias.