Introducción
Los objetivos fundamentales del clínico en el tratamiento de la enfermedad pulmonar obstructiva crónica (EPOC) son: impedir la progresión del proceso, mitigar su sintomatología, prevenir y tratar las complicaciones y agudizaciones, reducir la mortalidad y mejorar la capacidad de ejercicio y la calidad de vida relacionada con la salud del paciente1. La tarea desde luego no es sencilla pero afortunadamente disponemos ya de una estrategia basada en evidencias, con medidas farmacológicas y no farmacológicas aplicables de forma escalonada según la gravedad y la clínica del sujeto, y capaz de ayudar a la hora de tomar la mejor decisión terapéutica1-4.
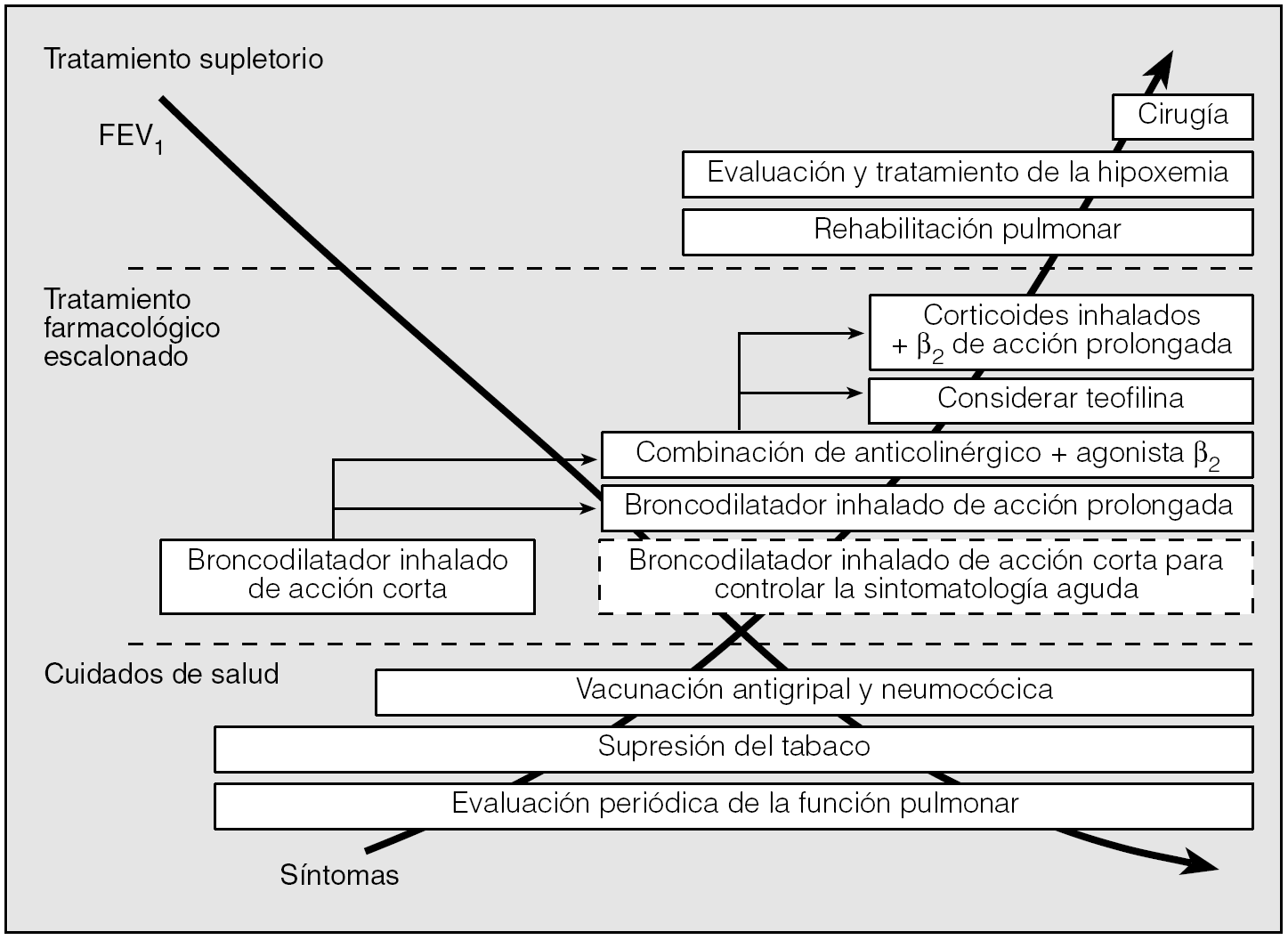
Dentro de ese esquema general, que va desde el abandono del hábito tabáquico hasta la cirugía (reducción de volumen y trasplante pulmonar) (fig. 1), los broncodilatadores representan hoy por hoy un elemento clave y las diversas normativas publicadas al respecto defienden bien a las claras tal afirmación1-3. Como señalábamos en una revisión reciente sobre el tema, los broncodilatadores, reviertan o no la obstrucción de "manera significativa" y atendiendo a los criterios más clásicos de cambio en el volumen espirado durante el primer segundo (FEV1), modifican la mecánica respiratoria de la EPOC al disminuir la capacidad pulmonar total y el volumen residual, incrementar la capacidad inspiratoria y reducir la hiperinsuflación pulmonar5. Esa conjunción de acciones justifica por qué este grupo de sustancias, con independencia de las variaciones en el FEV1, consiguen aliviar la disnea, aumentar la tolerancia al ejercicio y atenuar el impacto negativo que la EPOC tiene sobre el estado de salud6-11.
Fig. 1. Algoritmo general para el tratamiento de la EPOC en el que se incluyen cuidados generales de salud, medidas farmacológicas y tratamiento suplementario. (Modificada de Sutherland et al4.)
Uso de los broncodilatadores en el manejo de la EPOC. Puntos clave
Las normativas y los documentos actuales relativos a la EPOC mantienen una serie de afirmaciones comunes acerca de los broncodilatadores que cabe resumir en los siguientes puntos: a) los simpaticomiméticos β2 de acción corta, utilizados a demanda y con criterios similares a los del asma, son una buena opción a la hora de conseguir la reducción rápida de los síntomas; b) el tiotropio y los agonistas adrenérgicos β2 de acción prolongada (formoterol y salmeterol) representan la mejor alternativa como medicación broncodilatadora de mantenimiento; c) la teofilina es, de entrada, una opción de segunda línea, y d) cuando la sintomatología persiste, a pesar de la medicación de mantenimiento, la asociación de fármacos con mecanismos de acción distintos (p. ej., β2 de acción prolongada y antimuscarínicos tipo ipratropio) consigue aumentar el grado de broncodilatación y evita la aparición de afecciones secundarias que podrían aparecer si optamos por utilizar dosis mayores del broncodilatador inicial1-4,9.
Lo que las normativas dejan en el aire es cuál de las dos posibilidades de broncodilatador con acción prolongada (tiotropio o formoterol/salmeterol) resulta más eficiente a largo plazo para el tratamiento del paciente con EPOC. El asunto tiene su importancia y, por qué negarlo, también implicaciones económicas. El impacto de la EPOC en nuestra sociedad es muy importante y la industria farmacéutica, que financia la mayoría de los ensayos clínicos, sabe que ahí hay un enorme volumen de negocio para disputar. Nuestra obligación como médicos pasa por encontrar los aspectos relevantes de la discusión planteada, sopesar los pros y los contras, y actuar de manera independiente.
Medida de resultados en el tratamiento de la EPOC
Responder a la pregunta que acabamos de enunciar en el apartado anterior (formoterol/salmeterol frente a tiotropio) exige, de entrada, tener razonablemente acotado el terreno de comparación y definir qué variable o conjunto de variables de interés va a servir para formalizar la decisión final.
Como ha señalado Gross12, a diferencia de lo que ocurre con el asma, donde hay buenos marcadores del valor real aportado por las diferentes terapéuticas, en la EPOC todavía no hay un consenso comúnmente aceptado acerca de cuáles son los indicadores más relevantes. Para dicho autor, los resultados del tratamiento sujeto a estudio deben evaluarse considerando sus efectos sobre algunas de las siguientes dimensiones: la fisiológica, la funcional, la que el autor denomina "clínica-global", la biológica-estructural y una última clasificada como miscelánea, que incluye determinados aspectos, como el empleo de medicación de rescate, la actividad diaria o el abandono de tratamiento12. Las dimensiones fisiológica y funcional hacen referencia, respectivamente, al funcionalismo pulmonar y a la sintomatología respiratoria y la capacidad de ejercicio. La dimensión "clínica-global" incluye la calidad de vida y los hechos clínicos significativos (agudizaciones, ingresos hospitalarios o muerte), mientras que la biológica-estructural recoge, grosso modo, las alteraciones y lesiones del tejido pulmonar y el territorio extrapulmonar. En la tabla I se resumen las dimensiones apuntadas por Gross y algunas de las herramientas y parámetros de medición aplicables a ellas.
En sus comentarios, Gross no defiende que todas ellas hayan de formar parte necesariamente de la evaluación del resultado terapéutico, pero sí sugiere que cualquier tratamiento capaz de aportar beneficios en las primeras 3 dimensiones ha de ser considerado efectivo, aun cuando el mecanismo de acción no se comprenda bien. Por el contrario, si sólo consigue mejoras sobre una, el valor del tratamiento debe ser, al menos en parte, cuestionado. Finalmente, y según el tipo de estudio y la naturaleza de la intervención, una modificación positiva en los aspectos biológicos-estructurales corroboraría el efecto de la propia intervención12.
A nuestro entender, y para el problema que nos ocupa, todavía carecemos de la información suficiente para poder concluir, desde el marco de referencia propuesto por Gross antes comentado12, si el fármaco de primera elección aplicable en la EPOC es el simpaticomimético β2 de acción prolongada (formoterol/salmeterol) o el antimuscarínico tiotropio. Veamos en las líneas siguientes el estado de la cuestión.
Características generales de los simpaticomiméticos β2 de acción prolongada y el antimuscarínico tiotropio
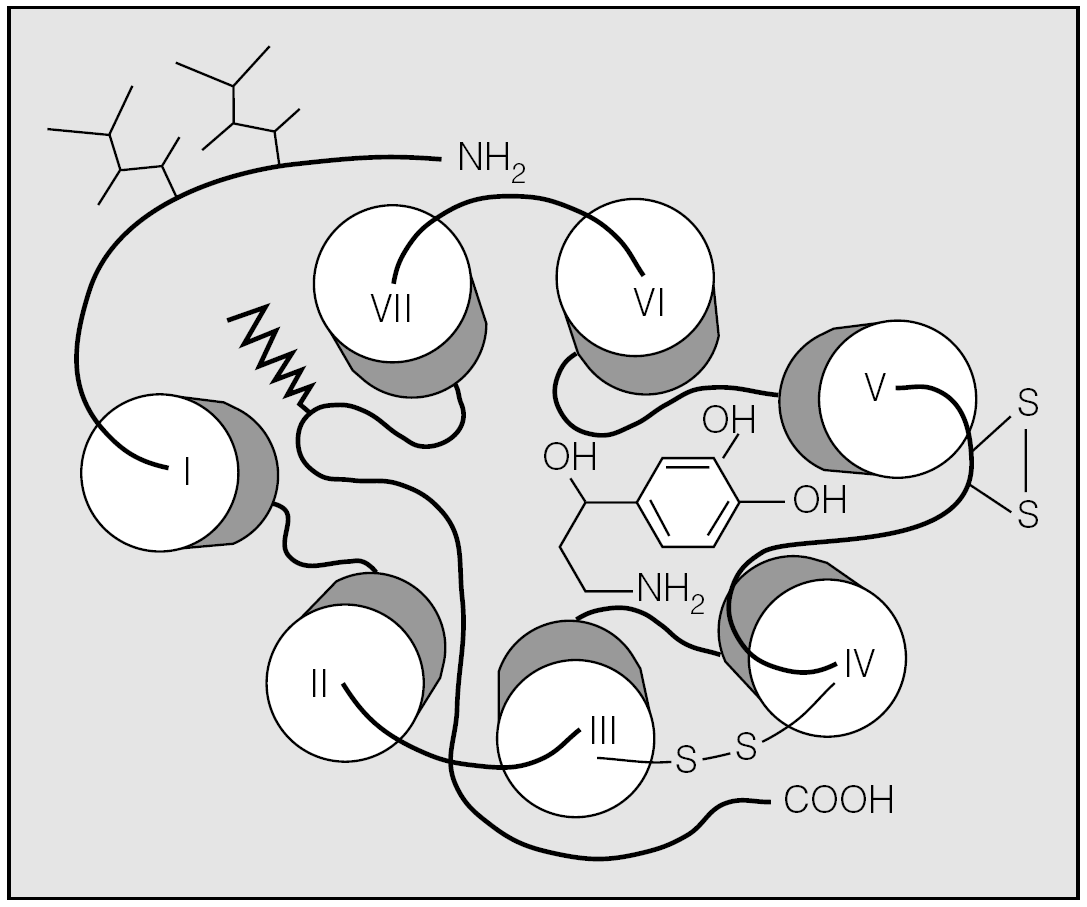
Las peculiaridades esenciales de los agonistas adrenérgicos β2 de larga duración (salmeterol y formoterol) y del antimuscarínico de acción prolongada tiotropio son bien conocidas y han sido motivo de excelentes actualizaciones13-18. A modo de resumen, recordaremos que salmeterol y formoterol ejercen su acción broncodilatadora al unirse, en la membrana celular del músculo liso de la vía aérea, al receptor adrenérgico β2, una estructura heptahelicoidal formada por 413 aminoácidos, que forma parte de una superfamilia de receptores conocida como receptores acoplados a proteína G (GPCR)19,20. Esta superfamilia, presente en las especies eucariotas, se activa por una gran variedad de estímulos (aminoácidos, iones, hormonas, luz, factores de crecimiento, neurotransmisores peptídicos y no peptídicos, etc.) y controla la transducción de señales de una enorme cantidad de procesos (liberación de neurotransmisores y hormonas, cambios transmembrana del flujo de iones, activación o represión de la expresión génica, proliferación, diferenciación y muerte celular, etc.)21. Atendiendo a las similitudes en la secuencia de los aminoácidos que los constituyen y a la naturaleza particular de sus ligandos, los GPCR se suelen clasificar en 3 grandes grupos22: a) clase 1, o receptores rodopsina-like, activados por aminas biógenas, quimiocinas, prostanoides y neuropéptidos; b) clase 2, o receptores secretina-like, cuyos ligandos incluyen sustancias como la secretina, la hormona paratiroidea, la calcitonina, el péptido relacionado con el gen de la calcitonina o el glucagón, y c) clase 3, que son los que guardan homologías con los receptores GABA. El receptor adrenérgico β2 pertenece a los GPCR de clase 2 y la unión con el agonista tiene lugar en un hueco delimitado por las regiones transmembrana III a VI, donde dos residuos serina de la hélice V interactúan con los grupos hidroxilo 3 y 4 del anillo bencénico del agonista, y un residuo aspartato de la hélice III se combina con el grupo aminoterminal de aquél19 (fig. 2).
Fig. 2. Representación axial de un receptor adrenérgico β2 que muestra sus 7 regiones transmembrana y el lugar de unión crítico para con el agonista (véase texto).
Por tanto, salmeterol y formoterol son dos agonistas β2 altamente selectivos, cuya capacidad broncodilatadora persiste durante unas 12 h tras su administración inhalada, pero con estructuras diferentes19,23. El salmeterol, desarrollado a partir de diversas modificaciones introducidas en el agonista adrenérgico β2 de acción corta salbutamol, es una molécula de unos 25 Å de longitud constituida por una cabeza de saligenina, acoplada a una larga cadena alifática lateral (17 Å) responsable de aumentar la lipofilia de la sustancia (unas 10.000 veces mayor que la del salbutamol)19. Esa cadena lateral interactúa con un grupo de aminoácidos muy hidrofóbicos ubicados en el cuarto dominio del receptor β2 e impide su disociación de este grupo, de manera que la cabeza activa de saligenina puede estimular repetidamente el lugar activo del adrenoceptor. De este modo, se prolonga el efecto de la sustancia aunque el comienzo de la acción aparece algo más tarde (10-20 min) de lo que ocurre con los simpaticomiméticos β2 convencionales13,19,23.
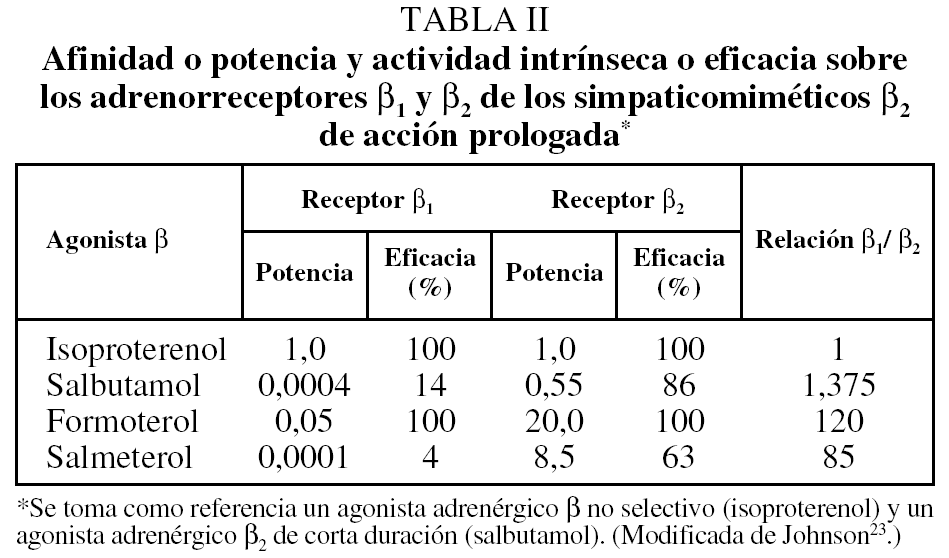
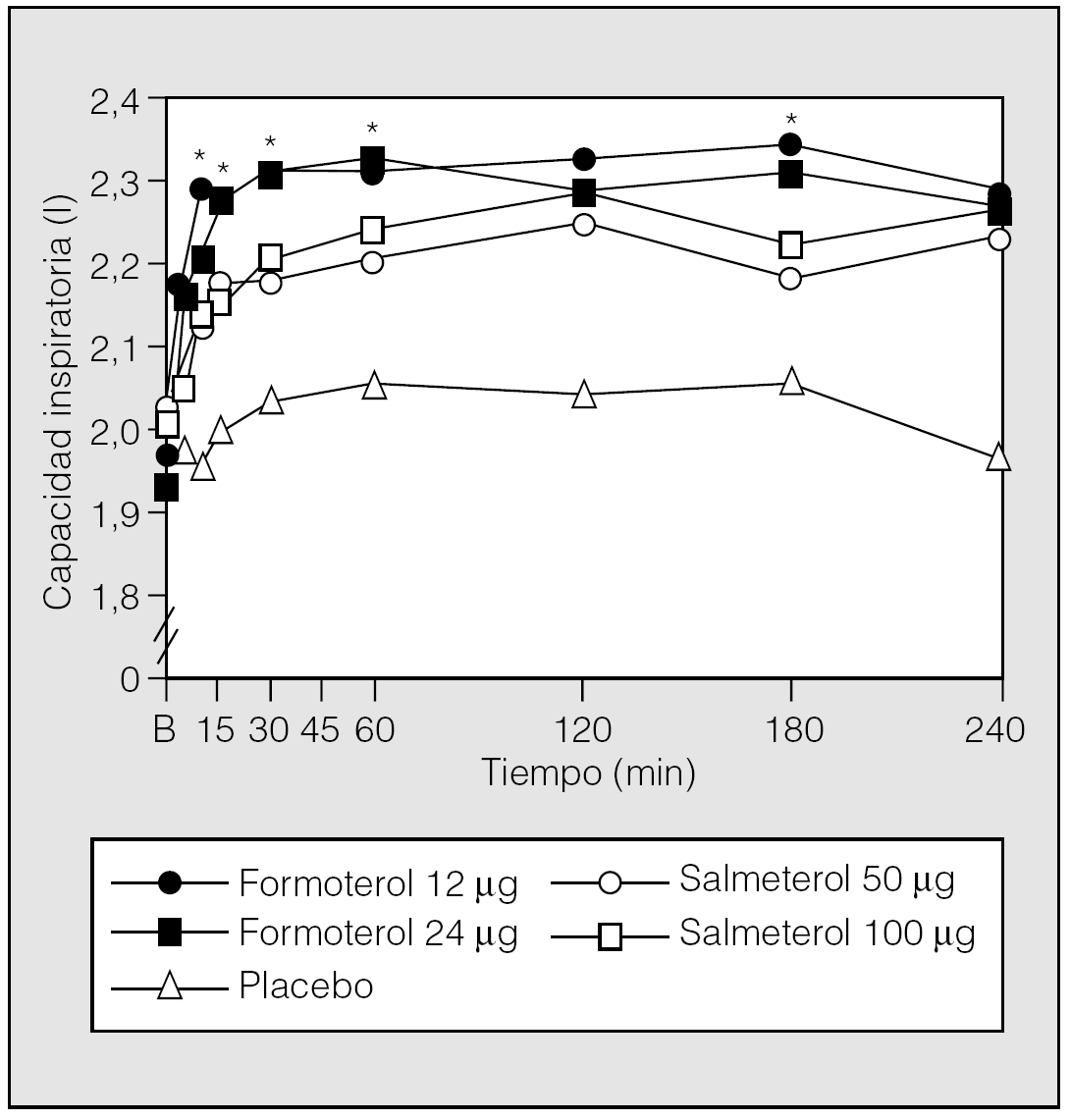
El formoterol, en cambio, tiene una cadena lateral más corta y posee una lipofilia intermedia entre salbutamol y salmeterol. La menor lipofilia permite que el formoterol entre en el plasmalema y quede allí retenido formando un depósito, desde el cual difunde lentamente para activar al receptor β2 durante un espacio de tiempo continuado. La cantidad de fármaco disponible en la biofase acuosa es suficiente para ligarse con el sitio activo del receptor, por lo que la acción comienza además de forma casi inmediata. Las diferencias farmacodinámicas entre salmeterol y formoterol quedan recogidas en la tabla II. El primero es un agonista parcial y el segundo un agonista completo13,19,23,24. La figura 3 ilustra los cambios experimentados en la capacidad inspiratoria tras la administración de formoterol (12 o 24 μg), salmeterol (50 o 100 μg) y placebo a un grupo de pacientes con EPOC y poca reversibilidad del FEV1.
Fig. 3. Cambios promedio en la capacidad inspiratoria en el transcurso del tiempo (0 a 4 h) de los pacientes con EPOC que presentan un test broncodilatador negativo, tras la inhalación de formoterol, salmeterol y placebo. *p < 0,05 formoterol 12 μg frente a salmeterol 50 μg. B: valores basales. (Modificada de Bouros et al25.)
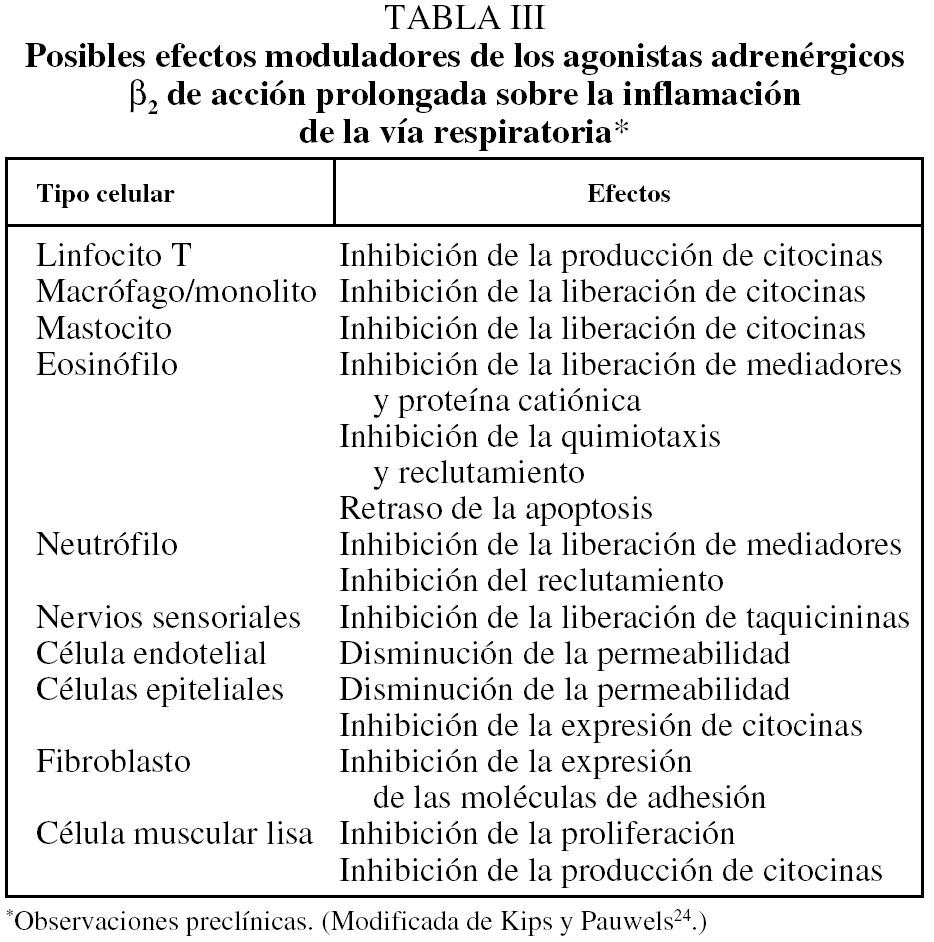
Junto a todo ello, salmeterol y formoterol, al menos in vitro, están dotados también de una cierta actividad antiinflamatoria (tabla III) capaz de contribuir, al menos sobre el papel, al control de las enfermedades inflamatorias de la vía aérea, como el asma o la EPOC24,26.
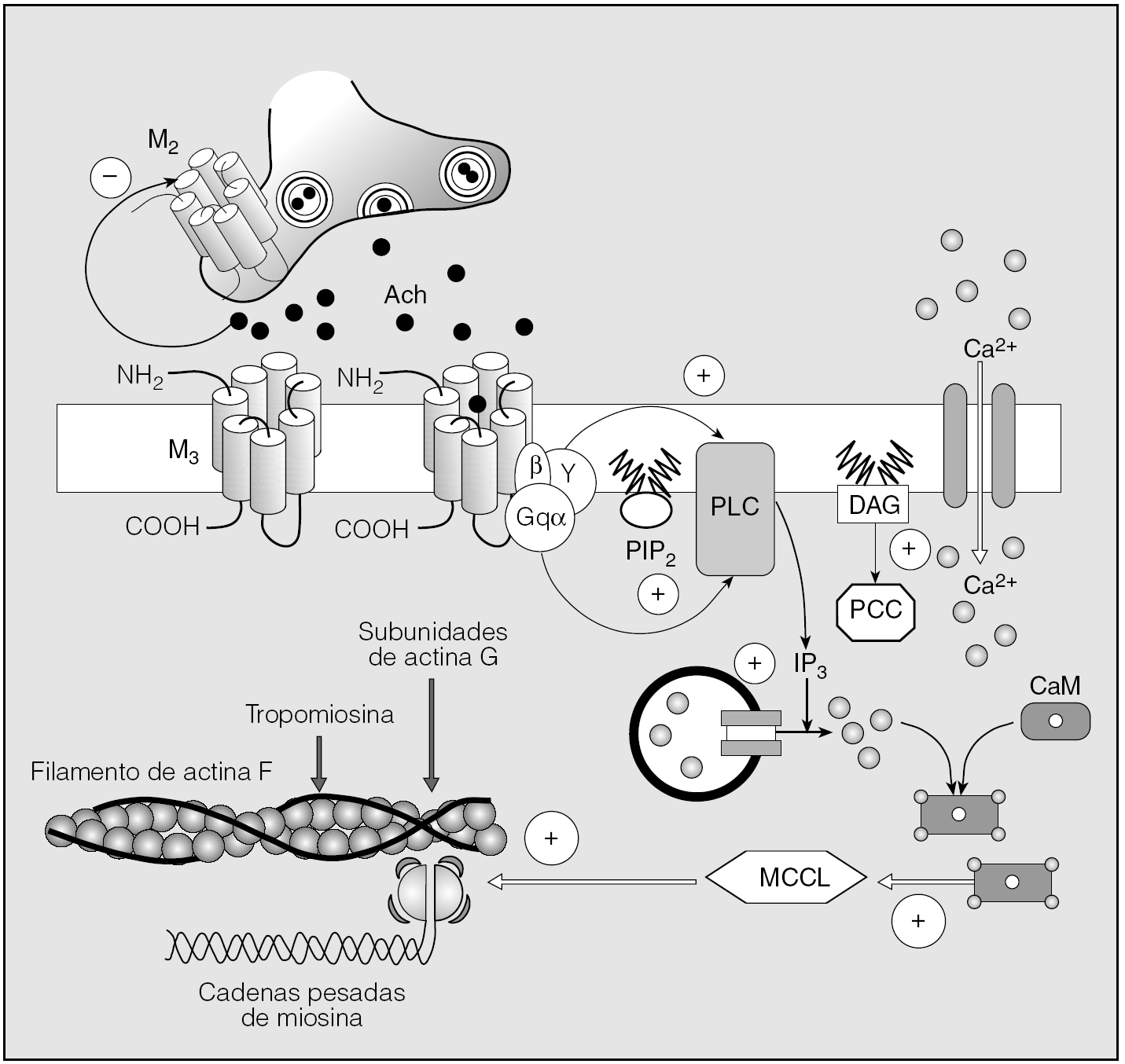
Por su parte, el tiotropio bloquea los receptores muscarínicos M1, M2 y M3. Los receptores muscarínicos pertenecen también a la superfamilia de receptores GPCR y se encuentran ampliamente distribuidos en el organismo (neuronas del sistema nervioso central y periférico, corazón, musculatura lisa y glándulas exocrinas). Hay descritos hasta 5 subtipos (M1-M5), que se agrupan en 2 categorías según sea la señal de transducción una vez estimulados por la acetilcolina. La estimulación de los M2 y M4 inhibe la actividad de la adenilciclasa y activa débilmente el ciclo de los fosfoinosítidos de membrana. La estimulación de los M1, M3 y M5 induce la hidrólisis de estos fosfoinosítidos27-29. En el control del calibre de la vía respiratoria, los M1 (localizados en los ganglios parasimpáticos), M2 (presentes en las terminaciones nerviosas colinérgicas) y M3 (ubicados sobre las glándulas y el músculo liso de la vía aérea) son los que desempeñan un papel capital30,31. En la figura 4 se describen los mecanismos celulares a través de los cuales los M2 y M3 modifican el tono de la célula muscular en el tracto respiratorio.
Fig. 4. Consecuencias sobre el músculo liso de la vía aérea de la activación de los receptores muscarínicos M2 y M3. La acetilcolina (Ach) liberada desde los nervios parasimpáticos posganglionares se une al receptor M3 presente en el músculo liso del árbol bronquial. El M3 activado experimenta cambios conformacionales que promueven su asociación y la activación subsiguiente de la proteína α de la subunidad Gq. La proteína α, a su vez, activa la fosfolipasa C unida a la membrana (PLC) que hidroliza al fosfoinositol 4,5-bifosfato (PIP2) en 1,2-diacilglicerol (DAG) e inositol 1,4,5-trifosfato (IP3). IP3 facilita la liberación de Ca2+ a partir de compartimientos intracelulares especializados. Asimismo, tiene lugar una entrada de Ca2+ desde el espacio extracelular a través de canales dependientes de voltaje, regulada por la propia activación del receptor M3. Por su parte, DAG promueve la activación de isoformas de la proteína cinasa C (PCC) que fosforilizan numerosas enzimas intracelulares. El aumento del Ca2+ libre intracitoplásmico induce la formación de complejos Ca2+-calmodulina (CaM) capaces de activar la miosina cinasa de cadenas ligeras (MCCL) y la subsiguiente fosforilización de las cadenas ligeras de miosina permite la activación de la miosin-ATPasa, la formación de puentes cruzados y la generación de fuerza. Al mismo tiempo, la Ach estimula los receptores muscarínicos presimpáticos M2 que limitan y autorregulan la liberación de más neurotransmisores.
El tiotropio, en comparación con los antimuscarínicos clásicos que tienen una significativa menor potencia, se disocia de los M1 y M3 más lentamente y presenta una capacidad de disociación de los M2 muy superior17,18. La vida media del complejo fármaco-receptor para el tiotropio y el M3 es de 35 h, mientras que para el ipratropio es de tan sólo 0,3 h16. Estas particularidades cinéticas posibilitan que el tiotropio mantenga la broncodilatación durante 24 h y permite obviar los efectos no deseados que conlleva un bloqueo prolongado de los receptores M217,18.
Simpaticomiméticos β2 de acción prolongada o tiotropio. ¿Cuál es la mejor elección?
Un buen número de estudios, como ya hemos avanzado anteriormente, han demostrado que formoterol/salmeterol son superiores a ipratropio para el tratamiento de la EPOC estable32-34, y que la combinación β2 de acción prolongada más ipratropio es una excelente opción cuando la monoterapia broncodilatora resulta insuficiente35. Incluso hay ensayos clínicos que indican que salmeterol o formoterol pueden ser eficaces en el tratamiento de las exacerbaciones agudas de la enfermedad, tanto si se administran a dosis acumuladas36-38 como si se emplean (caso del formoterol) en dosis elevada única39.
La introducción del tiotropio ha abierto, sin duda, nuevas perspectivas terapéuticas, sobre todo porque la idea general es que en la EPOC los anticolinérgicos son igual de efectivos o más que los agonistas adrenérgicos β2 tradicionales40. Tashkin y Cooper41 han analizado recientemente el tema, tomando como base la información procedente de 14 trabajos recogidos en la bibliografía especializada, y en la tabla IV se recoge la comparación establecida entre los efectos producidos por salmeterol, formoterol y tiotropio en los pacientes con EPOC, de acuerdo con lo apuntado en dicha revisión. A la vista de estos datos, la opinión de estos autores es muy clara: aunque los 3 fármacos mejoran la función pulmonar, sólo el antimuscarínico tiotropio ofrece una superioridad mayor que placebo e ipratropio en el resto de las variables consideradas (sintomatología, reducción de número de agudizaciones, calidad de vida relacionada con la salud y tolerancia al ejercicio)41. Los resultados respecto al salmeterol fueron particularmente pobres, lo cual coincide con lo descrito por 2 metaanálisis también publicados42,43, aunque uno de ellos señala explícitamente lo siguiente: "few of the results could be combined in meta-analyses because of differences in methods of reporting data"42.
De todos modos, el editorial firmado por Cazzola y Matera44, que acompaña a la publicación de Tashkin y Cooper, acota algunas reflexiones de lectura obligada. Su discurso final, y nosotros lo compartimos, es que a fecha de hoy parece prematuro establecer, como verdad completamente comprobada, la supremacía sobre los demás de cualquiera de los broncodilatadores de acción prolongada disponibles. Y el argumento es doble. En primer lugar, porque para poder alcanzar conclusiones sólidas, todavía necesitamos estudios adicionales, de diseño comparable y períodos de seguimiento largos, que incluyan en los análisis correspondientes variables superponibles y agrupen un volumen de enfermos suficiente. En segundo lugar, y más importante, porque el debate actual no estriba tanto en cuál es el broncodilatador "mejor", sino con qué combinación de ellos podemos alcanzar un control adecuado de la enfermedad, e incluso influir en su evolución.
Una posibilidad que cabría considerar es la administración de tiotropio más un β2 de acción prolongada, dado que el empleo conjunto de fármacos con mecanismos de acción distintos y complementarios parece siempre una opción lógica45. El mismo grupo de Cazzola et al46 ha comunicado su experiencia al respecto, demostrando que tiotropio más salmeterol es más eficaz que cualquiera de las 2 sustancias por separado a la hora de incrementar el FEV1 en pacientes con EPOC estable. De ser así, y confirmarse además la bondad de los resultados sobre otras variables, el reto estaría en desarrollar un inhalador combinado que pudiera utilizarse en una sola toma al día.
En cualquier caso, y a la espera de la solución definitiva, no estará de más recordar que la personalización del tratamiento hasta donde sea posible continúa siendo una realidad incuestionable. Para las enfermedades crónicas, complejas y sin curación (la EPOC reúne los 3 calificativos), el medicamento eficaz para todos los pacientes y todas las circunstancias es casi una entelequia. Quizá haya que admitir por fin que sólo los avances en la farmacogenómica y en el conocimiento de los cambios estructurales y funcionales que experimenta la vía aérea y su músculo liso durante la historia natural de la EPOC, permitirán elegir el mejor broncodilatador de manera individual según las características de cada sujeto.
Correspondencia: Dr. M. Perpiñá Tordera.
Servicio de Neumología. Hospital Universitario La Fe.
Avda. Campanar, 21. 46009 Valencia. España.
Correo electrónico: perpinya_mig@gva.es