Se ha señalado que la ciclooxigenasa-2 (COX-2) ejerce una función protectora en pacientes con asma mediante la producción de la prostaglandina E2. Con el objetivo de reproducir dicho efecto en un modelo experimental y dilucidar los mecanismos implicados, hemos evaluado, en un modelo de asma alérgica en el ratón, el efecto de la inhibición de la COX-2 en la respuesta de las vías aéreas expuestas a ovalbúmina y en la actividad de los mastocitos.
Material y métodosSe sensibilizaron ratones a la ovalbúmina (10 μg, vía intraperitoneal) y se reexpusieron a ovalbúmina al 0,5% por vía intranasal. La mitad de los animales sensibilizados recibió tratamiento con rofecoxib (15mg/kg al día, por vía oral, durante la fase de reexposición). Se evaluó la función pulmonar mediante pletismografía corporal antes y después de la reexposición a ovalbúmina, y se estableció el grado de inflamación broncovascular. También se midió la concentración sérica de la proteasa-1 de los mastocitos de ratón.
ResultadosLos ratones sensibilizados y tratados con rofecoxib mostraron una hiperreactividad bronquial 2,4 veces mayor que los del grupo control a una concentración de 100mg/ml de metacolina. Asimismo, se apreció una clara tendencia hacia el empeoramiento del proceso inflamatorio en presencia de rofecoxib, aunque sin significación estadística. Estos cambios se acompañaron de un aumento significativo de la actividad de los mastocitos de la mucosa.
ConclusionesLa inhibición farmacológica de la COX-2 durante la reexposición a ovalbúmina agrava la función pulmonar, un fenómeno que consideramos se debe, al menos en parte, al incremento de la actividad de los mastocitos de las vías aéreas.
Cyclooxygenase (COX)-2 activity has been said to have a protective effect in asthmatic patients as a result of prostaglandin E2 production. In order to elucidate the mechanisms involved, we evaluated the impact of selective inhibition of COX-2 with rofecoxib during ovalbumin challenge, assessing mast cell activity and airway response in a murine model of asthma.
Material and methodsMice were sensitized to ovalbumin (10μg injected intraperitoneally) and further challenged with 0.5% intranasal ovalbumin. Half the sensitized animals were treated orally with rofecoxib (15mg/kg/d during the challenge phase). Lung function was measured by whole body plethysmography before and after exposure to ovalbumin. The severity of airway inflammation was evaluated by means of a scoring system. Finally, the serum level of mouse mast cell protease-1 was determined as an indicator of mucosal mast cell activity.
ResultsSensitized mice treated with rofecoxib exhibited 2.4-fold greater airway hyperresponsiveness than did vehicle-treated mice at a methacholine concentration of 100mg/ml. A clear trend toward worsening airway inflammation in the presence of rofecoxib was observed, although the difference between rofecoxib-treated and vehicle-treated animals was not significant. These changes were accompanied by a significant increase in mucosal mast cell activity.
ConclusionsSelective pharmacological inhibition of COX-2 during the challenge phase worsens airway function in the ovalbumin -induced murine model of acute asthma. We suggest that this effect might be at least partially explained by the increase in airway mast cell activity.
Se considera que las prostaglandinas son potentes mediadores proinflamatorios, y se sabe que la prostaglandina E2 (PGE2) induce edema e hiperalgesia durante los ataques inflamatorios1,2. Las prostaglandinas son producto del metabolismo del ácido araquidónico por parte de la ciclooxigenasa (COX), que posee al menos 2 isoformas: la COX-1 y la COX-2. Aunque la COX-1 se expresa de forma constitutiva, la COX-2 está inducida por estímulos proinflamatorios y, por lo tanto, es fundamental en la respuesta inflamatoria. Se ha propuesto la administración de antiinflamatorios no esteroideos (AINE) que inhiben la COX-2 de modo no selectivo para tratar las enfermedades inflamatorias3, especialmente en pacientes con intolerancia a los AINE4,5.
En el asma, la actividad de la COX-2 se ha asociado al desarrollo de hiperreactividad de las vías respiratorias debido a su capacidad para producir prostaglandina D2, un agente broncoconstrictor del músculo liso del aparato respiratorio6. Sin embargo, hay evidencia de que prostaglandinas como la PGE2 y, por lo tanto, posiblemente la COX-2, pueden ejercer efectos protectores sobre el asma. Por ejemplo, la inhalación de PGE2 atenúa e incluso elimina por completo el broncoespasmo inducido por alérgenos, el ejercicio y ciertos AINE en pacientes con asma7–9. Por consiguiente, el período refractario que normalmente sigue a un episodio inicial de broncoespasmo inducido por el ejercicio parece acortarse con la administración de un inhibidor de la COX10,11. En consonancia con estas observaciones in vivo, células procedentes de las vías respiratorias de pacientes con asma inducida por la aspirina han mostrado poseer una capacidad reducida para producir COX-2 o PGE2 in vitro12–17. Además, en animales con bloqueo genético o farmacológico de la COX-1 y/o de la COX-2 se ha observado que la reacción respiratoria tras la exposición a alérgenos es más intensa que la observada en animales de control18–22.
Aunque estas observaciones avalan que los productos de la COX-2 ejercen una acción protectora frente a la inflamación y el broncoespasmo, estamos lejos de comprender los mecanismos implicados. Los mastocitos de las vías respiratorias, que se sabe están implicados en el desarrollo del asma23, presentan receptores de PGE2 en su superficie, donde algunos han demostrado reducir la actividad de los mastocitos in vitro tras su activación24,25. Puesto que los mastocitos producen una amplia gama de mediadores proinflamatorios y broncotrópicos23, el posible efecto protector de la COX-2 en la respuesta asmática in vivo puede estar mediado por un efecto restrictivo de la PGE2 en estas células. En consecuencia, el empeoramiento observado en la inflamación de las vías respiratorias de modelos murinos con deficiencia de COX19 podría explicarse por una mayor actividad de los mastocitos.
Para evaluar con mayor profundidad el papel que desempeña la COX-2 en la reactividad de vías respiratorias sensibilizadas y la relevancia de los mastocitos en el proceso, inhibimos la COX-2 por medio del fármaco selectivo rofecoxib en ratones sensibilizados a la ovalbúmina. El fármaco se administró sólo durante la fase de exposición a la ovalbúmina, y se valoró su efecto sobre la función de las vías respiratorias, la inflamación y la actividad de los mastocitos de la mucosa.
Material y métodosModelo de ratones sensibilizados a ovalbúminaLos estudios en animales se realizaron con la aprobación del Comité de Ética de la Universitat Autònoma de Barcelona. Mediante una modificación del protocolo de Kobayashi et al26, que está bien establecido, se expuso a ovalbúmina (Sigma, Madrid, España) a ratones hembra Balb/c de edad adulta (6–8 semanas). Brevemente, se indujo una sensibilización inicial a la ovalbúmina mediante la administración de 2 inyecciones intraperitoneales de 10μg de ovalbúmina adsorbida en 1mg de hidróxido de aluminio (Pierce, Rockford, Illinois, EE.UU.) en los días 0 (primer día del estudio) y 5, seguidas de varias exposiciones adicionales de 20min con aerosol nebulizador, que contenía una solución de 5mg/ml (0,5%) de ovalbúmina y que se administró en los días 12; 15; 18; 21, y 22.
Bloqueo selectivo de la ciclooxigenasa-2Se distribuyeron los ratones en 2 grupos experimentales: uno formado por ratones sensibilizados a la ovalbúmina y tratados sólo con placebo (grupo control; n=8), y otro constituido por ratones sensibilizados a ovalbúmina y tratados con rofecoxib, un inhibidor selectivo de la COX-2 (n=7). Los animales de ambos grupos se manipularon de forma idéntica, con excepción del tratamiento recibido, que fue rofecoxib (Vioxx, MSD, Madrid, España) o placebo (15g de sorbitol en 5ml de solución salina). El rofecoxib se administró por sonda oral para asegurar la administración de una dosis completa de 15mg/kg en todos los ratones tratados. Se administró el fármaco durante 14 días consecutivos, habiéndose iniciado el tratamiento un día antes de la primera exposición a ovalbúmina (es decir, el día 11); después de dicho período se sacrificaron los animales. Por consiguiente, los ratones tratados recibieron rofecoxib durante todo el proceso de exposición al alérgeno, pero no durante la fase inicial de sensibilización. Los ratones estuvieron bajo observación diaria a fin de detectar posibles efectos adversos al fármaco, y para ello se siguió un protocolo de supervisión que incluía la valoración del aspecto del pelaje, la postura corporal, la presencia de secreciones, el comportamiento y una respiración anormal.
Evaluación de la función de las vías respiratoriasPara evaluar la función de las vías respiratorias de los ratones de ambos grupos se les realizó una pletismografía de cuerpo entero no invasiva (WBP, Buxco, Winchester, Reino Unido). Esto permitió valorar la reactividad de las vías respiratorias a la metacolina 2 veces en el mismo animal: antes y después de la exposición a la ovalbúmina. La función de las vías respiratorias medida antes de la sensibilización (es decir, el día 2 del estudio) se tomó como referencia de la reactividad bronquial. También se evaluó la reactividad de las vías respiratorias en los ratones sensibilizados a la ovalbúmina el día 23, al cabo de 24h de la última exposición a la ovalbúmina. Para ello se colocaron los ratones de ambos grupos, conscientes, en las cámaras de pletismografía con flujo de aire controlado y se les expuso a una solución salina tamponada con fosfato mediante nebulización, seguida de dosis crecientes de metacolina nebulizada (3; 10; 30, y 100mg/ml). La reacción de las vías respiratorias a la metacolina se promedió a partir de lecturas realizadas durante un registro de 5min y se expresó como valores Penh, un indicador adimensional de la hiperreactividad de las vías respiratorias27,28. También se calculó la concentración de metacolina que producía el 200% de la respuesta basal (EC200) y se comparó entre amobs grupos.
Evaluación de la inflamación de las vías respiratoriasPara valorar la inflamación subyacente se realizó un análisis histológico de los pulmones tanto de los ratones sensibilizados a la ovalbúmina como de aquéllos sin sensibilizar. Para la evaluación histológica, el día 24 se sacrificaron ratones expuestos a ovalbúmina, tanto del grupo tratado con rofecoxib como del tratado con placebo, y 3 animales sin sensibilizar que se utilizaron como controles. Se extirpó el pulmón izquierdo, se realizó una perfusión de las vías respiratorias para eliminar cualquier obstrucción y se sumergió el tejido en formaldehído al 10% para su procesamiento histológico. El tejido se impregnó en parafina y se obtuvieron 6 secciones (4μm) de 3 zonas pulmonares distintas por cada animal. Las secciones se tiñeron con hematoxilina y eosina con objeto de valorar la inflamación, para lo cual se utilizó un sistema de puntuación que tenía en cuenta tanto el número de acumulaciones focales de células inflamatorias alrededor de las estructuras broncovasculares como su tamaño. Dos investigadores experimentados, que desconocían la asignación de grupos, realizaron un recuento de las acumulaciones focales, definidas como sitios donde las células inflamatorias se agrupaban alrededor de un bronquio y/o de un vaso. Brevemente, para el proceso se seleccionaron de forma aleatoria 4 estructuras broncovasculares por sección, se contaron las acumulaciones de células inflamatorias por estructura y se asignó una puntuación (0 para una acumulación; 1 para 2–3 acumulaciones; 3 para 4–5 acumulaciones, y 5 para 6 o más acumulaciones). Para determinar el tamaño de las acumulaciones focales, se contaron las capas celulares dentro de las acumulaciones más grandes alrededor de cada estructura y se aplicó un sistema similar de puntuación (1 para 1–4 capas; 3 para 5–9 capas; 5 para 10–16 capas, y 7 para 17 o más capas). La gravedad de la inflamación se expresó como la suma de las 2 puntuaciones.
Evaluación de la actividad de los mastocitosLos mastocitos de mucosa son la población celular más predominante en las vías respiratorias29. Su actividad puede evaluarse determinando la concentración del mediador específico de los mastocitos de mucosa, esto es, la proteasa-1 de los mastocitos de ratón (mMCP-1). El día 24, se exsanguinaron ratones sensibilizados de ambos grupos y se congelaron los sueros a −20°C hasta el momento del análisis. Se midió la concentración sérica de la mMCP-1 mediante una técnica de análisis inmunoenzimático específico (ELISA), siguiendo las instrucciones del fabricante (MS-RM3, Moredun Cientific Ltd., Penicuik, Escocia, Reino Unido).
Análisis estadísticoLa reactividad de las vías respiratorias a la metacolina se expresó como el incremento del valor Penh tras la exposición a la metacolina frente a la solución salina tamponada con fosfato. Se realizaron 2 comparaciones estadísticas: a) el incremento Penh antes de la sensibilización a la ovalbúmina se comparó en los mismos animales con su aumento tras la exposición mediante la prueba de la t de Student para muestras apareadas, y b) el aumento del valor Penh en los ratones sensibilizados tratados con rofecoxib se comparó con el de los ratones sensibilizados sin tratar mediante la prueba de la t de Student para muestras no apareadas. Por último, la intensidad de la inflamación y las concentraciones de mMCP-1 se compararon también entre grupos con la prueba de la t de Student no apareada. En todos los casos la significación estadística se estableció en valores de alfa de 0,05.
ResultadosTras la administración oral de rofecoxib no se observaron diferencias clínicas, conductuales, posturales ni fenotípicas entre los ratones tratados y aquéllos sin tratar.
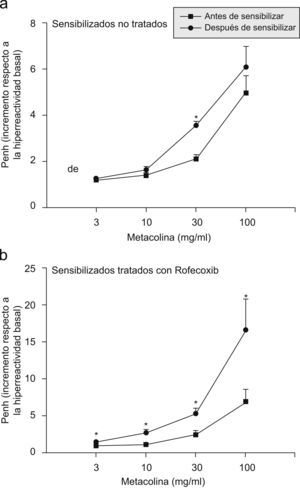
Función respiratoriaLa respuesta de las vías respiratorias a la metacolina antes y después de la sensibilización a la ovalbúmina, tanto en los ratones tratados con rofecoxib como en aquéllos sin tratar, se muestra en la figura 1. La respuesta bronquial al aumento de las concentraciones de metacolina antes de la sensibilización a la ovalbúmina fue similar en ambos grupos. Como se observa en la figura 1, el valor Penh aumentó con la exposición a la ovalbúmina tanto en los ratones tratados con rofecoxib como en los que no recibieron tratamiento. Sin embargo, la hiperreactividad de las vías respiratorias, según mostró el aumento de Penh en la curva de dosis-respuesta a la metacolina, fue significativamente mayor en los ratones tratados con rofecoxib y sensibilizados a la ovalbúmina. Estos datos se confirmaron mediante las comparaciones de la EC200: la diferencia entre la EC200 media (±error estándar de la media) de los ratones sensibilizados a la ovalbúmina sin tratar (7,62±0,5mg/ml) y la EC200 media de los tratados con rofecoxib (3,34±0,62mg/ml) fue estadísticamente significativa (p<0,0005).
Respuesta bronquial a un aumento de la concentración de metacolina en ratones sin tratar (a) y ratones tratados con rofecoxib (b), antes (cuadrados) y después (círculos) de la sensibilización de las vías respiratorias con ovalbúmina. La reacción a la metacolina antes de la sensibilización a la ovalbúmina fue similar en ambos grupos (cuadrados en ambos gráficos). La hiperreactividad de las vías respiratorias de los ratones sensibilizados sin tratar alcanzó un aumento de Penh medio (±error estándar) de 6,94±1,80 a una dosis de metacolina de 100mg/ml; este valor estaba significativamente por debajo del aumento de Penh obtenido en los ratones sensibilizados y tratados con rofecoxib a la misma concentración de metacolina, que fue de 16,86±4,04. Nótese que las escalas en las coordenadas y de ambos gráficos son distintas debido a que el orden de magnitud de las respuestas de las vías respiratorias a la metacolina en los 2 grupos fue diferente.
Los datos representados son medias, y las barras de error corresponden al error estándar de la media. La significación estadística se estableció en valores de p<0,05 (prueba de la t de Student para datos apareados en que se comparaba el valor de Penh antes y después de la sensibilización a la ovalbúmina).
PBS: solución salina tamponada con fosfato.
*Valores significativos.
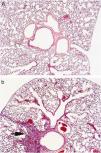
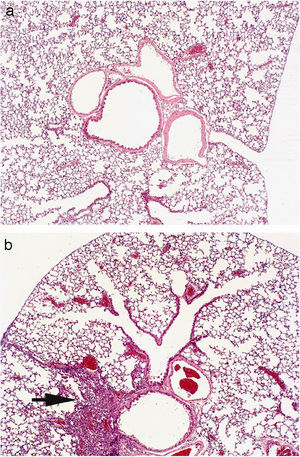
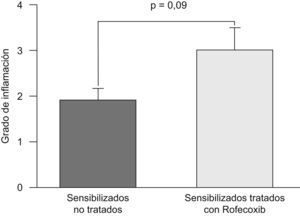
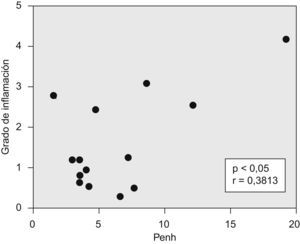
La puntuación fue reproducible con una concordancia elevada entre observadores (r2=0,99; p<0,001). Todos los ratones sensibilizados a la ovalbúmina, tanto los tratados con rofecoxib como aquéllos sin tratar, desarrollaron una respuesta inflamatoria, mientras que los animales no sensibilizados que se utilizaron como controles en la evaluación histológica no manifestaron signos de inflamación (fig. 2). Los eosinófilos y las células mononucleares eran predominantes en las zonas perivascular y peribronquial de los pulmones inflamados. La inflamación se manifestó por lo general como acumulaciones focales de células inflamatorias alrededor de las estructuras broncovasculares, pero ocasionalmente también se observaron células diseminadas. En la figura 3 se ilustra el grado de inflamación de los ratones sensibilizados a la ovalbúmina sin tratar y los tratados con rofecoxib, cuantificada según el sistema de puntuación descrito anteriormente. Se observó una tendencia (p=0,09) hacia puntuaciones más elevadas en los animales tratados con rofecoxib; sin embargo, la diferencia entre los ratones tratados y sin tratar no fue significativa. Un resultado análogo se obtuvo en el recuento de eosinófilos por milímetro cuadrado (área de la sección histológica): se observó una media de 6,22±2,0células/mm2 en los animales tratados con placebo y de 10,69±3,47células/mm2 en los tratados con rofecoxib (p=0,2). Por último, se observó una correlación significativa entre la respuesta de las vías respiratorias a 100mg/ml de metacolina y el grado de inflamación en los ratones sensibilizados (fig. 4) (r2=0,38; p=0,019).
Microfotografías de las vías respiratorias bajas de los ratones no sensibilizados (a) y sensibilizados sin tratar (b). Los animales sin sensibilizar no mostraron ningún signo de inflamación, mientras que los sensibilizados presentaban acumulaciones focales de células inflamatorias alrededor de las estructuras broncovasculares (flecha). El infiltrado se componía en gran parte de células mononucleares, con un número elevado de eosinófilos. Las imágenes son representativas de observaciones procedentes de los grupos estudiados.
Grado de inflamación en los pulmones de ratones sensibilizados y tratados con rofecoxib, un inhibidor selectivo de la ciclooxigenasa-2, y de animales de control sensibilizados y tratados con placebo en solución salina. La puntuación para la inflamación fue mayor en los ratones tratados con rofecoxib, pero la diferencia no alcanzó la significación estadística (p=0,09). Los datos representados son las medias, y las barras de error corresponden al error estándar de la media.
Correlación significativa entre la reactividad de las vías respiratorias (Penh) a una concentración de metacolina de 100mg/ml y el grado de inflamación (puntuación). p<0,05 para un coeficiente de determinación (r2) de 0,3813; es decir, el 38% de la variabilidad de Penh puede explicarse mediante la variación de la inflamación.
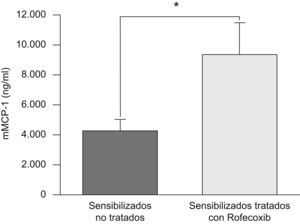
Como se muestra en la figura 5, la concentración sérica de mMCP-1 fue más de 2 veces mayor en los animales sensibilizados a la ovalbúmina y tratados con rofecoxib que en aquéllos sin tratar (9,4±2,3 frente a 4,3±0,8ng/ml, respectivamente).
Concentración sérica de proteasa-1 de mastocitos de ratón (mMCP-1) en animales tratados con rofecoxib y animales sensibilizados sin tratar, medida mediante un análisis inmunoenzimático 48h después de la última exposición a la ovalbúmina. Los datos representados son las medias, y las barras de error corresponden al error estándar de la media.
*p<0,05.
Hemos mostrado que, en un modelo murino de asma aguda, el bloqueo farmacológico selectivo de la actividad de la COX-2 con rofecoxib durante la exposición a la ovalbúmina aumenta la respuesta de las vías respiratorias ante la metacolina, y que dicho aumento se acompaña de un incremento de la actividad de los mastocitos de la mucosa. Nuestros resultados también indican que la inflamación subyacente de las vías respiratorias empeora en los ratones sensibilizados y tratados con el inhibidor selectivo de la COX-2.
El empleo de una técnica no invasiva (pletismografía de cuerpo entero) para evaluar la función de las vías respiratorias nos permitió medir la reactividad bronquial en los mismos ratones antes y después de la sensibilización de las vías respiratorias. Por consiguiente, los ratones sirvieron de controles de sí mismos dentro de cada situación experimental. Con este enfoque observamos que el inhibidor de la COX-2 rofecoxib provocó un empeoramiento de la hiperreactividad de las vías respiratorias en los ratones sensibilizados en 2 ámbitos; en primer lugar, indujo una reacción más pronunciada ante la metacolina, y en segundo lugar, favoreció el desarrollo de una respuesta a concentraciones inferiores de metacolina, según indica el valor EC200, que revelaba una reactividad incrementada de las vías respiratorias en presencia de rofecoxib. Es interesante observar que la actividad de los mastocitos se duplicó con el rofecoxib, según demostró el aumento sostenido de la concentración sérica de mMCP-1 aun al cabo de 48h de la última exposición a la ovalbúmina. Aunque nuestro enfoque experimental no permite establecer de forma concluyente una relación causal, parece probable que haya un vínculo directo entre el aumento observado de la actividad mastocítica y la potenciación de la reactividad bronquial26. Harían falta experimentos adicionales para dilucidar la relación entre el rofecoxib y los mastocitos; no obstante, es posible proponer de forma provisional que el mecanismo que subyace en el aumento observado implica la expresión de receptores que inhibirían su degranulación de la PGE2 por parte de los mastocitos de las vías respiratorias24,25. Por lo tanto, la potencial disminución de la producción de PGE2 causada por el rofecoxib podría abolir el efecto inhibitorio que esta prostaglandina pudiera ejercer en dichas células, con lo que aumentaría la actividad de los mastocitos. Según esta hipótesis, aunque los inhibidores selectivos de la COX-2 se consideran en general seguros para los pacientes con asma inducida por la aspirina4,5, se debería analizar la relevancia de los mastocitos en la mediación, al menos parcial, de los efectos adversos inducidos por los AINE a través de un mecanismo similar. Finalmente, hay que señalar que, aunque la inclusión de otro grupo experimental con ratones tratados con rofecoxib pero no sensibilizados hubiera ayudado a descartar un posible efecto directo de los AINE sobre la reactividad de las vías respiratorias en estos ratones, creemos que esta posibilidad es improbable, ya que no se ha descrito que este u otros inhibidores de la COX-2 tengan efectos sobre la función normal de las vías respiratorias o sobre una mayor actividad de los mastocitos en ratones o seres humanos. Aunque otros autores han observado que los inhibidores selectivos de la COX acentúan la hiperreactividad de las vías respiratorias ante la metacolina intravenosa20,21, nunca se ha señalado que la modulación de los mastocitos pudiera ser un factor contribuyente. Proponemos un mecanismo dependiente de los mastocitos para explicar el empeoramiento de la hiperreactividad en las vías respiratorias bajo un bloqueo farmacológico (AINE) de la COX en ratones. Esto es particularmente interesante porque los estudios del asma inducida por AINE han revelado cambios en la actividad mastocítica30,31, aunque nunca se haya propuesto un vínculo entre tal aumento de la actividad y la reducción de la producción de prostanoides.
Es interesante observar que en un estudio en que se administró nimesulida, otro inhibidor de la COX-2, a ratones sensibilizados y deficientes en COX-2 (−/−), y a ratones normales, Nakata et al22 no observaron cambios en la hiperreactividad de las vías respiratorias de estos ratones al compararlos con ratones sensibilizados y sin tratar. Según se señala en un estudio anterior con un enfoque experimental similar19, la falta de alteración en la hiperreactividad de los ratones modificados puede explicarse por el desarrollo de mecanismos compensatorios en los animales knockout. Además, el modo en que Nakata et al22 bloquearon la actividad de la COX-2 en su estudio podría haber interferido en la capacidad de detectar posibles diferencias funcionales. En primer lugar, el tratamiento implicaba administrar el agente bloqueador 3 veces durante el protocolo de sensibilización de las vías respiratorias, en contraposición con nuestro protocolo, que suponía una administración diaria durante toda la fase de exposición a la ovalbúmina. En segundo lugar, el fármaco que emplearon, la nimesulida, es un inhibidor de la COX-2 menos selectivo que el rofecoxib. Habría que determinar el grado en que nuestro enfoque, más agresivo, para inhibir la COX-2 puede explicar el efecto sobre la reactividad de las vías respiratorias, pero parece probable que, para imitar una deficiencia en la regulación de esta enzima, que puede tener lugar de forma natural, la inhibición farmacológica de la COX-2 requiere un bloqueo fuerte y sostenido en el curso de la exposición. También parece razonable pensar que, con independencia de la intensidad de la inhibición, es probable que haya un efecto distinto sobre la función respiratoria según la COX-2 se inhiba durante la sensibilización o durante la fase de exposición. Por último, Nakata et al22 utilizaron una concentración máxima de metacolina bastante baja (20mg/ml) y la cepa de ratones que estudiaron fue la C57BL/6J. Por lo tanto, las discrepancias entre nuestros resultados y los suyos respecto a la función respiratoria pueden explicarse en gran parte por las diferencias metodológicas.
El sistema de puntuación que desarrollamos, basado en métodos publicados con anterioridad20, tuvo en cuenta tanto el número de acumulaciones focales de células inflamatorias como su tamaño. No se observó ninguna diferencia estadística entre los animales tratados con rofecoxib y aquéllos sin tratar. Sin embargo, basándonos en 3 conjuntos de datos, proponemos que parece haber una tendencia hacia una inflamación de las vías respiratorias más pronunciada en los animales con la COX-2 inhibida. En primer lugar, el aumento de la puntuación de la inflamación fue constante en cada animal, lo que indica que en un grupo más numeroso los resultados podrían adquirir significación estadística. En segundo lugar, se apreció una correlación entre las puntuaciones de la inflamación y la respuesta de las vías respiratorias a la metacolina en los animales tratados con rofecoxib. Esto es compatible con la idea de que la inflamación desempeña un papel en el desarrollo de la hiperreactividad de las vías respiratorias en el modelo murino utilizado, y avala la hipótesis de que la mayor reactividad bronquial que se observa con el bloqueo de la COX-2 podría estar causada, al menos en parte, por un empeoramiento de la inflamación de las vías respiratorias. En tercer y último lugar, es posible que el aumento de la actividad de los mastocitos de la mucosa que hemos observado de lugar a un aumento de la inflamación.
Es necesario investigar más para confirmar si la inhibición farmacológica de la COX-2 afecta a la inflamación de las vías respiratorias y evaluar los mecanismos implicados. Sin embargo, nuestros resultados indican que una inhibición fuerte y sostenida de la COX-2 durante la exposición a alérgenos conduce a una alteración de la función de las vías respiratorias, e invitan a pensar que este efecto está asociado a un aumento de la inflamación subyacente. Nuestra principal aportación consiste en señalar la potencial relevancia de una mayor actividad de los mastocitos relacionada con los efectos observados con el tratamiento con rofecoxib. Finalmente, nuestros datos respaldan la hipótesis de que en el desarrollo del asma alérgica podría haber una regulación anormal de la COX-2.
Agradecemos a las Dras. Anna Puigdemont y Maite Martín, de la Universitat Autònoma de Barcelona, su generosa contribución al procedimiento experimental. También queremos dar las gracias al Sr. Pere Losada por su valioso apoyo técnico.
Trabajo financiado por una subvención (FIS PI060592) del Instituto de Salud Carlos III, del Ministerio de Sanidad.