Introducción
Se denomina derrame pleural a la acumulación anormal de líquido en el espacio pleural. Desde el punto de vista fisiopatológico, el derrame pleural expresa un desequilibrio entre la formación de líquido pleural y su reabsorción. Desde el punto de vista clínico, es siempre patológico, pero al menos un 30% de ellos se consideran idiopáticos. La mayoría de los casos, sin embargo, están justificados tanto por enfermedades pleuropulmonares como extrapulmonares. Dentro de estas últimas se conoce una miscelánea de causas relacionadas con enfermedades de otros órganos (p. ej., cardíacas, hepáticas, renales o pancreáticas), enfermedades del sistema conectivo (lupus, artritis reumatoide) o enfermedades neoplásicas (con o sin metástasis a pleura). Por otra parte, resulta especialmente interesante la evidencia de que el tratamiento con algunos fármacos puede precipitar la aparición de derrame pleural. Entre ellos, los más frecuentes son la nitrofurantoína, el propranolol y los agentes quimioterápicos (bleomicina, metotrexato, mitomicina y procarbacina), en cuyos casos puede coexistir la toxicidad pulmonar (neumonitis o fibrosis)1.
Observación clínica
Varón de 78 años de edad, sin antecedentes de tabaquismo ni de exposición a compuestos orgánicos o inorgánicos inhalados. No recibía ningún tratamiento farmacológico habitual ni tenía antecedentes de alergias medicamentosas conocidas. Ingresó programado para el estudio de un derrame pleural izquierdo de tiempo de evolución incierto. No seguía ningún tratamiento en el momento del ingreso (interrumpido por orden de su neurólogo habitual). Como antecedentes de interés destacaba el seguimiento en otro centro por diagnóstico de síndrome parkinsoniano. El primer síntoma se había iniciado aproximadamente 3 meses antes de acudir a nuestro hospital en forma de insomnio, cefalea, astenia, edemas progresivos en las extremidades inferiores, acompañados de cambios tróficos cutáneos no pruriginosos, tos seca y disnea progresiva hasta hacerse de mínimos esfuerzos. En ese contexto su neurólogo solicitó una radiografía de tórax, que resultó patológica por la presencia de derrame pleural, motivo por el cual se le remitió a nuestro centro para valoración. Cuatro meses antes de acudir a nuestro centro se le había indicado iniciar tratamiento con cabergolina (Sogilen®) a dosis de 1 mg/día por vía oral. Desde la evaluación por nuestro servicio hasta su ingreso programado el paciente interrumpió dicho tratamiento (aproximadamente una semana). Durante ese período observó una disminución de los edemas y la mejoría de las lesiones dérmicas, y sólo persistieron escasos síntomas de tipo tos seca y disnea de menor intensidad a la previa. Al ingresar el paciente en nuestro centro se encontraba consciente y orientado, con coloración e hidratación normales, presión arterial de 110/70 mmHg, frecuencia cardíaca de 74 lat/min y temperatura axilar de 36 ºC. Semiológicamente destacaba la disminución del murmullo vesicular en el tercio medio del hemitórax derecho, pero sin ningún ruido respiratorio adventicio. Las extremidades inferiores mostraban signos de insuficiencia venosa, con cambios distróficos cutáneos descamativos (fig. 1a). Se apreciaban además rigidez cervical y del brazo izquierdo, acinesia moderada en el brazo y la pierna izquierdos, y temblor de reposo en la extremidad superior izquierda. La marcha y el equilibrio eran normales.
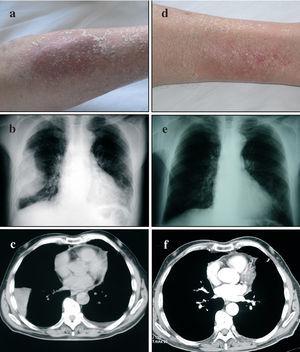
Fig. 1. Imágenes de algunos de los aspectos más relevantes del caso, donde aparecen de forma comparativa las lesiones cutáneas (a y d), radiografía de tórax convencional (proyección posteroanterior) (b y e) y tomografía axial computarizada de tórax (c y f), tanto en la evaluación precoz (a-c) como en la evaluación tardía (d-f). Para detalles específicos de la interpretación de estas imágenes y exploraciones, por favor remítanse al texto.
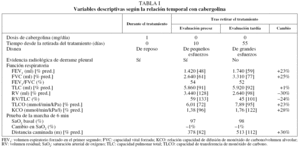
La radiografía de tórax (fig. 1b) mostró una imagen extrapulmonar derecha con ocupación de senos costofrénicos posterior y lateral, indicativa de la presencia de líquido pleural y asociada a doble convexidad periférica de aspecto asimismo pleural, con componente cisural y ocupación de senos costofrénicos posterior y lateral izquierdos, coherente con la existencia de discreta cantidad de líquido pleural en esa región. Además mostraba una trama broncovascular aumentada, con engrosamientos peribronquiales (bronchial cuffing) atribuibles a edema intersticial, y colapso pulmonar pasivo en la base pulmonar derecha. La tomografía axial computarizada del tórax (fig. 1c) confirmó la presencia de derrame pleural derecho con componente cisural. Además evidenció imágenes ganglionares inespecíficas en las zonas prevascular y paratraqueal derechas, y engrosamiento pericárdico sin evidencia de derrame. En el parénquima pulmonar se evidenció un discreto engrosamiento peribronquial y de septos interlobulares, atribuibles a afectación intersticial. Las pruebas mostraron alteraciones tanto espirométricas como de la capacidad de transferencia del monóxido de carbono (tabla I).
Los autores consideramos que, desde el punto de vista clínico, como se discute más abajo, era razonable considerar la coexistencia de neumonitis y serositis pleural transitoria asociadas como efecto adverso al tratamiento con cabergolina, por lo cual desaconsejamos continuar o reiniciarlo en este paciente. Se pautó tratamiento broncodilatador y esteroideo inhalado.
Discusión
El presente artículo resume la presentación de derrame pleural, engrosamiento pericárdico y afectación pulmonar en un paciente sin antecedentes de tabaquismo ni de enfermedad pulmonar o cardíaca conocidas, que acudió a nuestro servicio de urgencias por síntomas subagudos de disnea, edemas y afectación cutánea de extremidades inferiores. Según el resultado de la aplicación de la escala de Naranjo2, este caso constituye la primera descripción clínica de probable toxicidad pleuropulmonar precoz asociada al tratamiento con cabergolina.
La cabergolina es un derivado sintético (C26H37N5O2) de la ergolina, que actúa y se utiliza como agonista de la dopamina3. Este fármaco fue aprobado por la Food and Drug Administration en 1997 y comercializado en España con el nombre de Sogilen® en 2001. Generalmente se indica para el tratamiento de las alteraciones hiperprolactinémicas (tanto idiopáticas como asociadas a adenomas de la pituitaria)4. Ejerce su efecto en una relación dependiente de la dosis gracias a su actividad agonista sobre los receptores de la dopamina D2 de la pituitaria anterior. La afinidad de otros receptores (p. ej., adrenérgicos, serotoninérgicos o histaminérgicos) a la cabergolina es muy baja. La cabergolina se administra por vía oral y experimenta un metabolismo significativo de primer paso después de su absorción sistémica. Se metaboliza extensamente por hidrólisis en el hígado, con una implicación mínima del citrocromo P450 microsómico4. Al menos se producen 4 metabolitos, pero ninguno parece contribuir a la acción del fármaco3. Su vida media de eliminación es de aproximadamente 60 h. Sus metabolitos se eliminan en las heces (del 60-70%), aunque su eliminación renal supone el 22% de la dosis3.
La principal indicación actual de la cabergolina está relacionada con el tratamiento de las alteraciones hiperprolactinémicas y secundariamente con el tratamiento de las fluctuaciones motoras asociadas a la enfermedad de Parkinson, donde ha demostrado su eficacia en forma de monoterapia en las fases iniciales de la enfermedad5. Las dosis efectivas parecen ser de unos 3 mg al día aproximadamente. La cabergolina se utiliza como adyuvante del tratamiento con levodopa/carbidopa en los pacientes con parkinsonismo que experimentan fluctuaciones motoras. Aunque esta combinación parece ser segura y efectiva, es posible que aparezcan algunos efectos neurológicos adicionales. En efecto, se han observado alucinaciones con el uso simultáneo de cabergolina y levodopa. Los efectos secundarios más frecuentemente observados con la cabergolina son: náuseas, vómitos, cefalea, mareos, estreñimiento, astenia, dolor abdominal y vértigo. Las náuseas son el único síntoma que parece estar relacionado con la dosis. El prospecto del fármaco hace referencia a efectos secundarios comunes que se han observado en pacientes con enfermedad de Parkinson tratados con cabergolina, tales como confusión, discinesia, alucinaciones y edemas periféricos. La resolución de los síntomas se consigue con la retirada del fármaco6.
El caso aquí descrito no es el único en que se establece una asociación entre el tratamiento con cabergolina y alteraciones pleuropulmonares. El prospecto del fabricante hace referencia a reacciones adversas sobre el aparato respiratorio, aunque de incidencia rara7, lo cual les hace aconsejar que se use con precaución en pacientes con enfermedad pulmonar de base. Al igual que otros derivados de la ergotamina, la cabergolina se ha asociado a cambios pleuropulmonares, como efusión pleural y fibrosis pulmonar6,8-11. Una búsqueda específica ha permitido identificar sólo 2 descripciones clínicas similares de toxicidad por cabergolina6,9.
Tres de los puntos fuertes del presente caso clínico tienen que ver con el período de seguimiento, la evaluación funcional respiratoria y la ausencia de enfermedades de base o de un diagnóstico alternativo. Hasta donde hemos podido investigar, éste es el primer caso de toxicidad pleuropulmonar por cabergolina que se describe en nuestro medio. Al acudir al servicio de urgencias de nuestro centro el paciente presentaba evidencia de líquido en el espacio pleural, que tras retirar el tratamiento disminuyó y desapareció sin ninguna intervención terapéutica específica (fig. 1e), excepto la de no volver a indicar el fármaco. Desde el punto de vista funcional, el presente caso mostraba: a) signos de incremento de la resistencia de las vías aéreas y un patrón obstructivo en la espirometría, lo cual es indicativo de enfermedad de las vías aéreas, aun cuando el paciente no tenía antecedentes de tabaquismo, asma bronquial u otra enfermedad que justificara esta alteración funcional; b) el paciente mostró disminución de la capacidad de transferencia del monóxido de carbono, lo cual es indicativo de enfermedad pulmonar intersticial; c) la evidencia de derrame pleural y pericárdico (este último de escasa cuantía) hicieron suponer la presencia de serositis; d) las alteraciones funcionales descritas coincidieron temporalmente con edema de las extremidades y alteraciones cutáneas tróficas, que se han descrito también en asociación con el fármaco6 (fig. 1a y 1d), y e) el seguimiento evolutivo del paciente, que incluyó evaluaciones clínicas y funcionales, demostró que el período de "lavado" del fármaco se asoció a la desaparición completa del derrame pleural (fig. 1e y 1f) y parcial de las alteraciones funcionales respiratorias. Desde el punto de vista toxicológico, la presente descripción no permite asignar una relación de causa-efecto entre el fármaco y los efectos pleuropulmonares y cutáneos evidenciados en el paciente. Si bien esto representa una potencial limitación desde el punto de vista metodológico, no existe la posibilidad de considerar la realización de un ensayo clínico alternativo que permitiera demostrar o refutar esta potencial relación de causalidad. No obstante, teniendo en cuenta las definiciones de la escala de estimación de la probabilidad de reacciones farmacológicas adversas de Naranjo2, los argumentos anteriores permiten declarar que hay una relación probable de causalidad entre el tratamiento con cabergolina y la clínica del paciente. Estas evidencias han justificado la notificación del caso al Departamento de Toxicología del sistema sanitario estatal.
Una potencial limitación del presente estudio tiene que ver con la ausencia de estudios citoquímicos del líquido pleural. Durante los días transcurridos entre la retirada del tratamiento, la detección del caso en urgencias de nuestro centro y el ingreso en el hospital disminuyó casi completamente el derrame, lo cual imposibilitó acceder a él mediante punción transtorácica. Cuando el paciente interrumpió la medicación, tanto los edemas como la dificultad respiratoria que había presentado al inicio se resolvieron espontáneamente sin necesidad de ninguna intervención.
Es necesario continuar el seguimiento del paciente a más largo plazo para evaluar la posibilidad de alteraciones irreversibles como secuela de la toxicidad idiosincrásica que mostró ante el fármaco. Es imposible prever cuál sería el impacto de estas alteraciones en pacientes que, a diferencia del caso descrito, puedan tener una enfermedad cardíaca o pulmonar de base.
En conclusión, consideramos que debe tenerse en cuenta la posibilidad de que la cabergolina ocasione enfermedad pleuropulmonar (sintomática o no) en pacientes que reciben el fármaco para el tratamiento de hiperprolactinemia o parkinsonismo.
Agradecimientos
Los autores agradecen especialmente al paciente su valiosa colaboración en los estudios realizados. Asimismo dan las gracias al Dr. J. Roquer, Jefe del Servicio de Neurología por sus sugerencias sobre el manuscrito.
Correspondencia: Dr. M. Orozco-Levi.
Servicio de Neumología. Hospital del Mar.
Pg. Marítim, 25. 08003 Barcelona. España.
Correo electrónico: morozco@IMIM.es
Recibido: 20-7-2006; aceptado para su publicación: 30-8-2006.