Introducción
La fibrosis pulmonar idiopática (FPI) es un tipo específico de neumonía intersticial idiopática, que se caracteriza por la existencia histológica de neumonía intersticial usual1. El pronóstico de la enfermedad es desfavorable, presentando una historia natural con lenta evolución hacia la insuficiencia respiratoria, cor pulmonale y muerte en el plazo aproximado de 3-5 años. Sin embargo, en un pequeño porcentaje de casos la enfermedad evoluciona en forma de exacerbación aguda, también llamada "fase acelerada" de FPI, que se caracteriza por un cuadro, de instauración en días o pocas semanas, de disnea e insuficiencia respiratoria intensa, con aparición de opacidades en vidrio deslustrado en ausencia de infección o insuficiencia cardíaca. La mortalidad de este cuadro es superior al 80%.
En la literatura médica hay referencias a la elevación de marcadores tumorales como el antígeno carcionembrionario (CEA)2, CA 19/93-5, CYFRA6 y otros reactantes de fase aguda durante dicha exacerbación. Sin embargo, en una revisión bibliográfica en Medline desde el año 1966 no se ha encontrado asociación entre exacerbación aguda de FPI y el CA 15/3, marcador tumoral ligado a la neoplasia mamaria.
Observación clínica
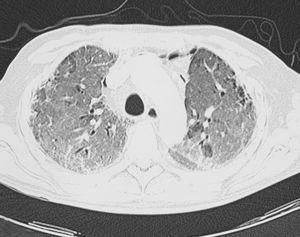
Varón de 71 años, que ingresó en el Servicio de Neumología procedente de una clínica privada. No tenía antecedentes epidemiológicos ni laborales de interés, hábitos tóxicos ni medicación habitual hasta el inicio del cuadro que motivó el ingreso, y tampoco presentaba cardiopatía ni broncopatía previas. Cuatro meses antes de ingresar se encontraba asintomático y se le evaluó en preoperatorio de colecistectomía por radiografía de tórax. Un mes después se le realizó una tomografía axial computarizada de alta resolución (TACAR) ante la sospecha de enfermedad intersticial, y se objetivó afectación intersticial bilateral de predominio basal y periférico, con engrosamiento septal, líneas subpleurales, áreas de panalización y bronquiectasias por tracción, así como adenopatías subcéntricas en el espacio prevascular y paratraqueales derechas (fig. 1). Ante la sospecha de FPI el paciente comenzó tratamiento esteroideo y presentó como complicación descompensación diabética, que precisó tratamiento con antidiabéticos orales. Permaneció asintomático hasta 6 días antes del ingreso actual, cuando comenzó a presentar picos de fiebre de 38 ºC y tos de predominio nocturno hasta hacerse de reposo en las últimas 48 h.
Figura 1. Patrón radiológico, típico de la fibrosis pulmonar idiopática, con afectación intersticial de predominio basal y periférico, engrosamiento septal, líneas subpleurales, áreas de panalización y bronquiectasis por tracción.
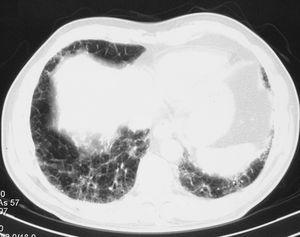
Al ingresar presentaba una presión arterial de 110/60 mmHg, frecuencia cardíaca de 120 lat/min, taquipnea intensa (> 40 respiraciones/min) y saturación del 80% con oxígeno por Ventimask al 50%. Se realizó una nueva TACAR que evidenció áreas extensas y bilaterales de opacidades en vidrio deslustrado, superpuestas al patrón crónico de engrosamiento intersticial y panalización que presentaba previamente (fig. 2). Se inició tratamiento empírico con esteroides a dosis de 2 mg/kg/día, así como levofloxacino y cotrimoxazol. Ante la ausencia de mejoría clínica y gasométrica a las 24 h (saturación arterial de oxígeno < 80% respirando aire en reservorio de 10 l), se decidió su ingreso en la unidad de cuidados intensivos para la realización de catéter telescopado y lavado broncoalveolar (BAL). Se enviaron únicamente muestras para microbiología y la exploración se interrumpió por intensa desaturación y mala tolerancia al BAL. El paciente permaneció 5 días en la unidad de cuidados intensivos, donde se retiró el tratamiento con cotrimoxazol y se añadió azatioprina a dosis iniciales de 1 mg/kg/día, sin que precisar soporte inotrópico ni ventilatorio. Ingresó de nuevo en planta de hospitalización en un estado clínico y gasométrico similar, persistiendo la insuficiencia respiratoria refractaria y la taquipnea intensa.
Figura 2. En la imagen se pueden apreciar áreas extensas en vidrio deslustrado, bilaterales, superpuestas a imágenes de engrosamiento septal y subpleural.
En la analítica, la bioquímica era normal (incluyendo la serie hepática), con lactatodeshidrogenasa de 798 U/l (valores normales [VN]: 230-460) y leve leucocitosis (13.300/ml) con fórmula normal. La velocidad de sedimentación globular era de 76 mm/h; el factor reumatoide, normal, y los anticuerpos antinucleares y anti-ADN, negativos. Los valores de los marcadores tumorales fueron los siguientes: CA 15/3 de 560 U/ml (VN: 0-25 U/ml), CA 19/9 de 0,8 U/ml (VN: 0-35 0,8 U/ml) y CEA de 6,8 ng/ml (VN: 0-5 ng/ml). Las precipitinas frente a neumoalérgenos habituales fueron negativas, al igual que las serologías para gérmenes atípicos y virus (de la gripe, paragripal, adenovirus y virus respiratorio sincitial). Los cultivos de hongos y virus, la tinción de auramina y de azul de toluidina en LAB fueron negativos. En el cultivo aparecieron cocos grampositivos aerobios, que se tipificaron como Rothia mucilaginosa resistente a levofloxacino y sensible a cefalosporinas, así como Peptostreptococcus anaerobius.
Dada la elevación de CA 15/3, se realizaron una mamografía y ecografía abdominopélvica, sin que se objetivaran hallazgos indicativos de enfermedad neoplásica.
La situación clínica del paciente se deterioró progresivamente. Se intentó aplicar ventilación no invasiva con modalidad de soporte de presión, que se retiró al cabo de unas horas por agitación e intolerancia. Tras precisar sedación con cloruro mórfico y midazolam, el paciente falleció a los 16 días del ingreso.
En la autopsia se observaron ectasias en ambos lóbulos inferiores y áreas de daño alveolar difuso, con inflamación, congestión y edema intersticial, y tapizamiento de las paredes alveolares por membranas hialinas, así como hiperplasia reactiva de neumocitos tipo II. Alternando con éstas, se visualizaban áreas de daño alveolar difuso en fase de resolución, con fibrosis y engrosamiento de los tabiques alveolares. Se apreciaron asimismo incidentalomas abdominales (quistes renales y adenoma suprarrenal), sin adenopatías ni imágenes indicativas de neoplasia en abdomen y pelvis.
Discusión
El caso presentado corresponde, como confirmó la autopsia, a la fase acelerada de FPI.
La causa precipitante de la agudización con frecuencia no se reconoce, si bien puede descartarse razonablemente la etiología infecciosa ante la ausencia de crecimiento bacteriano o vírico en la analítica sérica y en el BAL. Esporádicamente se citan como causas precipitantes la realización del BAL y la cirugía torácica7,8.
El hallazgo de R. mucilaginosa (implicado en enfermedades periodontales y otras infecciones bucales) en el BAL, acompañado de otras bacterias anaerobias, induce a pensar en el arrastre de comensales de la boca al realizar el BAL en un paciente con taquipnea intensa y mala tolerancia a la prueba. Además, a pesar de variar el tratamiento antibiótico con el objetivo de proporcionar cobertura frente a estos gérmenes, el estado del paciente empeoró progresivamente. Los hallazgos radiológicos observados a los 3 meses de la primera TACAR (imágenes extensas en vidrio deslustrado9,10), en un paciente previamente diagnosticado de FPI, que presentaba importante deterioro clínico y gasométrico y no respondía al tratamiento corticoide e inmunodepresor, una vez excluidas otras causas infecciosas que cursan con dicho patrón, como la infección por citomegalovirus o Pneumocystis carinii, son muy indicativos del diagnóstico de fase acelerada de FPI.
Esta afectación radiológica resulta paradójica, ya que el patrón extenso en vidrio deslustrado en el diagnóstico inicial de la FPI no es frecuente y puede inducir a pensar en un diagnóstico alternativo como neumonía intersticial linfoide, neumonía intersticial descamativa, formas celulares de neumonía intersticial no específica, alveolitis alérgica, cuadros todos ellos que presentan mejor respuesta a los esteroides al tratar teóricamente fenómenos extensos de alveolitis.
Existe evidencia respecto a la elevación de reactantes de fase aguda (proteína C reactiva, velocidad de sedimentación globular, gammaglobulinas), marcadores inmunológicos (factor reumatoide, anticuerpos antinucleares en el 20% de los casos de FPI) y marcadores tumorales como el CEA, CA 19/9 y CYFRA en enfermedades inflamatorias pulmonares2-6. La originalidad de nuestro caso creemos que radica en las elevadas cifras séricas de CA 15/3, no descritas hasta la fecha, en ausencia de afección mamaria demostrada por mamografía y de neoplasia en otros órganos de la economía, como descartó la autopsia.
En resumen, la agudización grave de la FPI es una forma evolutiva infrecuente de etiología no clara, con una mortalidad elevada y escasa respuesta al tratamiento esteroideo e inmunodepresor11, que puede llevar asociada elevación sérica de reactantes de fase aguda y marcadores tumorales. Creemos que la aparición de cifras elevadas de marcadores tumorales en pacientes en fase acelerada de FPI no debe hacernos priorizar el algoritmo diagnóstico en búsqueda de posibles neoplasias, y sobre todo hemos de evitar la realización de técnicas agresivas con dicho fin.
Correspondencia: Dr. L. Altube Urrengoetxea.
Servicio de Neumología. Hospital de Galdakao.
Labeaga Auzoa, s/n. 48960 Galdakao. Vizcaya. España.
Correo electrónico: lander.altubeurrengoetxea@osakidetza.net
Recibido: 31-7-2006; aceptado para su publicación: 30-8-2006.