El síndrome hepatopulmonar (SHP) se caracteriza por la tríada de alteración en la oxigenación arterial causada por dilataciones vasculares intrapulmonares (DVIP) en el contexto de enfermedad hepática avanzada1. La disnea progresiva es el síntoma respiratorio más frecuente2,3. La platipnea y la ortodesoxia (aumento de la disnea y descenso de la saturación de oxígeno en ortostatismo) pueden presentarse hasta en el 25% de los pacientes1. Otros signos sugestivos del SHP son las telangiectasias, la acropaquia y la cianosis periférica4. La ecocardiografía con contraste mediante la inyección con suero salino agitado es el método de confirmación más utilizado para detectar las dilataciones vasculares intrapulmonares1,3. Actualmente el trasplante hepático (TH) es el tratamiento de elección, ya que las opciones médicas no han demostrado su eficacia5. Se ha descrito que el SHP puede coexistir con otras enfermedades respiratorias que agravan el intercambio gaseoso hasta en un 30% de los casos6. Sin embargo, la asociación con la enfermedad pulmonar intersticial difusa (EPID) ha sido escasamente comunicada en la literatura. Cuando el SHP se desarrolla en un paciente con EPID se dificulta el proceso diagnóstico de la misma y puede limitar las opciones de tratamiento en ambas entidades7–10. Basados en estas premisas, hemos revisado 3 casos de SHP coexistente con EPID con el fin de describir las características de presentación clínica y su evolución (tabla 1 y fig. 1).
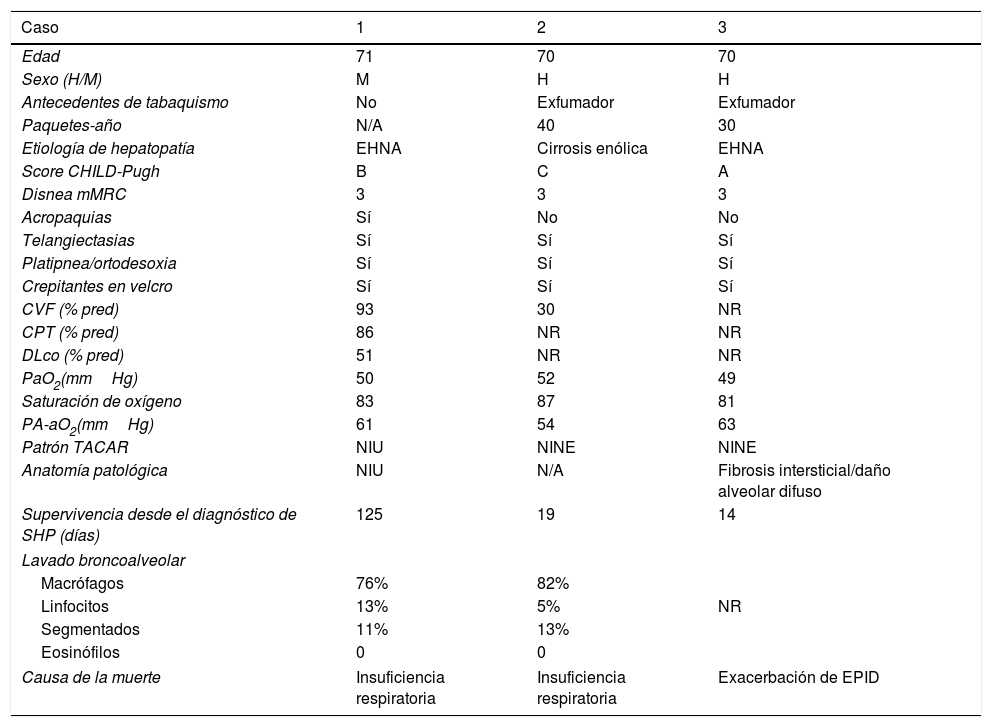
Descripción clínica, funcional y radiológica de los pacientes incluidos en la serie
| Caso | 1 | 2 | 3 |
|---|---|---|---|
| Edad | 71 | 70 | 70 |
| Sexo (H/M) | M | H | H |
| Antecedentes de tabaquismo | No | Exfumador | Exfumador |
| Paquetes-año | N/A | 40 | 30 |
| Etiología de hepatopatía | EHNA | Cirrosis enólica | EHNA |
| Score CHILD-Pugh | B | C | A |
| Disnea mMRC | 3 | 3 | 3 |
| Acropaquias | Sí | No | No |
| Telangiectasias | Sí | Sí | Sí |
| Platipnea/ortodesoxia | Sí | Sí | Sí |
| Crepitantes en velcro | Sí | Sí | Sí |
| CVF (% pred) | 93 | 30 | NR |
| CPT (% pred) | 86 | NR | NR |
| DLco (% pred) | 51 | NR | NR |
| PaO2(mmHg) | 50 | 52 | 49 |
| Saturación de oxígeno | 83 | 87 | 81 |
| PA-aO2(mmHg) | 61 | 54 | 63 |
| Patrón TACAR | NIU | NINE | NINE |
| Anatomía patológica | NIU | N/A | Fibrosis intersticial/daño alveolar difuso |
| Supervivencia desde el diagnóstico de SHP (días) | 125 | 19 | 14 |
| Lavado broncoalveolar | |||
| Macrófagos | 76% | 82% | |
| Linfocitos | 13% | 5% | NR |
| Segmentados | 11% | 13% | |
| Eosinófilos | 0 | 0 | |
| Causa de la muerte | Insuficiencia respiratoria | Insuficiencia respiratoria | Exacerbación de EPID |
La alteración de la oxigenación como criterio diagnóstico del SHP se definió en función de la diferencia alvéolo-arterial de oxígeno (PA-aO2) basal (≥15mmHg en los menores de 64 años y ≥20mmHg en los mayores de 64 años)1.
CPT: capacidad pulmonar total; CVF: capacidad vital forzada; DLCO: difusión alveolar del mónóxido de carbono; EHNA: esteatohepatitis no alcohólica; H: hombre; M: mujer; mMRC: modified Medical Research Council; N/A: no aplicable; NR: no realizado; PaO2: presión arterial de oxígeno; TACAR: tomografía axial computarizada de alta resolución.
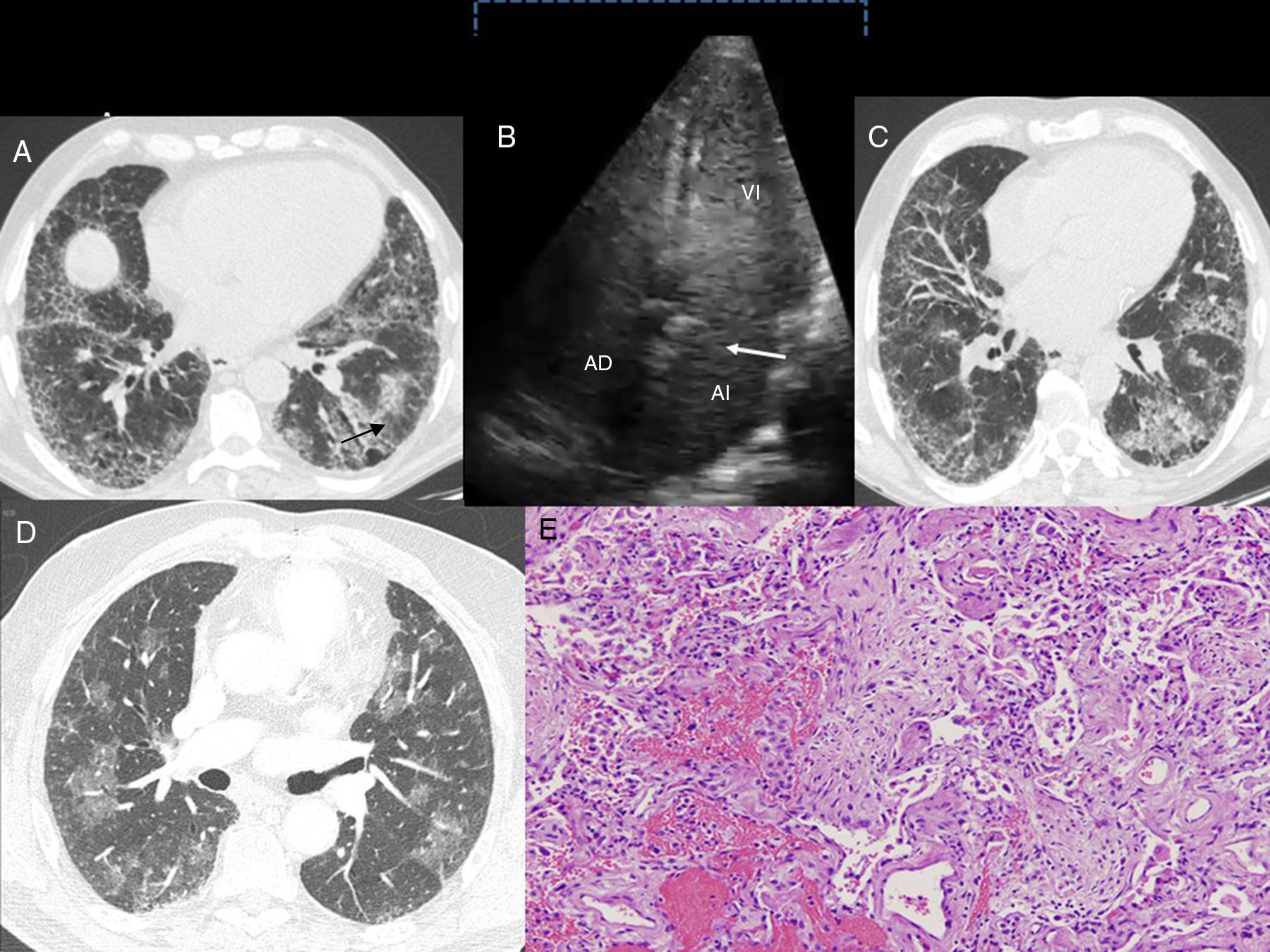
A. Caso 1: corte axial de TACAR torácica (ventana pulmonar). Se muestra una afectación intersticial reticular, con engrosamientos septales y opacidades en vidrio deslustrado en las bases pulmonares y bronquiectasias por tracción (flecha). B. Caso 1: en la ecocardiografía con contraste mediante la inyección con suero salino agitado se observa el paso tardío de las burbujas en la aurícula izquierda luego de 3 a 6 latidos (flecha). AD: aurícula derecha; AI: aurícula izquierda; VI: ventrículo izquierdo. C. Caso 2: corte axial de TACAR torácica (ventana pulmonar). Presencia de una reticulación subpleural con gradiente apicobasal, que se acompaña de distorsión de la arquitectura pulmonar y bronquiectasias por tracción. También se aprecian áreas de vidrio deslustrado con engrosamientos septales. D. Caso 3: corte axial de TACAR torácica (ventana pulmonar) en el que se observan opacidades pulmonares en vidrio deslustrado bilaterales, parcheadas. E. Caso 3. Imagen histológica en la que se evidencian focos de hemorragia con escasos cambios reactivos del epitelio alveolar. También se observa inflamación e hiperplasia neumocitaria que alternan con áreas de fibrosis laxa que sustituye el parénquima pulmonar. Estos hallazgos son compatibles con daño alveolar agudo (tinción hematoxilina-eosina, ×100).
Caso 1. Mujer de 71 años, sin antecedentes de tabaquismo ni enolismo, diagnosticada de fibrosis pulmonar idiopática, confirmada por biopsia compatible con neumonía intersticial usual en 2011. En la analítica de rutina se detectó aumento de las enzimas hepáticas, remitiéndose al servicio de digestivo. Mediante biopsia hepática se diagnosticó de esteatohepatitis no alcohólica. A los 3 meses de establecerse este diagnóstico presentó empeoramiento de su disnea, mayor hipoxemia y de la difusión del monóxido de carbono. No había progresión del score de fibrosis en la tomografía axial computarizada de ala resolución (TACAR) ni descenso de la capacidad vital forzada. Tras confirmarse la presencia de SHP asociado la paciente presentó un deterioro clínico progresivo siendo exitus a los 4 meses.
Caso 2. Varón de 70 años exfumador y con antecedentes de consumo crónico de alcohol, diagnosticado de cirrosis enólica a los 65 años, ingresado en el servicio de digestivo por hemorragia digestiva alta. Refería disnea de medianos esfuerzos de 3 meses de evolución. Presentaba en la radiografía de tórax signos radiológicos de EPID. La TACAR mostró patrón de neumonía intersticial no específica (NINE). Por la presencia de insuficiencia respiratoria se prescribió oxigenoterapia domiciliaria al alta y se completaría el estudio ambulatoriamente. La autoinmunidad y las inmunoglobulinas G específicas para antígenos aviares y hongos fueron negativos. La biopsia pulmonar no pudo realizarse porque el paciente presentó empeoramiento clínico y gasométrico, requiriendo nuevamente ingreso al siguiente mes. Durante este ingreso se confirmó el SHP y el paciente evolucionó desfavorablemente, requiriendo altos flujos de oxígeno, falleciendo a los 19 días.
Caso 3. Varón de 70 años exfumador y sin antecedentes de enolismo, con sospecha de esteatohepatitis no alcohólica estudiado en otro centro. Presentaba disnea progresiva hasta hacerse de mínimos esfuerzos de 20 meses de evolución. Refería artralgias matutinas en las manos y los tobillos desde hacía 2 años. Por el antecedente de cardiopatía isquémica se habían realizado diversas exploraciones cardiológicas, todas sin alteraciones significativas. Ingresa en urgencias por empeoramiento de su disnea y por insuficiencia respiratoria aguda. En una radiografía de tórax 11 meses previa al ingreso se evidenciaba un patrón intersticial bilateral. Se realizó TACAR en la que se describió un patrón sugestivo de neumonía intersticial no específica. En la analítica presentaba positividad para anticuerpos antinucleares (1/320), anticuerpos antipéptido citrulinado (46U/ml) y factor reumatoide (46UI/ml). Cursó con evolución tórpida con hipoxemia grave que condicionó su ingreso en la unidad de cuidados respiratorios intermedios, donde se realizó la ecocardiografía que confirmó el SHP. El paciente fallece a los 14 días y fue realizada la autopsia que describió la presencia de daño alveolar agudo y cirrosis hepática.
Estos casos ilustran 3 escenarios clínicos diferentes, en los cuales la coexistencia del SHP y EPID plantean varias observaciones. En primer lugar, el SHP puede ser una causa de hipoxemia desproporcionada en pacientes con EPID. En este contexto, una mayor disminución de la difusión del monóxido de carbono a la esperada conllevaría buscar una alteración vascular asociada o la presencia de enfisema. La valoración de esta variable en la monitorización de la evolución o de la respuesta a un tratamiento concreto en la EPID podría resultar, entonces, menos sensible. En segundo lugar, la presencia de SHP puede limitar el proceso diagnóstico de la EPID por el riesgo que entraña la realización de una biopsia pulmonar en estos pacientes. Además, en el caso de que se tuviera un diagnóstico previo de fibrosis pulmonar idiopática (como nuestro primer paciente), la hepatopatía grave contraindicaría los tratamientos antifibróticos disponibles. Por último, la EPID puede empeorar el pronóstico del SHP al condicionar la inclusión de estos pacientes al TH. El riesgo de muerte en los pacientes con SHP es el doble con respecto a los pacientes con cirrosis sin SHP1. Por ello, se recomienda la incorporación precoz a un programa de TH tras su diagnóstico1,4. La supervivencia a los 5 años posterior al TH se sitúa hasta en un 76%2,11, mientras que, sin la posibilidad del mismo, la supervivencia media es de 24 meses2. Las principales causas de muerte descritas en el SHP son derivadas de las complicaciones de la propia enfermedad hepática6. Consecuentemente, la coexistencia de EPID pudo influir en la menor sobrevida en nuestra serie con respecto a lo comunicado previamente.
La etiopatogenia de esta asociación es desconocida. No obstante, las neumopatías fibrosantes y la cirrosis se caracterizan por la presencia de lesión epitelial/endotelial con cicatrización anómala que conduce a fibroproliferación y remodelación tisular10, estando involucradas diferentes citocinas inflamatorias y factores de crecimiento en común (TNF-a, IL-1, TGF-β y VEGF)2,6,10. Un estudio reciente ha señalado el acortamiento telomérico como uno de los posibles mecanismos implicados12.
En conclusión, la coexistencia de SHP y EPID plantea varias dificultades en el abordaje diagnóstico y terapéutico de ambas entidades, condicionado su evolución. Son necesarios más estudios que permitan ampliar las particularidades de esta asociación con el fin de poder crear estrategias que mejoren su pronóstico.
Los autores agradecen al Dr. J.L. Mate-Sanz por la cesión y análisis de las imágenes histológicas.