Introducción
Los trastornos respiratorios del sueño (TRS), principalmente el síndrome de apneas-hipopneas durante el sueño (SAHS), constituyen un problema de primera magnitud en los países desarrollados, donde afectan a un 4% de los varones y a un 2% de las mujeres en población adulta1. Se admite que el SAHS ocasiona morbilidad cardiovascular del tipo hipertensión, cardiopatía isquémica y enfermedad cerebrovascular2,3; mortalidad derivada de accidentes de tráfico4, y alteraciones cognitivas de origen multifactorial5. En los últimos años la atención se ha centrado en la población infantil, y estudios de prevalencia muestran que puede afectar al 2% de los niños6. En la mayoría, la causa principal es la hipertrofia adenoamigdalar, pero otras causas, como la obesidad y el tono anormal de la vía aérea superior, también pueden observarse en esta población. De hecho, en algunos países la prevalencia de sobrepeso en niños y adolescentes es del 17%7. Por otra parte, ciertos síndromes que afectan a la población infantil pueden predisponer o producir SAHS, tales como las dismorfias del macizo facial8, síndrome de Down, enfermedades neuromusculares, etc.9. El SAHS constituye una importante causa de morbilidad en niños y está asociado con trastornos neurocognitivos y del comportamiento10. Los efectos cardiovasculares del SAHS infantil se están reconociendo y algunos trabajos muestran, al igual que en adultos, un aumento del riesgo de enfermedad cardiovascular11. Además, su expresión clínica es muy variable, adoptando diversas y distintas manifestaciones9. El SAHS en niños se aborda con mayor frecuencia en las unidades de sueño de neumología, aunque en la mayoría de unidades la experiencia en su manejo es escasa.
Los objetivos del presente trabajo han sido evaluar las características del SAHS infantil en nuestra Unidad de Sueño y valorar si hay diferencias en la expresión clínica, polisomnográfica o terapéutica del SAHS en niños con hipertrofia amigdalar frente a los que presentan enfermedades concomitantes.
Pacientes y métodos
Período de estudio y población
Se revisaron retrospectivamente las características clínicas y antropométricas de los pacientes menores de 15 años diagnosticados en los últimos 10 años de TRS en nuestra unidad, que habían sido remitidos por distintos especialistas por la presencia de roncopatía, apneas referidas por sus padres y otras manifestaciones relativas a la baja calidad de sueño nocturno, acompañadas o no de manifestaciones diurnas neuropsíquicas o físicas, tales como cansancio o somnolencia.
Se obtuvieron las características antropométricas (altura, peso y perímetro del cuello). Se consideró el porcentaje de obesidad basado en el porcentaje de pacientes con un índice de masa corporal (IMC) igual o superior al percentil 97, según las tablas de referencia españolas para edad y sexo. Además, en el examen físico se incluyeron la exploración de la cavidad bucal, la escala de Mallampati, el grado de estrechamiento del paladar, la morfología craneal y las características del macizo facial.
A los padres se les realizó una entrevista clínica dirigida mediante un cuestionario, que recogió información acerca de la presencia o no de ronquidos, apneas, respiración dificultosa nocturna, sueño inquieto, sudación nocturna, enuresis, obstrucción nasal, rinorrea, respiración bucal, problemas auditivos, infecciones recurrentes, sibilancias, pirosis, cefaleas, hiperactividad o falta de atención, apatía, timidez, somnolencia, bajo rendimiento escolar, retraso ponderal y otras como mal apetito o polifagia.
Protocolo diagnóstico
El diagnóstico de SAHS se realizó mediante polisomnografía, poligrafía respiratoria (PR) hospitalaria o pulsioximetría. Para la polisomnografía se empleó un equipo convencional (Sleeplab, Jaeger®) que permite controlar variables neurofisiológicas mediante electroencefalograma (C3-A2), electrooculograma y electromiograma mentoniano, así como variables respiratorias tales como flujo aéreo nasal mediante cánula nasal, esfuerzo respiratorio a través de bandas toracoabdominales y saturación de oxígeno. Se controlaron además el electrocardiograma, la posición corporal, el ronquido y el electromiograma tibial.
La apnea se definió como una interrupción mayor del 90% de la amplitud de la señal del flujo oronasal, asociada o no a microdespertar (arousal) o desaturación. Se entendió por hipopnea una disminución discernible (> 30% y < 90%) de la amplitud de la señal del flujo oronasal, acompañada de un microdespertar y/o desaturación del 3%. Se definió esfuerzo respiratorio asociado a microdespertar como el período mayor de 10 s y menor de 2 min de limitación de flujo que finaliza en un microdespertar12. El número total de apneas, hipopneas y esfuerzos respiratorios asociados a microdespertar se dividieron por el tiempo total de sueño para obtener el índice de alteración respiratoria (IAR), equivalente al Respiratory Disturbance Index (RDI) propuesto por Guilleminault et al13. Los estadios de sueño se clasificaron siguiendo las guías internacionales14.
Para la PR se usó un polígrafo respiratorio (Stardust, Respironics®) previamente validado15, que permite el registro del flujo aéreo mediante cánula nasal, movimientos respiratorios con banda torácica, saturación de oxígeno, frecuencia cardíaca y posición corporal. Las definiciones de apnea e hipopnea fueron las mismas que para la polisomnografía, aunque, dado que la PR no dispone de registro de las variables neurológicas, para la hipopnea se exigió siempre la presencia de desaturación de al menos el 3%, obteniendo finalmente el índice de apneas-hipopneas (IAH), expresado como el número total de eventos dividido por el tiempo de registro. Todas las señales se integraron en un sistema informático y fueron revisadas manualmente por un observador entrenado. Para la pulsioximetría se utilizó un pulsioxímetro Nonin 5000® a una frecuencia de muestreo de 5 s; se consideró desaturación un descenso de al menos el 3% sobre la media de saturación del minuto previo. El registro se recogió en un sistema informático para revisar el trazado raíz de forma manual a intervalos de 1 min16. Se obtuvo así el índice de desaturaciones, definido como el número total de desaturaciones dividido por el tiempo de registro. Todas las exploraciones se realizaron en una cama individual destinada a tal efecto, con seguimiento continuo de enfermería.
El punto de corte para diagnosticar SAHS fue de al menos 3/h, de acuerdo con el reciente Consenso Nacional sobre el SAHS12, estimado por el IAR, IAH o el índice de desaturaciones; grado leve entre 3 y 5/h; moderado entre 5 y 10/h, y grave, superior a 10/h. El diagnóstico de hipoventilación se efectuó por la presencia de un tiempo de al menos el 10% de trazado con saturación inferior al 90%, junto con una presión arterial de anhídrido carbónico en vigilia superior a 45 mmHg.
Grupos de pacientes
Tras la evaluación de las características globales de los pacientes estudiados se realizó un estudio comparativo de las características antropométricas, clínicas y evolutivas, así como del estudio poligráfico nocturno, para lo cual se dividió a los pacientes en 2 grupos: pacientes con diagnóstico de SAHS secundario a hipertrofia amigdalar/adenoidea (grupo A), y pacientes con SAHS y enfermedad concomitante (grupo B). Este último grupo estuvo constituido por pacientes previamente diagnosticados de enfermedades que podían predisponer al TRS (dismorfias del macizo facial, síndrome de Down, etc.), pero a los que se había evaluado igualmente por roncopatía o síntomas de sospecha de SAHS.
Protocolo terapéutico
Tras el diagnóstico, se remitió a los pacientes de forma preferente al Servicio de Otorrinolaringología, si la actitud terapéutica considerada era la adenoamigdalectomía, y a cirugía maxilofacial si precisaban tratamiento quirúrgico maxilar. A los niños que precisaron presión positiva continua de la vía aérea (CPAP)/BiPAP® se les ofreció utilizar inicialmente la mascarilla nasal en vigilia durante una semana antes de iniciar el tratamiento, para que se familiarizaran con ella. Una vez adaptados, se les realizó un estudio hospitalario de titulación mediante polisomnografía. Para el seguimiento, se volvió a entrevistar a todos los padres con los mismos cuestionarios del inicio. A los niños sin enfermedad concomitante se les realizó un estudio de sueño de control a los 6-12 meses de la intervención quirúrgica. A los niños con ventilación se les siguió de forma continua, con revisiones en consultas externas mensuales al principio y posteriormente trimestrales; se les repitió el estudio mediante polisomnografía a los 3 meses y, con posterioridad, según clínica y crecimiento.
Para evaluar la respuesta al tratamiento se combinaron síntomas y criterios poligráficos (mediante polisomnografía o PR hospitalaria). Así, se consideró curación cuando desaparecieron los síntomas y el IAR/IAH era inferior a 3/h; mejoría cuando persistía el 50% de los síntomas y/o el IAR/IAH había descendido más del 50% del previo, y no curación cuando persistían los síntomas y/o no había cambios en los parámetros de los estudios del sueño.
Análisis estadístico
Se empleó una medida de tendencia central para las variables numéricas, expresadas como media ± desviación estándar, y se obtuvo la distribución de frecuencias de las variables cualitativas, expresadas en porcentaje. Para la comparación de las variables cualitativas entre grupos se empleó el test de Fisher, y para las numéricas, el test de la t de Student para muestras no emparejadas, o el test de Mann-Whitney cuando éstas no siguieron una distribución normal. Se consideró significativo un valor de p < 0,05. Todos los cálculos se efectuaron con el paquete estadístico SPSS versión 12 (SPSS, Inc., Chicago, IL, EE.UU.).
Resultados
Durante un período de 10 años se estudió a 42 pacientes con sospecha de TRS 24 niños y 18 niñas; edad media ± desviación estándar de 8 ± 4 años, IMC de 19,6 ± 5,2 kg/m2, perímetro del cuello de 29 ± 4 cm, percentil de IMC de 67 ± 36, percentil de peso de 67 ± 37 (con un porcentaje de obesos del 17%), remitidos desde los servicios de Pediatría (38%), Otorrinolaringología (31%), Neumología (26%), Neurología (2,5%) y Cirugía Maxilofacial (2,5%). Se encontraban sanos 26 niños y 16 presentaban enfermedad concomitante: síndrome de Down (n = 3), síndrome de Prader-Willi (n = 3), fibrosis quística (n = 2), asma (n = 3), discinesia ciliar (n = 1), obesidad mórbida (n = 1), síndrome de Pierre Robin (n = 1), síndrome de Rett (n = 1) y enfermedad neuromuscular (n = 1).
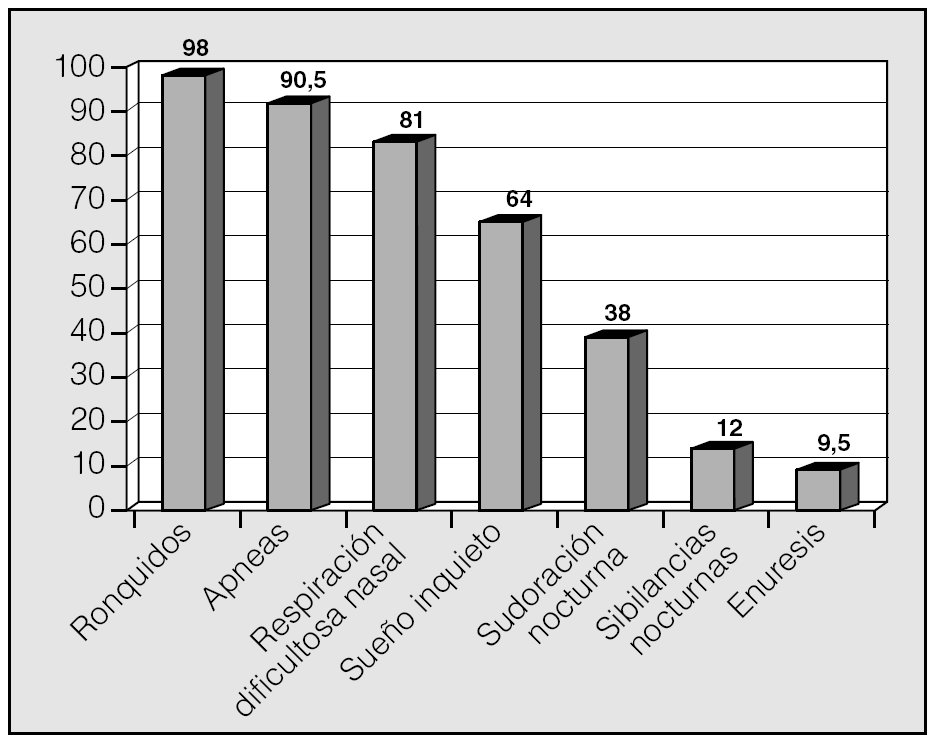
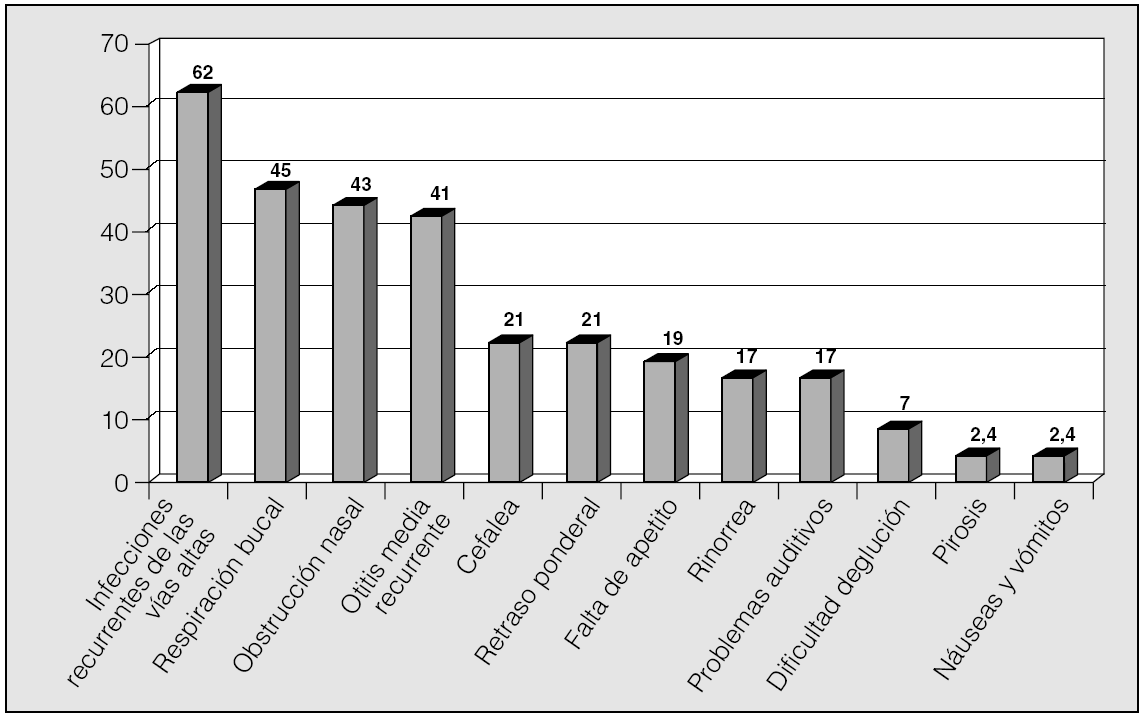
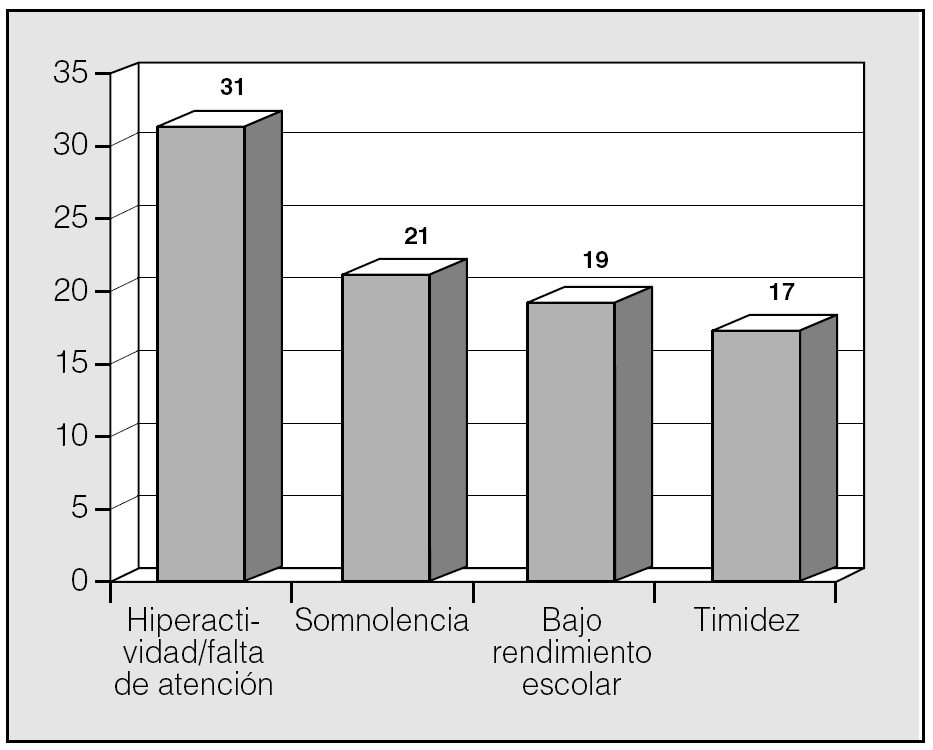
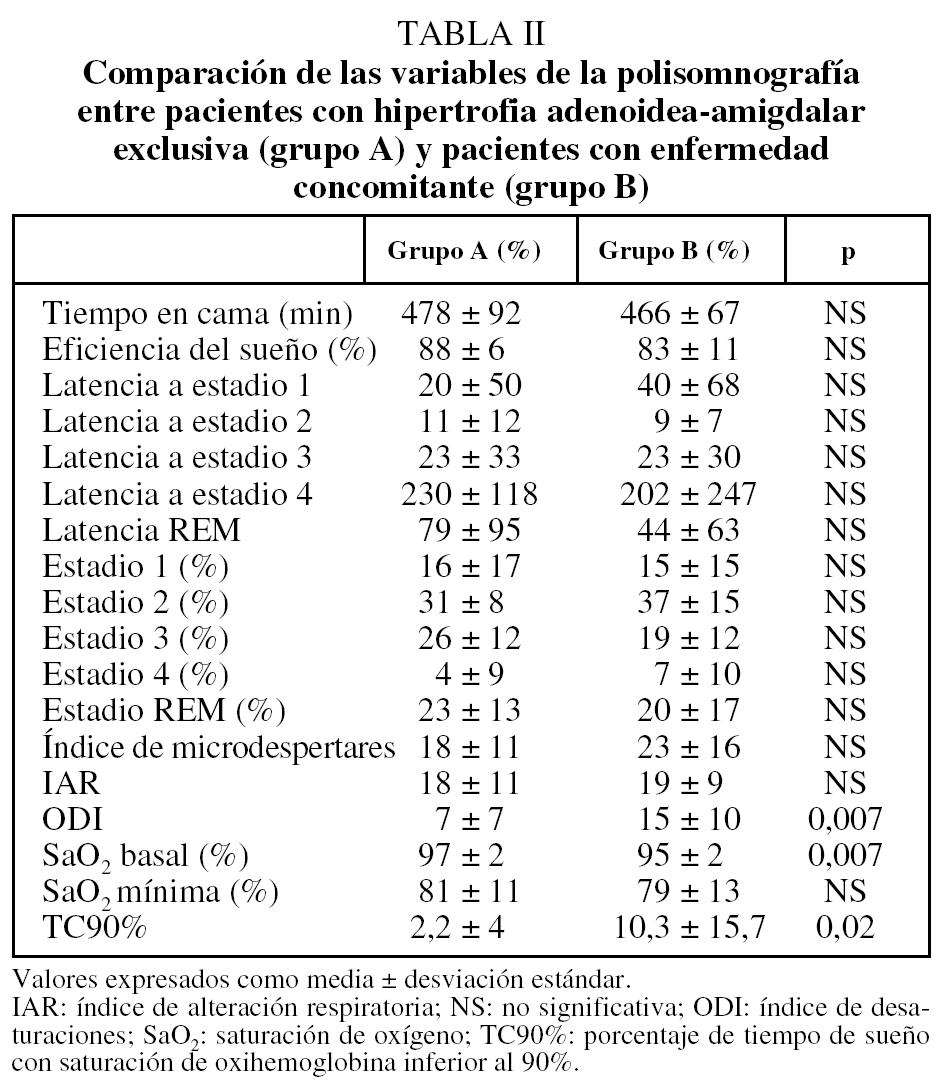
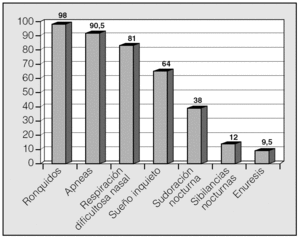
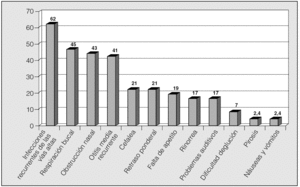
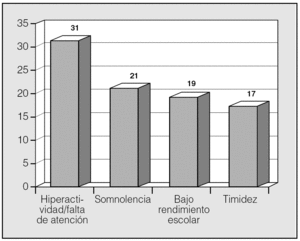
Las manifestaciones clínicas en el conjunto de los pacientes fueron, por orden de frecuencia: ronquidos (98%), apneas (90,5%), respiración dificultosa nocturna (81%), sueño inquieto (64%), infecciones recurrentes de las vías altas (62%), obstrucción nasal (43%), respiración bucal (45%), otitis media recurrente (41%), sudación nocturna (38%), hiperactividad/falta de atención (31%), somnolencia (21%), cefalea (21%), retraso ponderal (21%), falta de apetito (19%), bajo rendimiento escolar (19%), rinorrea (17%), timidez (17%), problemas auditivos (17%), sibilancias nocturnas (12%), enuresis (9,5%), dificultad en la deglución (7%), pirosis (2,4%), náuseas y vómitos (2,4%). En la figura 1 se expresan las manifestaciones nocturnas; en la figura 2, las diurnas, y en la figura 3, las de tipo neuropsíquico. Los factores predisponentes fueron uno o más de los siguientes: hipertrofia amigdalar (76%), adenoidea (48%), sobrepeso (36%), alteraciones del macizo facial (31%), paladar ojival (21,4%), macroglosia (7%) y dolicocefalia (7%), presentando 6 de los pacientes amigdalectomía previa (14,3%). El porcentaje de pacientes con un IMC superior o igual al percentil 97 por edad y sexo fue del 17%.
Fig. 1. Manifestaciones nocturnas del síndrome de apneas-hipopneas durante el sueño en niños, por orden de frecuencia.
Fig. 2. Manifestaciones diurnas del síndrome de apneas-hipopneas durante el sueño en niños, por orden de frecuencia.
Fig. 3. Manifestaciones neuropsíquicas del síndrome de apneas-hipopneas durante el sueño en niños, por orden de frecuencia.
Para el diagnóstico se efectuaron 26 polisomnografías (62%), 11 PR hospitalarias (26%) y 5 pulsioximetrías (12%). La intensidad de la afectación se consideró leve en 1 caso (4%), moderada en 7 (23%) y grave en 22 (73%). El diagnóstico final fue SAHS secundario a hipertrofia amigdalar o adenoidea exclusivamente en 26 pacientes (62%), y en 16 distintos factores combinados provocaban el SAHS (38%), que se acompañaba de hipoventilación en 3 (7%).
La actitud terapéutica fue amigdalectomía con/sin adenoidectomía o cirugía maxilar en el 71,4%, CPAP en el 19% y BiPAP® en 2 niños con síndrome de Prader-Willi (5%) que cumplieron criterios de hipoventilación asociada. De los 9 niños tratados con CPAP o BiPAP®, uno no logró adaptarse, 2 se consideraron malos cumplidores y 6 cumplieron más de 6 h diarias, lo que supone un cumplimiento global de un 60%.
Tras el tratamiento se consideró que había curación en el 54% de los pacientes, mejoría en el 40% y persistencia en el 3%; un paciente con síndrome de Prader-Willi presentó muerte súbita nocturna al abandonar temporalmente la ventilación nocturna con BiPAP®. El niño que no aceptó el tratamiento se perdió en el seguimiento.
Al comparar las características antropométricas de los grupos A (niños con hipertrofia amigdalar exclusiva) y B (niños con enfermedades concomitantes) no se observaron diferencias en la edad (7,7 ± 3,9 frente a 8,4 ± 3,9 años; p = no significativa [NS]), el sexo, el IMC (17,6 ± 4 frente a 20,4 ± 6 kg/m2; p = NS), el perímetro del cuello (29,3 ± 4,7 frente a 30,7 ± 3,5 cm; p = NS) el percentil del IMC (61 ± 37 frente a 76 ± 34; p = NS) ni el percentil de peso (61 ± 42 frente a 71 ± 33; p = NS). Aunque el porcentaje de obesos en el grupo con hipertrofia amigdalar fue inferior (un 14 frente al 28% en el grupo con enfermedad concomitante), esta diferencia no fue significativa.
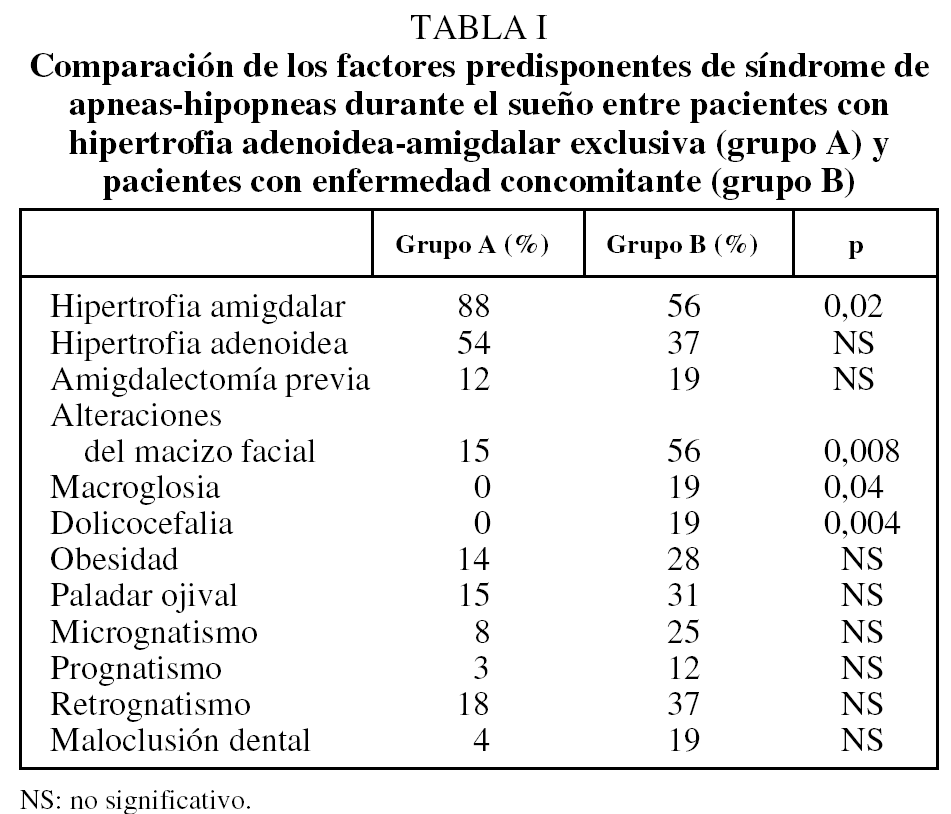
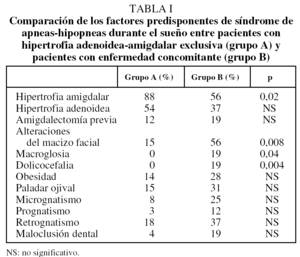
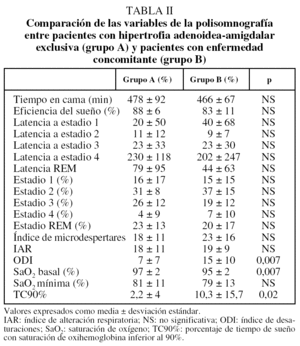
No hubo diferencias entre ambos grupos por lo que se refiere a las manifestaciones clínicas tanto nocturnas como diurnas. Al comparar los factores predisponentes, en el grupo A fue más frecuente la hipertrofia amigdalar, mientras que las alteraciones del macizo facial, la macroglosia y la dolicocefalia lo fueron en el B. En la tabla I se muestra la comparación de los factores predisponentes en ambos grupos. Respecto a la polisomnografía, no se observaron diferencias en las variables neurofisiológicas ni en el IAR, aunque el grupo A presentó mayor saturación de oxígeno basal, menor índice de desaturaciones y menor porcentaje de tiempo de sueño con saturación de oxihemoglobina inferior al 90% (tabla II).
Se practicó amigdalectomía a 23 pacientes del grupo A (88,5%) frente a 7 (44%) del B (p = 0,003). En el grupo B recibieron CPAP 7 pacientes (44%), frente a uno (3,8%) en el A (p = 0,003). Los 2 pacientes tratados con BiPAP® pertenecían igualmente al grupo B. Además, en este grupo se realizó cirugía del maxilar inferior a 2 niños y cirugía ortodóncica a uno.
La evolución del SAHS (valorada por la suma de la respuesta clínica y el estudio poligráfico nocturno) con uno o más tratamientos combinados fue más favorable en el grupo A (p = 0,04), si bien no se consideró curado a ningún paciente de ambos grupos al aplicar la combinación de criterios clínicos y poligráficos.
Discusión
El SAHS es una entidad clínica bien conocida en los adultos, pero ha sido menos estudiada en la edad pediátrica. El SAHS infantil, que afecta al 1-3% de los niños6, difiere del adulto tanto en su etiología como en sus manifestaciones clínicas, diagnóstico y tratamiento. Su principal factor predisponente es la hipertrofia adenoamigdalar, aunque el aumento de la prevalencia de obesidad en la media infancia y adolescencia puede estar favoreciendo este factor de riesgo7. Otros factores son las malformaciones craneales y el estrechamiento anatómico de la vía aérea superior, las enfermedades neuromusculares, la disminución del tono de la vía aérea superior y la prematuridad17,18.
El SAHS no tratado se asocia a trastornos neurocognitivos y cardiovasculares. En un metaanálisis reciente cuyo objetivo era determinar si existe relación con la enfermedad cardiovascular en niños, se observó que el riesgo está aumentando, pero todavía no existe una evidencia adecuada de su asociación con anormalidades detectables11.
A diferencia de lo observado en adultos, el perfil de niño obeso, con tendencia al sueño y roncador sólo corresponde a una pequeña parte de los niños con SAHS. Por el contrario, la mayoría tiene retraso ponderal y son hiperactivos durante el día18. En este sentido, en nuestra serie la somnolencia se apreció sólo en el 21% de los casos, mientras que el retraso ponderal y las alteraciones del comportamiento fueron más frecuentes. No obstante, recientemente se ha descrito que hasta en un 43% puede objetivarse somnolencia, si se emplean cuestionarios específicos y se valoran las variables neurofisiológicas de la polisomnografía19.
No se conocen la historia natural y el pronóstico a largo plazo del SAHS pediátrico, aunque las complicaciones pueden abarcar desde el ronquido simple hasta trastornos del comportamiento, falta de crecimiento, cor pulmonale o incluso muerte súbita20, como sucedió en uno de nuestros pacientes. Por otra parte, los niños con SAHS son grandes consumidores de servicios de salud un año antes del diagnóstico y tratamiento, por lo que una intervención temprana puede ser coste-efectiva21.
El método diagnóstico de referencia es la polisomnografía nocturna22,23, si bien se han propuesto métodos diagnósticos sencillos24,25, como el índice de Brouillette26, aunque otros han cuestionado su validez para predecir la probabilidad de SAHS24. También Brouillette et al27 demostraron que, cuando la historia clínica es indicativa de SAHS, una pulsioximetría anormal presenta un valor predictivo positivo del 97%. Sin embargo, una pulsioximetría normal no excluye SAHS leve o moderado, ya que sólo el 44% de los pacientes con SAHS comprobado por polisomnografía muestran resultados anormales en la pulsioximetría27. Igualmente, hay que ser cautelosos ante un test abreviado positivo, ya que la tasa de falsos positivos es elevada28. La PR, empleada en el 26% de nuestros pacientes, no está plenamente validada en niños, aunque existen trabajos prometedores29; unida a criterios clínicos y vídeo doméstico, puede ser una buena aproximación al diagnóstico inicial de niños con sospecha clínica de SAHS30.
En una cohorte de niños de 6 a 11 años se observó que el ronquido, la somnolencia diurna y los problemas de aprendizaje eran por sí mismos muy específicos pero poco sensibles para diagnosticar TRS. Sin embargo, combinando los 3 factores, la especificidad y el valor predictivo positivo eran lo bastante altos para señalar que muchos niños no requieren una polisomnografía para el diagnóstico31. Nuestro objetivo fue realizar polisomnografía, que practicamos al 62% de los pacientes; sólo en pocos casos realizamos pulsioximetría (12%), que fue sustituida por PR hospitalaria en los más urgentes.
Los pacientes con SAHS y enfermedad concomitante merecen un comentario especial. En este grupo incluimos a niños con asma y fibrosis quística, entre otras afecciones. Se ha demostrado que el ronquido y las apneas observadas son más prevalentes en pacientes con síntomas de asma, y se ha apuntado una asociación con los TRS32. Además, se ha encontrado asociación entre obesidad y sibilancias, de tal manera que algunos autores señalan que esta relación debe de estar en parte mediada por algunos factores asociados con TRS, como la obesidad33,34. Los niños con síndrome de Down tienen más riesgo de presentar SAHS debido a la conjunción de factores como micrognatia, hipotonía, macroglosia e hipoplasia mediofacial, junto con obesidad, además de hipertrofia adenoamigdalar34. En un estudio en el que se efectuó PR a 108 niños con síndrome de Down, se concluyó que la prevalencia de TRS era del 55%, y que era mayor en niños que en niñas35. Del mismo modo, en otro reciente trabajo realizado en 56 niños de 2 a 4 años, se diagnosticó SAHS al 57%, porcentaje que se elevó al 80% si se tenía en cuenta un índice de microdespertares patológico. Por lo tanto, en estos niños se recomienda realizar una polisomnografía aun cuando los padres no refieran sospecha de un trastorno de sueño en su hijo36. En el síndrome de Prader-Willi hay una elevada prevalencia de SAHS (IAH > 10/h en el 69%) y es común la obesidad, asociándose a trastornos respiratorios del sueño más graves. Estos pacientes presentan excesiva somnolencia diurna, aumento de la impulsividad, trastornos del comportamiento seudoautista37 y una amplia variedad de anomalías respiratorias, como SAHS e hipoventilación nocturna. La anormal respuesta a la hipoxia en estos pacientes puede conllevar alta morbilidad, e incluso muerte súbita34,37, como sucedió en uno de nuestros casos al abandonar transitoriamente el tratamiento.
Las evidencias sobre las consecuencias clínicas del SAHS son abrumadoras, por lo que la actitud expectante no está justificada30. El tratamiento de elección es la adenoamigdalectomía, que es curativa en la mayoría cuando no hay comorbilidad asociada38-41. En un metaanálisis reciente, en el que se incluyeron aquellos estudios en que se realizaba polisomnografía antes y después del tratamiento quirúrgico, y en los que se excluyó a los niños con comorbilidad importante, incluidos síndromes craneofaciales, obesidad mórbida o enfermedades neuromusculares, el tratamiento fue efectivo en el 83%41. No obstante, el SAHS residual puede estar presente en un porcentaje elevado, por lo que se debería comprobar de forma sistemática su completa resolución. En nuestro trabajo, 3 niños presentaron SAHS residual tras la adenoamigdalectomía, aunque todos pertenecían al grupo de enfermedad concomitante, en el que la probabilidad de SAHS residual es mayor42.
En una serie de casos con SAHS clínico a los que se practicó adenoamigdalectomía, se observó que los niños menores de 3 años tenían alrededor de 2 veces más riesgo de presentar complicaciones (10%) que aquéllos con mayor edad43,44. Estos datos deben tenerse en cuenta para valorar si a un paciente se le debe realizar cirugía ambulatoria o debe permanecer ingresado. Además, la adenoamigdalectomía disminuye significativamente el uso de recursos sanitarios en niños con SAHS. Los niños no tratados consumen muchos recursos, y su elevada morbilidad está principalmente asociada a infecciones del tracto respiratorio superior (en nuestra serie, el 62%)45. Se ha constatado mejoría en el comportamiento y en la capacidad de atención en niños de 4 a 11 años transcurridos 3 meses después de la adenoamigdalectomía10, así como una correlación entre el incremento de peso y la disminución de la hiperactividad un año después de la intervención40 y mejoría de la enuresis nocturna46.
La CPAP está indicada sobre todo para los pacientes que no presentan respuesta o sólo una respuesta parcial a la adenoamigdalectomía, y en aquéllos con factores predisponentes29,38,47. En un estudio retrospectivo en el que se incluyó a 80 niños tratados con CPAP, muchos con síndromes congénitos o malformaciones, se concluyó que este tratamiento era efectivo en el 90% de los casos y, en general, bien tolerado48. Marcus et al47 han comprobado que tanto la CPAP como BiPAP® son muy eficaces en el SAHS pediátrico, pero se asocian a una elevada tasa de abandonos (un tercio de los pacientes), e incluso en los niños cumplidores el número de horas de uso es subóptimo (5,3 h de media). El cumplimiento en nuestra serie alcanzó un 60%, lo cual está en la línea de la literatura médica.
En los casos secundarios a hipoplasia mandibular se ha comprobado la mejoría del SAHS a largo plazo tras la cirugía de tracción mandibular8, tal como sucedió en 2 de nuestros casos, si bien el tratamiento inicial en un paciente con síndrome de Pierre-Robins fue la CPAP nasal, con un grado de adaptación y cumplimiento óptimo hasta que pudo intervenirse al paciente, 4 años más tarde, tras el crecimiento.
Es conocida la presencia de eventos residuales incluso después de la cirugía y, dado que muchos pacientes asocian síndromes complejos u obesidad, consideramos que debe realizarse una técnica de comprobación, aunque sea abreviada, para evaluar la necesidad de tratamiento complementario49. Aunque en nuestro estudio en la mayoría la comprobación fue mediante polisomnografía, probablemente la PR sea en el futuro suficiente.
Nuestro trabajo presenta unas limitaciones potenciales. Por una parte, debido al empleo de distintos métodos diagnósticos, los resultados podrían no ser homogéneos. A este respecto, en la mayoría de los pacientes se recurrió a la polisomnografía, y las diferencias que pudiera haber entre los distintos métodos quedan en gran parte subsanadas al utilizar un índice de eventos respiratorios común para los 3 métodos utilizados. Aunque nuestro estudio es retrospectivo, a lo largo de los años se empleó el mismo protocolo de recogida de datos, administrado por los 2 investigadores principales, los cuales efectuaron asimismo las revisiones manuales de los estudios poligráficos nocturnos.
De nuestro trabajo concluimos que los niños con SAHS cursan con un elevado porcentaje de infecciones de repetición, retraso ponderal, hiperactividad y manifestaciones neuropsíquicas, mientras que son muy poco frecuentes la somnolencia y la obesidad, la cual se asocia a enfermedad concomitante. Aunque la mayoría necesitará tratamiento quirúrgico para su resolución, hasta un tercio de los pacientes precisará tratamiento con CPAP/BiPAP®. Además, los niños con SAHS y enfermedad concomitante no muestran características especiales en su expresión clínica, aunque tienden a ser más obesos, presentan mayores alteraciones del macizo facial y mayor hipoventilación nocturna. Con frecuencia precisarán tratamiento combinados, como CPAP/BiPAP®, además de cirugía.
Correspondencia: Dra. M. Llombart.
Sección de Neumología. Hospital Universitari Sant Joan d'Alacant.
Ctra. Alicante-Valencia, s/n. 03550 San Juan de Alicante. Alicante. España.
Correo electrónico: llombart_mon@gva.es.
Recibido: 9-10-2006; aceptado para su publicación: 3-4-2007.