El nuevo coronavirus SARS-CoV-2 ha supuesto un problema sanitario mundial sin precedentes, y ha ocasionado más de 250.000 muertes confirmadas. La enfermedad producida por este virus, denominada COVID-19, cursa con presentaciones clínicas variables, desde cuadros paucisintomáticos y procesos catarrales hasta neumonías graves que evolucionan rápidamente a síndrome de distrés respiratorio agudo (SDRA) y fallo multiorgánico. En las últimas semanas se han publicado algunos trabajos que describen alteraciones de la coagulación y complicaciones trombóticas arteriales y venosas en estos pacientes, principalmente entre aquellos ingresados en unidades de cuidados intensivos. Las infecciones desencadenan una respuesta inmunitaria, que provoca la liberación de distintos mediadores inflamatorios a la sangre. Entre ellos se encuentran las citocinas, que interaccionan con las plaquetas y con distintas proteínas de la coagulación, y favorecen la trombogénesis. Uno de los marcadores de la coagulación más estudiados en la COVID-19 es el dímero D (DD), y su elevación tiene implicaciones pronósticas, aunque no se ha aclarado el mejor punto de corte para el diagnóstico de enfermedad tromboembólica venosa (ETEV) en esta población ni su utilidad para decidir la intensidad de la tromboprofilaxis para estos pacientes. Hasta disponer de información suficientemente robusta (preferentemente de ensayos clínicos bien diseñados), se deberían seguir las recomendaciones de las guías de práctica clínica para la profilaxis, diagnóstico y tratamiento de la ETEV en los pacientes COVID-19.
The new SARS-CoV-2 coronavirus has created an unprecedented global health problem, resulting in more than 250,000 confirmed deaths. The disease produced by this virus, called Covid-19, presents with variable clinical manifestations, from practically asymptomatic patients with catarrhal processes to severe pneumonias that rapidly evolve to acute respiratory distress syndrome (ARDS) and multiorgan failure. In recent weeks, papers have been published describing coagulation disorders and arterial and venous thrombotic complications in these patients, mainly among those admitted to intensive care units. The infection triggers an immune response, which causes different inflammatory mediators to be released into the blood. These include cytokines, which interact with platelets and different coagulation proteins, and promote thrombogenesis. One of the most widely studied coagulation markers in Covid-19 is D-dimer (DD), raised levels of which have prognostic implications, although the best cut-off point for the diagnosis of venous thromboembolism (VTE) in this population has not been clarified, nor has its usefulness in determining the intensity of thromboprophylaxis required in these patients. Until sufficiently robust information (preferably from well-designed clinical trials) is available, the recommendations of clinical practice guidelines for the prophylaxis, diagnosis and treatment of VTE should be followed in Covid-19 patients.
A finales de 2019 las autoridades chinas informaron a la Organización Mundial de la Salud (OMS) sobre la aparición de neumonías atípicas de origen incierto en la ciudad de Wuhan. El 7 de enero de 2020 identificaron el microorganismo causante, un nuevo tipo de virus de la familia Coronaviridae denominado SARS-CoV-2. La enfermedad asociada a la infección por el SARS-CoV-2 se ha denominado COVID-19 y abarca desde casos asintomáticos hasta casos graves que evolucionan rápidamente a síndrome de distrés respiratorio agudo (SDRA) y a la muerte.1 El virus se ha propagado rápidamente y actualmente afecta a países de todo el mundo. En el momento de la publicación de esta revisión, la COVID-19 ha sido diagnosticada en más de 7.000.000 de pacientes y ha causado más de 400.000 muertes (Centers for Disease Control and Prevention [CDC], WHO; 10 de junio de 2020).
Desde el inicio de la actual pandemia se han publicado múltiples trabajos sobre diferentes aspectos de la enfermedad. Algunos de estos trabajos apuntan a que esta infección ocasiona una coagulopatía que predispone a la aparición de complicaciones trombóticas arteriales y venosas.
Por todo ello, este documento revisa la literatura actual sobre aspectos claves relacionados con la prevención, diagnóstico y tratamiento de la enfermedad tromboembólica venosa (ETEV) en pacientes con COVID-19.
Coagulopatía asociada a COVID-19La enfermedad grave por SARS-CoV-2 se asocia a un estado de hipercoagulabilidad.2–9 El patrón de coagulopatía más común se caracteriza por elevación en los niveles de fibrinógeno y DD. A diferencia del patrón que se observa en la coagulación intravascular diseminada (CID) clásica producida en la sepsis, la trombocitopenia asociada a la COVID-19 es leve y hay un consumo escaso de los factores de coagulación.10–12 La tabla 1 resume las principales características de la coagulopatía asociada a COVID-19.
Características de la coagulopatía asociada a COVID-19
| La coagulopatía asociada a la COVID-19 se caracteriza por elevación del fibrinógeno y del DD, discreta elevación del TP y el TTPa, y leve trombocitopenia en las primeras etapas de la enfermedad (2-8,11,12,16,20-22) |
| Los niveles de IL-6 muestran una correlación positiva con el aumento del fibrinógeno (16) |
| La coagulopatía parece estar relacionada con la gravedad de la enfermedad y la inflamación asociada, y no con la actividad viral intrínseca (11) |
| El DD elevado al ingreso se asocia con una mayor mortalidad (6) |
| El aumento progresivo del DD durante la hospitalización se asocia con fallo multiorgánico y CID (11) |
| Los datos sobre las manifestaciones hemorrágicas en la COVID-19 son muy escasos, aunque parecen no ser comunes a pesar de la coagulopatía (2-5,7-9,21) |
CID: coagulopatía intravascular diseminada; DD: dímero D; IL-6: interleucina 6; TP: tiempo de protrombina; TTPa: tiempo de tromboplastina parcial activada.
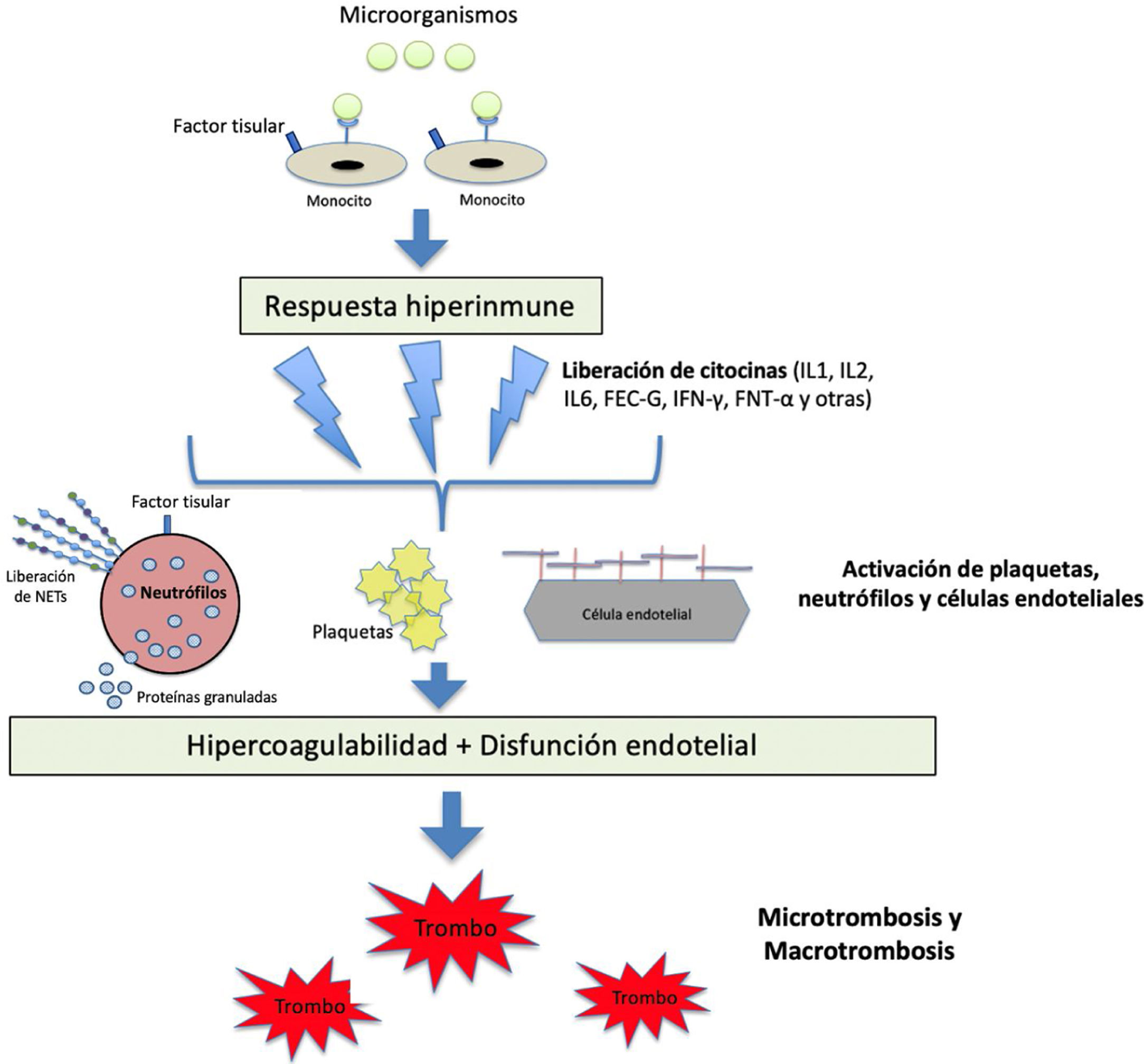
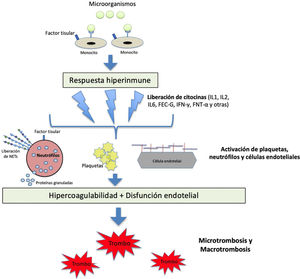
La sepsis es una complicación sistémica grave de las enfermedades infecciosas, sobre todo bacterianas, y se caracteriza por un estado procoagulante, proinflamatorio y antifibrinolítico, que incluye múltiples estirpes celulares con potencial inflamatorio que producen daño endotelial. Entre ellas se incluyen monocitos, macrófagos, neutrófilos y el propio endotelio vascular, que actúan liberando diversas citocinas, como las interleucinas 1 (IL-1) y 6 (IL-6), el factor de necrosis tumoral alfa (TNF-α) y otros mediadores inflamatorios. La IL-6 expresa factor tisular que tiene capacidad para activar la vía extrínseca de la coagulación, que conduce a la generación de trombina y fibrina, que se deposita en la microcirculación.13 Cuando estos mecanismos se activan de forma indiscriminada, se origina el cuadro conocido como CID, que se caracteriza por la presencia de trombocitopenia, consumo de los factores de la coagulación y niveles elevados de productos de degradación de la fibrina, como el DD.13–15 La figura 1 describe la fisiopatología de la respuesta inmunotrombótica en situación de sepsis.
Fisiopatología de la activación de la coagulación en situación de sepsis.
Los patógenos y sus componentes estimulan a los monocitos a través de receptores específicos situados en su superficie celular. Los monocitos activados producen una respuesta hiperinmune con liberación de distintas citocinas y otros mediadores inflamatorios, que activan plaquetas, neutrófilos y células endoteliales. Se produce un estado de hipercoagulabilidad y daño endotelial que modifica las propiedades del endotelio de un estado anticoagulante a uno procoagulante a través de la interrupción del glicocalix y la expresión del factor de von Willebrand (FVW). Por su parte, los neutrófilos expresan factor tisular y liberan proteínas granuladas y otros mediadores procoagulantes, como las trampas extracelulares de neutrófilos (NETs), compuestas de ADN procoagulante, histonas y otros patrones moleculares asociados al daño celular. Todo lo anterior lleva al desarrollo de los fenómenos micro y macrotrombóticos.
FEC-G: factor estimulante de colonias de granulocitos; FNT-α: factor de necrosis tumoral alfa; IFN-γ: interferón gamma; IL: inteleucina; NETs: trampas extracelulares de neutrófilos.
En la infección por SARS-CoV-2, los mecanismos que activan la coagulación no están completamente aclarados, pero parecen relacionarse también con la respuesta inflamatoria, más que con las propiedades virulentas específicas del germen.11 Se postula que la activación excesiva del sistema inmune innato causa una tormenta de citocinas que ocasiona daño en el sistema microvascular y activa el sistema de coagulación. De este modo, se ha descrito cómo los pacientes con infección grave por SARS-CoV-2 presentan una respuesta inflamatoria excesiva, con linfopenia, niveles altos de ferritina, de DD, y de los receptores de IL-2 (IL-2R), IL-6 y TNF-α.11,12 En un trabajo de Ranucci et al. que incluyó 16 pacientes COVID-19 con SDRA que requirieron ventilación mecánica, se objetivó un estado procoagulante basal, consistente en elevación del DD (5,5 mg/L) e hiperfibrinogenemia (794 mg/dL).16 Los niveles de fibrinógeno se asociaron de forma significativa (p = 0,003) con los de IL-6, lo que sugiere un vínculo entre la inflamación y el estado procoagulante.16
Otro de los posibles factores implicados en la coagulopatía asociada a COVID-19 es la hipoxia, característica de los casos de neumonía grave. Durante la respuesta celular a la hipoxia se activan factores transcripcionales tales como el complejo activador de proteína-1 (AP-1), factor de crecimiento de respuesta temprana-1 (Egr-1), NF-B y factores inducidos por hipoxia (HIF). El más estudiado es el HIF-1 que, bajo condiciones de hipoxia, es responsable de la activación de una serie de proteínas implicadas en el mantenimiento de la homeostasis vascular17 (factor de crecimiento del endotelio vascular [VEGF] y eritropoyetina [EPO]), favorecedoras de un estado procoagulante tal y como se ha estudiado en pacientes con cáncer.18 Algunos autores sugieren que la infección por SARS-CoV-2 facilita la inducción de una endotelitis en el lecho vascular pulmonar, consecuencia de la replicación viral rápida, que causa apoptosis masiva de células endoteliales y desencadena la pérdida de la función anticoagulante de la luz vascular.19
En resumen, la infección grave por COVID-19 se asocia a anomalías de la coagulación que recuerdan a la CID clásica, pero con características propias, que probablemente la hacen relevante dada la alta incidencia de complicaciones tromboembólicas observadas en pacientes graves.
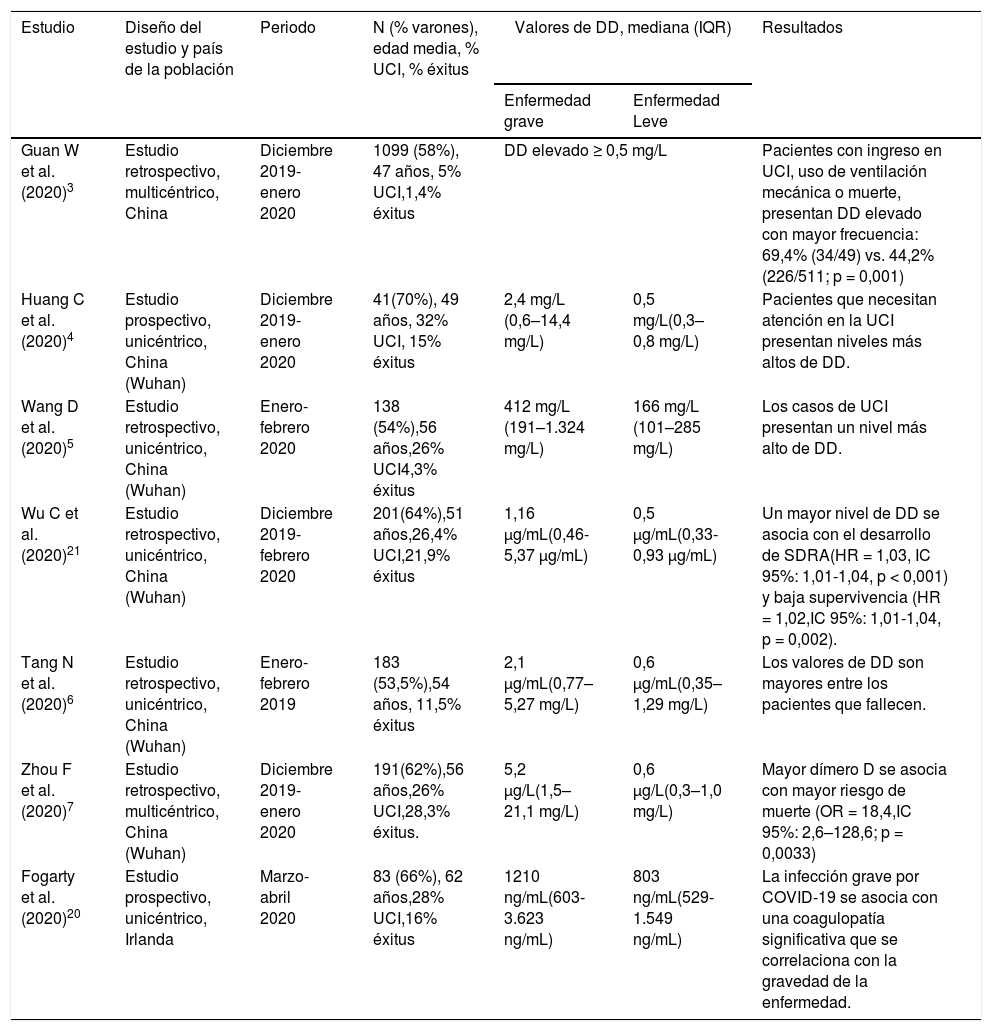
Dímero D y COVID-19La evidencia actual muestra que los valores de DD están elevados en los pacientes con COVID-19, y esta elevación se correlaciona positivamente con la gravedad de la presentación y con el pronóstico de la enfermedad.3–7 La tabla 2 presenta los resultados de los principales estudios que han analizado los valores de DD en pacientes con COVID-19.3–7,20,21
Dímero D y COVID-19
| Estudio | Diseño del estudio y país de la población | Periodo | N (% varones), edad media, % UCI, % éxitus | Valores de DD, mediana (IQR) | Resultados | |
|---|---|---|---|---|---|---|
| Enfermedad grave | Enfermedad Leve | |||||
| Guan W et al. (2020)3 | Estudio retrospectivo, multicéntrico, China | Diciembre 2019- enero 2020 | 1099 (58%), 47 años, 5% UCI,1,4% éxitus | DD elevado ≥ 0,5 mg/L | Pacientes con ingreso en UCI, uso de ventilación mecánica o muerte, presentan DD elevado con mayor frecuencia: 69,4% (34/49) vs. 44,2%(226/511; p = 0,001) | |
| Huang C et al. (2020)4 | Estudio prospectivo, unicéntrico, China (Wuhan) | Diciembre 2019-enero 2020 | 41(70%), 49 años, 32% UCI, 15% éxitus | 2,4 mg/L (0,6–14,4 mg/L) | 0,5 mg/L(0,3–0,8 mg/L) | Pacientes que necesitan atención en la UCI presentan niveles más altos de DD. |
| Wang D et al. (2020)5 | Estudio retrospectivo, unicéntrico, China (Wuhan) | Enero-febrero 2020 | 138 (54%),56 años,26% UCI4,3% éxitus | 412 mg/L (191–1.324 mg/L) | 166 mg/L (101–285 mg/L) | Los casos de UCI presentan un nivel más alto de DD. |
| Wu C et al. (2020)21 | Estudio retrospectivo, unicéntrico, China (Wuhan) | Diciembre 2019-febrero 2020 | 201(64%),51 años,26,4% UCI,21,9% éxitus | 1,16 μg/mL(0,46-5,37 μg/mL) | 0,5 μg/mL(0,33-0,93 μg/mL) | Un mayor nivel de DD se asocia con el desarrollo de SDRA(HR = 1,03, IC 95%: 1,01-1,04, p < 0,001) y baja supervivencia (HR = 1,02,IC 95%: 1,01-1,04, p = 0,002). |
| Tang N et al. (2020)6 | Estudio retrospectivo, unicéntrico, China (Wuhan) | Enero- febrero 2019 | 183 (53,5%),54 años, 11,5% éxitus | 2,1 μg/mL(0,77–5,27 mg/L) | 0,6 μg/mL(0,35–1,29 mg/L) | Los valores de DD son mayores entre los pacientes que fallecen. |
| Zhou F et al. (2020)7 | Estudio retrospectivo, multicéntrico, China (Wuhan) | Diciembre 2019-enero 2020 | 191(62%),56 años,26% UCI,28,3% éxitus. | 5,2 μg/L(1,5–21,1 mg/L) | 0,6 μg/L(0,3–1,0 mg/L) | Mayor dímero D se asocia con mayor riesgo de muerte (OR = 18,4,IC 95%: 2,6–128,6; p = 0,0033) |
| Fogarty et al. (2020)20 | Estudio prospectivo, unicéntrico, Irlanda | Marzo-abril 2020 | 83 (66%), 62 años,28% UCI,16% éxitus | 1210 ng/mL(603-3.623 ng/mL) | 803 ng/mL(529-1.549 ng/mL) | La infección grave por COVID-19 se asocia con una coagulopatía significativa que se correlaciona con la gravedad de la enfermedad. |
DD: dímero D; IQR: rango intercuartílico; HR: hazard ratio; OR: odds ratio; IC: intervalo de confianza; SDRA: síndrome de distrés respiratorio agudo; UCI: unidad de cuidados intensivos.
En una de las primeras series publicadas, que incluyó 1.099 pacientes recogidos de 552 hospitales de China, se encontró que el 46% de los pacientes presentaban cifras de DD por encima del punto de corte habitual (≥ 0,5 mg/L), particularmente en aquellos con enfermedad grave (60% en formas graves vs. 43% en formas leves; p = 0,002).3
Otros dos trabajos con datos de pacientes hospitalizados por COVID-19 en China encontraron que las medianas de DD al ingreso eran superiores en aquellos que precisaron ingreso en la unidad de cuidados intensivos (UCI) frente a los que no (2,4 mg/L vs. 0,5 mg/L; p = 0,004 y 414 mg/L vs. 166 mg/L; p < 0,001).4,5 Además, en los pacientes más graves la mediana del tiempo de protrombina (TP) también fue significativamente superior en los pacientes que acabaron precisando UCI (12,2 segundos vs. 10,7 segundos; p = 0,012)4
Por otra parte, el DD también se ha identificado como un marcador relacionado con el pronóstico de los pacientes COVID-19. En un estudio retrospectivo que incluyó 183 pacientes con COVID-19, la mediana de DD fue casi 3,5 veces superior en aquellos pacientes que fallecieron comparada con la de los que sobrevivieron (2,1 mg/L vs. 0,6 mg/L; p = 0,001).6 Los pacientes que fallecieron también presentaron más producto de degradación de la fibrina (7,6 mg/L vs. 4,0 mg/L; p < 0,001) y una mediana superior del TP (15,5 segundos vs. 13,6 segundos; p < 0,001). Cabe reseñar que la mayoría de los pacientes fallecidos presentaban CID según los criterios de la Sociedad Internacional de Trombosis y Hemostasia (ISTH), a diferencia de los supervivientes (71,4% vs. 0,6%).6 En la misma línea, Zhou et al. publicaron los datos de una cohorte retrospectiva de 191 pacientes COVID-19 y encontraron que los pacientes fallecidos presentaron una mediana de DD casi nueve veces superiores a la de los supervivientes (5,2 mg/L vs. 0,6 mg/L; p < 0,001).7 En el análisis multivariable encontraron que un valor de DD por encima de 1,0 mg/L al ingreso se asociaba de forma independiente a la mortalidad (odds ratio [OR] 18,4; intervalo de confianza [IC] del 95%, 2,6-128,6; p = 0,0033). Además, el TP fue significativamente superior en los pacientes fallecidos (12,1 segundos vs. 11,4 segundos; p = 0,0004).7
En un metaanálisis reciente de 553 pacientes con diagnóstico de COVID-19 (22% con ingreso en UCI), se determinó un punto de corte del DD de 3,0 mg/L para identificar a los pacientes graves.8
Microtrombosis asociada a COVID-19Los pacientes con COVID-19 a menudo evolucionan rápidamente a una situación de distrés respiratorio y fallo multiorgánico.3 La fisiopatología del SDRA en casos graves de infección por SARS-CoV-2 se atribuye principalmente a una respuesta hiperinmune del huésped. Las series de necropsias de pacientes fallecidos por COVID-19 muestran, en la mayoría de ellos, signos de daño alveolar difuso con neumocitos atípicos, así como signos de microtrombosis difusa a nivel periférico.21–24 Estos hallazgos podrían explicar la hipoxemia grave que caracteriza al SDRA de pacientes con COVID-19, consecuencia del trastorno ventilación-perfusión y de la pérdida del reflejo de vasoconstricción hipóxica, y apoyarían la hipótesis propuesta por algunos autores que sugieren que las formas graves de COVID-19 se relacionan con disfunción endotelial y trombosis microvascular. Así, se ha propuesto el concepto de MicroCLOTS (microvascular COVID-19 lung vessels obstructive thromboinflammatory syndrome) como hipótesis fisiopatológica del SDRA atípico asociado a COVID-19.25
No obstante, este fenómeno de microtrombosis, aunque característico, no es exclusivo del SDRA por COVID-19, y es un hallazgo frecuente de la fase evolutiva intermedia o proliferativa del daño alveolar agudo de cualquier etiología, junto con la hiperplasia, atipia y mitosis de los neumocitos tipo II.26
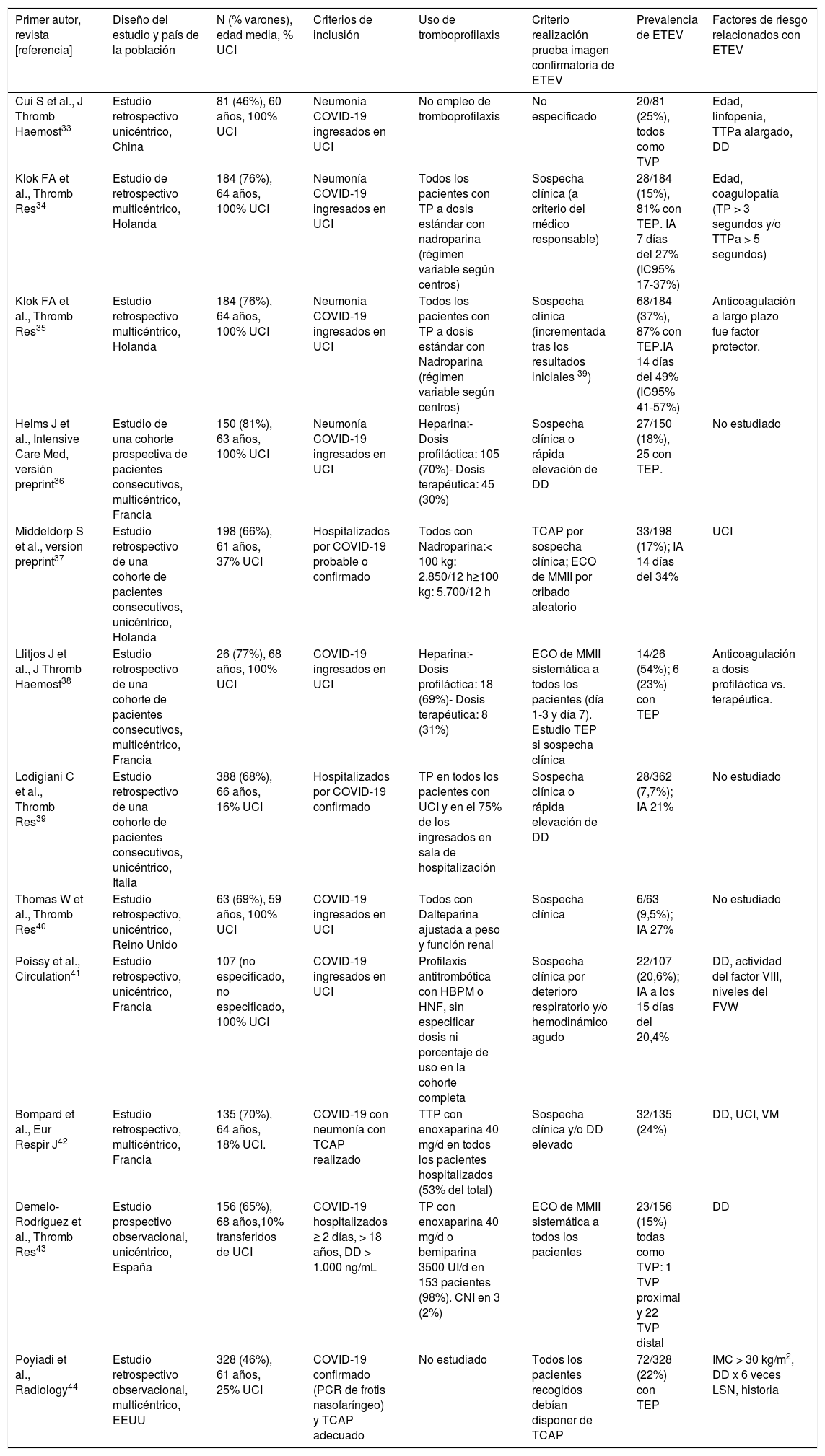
Infección respiratoria por SARS-CoV-2 y ETEVEl riesgo de ETEV en pacientes con COVID-19 es un problema emergente y varias publicaciones han abordado esta cuestión en los últimos meses. La ETEV es consecuencia de la interacción de distintos factores de riesgo protrombóticos relacionados tanto con el paciente como con el entorno. Los pacientes con COVID-19 presentan con frecuencia factores de riesgo para ETEV como la edad, la obesidad o una historia previa de trombosis venosa profunda (TVP) y/o TEP; y la propia COVID-19 condiciona un estado de hipercoagulabilidad asociado a la infección aguda per se, la inflamación excesiva, la hipoxemia o la inmovilización.3,4,7,19,27–32 Hasta la fecha, se han publicado 12 trabajos que analizan la incidencia de ETEV en los pacientes con COVID-19 (tabla 3).34–44 La mayoría de estos trabajos han incluido pacientes ingresados en UCI.
Frecuencia de ETEV en pacientes con COVID-19 y factores de riesgo relacionados
| Primer autor, revista [referencia] | Diseño del estudio y país de la población | N (% varones), edad media, % UCI | Criterios de inclusión | Uso de tromboprofilaxis | Criterio realización prueba imagen confirmatoria de ETEV | Prevalencia de ETEV | Factores de riesgo relacionados con ETEV |
|---|---|---|---|---|---|---|---|
| Cui S et al., J Thromb Haemost33 | Estudio retrospectivo unicéntrico, China | 81 (46%), 60 años, 100% UCI | Neumonía COVID-19 ingresados en UCI | No empleo de tromboprofilaxis | No especificado | 20/81 (25%), todos como TVP | Edad, linfopenia, TTPa alargado, DD |
| Klok FA et al., Thromb Res34 | Estudio de retrospectivo multicéntrico, Holanda | 184 (76%), 64 años, 100% UCI | Neumonía COVID-19 ingresados en UCI | Todos los pacientes con TP a dosis estándar con nadroparina (régimen variable según centros) | Sospecha clínica (a criterio del médico responsable) | 28/184 (15%), 81% con TEP. IA 7 días del 27% (IC95% 17-37%) | Edad, coagulopatía (TP > 3 segundos y/o TTPa > 5 segundos) |
| Klok FA et al., Thromb Res35 | Estudio retrospectivo multicéntrico, Holanda | 184 (76%), 64 años, 100% UCI | Neumonía COVID-19 ingresados en UCI | Todos los pacientes con TP a dosis estándar con Nadroparina (régimen variable según centros) | Sospecha clínica (incrementada tras los resultados iniciales 39) | 68/184 (37%), 87% con TEP.IA 14 días del 49% (IC95% 41-57%) | Anticoagulación a largo plazo fue factor protector. |
| Helms J et al., Intensive Care Med, versión preprint36 | Estudio de una cohorte prospectiva de pacientes consecutivos, multicéntrico, Francia | 150 (81%), 63 años, 100% UCI | Neumonía COVID-19 ingresados en UCI | Heparina:- Dosis profiláctica: 105 (70%)- Dosis terapéutica: 45 (30%) | Sospecha clínica o rápida elevación de DD | 27/150 (18%), 25 con TEP. | No estudiado |
| Middeldorp S et al., version preprint37 | Estudio retrospectivo de una cohorte de pacientes consecutivos, unicéntrico, Holanda | 198 (66%), 61 años, 37% UCI | Hospitalizados por COVID-19 probable o confirmado | Todos con Nadroparina:< 100 kg: 2.850/12 h≥100 kg: 5.700/12 h | TCAP por sospecha clínica; ECO de MMII por cribado aleatorio | 33/198 (17%); IA 14 días del 34% | UCI |
| Llitjos J et al., J Thromb Haemost38 | Estudio retrospectivo de una cohorte de pacientes consecutivos, multicéntrico, Francia | 26 (77%), 68 años, 100% UCI | COVID-19 ingresados en UCI | Heparina:- Dosis profiláctica: 18 (69%)- Dosis terapéutica: 8 (31%) | ECO de MMII sistemática a todos los pacientes (día 1-3 y día 7). Estudio TEP si sospecha clínica | 14/26 (54%); 6 (23%) con TEP | Anticoagulación a dosis profiláctica vs. terapéutica. |
| Lodigiani C et al., Thromb Res39 | Estudio retrospectivo de una cohorte de pacientes consecutivos, unicéntrico, Italia | 388 (68%), 66 años, 16% UCI | Hospitalizados por COVID-19 confirmado | TP en todos los pacientes con UCI y en el 75% de los ingresados en sala de hospitalización | Sospecha clínica o rápida elevación de DD | 28/362 (7,7%); IA 21% | No estudiado |
| Thomas W et al., Thromb Res40 | Estudio retrospectivo, unicéntrico, Reino Unido | 63 (69%), 59 años, 100% UCI | COVID-19 ingresados en UCI | Todos con Dalteparina ajustada a peso y función renal | Sospecha clínica | 6/63 (9,5%); IA 27% | No estudiado |
| Poissy et al., Circulation41 | Estudio retrospectivo, unicéntrico, Francia | 107 (no especificado, no especificado, 100% UCI | COVID-19 ingresados en UCI | Profilaxis antitrombótica con HBPM o HNF, sin especificar dosis ni porcentaje de uso en la cohorte completa | Sospecha clínica por deterioro respiratorio y/o hemodinámico agudo | 22/107 (20,6%); IA a los 15 días del 20,4% | DD, actividad del factor VIII, niveles del FVW |
| Bompard et al., Eur Respir J42 | Estudio retrospectivo, multicéntrico, Francia | 135 (70%), 64 años, 18% UCI. | COVID-19 con neumonía con TCAP realizado | TTP con enoxaparina 40 mg/d en todos los pacientes hospitalizados (53% del total) | Sospecha clínica y/o DD elevado | 32/135 (24%) | DD, UCI, VM |
| Demelo-Rodríguez et al., Thromb Res43 | Estudio prospectivo observacional, unicéntrico, España | 156 (65%), 68 años,10% transferidos de UCI | COVID-19 hospitalizados ≥ 2 días, > 18 años, DD > 1.000 ng/mL | TP con enoxaparina 40 mg/d o bemiparina 3500 UI/d en 153 pacientes (98%). CNI en 3 (2%) | ECO de MMII sistemática a todos los pacientes | 23/156 (15%) todas como TVP: 1 TVP proximal y 22 TVP distal | DD |
| Poyiadi et al., Radiology44 | Estudio retrospectivo observacional, multicéntrico, EEUU | 328 (46%), 61 años, 25% UCI | COVID-19 confirmado (PCR de frotis nasofaríngeo) y TCAP adecuado | No estudiado | Todos los pacientes recogidos debían disponer de TCAP | 72/328 (22%) con TEP | IMC > 30 kg/m2, DD x 6 veces LSN, historia |
CNI: compresión neumática intermitente; DD: dímero D; ECO: ecografía; ETEV: enfermedad tromboembólica venosa; EEUU: Estados Unidos; FVW: antígeno del factor de von Villebrand HBPM: heparina de bajo peso molecular; HNF: heparina no-fraccionada; IA: incidencia acumulada; IMC: índice de masa corporal; LSN: límite superior normal; MMII: miembros inferiores; PCR: reacción en cadena de la polimerasa; TCAP: tomografía computarizada de arterias pulmonares; TP: tromboprofilaxis; TTPa: tiempo de tromboplastina parcial activada; TVP: trombosis venosa profunda; UCI: unidad de cuidados intensivos; VM: ventilación mecánica.
Los estudios que incluyeron pacientes ingresados en planta de hospitalización a los que se realizó una prueba de imagen por sospecha de ETEV han encontrado una tasa de TEP y/o TVP de un 1-2%.37,39 Esta tasa de ETEV sintomática no es superior a la obtenida en estudios previos de pacientes no COVID-19 hospitalizados por causa médica.44–46 En un estudio que realizó una búsqueda sistemática de TVP de miembros inferiores entre pacientes hospitalizados por COVID-19 y valores de DD superiores a 1.000 ng/mL, la tasa de TVP proximal asintomática fue < 1%.43
Los pacientes críticos tienen un alto riesgo de desarrollar ETEV con incidencias que varían del 13 al 30% sin profilaxis antitrombótica,47,48 y del 5,8% al 15,5% cuando reciben tromboprofilaxis.49 Igualmente, los pacientes COVID-19 ingresados en una UCI presentan un riesgo elevado de ETEV. Middeldorp et al. estudiaron 198 enfermos con COVID-19, 74 (37%) de los cuales ingresaron en UCI. La incidencia acumulada de ETEV a los 14 días fue superior en los pacientes ingresados en UCI (48%; IC del 95%, 33-61%) comparada con la de los pacientes ingresados en planta de hospitalización (10%; IC del 95%, 3-24%).37 En un estudio que analizó los resultados de todas las tomografías computarizadas de arterias pulmonares realizadas a pacientes con COVID-19 por sospecha clínica de TEP o presencia de DD elevado, la incidencia acumulada de TEP fue del 24%, significativamente mayor en los pacientes ingresados en UCI (50%; IC del 95%, 30-70%) que en los ingresados en planta de hospitalización (18%; IC del 95%, 12-27%).42
La prevalencia de ETEV en los restantes siete estudios que incluyeron pacientes críticos con COVID-19 varió entre el 9,5 y el 54%, condicionada por diferencias metodológicas, el uso de tromboprofilaxis y el cribado sistemático de ETEV.33–36,38,40,41 En el estudio de Cui et al. 33 los pacientes no recibieron tromboprofilaxis farmacológica y la prevalencia de ETEV fue de 25%. Por otro lado, el trabajo de Llitjos et al. obtuvo la incidencia más alta de ETEV (54%), a pesar de que hasta el 69% de los pacientes habían recibido anticoagulación a dosis plenas. La gravedad de la cohorte estudiada, el estado de hipercoagulabilidad y la realización de cribado sistemático de detección de TVP mediante ecografía de miembros inferiores podrían explicar parcialmente estos resultados.38
Un trabajo prospectivo francés comparó la incidencia de eventos trombóticos en pacientes ingresados en UCI con COVID-19 (n = 150) con pacientes ingresados en UCI no COVID-19 (n = 150). Mediante el uso de análisis de propensión encontraron que los pacientes con SDRA por COVID-19 presentaron un mayor riesgo de eventos trombóticos que el grupo control no COVID-19 (11,7% vs. 4,8%; OR 2,6; IC del 95%, 1,1-6,1%).37
Por lo tanto, los datos de incidencia de ETEV en los pacientes hospitalizados por COVID-19 son similares a los publicados en series de otras enfermedades médicas. En los pacientes COVID-19 ingresados en UCI se ha observado un riesgo incrementado de ETEV, aunque no se ha aclarado completamente si es superior al de enfermos críticos por otros procesos.47–49 Prevención, diagnóstico y tratamiento de la ETEV asociada a COVID-19. Los resultados de las publicaciones científicas recientes sobre la coagulopatía asociada a COVID-19 y el riesgo de eventos trombóticos han generado dudas y controversia sobre la mejor estrategia de profilaxis, diagnóstico y tratamiento antitrombótico de la ETEV, lo que se refleja en la variabilidad de las recomendaciones publicadas por las distintas organizaciones y sociedades científicas.
Tromboprofilaxis en COVID-19La prevalencia de ETEV en los pacientes hospitalizados por enfermedades médicas agudas es aproximadamente de 10-20%, motivo por el que las guías de práctica clínica recomiendan el uso de tromboprofilaxis farmacológica en aquellos con alto riesgo trombótico, identificados mediante escalas bien validadas (Padua, IMPROVE).28,50–52 Estas recomendaciones también son aplicables a los pacientes hospitalizados por COVID-19.53–56 En un estudio de 1.026 pacientes hospitalizados con COVID-19, los autores evaluaron el riesgo trombótico basal mediante el modelo de predicción de Padua y encontraron que hasta el 40% de los pacientes presentaba un riesgo alto de ETEV (score > 4).57 En una cohorte china de 449 pacientes con COVID-19 grave, los pacientes que recibieron heparina a dosis profilácticas durante al menos siete días presentaron una reducción no significativa de la mortalidad a los 28 días (OR 1,65; IC del 95% 0,93-2,9), que alcanzó la significación en el subgrupo de pacientes con criterios de coagulopatía inducida por sepsis o con DD muy elevado (> 3 mg/L).58 Con todo ello, los diferentes documentos de consenso publicados proponen el uso temprano de heparinas de bajo peso molecular (HBPM) como primera opción para la tromboprofilaxis, en ausencia de contraindicaciones, en todo paciente que precise ingreso hospitalario por COVID-19, con especial hincapié en los casos que necesiten ingreso en UCI.59 La profilaxis mecánica con compresión neumática intermitente debería reservarse para los pacientes con contraindicación para la tromboprofilaxis farmacológica.60,61 La tabla 4 resume las principales recomendaciones de las organizaciones internacionales y sociedades científicas sobre la tromboprofilaxis en pacientes con COVID-19.59,60,62–65Algunos autores y sociedades científicas sugieren el uso de tromboprofilaxis a dosis intermedias o ajustadas al peso en pacientes hospitalizados con COVID-19.65–68 El uso de dosis más elevadas se ha sustentado en un estudio realizado en pacientes críticos con sepsis (no COVID-19), que evidenció 1. el fracaso de la tromboprofilaxis a dosis estándar en un 12% de los pacientes y 2. el efecto beneficioso sobre el intercambio gaseoso (PaO2/FiO2) en el subgrupo de pacientes con SDRA que recibieron dosis altas de HBPM.69 Sin embargo, en ausencia de datos fiables sobre la tasa real de eventos trombóticos y hemorrágicos en los pacientes con COVID-19, los cambios en los esquemas habituales de tromboprofilaxis deberían sustentarse en los resultados de ensayos clínicos bien diseñados (NCT04345848, NCT04367831, NCT04373707, NCT04366960, NCT04359277).
Guías y recomendaciones de tromboprofilaxis en pacientes COVID-19
| Organización /Sociedad científica | PacientesCOVID-19 | Recomendaciones de tromboprofilaxis | ||
|---|---|---|---|---|
| Organización Mundial de la Salud (OMS)61 | Infección respiratoria aguda grave | HBPM (preferentemente).Heparina no fraccionada 5000 UI/12 h.Compresión neumática intermitente si contraindicación de anticoagulación farmacológica. | ||
| Sociedad Internacional de Hemostasia y Trombosis (ISTH)60 | AmbulatoriaEnfermedad leve | Fomentar una mayor movilidad.Estratificación individualizada del riesgo trombótico y hemorrágico | ||
| HospitalizadosEnfermedad moderada o severa sin CID | Estratificación individualizada del riesgo trombótico y hemorrágicoDosis profilácticas HBPM (preferentemente) o HNFTromboprofilaxis mecánica (compresión neumática intermitente) si la anticoagulación farmacológica está contraindicadaNo se recomienda anticoagulación terapéutica o dosis intermedias en ausencia de ETEV confirmada | |||
| HospitalizadosEnfermedad moderada o severa con CID | Todo paciente debe recibir anticoagulación profiláctica a menos que existan contraindicaciones (sangrado activo y recuento de plaquetas < 25 x 109/L).No se recomienda anticoagulación terapéutica o dosis intermedias en ausencia de ETEV confirmada.Al alta considerar profilaxis farmacológica hasta 45 días después. | |||
| Sociedad Americana de Hematología(ASH)63 | Hospitalizados | Todos los pacientes deben recibir tromboprofilaxis farmacológica con HBPM o fondaparinux (de preferencia frente a HNF para reducir el contacto), a menos que exista un mayor riesgo de hemorragia.Fondaparinux en casos de trombocitopenia inducida por heparina.Tromboprofilaxis mecánica si la anticoagulación farmacológica está contraindicada.No se recomienda la anticoagulación a dosis terapéuticas en ausencia de ETEV confirmada. | ||
| Sociedad Española de Hemostasia y Trombosis(SETH)66 | Infección sin factores de riesgo mayores de trombosis | HBPM con ajuste de dosis a peso y función renal: | ||
| Aclaramiento de creatinina > 30 mL/min | Aclaramiento de creatinina < 30 mL/min | |||
| Enoxaparina | < 80 kg: 40 mg/24 h80-100 kg: 60 mg/24 h > 100 kg: 40 mg/12 h | < 80 kg: 20 mg/24h > 80 kg: 40 mg/24h | ||
| Tinzaparina | < 60 kg: 3500 UI/24 h > 60 kg: 4.500 UI/24 h | < 60 kg: 3.500 UI/24 h > 60 kg: 4.500 UI/24 h | ||
| Bemiparina | 3.500 UI/24 h | 2.500 UI/24 h | ||
| Nadroparina | 0,3 mL/24 h | -- | ||
| Dalteparina | 5.000 UI/24 h | -- | ||
| Fondaparinux si alergia a heparina o trombocitopenia inducida por heparina: | ||||
| Aclaramiento de creatinina > 50 mL/min | 2,5 mg/24 h | |||
| Aclaramiento de creatinina < 50 y > 20 mL/min | 2,5 mg/24 h | |||
| Aclaramiento de creatinina < 20 mL/min | Contraindicado | |||
| Infección con factores de riesgo mayores de trombosis | HBPM con ajuste de dosis a función renal: | |||
| Aclaramiento de creatinina > 30 mL/min | Aclaramiento de creatinina < 30 mL/min | |||
| Enoxaparina | 1 mg/kg/24 h | 0,5 mg/kg/24 h | ||
| Tinzaparina | 75 UI/kg/24 h | 75 UI/kg/24 h | ||
| Bemiparina | 5.000 UI/24 h | 3.500 UI/24 h | ||
| Nadroparina | < 70 kg: 0,4 mL/24 h > 70 kg: 0,6 mL/24 h | -- | ||
| Dalteparina | 5.000 UI/24 h | -- | ||
| Fondaparinux si alergia a heparina o trombocitopenia inducida por heparina: | ||||
| Aclaramiento de creatinina > 50 mL/min | 5 mg/24 h | |||
| Aclaramiento de creatinina < 50 y > 20 mL/min | 2,5 mg/24 h | |||
| Aclaramiento de creatinina < 20 mL/min | Contraindicado | |||
| Trombosis Reino Unido (Thrombosis UK)64 | Hospitalizados | Evaluar el riesgo trombótico en todos los pacientes (NICE / ASH).HBPM si inmovilización y criterios de gravedad a menos que esté contraindicado:CrCl > 30: HBPM o fondaparinux s.c.CrCl < 30: heparina no fraccionada 5.000 UI sc o dosis baja de HBPM.Todo paciente con inmovilización completa se recomienda compresión neumática intermitente además de la tromboprofilaxis farmacológica.Tromboprofilaxis mecánica exclusiva si plaquetas < 30.000 o sangrado. | ||
| Grupo de Trabajo de Trombosis Cardiovascular de la Sociedad Española de Cardiología65 | Hospitalizados | Todos los pacientes hospitalizados deben recibir HBPM, se recomienda ajuste de dosis en IMC > 35 y tras valorar el riesgo hemorrágico y el recuento plaquetario.En pacientes con criterios de gravedad y alto riesgo trombótico se recomienda HBPM a dosis intermedia/extendida o terapéutica, previa valoración de riesgo hemorrágico.Prolongar HBPM en dosis profilácticas durante 7-10 días tras el alta hospitalaria. | ||
| Sociedad Británica de Tórax (BTS) 68 | Bajo riesgo | Dosis profiláctica ajustada a peso (70 kg con CrCl > 30 mL/min: Dalteparina 5.000 UI/día, enoxaparina 40 mg/día). | ||
| Alto riesgo | HBPM a dosis intermedias (70 kg con CrCl > 30 mL/min: Dalteparina 5.000 UL/12 h, enoxaparina 40 mg/12 h). | |||
CID: coagulopatía intravascular diseminada; CrCl: aclaramiento de creatinina; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; IMC: índice de masa corporal; NICE: National Institute for Health and Care Excellence.
Tampoco existen estudios sobre el empleo de tromboprofilaxis ajustada a peso en pacientes COVID-19. Su uso probablemente se fundamenta en 1. que los pacientes con sobrepeso estuvieron infrarrepresentados en los ensayos clínicos pivotales,44–46,70–76 y 2. una revisión sistemática en pacientes obesos sometidos a cirugía bariátrica que mostró una tendencia no significativa hacia una tasa más baja de ETEV en aquellos que recibieron tromboprofilaxis ajustada a peso (0,5% vs. 2,0%) con una tasa de hemorragia mayor similar en ambos grupos (1,6% vs. 2,3%).77
Otro aspecto controvertido es el uso de tromboprofilaxis extendida tras la hospitalización en el paciente con enfermedad COVID-19.78 Los estudios de tromboprofilaxis extendida en pacientes (no COVID-19) con enfermedades agudas no han demostrado un efecto beneficioso neto y las guías de práctica clínica sólo recomiendan su uso durante la hospitalización del paciente.79,80 Para los pacientes COVID-19, algunos expertos sugieren considerar la tromboprofilaxis extendida (hasta completar un mes o incluso 45 días) en pacientes con factores de riesgo de ETEV preexistentes o persistentes (movilidad reducida, obesidad, ETEV previa, cáncer activo, etc.) o DD elevado (> dos veces el límite superior normal al alta) si el riesgo hemorrágico es bajo.28,81
No existe evidencia sobre el papel de la tromboprofilaxis en el paciente ambulatorio con COVID-19 leve pero con comorbilidades significativas. En el documento de consenso de Bikdeli et al., en pacientes confinados con COVID-19 leve que no requieren ingreso hospitalario se recomienda fomentar la movilidad y considerar la profilaxis farmacológica de forma individualizada en aquellos con riesgo alto de ETEV y riesgo bajo de hemorragia.27
Diagnóstico de ETEV en COVID-19El diagnóstico de ETEV se realiza mediante algoritmos bien validados, que combinan escalas de probabilidad clínica (Wells, Ginebra, YEARS), los resultados del DD y las pruebas de imagen.28 Un valor normal de DD permite excluir el diagnóstico de ETEV en pacientes con sospecha clínica baja o intermedia. En pacientes con probabilidad clínica alta (debido al valor predictivo negativo bajo del DD en este subgrupo) o con un DD positivo (debido a la baja especificidad del DD para el diagnóstico de ETEV), se requiere una prueba de imagen confirmatoria para el diagnóstico.28,81 El porcentaje elevado de pacientes COVID-19 con elevación de DD3–7,20,21 permite anticipar que una amplia mayoría requerirá una angioTC de tórax y/o ecografía de miembros inferiores en caso de sospecha clínica de TEP y/o de TVP, respectivamente.
Dada la inespecificidad de los síntomas respiratorios en pacientes COVID-19 (particularmente en los más graves), los expertos recomiendan un alto grado de sospecha clínica, particularmente en aquellos que experimentan deterioro respiratorio o hemodinámico.67,81
Anticoagulación en COVID-19La anticoagulación terapéutica en pacientes COVID-19 se reserva para los diagnósticos confirmados de ETEV. Sin embargo, algunos clínicos han planteado el uso de anticoagulación terapéutica en los pacientes críticos, aún en ausencia de confirmación de ETEV, bajo la hipótesis no demostrada de un potencial beneficio para prevenir la trombosis microvascular.34,59,65 Las interacciones farmacológicas entre el tratamiento antiviral y los anticoagulantes orales (tanto los antagonistas de la vitamina K [AVK] como los de acción directa), y la dificultad para realizar controles ambulatorios periódicos de la actividad de los AVK, hacen que las HBPM en monoterapia sean consideradas el tratamiento anticoagulante de elección (al menos durante las primeras semanas después del episodio trombótico).58
En pacientes hospitalizados por COVID-19 que recibían tratamiento anticoagulante oral previamente (fibrilación auricular, valvulopatía, ETEV, etc.) se recomienda el cambio a HBPM a dosis terapéuticas, para evitar las interacciones medicamentosas con los fármacos utilizados para tratar la COVID-19 y facilitar su manejo durante la hospitalización en pacientes potencialmente graves o vulnerables. Dicho cambio se propone hasta la resolución del cuadro clínico y/o fin de la interacción farmacológica, teniendo en cuenta la vida media de los fármacos administrados.66
En los pacientes que ingresan por infección por SARS-CoV-2 en situación de estabilidad y que reciban ningún fármaco potencialmente causante de una interacción, podría mantenerse su tratamiento anticoagulante habitual, aunque no hay suficiente evidencia ni un consenso claro.
ConclusionesLa infección COVID-19 induce un estado protrombótico, secundario a la respuesta hiperinflamatoria del organismo y a la hipoxia, que puede predisponer a una incidencia aumentada de eventos trombóticos venosos, sobre todo en los pacientes con afectación más grave. Aún no se ha aclarado si la tasa de fracasos de la tromboprofilaxis farmacológica es mayor en los pacientes COVID-19 críticos que en los pacientes críticos por otros procesos, por lo que parece prematuro recomendar el uso de tromboprofilaxis a dosis intermedias o de anticoagulación terapéutica hasta disponer de los resultados de los ensayos clínicos actualmente en marcha. El diagnóstico y el tratamiento de la ETEV en pacientes con neumonía por SARS-CoV-2 debería seguir las recomendaciones propuestas por las sociedades científicas para cualquier paciente con sospecha y confirmación de la enfermedad trombótica, respectivamente.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.