La ecografía torácica ha mostrado ser útil para el diagnóstico de la afectación pulmonar por COVID-19. Para cuantificar el grado de afectación se han descrito varias escalas, aunque no existe evidencia de si su determinación podría tener alguna capacidad predictiva de evolución desfavorable.
MetodologíaEstudio prospectivo de cohortes en el que se incluyó a pacientes ingresados por COVID-19. La muestra se estratificó en función de la evolución clínica, considerándose desfavorable en los pacientes que precisaron soporte respiratorio invasivo o no invasivo. Se analizaron biomarcadores al ingreso y el mismo día de la ecografía torácica, así como las escalas pronósticas al ingreso. Según la posibilidad de sedestación o no, se aplicó clasificación ecográfica en 8 o 14 áreas.
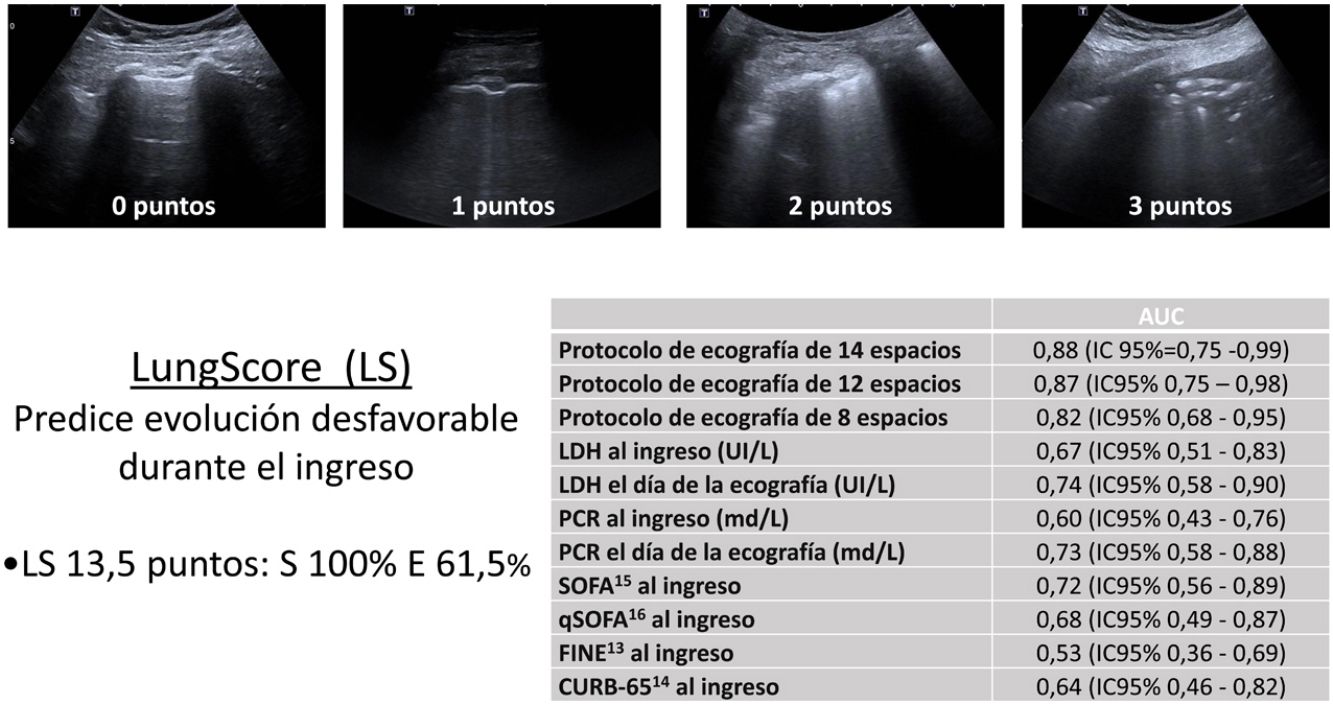
ResultadosSe incluyó a 44 pacientes, 13 (29,5%) con necesidad posterior de soporte ventilatorio. En todos se exploraron 8 áreas y en 35 (79,5%) las 14. Las zonas más afectadas fueron los lóbulos inferiores en la zona posterior. Se detectaron diferencias significativas entre los 2grupos en las escalas multidimensionales SOFA y quick SOFA, la PCR y LDH del mismo día de la ecografía torácica y la puntuación de las escalas ecográficas. La mejor área bajo la curva ROC (AUC) se obtuvo con la escala de 14 áreas, que fue de 0,88 (IC 95%: 0,75-0,99). Su sensibilidad y especificidad para un punto de corte 13,5 fue del 100% y del 61,5%.
ConclusionesEl uso de escalas para cuantificar la afectación pulmonar mediante ecografía torácica proporciona información útil para facilitar la estratificación del riesgo en los pacientes hospitalizados con COVID-19.
Thoracic ultrasound has been shown to be useful in the diagnosis of COVID-19 pulmonary involvement. Several scores for quantifying the degree of involvement have been described, although there is no evidence to show that they have any capacity for predicting unfavorable progress.
MethodologyProspective cohort study of patients hospitalized for COVID-19. The sample was stratified according to clinical course, and patients requiring invasive or non-invasive respiratory support were classified as having unfavorable progress. Biomarkers were analyzed at admission and on the same day that thoracic ultrasound was performed. Prognostic scales were also determined at admission. The ultrasound score was obtained in 8 or 14 areas, depending on the patient's ability to sit.
ResultsWe included 44 patients, 13 (29,5%) of whom subsequently needed ventilatory support. Eight areas were explored in all patients and 14 areas in 35 (79.5%). The most affected areas were the posterior lower lobes. Significant differences were found between the 2groups on the SOFA and quick SOFA multidimensional scales, and PCR and LDH on the same day as thoracic ultrasound, and the ultrasound scores. The best area under the ROC curve (AUC) was obtained with the 14-area score, with a result of 0.88 (95% CI: 0.75-0.99). Its sensitivity and specificity for a cut-off score of 13.5 were 100% and 61.5%, respectively.
ConclusionsThe use of scores to quantify lung involvement measured by thoracic ultrasound provides useful information, facilitating risk stratification in patients hospitalized with COVID-19.
La enfermedad por el nuevo coronavirus SARS-CoV-2 (COVID-19) fue identificada por primera vez en la ciudad de Wuhan, provincia de Hubei, en China, en diciembre de 2019 y se ha convertido en una amenaza global. Fue declarada pandemia el 11 de marzo de 2020 por la Organización Mundial de la Salud1. El espectro clínico de la infección por COVID-19 es amplio y, aunque la mayoría de las personas infectadas desarrollan síntomas leves-moderados, hasta un 15-20% de los pacientes precisan ser hospitalizados y desarrollan complicaciones que incluyen neumonía viral grave, con posible evolución a síndrome de distrés respiratorio agudo, e incluso muerte2. Aunque el curso clínico puede ser variable en los primeros días del ingreso, hasta el 20% de los pacientes hospitalizados por neumonía debido a SARS-CoV-2 presentan un deterioro respiratorio que precisa de traslado a unidades de cuidados respiratorios intermedios o de críticos para optimizar su manejo y aportar el soporte ventilatorio necesario3. Predecir estos eventos de forma fiable puede ser muy útil para el ajuste de las decisiones terapéuticas o para valorar si alta hospitalaria o traslado a centros de cuidados de menor intensidad. En esta línea se han publicado múltiples trabajos y 2 revisiones sistemáticas, que se han centrado fundamentalmente en la utilización, con fines predictivos, de parámetros clínicos y en la combinación de diversos biomarcadores3,4. Recientemente Liu et al. han demostrado que los hallazgos en tomografía computarizada (TC) también pueden predecir la evolución en estos pacientes5.
La ecografía torácica (ET) es una técnica de bajo coste y muy segura que, en el contexto de una pandemia, ofrece claras ventajas sobre otros métodos radiológicos, al disminuir el riesgo de transmisión nosocomial, ya que puede realizarse a pie de cama. En varios trabajos se ha mostrado su utilidad en la evaluación de los pacientes con COVID-19 y sus posibles complicaciones6-9. Incluso en algunos de ellos, los hallazgos del estudio ecográfico permiten estratificar qué pacientes precisan ingreso hospitalario10.
Sin embargo, hasta este momento no se han publicado trabajos que evalúen si esta técnica es útil en la predicción de eventos graves una vez el paciente ha sido hospitalizado. Tampoco se conoce si las escalas recomendadas para la evaluación de pacientes con afectación pulmonar con COVID-19 podrían tener utilidad con este fin y, combinados con biomarcadores o parámetros clínicos, podrían mejorar la capacidad predictiva de una evolución desfavorable11. Con el objetivo de analizar si la ET, utilizando una clasificación ecográfica, puede predecir qué pacientes van a requerir una mayor intensidad de cuidados o soporte ventilatorio o incluso fallecer, llevamos a cabo el presente trabajo.
MetodologíaDiseño del estudioSe desarrolló un estudio prospectivo en una cohorte de pacientes ingresados por primera vez por neumonía debida a SARS-CoV-2, en los que se realizó una ET reglada en los primeros 4±1 días desde el ingreso, en un hospital de tercer nivel. Se excluyó a los pacientes que en el momento de la ecografía presentaban ya deterioro respiratorio, con necesidad de algún tipo de soporte ventilatorio diferente a la oxigenoterapia convencional.
Todos los pacientes firmaron el documento de consentimiento informado. Los objetivos y metodología del presente estudio fueron aprobados por el Comité de Ética e Investigación de Galicia.
Recogida de la informaciónVariables clínicas, analíticas y demográficasSe recogieron parámetros clínicos, demográficos y analíticos al ingreso. Se registró la edad, sexo, peso, fragilidad12 y comorbilidades. Se clasificó la gravedad de la afectación pulmonar al ingreso según las escalas de Pronostic Severity Index (FINE)13, Community Acquired Pneumonia (CURB-65)14, Sequential Organ Failure Assessment Score (SOFA)15 y quick SOFA16. Los parámetros analíticos recogidos fueron la proteína C reactiva (PCR) y la lactato deshidrogenasa (LDH), tanto al ingreso como los obtenidos el mismo día de la ET.
Los pacientes fueron clasificados en función de la evolución presentada durante el ingreso. Definimos como evolución desfavorable la necesidad de soporte respiratorio no invasivo (SRNI)17 o invasivo, el ingreso en una unidad de cuidados críticos o el fallecimiento.
Variables ecográficasSe utilizó un ecógrafo portátil destinado al área de pacientes COVID-19. El estudio se llevó a cabo con una sonda convexa en pacientes con elevado índice de masa corporal; en el resto se utilizó una sonda lineal. La exploración se hizo en modo B, unifocal con el foco situado en la línea pleural. Para la limpieza y esterilización del equipo se siguieron las recomendaciones publicadas18.
Todas las ecografías fueron efectuadas por un solo operador, siguiendo las indicaciones del documento de Consenso Internacional de Ecografía Torácica para pacientes con COVID-1911. Se exploraron 14 áreas (3 posteriores, 2 laterales y 2 anteriores en cada hemitórax) (fig. 1). Se analizó el valor de la exploración de 12 espacios recomendada por la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), obviando las áreas medias del campo posterior del protocolo de 14 espacios19. En los pacientes incapaces de mantener la sedestación se exploraron solo las áreas anteriores y laterales, intentando deslizar la sonda hacia la línea axilar posterior19,20.
Protocolo de exploración11.
1. Basal derecho, en la línea paravertebral, sobre el signo de la cortina. 2. Medio derecho, en la línea paravertebral, en el ángulo inferior de la escápula. 3. Superior derecho, en la línea paravertebral, en la zona superior de la escápula. 4. Basal izquierdo, en la línea paravertebral, sobre el signo de la cortina. 5. Medio izquierdo, en la línea paravertebral en el ángulo inferior de la escápula. 6. Superior izquierdo, en la línea paravertebral, en la zona superior de la escápula. 7. Basal derecho, en la línea axilar media, debajo de la línea de la aréola mamaria. 8. Superior derecho, en la línea axilar media por encima de la aréola mamaria. 9. Basal izquierdo en la línea axilar media debajo de la aréola mamaria.10. Parte superior izquierda en la línea axilar media encima de la aréola mamaria. 11. Basal derecho en la línea clavicular media debajo de la aréola mamaria. 12. Parte superior derecha, en la línea clavicular media, encima de la aréola mamaria. 13. Basal izquierdo, en la línea clavicular media, debajo de la aréola mamaria. 14. Parte superior izquierda, en la línea clavicular media, encima de la aréola mamaria.
Imagen de elaboración propia.
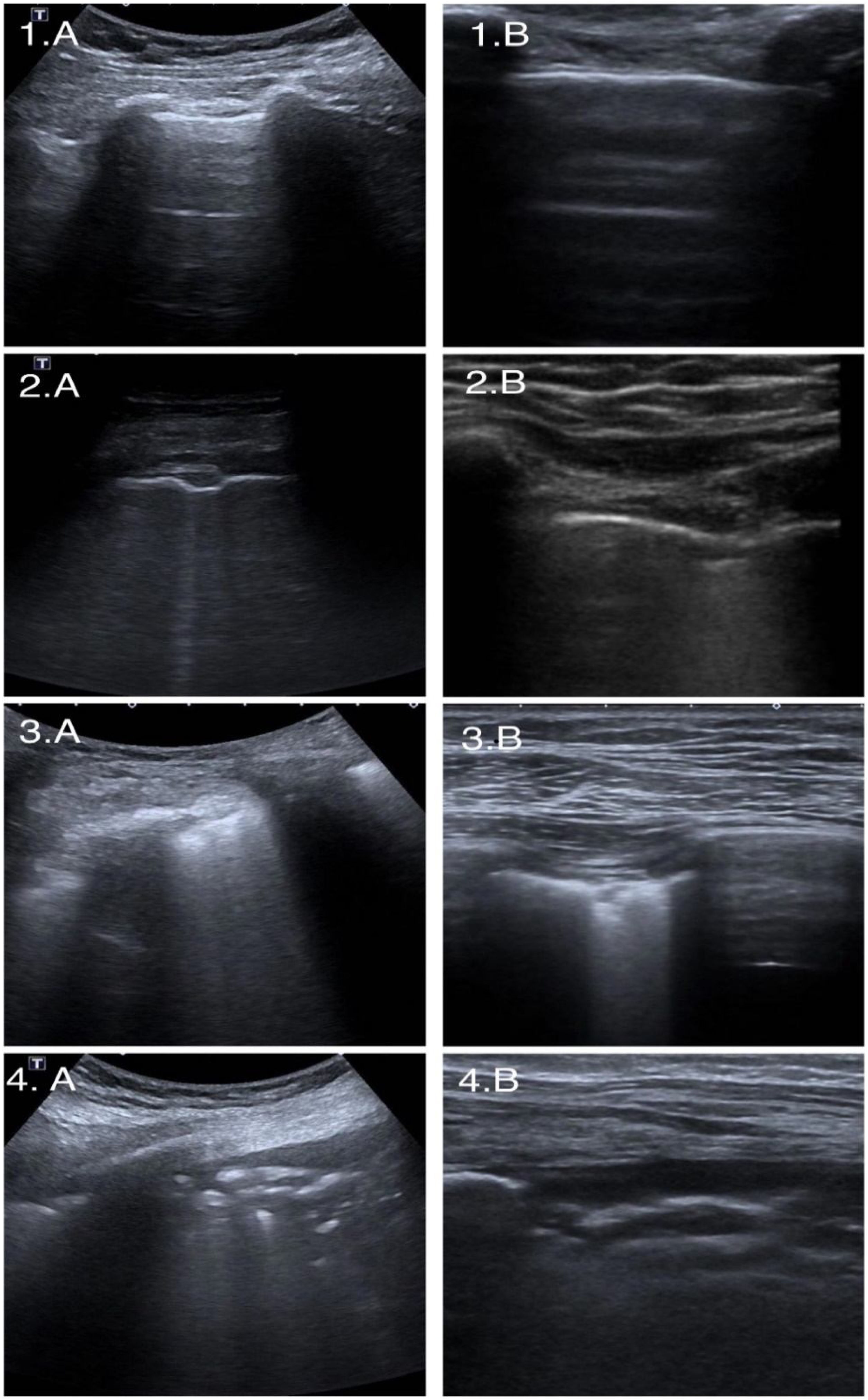
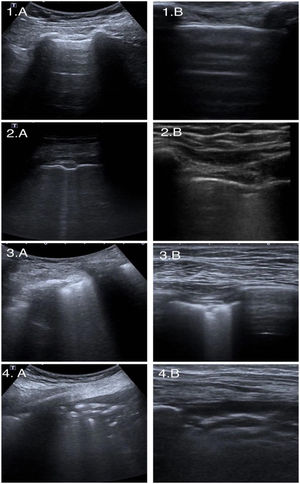
Se utilizó un sistema de puntuación para cuantificar la gravedad de la afectación por ecografía11. Cada una de las áreas recibió una puntuación en función de las alteraciones ecográficas (fig. 2).
Escala ecográfica.
La columna de la izquierda (A) representa imágenes ecográficas obtenidas con una sonda convexa y la columna derecha (B) representa imágenes obtenidas con una sonda lineal. La fila 1 representa la puntuación 0. La fila 2 representa la puntuación 1. La fila 3 representa la puntuación 2. La fila 4 representa la puntuación 3. Elaboración propia a partir de los hallazgos de casos incluidos en el propio estudio.
Clasificación 0: área con línea pleural intacta y presencia de líneas A, que indican adecuada aireación del parénquima pulmonar.
Clasificación 1: pleura desflecada, tras la cual se identifican artefactos hiperecogénicos verticales, que traducen la pérdida local de aireación pulmonar.
Clasificación 2: pleura fragmentada por pequeñas consolidaciones hipoecoicas que borran la línea de la pleura e identificación de líneas B coalescentes tras la consolidación.
Clasificación 3: el área explorada muestra pulmón blanco, con o sin consolidaciones de mayor tamaño.
Análisis estadísticoLas variables cuantitativas se expresaron como media y su intervalo de confianza del 95% (IC 95%) y las cualitativas como número y porcentaje. Para la comparación de las variables cuantitativas se utilizó la U de Mann-Whitney y para las cualitativas se crearon tablas de contingencia y se compararon mediante el test de χ2 o el test exacto de Fisher. Se calcularon las curvas receiver operating characteristic (ROC) y se comparó el área bajo la curva (AUC) del estadístico C para la valoración ecográfica de 14 espacios11 y la de 8 espacios19,20. Se calcularon además AUC de las escalas pronósticas multidimensionales al ingreso (FINE, CURB-65, qSOFA, SOFA) y de biomarcadores (LDH y PCR), tanto al ingreso como el mismo día en que se llevó a cabo el estudio ecográfico, analizando su significación con el método DeLong. El análisis estadístico se hizo con el programa IBM SPSS Statistics 21 SPSS versión 21 (IBM Corp., Armonk, NY, EE. UU.).
En nuestro centro los pacientes ingresaban desde el Servicio de Urgencias en las plantas de hospitalización convencional específicas para aislamiento y con presión negativa. De forma diaria a todos los pacientes, además del registro de constantes (presión arterial, saturación, temperatura, frecuencia cardíaca y respiratoria) se les realizaba una analítica de sangre, que incluía hemograma y bioquímica con perfil hepático y renal, LDH y PCR. En caso de deterioro clínico o sospecha de complicaciones, a la analítica rutinaria se le añadían los parámetros: ferritina, bilirrubina, interlucina 6, procalcitonina o dímero D. El protocolo de nuestro centro se basó en las recomendaciones y publicaciones iniciales de expertos4.
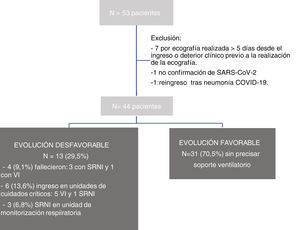
ResultadosDescripción de la muestraSe incluyó a 53 pacientes, de los que se excluyó a 9 por las razones explicadas en la figura 3. La muestra total analizada fue de 44 pacientes, 30 varones (68,2%), con una edad de 69,1 años (IC 95%: 43,0-85,7). Durante el ingreso, 13 pacientes (29,5%) presentaron una evolución desfavorable y precisaron soporte respiratorio invasivo o no invasivo. De ellos, 4 (9,1%) fallecieron, 6 (13,6%) precisaron ingreso en una unidad de críticos y 3 (6,8%) SRNI17 en una unidad de monitorización respiratoria. La estancia media de los pacientes que precisaron cuidados en la unidad de críticos o SRNI fue de 20,1 días (IC 95%:13,0-34,5), mientras que la de los que no lo hicieron fue de 9,5 días (IC 95%: 1,0-27,5; p=0,01).
Variables predictoras de evolución desfavorableEn la tabla 1 se representan los resultados del análisis bivariante. Las variables que fueron diferentes entre los que evolucionaron de forma desfavorable y los que presentaron una buena evolución fueron la puntuación en las escalas SOFA y qSOFA al ingreso, los biomarcadores PCR y LDH obtenidos el mismo día de la ecografía pulmonar y la puntuación (Lung Score) obtenida tanto por el protocolo de exploración de 14 espacios11 como por el de 8 espacios19,20.
Características clínicas y analíticas de los grupos de estudio al ingreso
| Evolución desfavorable (n=13) | Evolución favorable (n=31) | p | |
|---|---|---|---|
| Edad (IC 95%) | 72,9 (62-83) | 67,5 (37-87) | 0,37 |
| Fragilidad12 (IC 95%) | 3,7 (2-5,6) | 4,1 (1,6 -7,4) | 0,72 |
| Sexo (varón) (%) | 11 (84,6) | 19 (61,3) | 0,13 |
| Obesidad (%) | 6 (46,2) | 12 (38,7) | 0,10 |
| Hipertensión arterial (%) | 7 (53,8) | 16 (51,6) | 0,44 |
| Diabetes mellitus (%) | 4 (30) | 5 (16,1) | 0,28 |
| Cardiopatía isquémica (%) | 3 (23,1) | 6 (19,4) | 0,82 |
| Comorbilidad hematológica (%) | 2 (15,4) | 5 (16,1) | 0,59 |
| Patología respiratoria previa (%) | 5 (38,5) | 6 (19,4) | 0,22 |
| Neoplasia previa (%) | 1 (7,7) | 6 (19,4) | 0,27 |
| FINE13 al ingreso (IC 95%) | 3,6 (3,4-3,8) | 3,3 (2,9-3,7) | 0,43 |
| CURB-6514 al ingreso (IC 95%) | 0,85 (0,65-1,05) | 0,48 (0,3-0,7) | 0,07 |
| SOFA15 al ingreso (IC 95%) | 3,9 (0-8) | 1,81 (0-5,4) | 0,01 |
| qSOFA16 al ingreso (IC 95%) | 1 (0-2) | 0,29 (950-1,4) | 0,02 |
| Dímero D al ingreso en ng/mL (IC 95%) | 1.989,6 (805,7-3.173,4) | 1.822,8 (1.317,2-2.328,3) | 0,8 |
| PCR al ingreso en mg/L (IC 95%) | 82,3 (20-220,5) | 80,4 (3,2-294,8) | 0,28 |
| PCR día de la ecografía (IC 95%) | 97,2 (16-260,5) | 62,8 (954-302,5) | 0,02 |
| LDH al ingreso en UI/L (IC 95%) | 328,6 (214-525,5) | 271,2 (140,4-550,2) | 0,07 |
| LDH día de la ecografía (IC 95%) | 344,6 (169-560,1) | 241,1 (148,3-498,7) | 0,01 |
| LS 8 espacios, n=44 (IC 95%) | 11,4 (1-17) | 5,1 (0,0-17,1) | 0,001 |
| LS 14 espacios, n=35 (IC 95%) | 21,8 (14-27) | 10,6 (1,3-23,6) | 0,001 |
CURB-65: Community Acquired Pneumonia; FINE: Pronostic Severity Index; IC 95%: intervalo de confianza al 95%; LDH: lactato deshidrogenasa; LS: Lung Score; PCR: proteína C reactiva; qSOFA: quick SOFA; SOFA: Sequential Organ Failure Assessment Score.
En todos los pacientes se realizó una exploración de 8 segmentos (2 anteriores y 2 laterales de cada hemitórax)20 y en 35 (79,5%) se pudo hacer la exploración completa en sedestación de las 14 áreas recomendadas en el protocolo de exploración útilizado11, que incluye, además, la valoración de segmentos posteriores. El signo ecográfico más frecuentemente encontrado fue el aumento patológico de líneas B, con más de 2líneas B en un mismo espacio intercostal, signo que estuvo presente en 33 pacientes (75%). De los pacientes, 26 (59,1%) presentaron artefactos hipoecoicos que borraban la línea pleural. Se evidenció derrame pleural en 13 pacientes (29,5%) y engrosamiento pleural en 11 (25%).
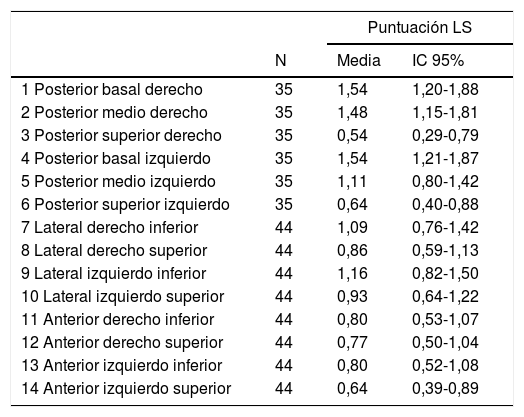
Las áreas pulmonares más afectadas fueron los lóbulos inferiores en la zona posterior, con una puntuación media de 1,54 (IC 95%: 1,2-1,8) por lóbulo explorado (tabla 2).
Puntuación en el Lung Score para cada área explorada
| Puntuación LS | |||
|---|---|---|---|
| N | Media | IC 95% | |
| 1 Posterior basal derecho | 35 | 1,54 | 1,20-1,88 |
| 2 Posterior medio derecho | 35 | 1,48 | 1,15-1,81 |
| 3 Posterior superior derecho | 35 | 0,54 | 0,29-0,79 |
| 4 Posterior basal izquierdo | 35 | 1,54 | 1,21-1,87 |
| 5 Posterior medio izquierdo | 35 | 1,11 | 0,80-1,42 |
| 6 Posterior superior izquierdo | 35 | 0,64 | 0,40-0,88 |
| 7 Lateral derecho inferior | 44 | 1,09 | 0,76-1,42 |
| 8 Lateral derecho superior | 44 | 0,86 | 0,59-1,13 |
| 9 Lateral izquierdo inferior | 44 | 1,16 | 0,82-1,50 |
| 10 Lateral izquierdo superior | 44 | 0,93 | 0,64-1,22 |
| 11 Anterior derecho inferior | 44 | 0,80 | 0,53-1,07 |
| 12 Anterior derecho superior | 44 | 0,77 | 0,50-1,04 |
| 13 Anterior izquierdo inferior | 44 | 0,80 | 0,52-1,08 |
| 14 Anterior izquierdo superior | 44 | 0,64 | 0,39-0,89 |
IC: intervalo de confianza; LS: Lung Score.
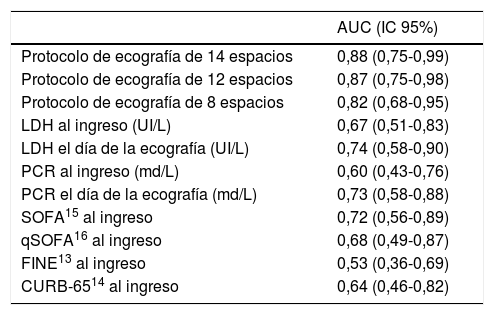
Se analizó la capacidad del Lung Score para predecir la necesidad de cuidados críticos o SRNI en los siguientes días a la exploración ecográfica. El AUC del protocolo ecográfico de 14 espacios fue de 0,88 (IC 95%: 0,75-0,99). La sensibilidad y especificidad del Lung Score con el protocolo de 14 espacios para un punto de corte de 15,5 fue de 88,9% y 69,2%, respectivamente, y para un punto de corte de 13,5 fue de 100% y 61,5%, respectivamente.
El AUC del Lung Score para el protocolo de 8 espacios resultó de 0,82 (IC 95%: 0,68-0,95).
En la tabla 3 se describen los resultados de las AUC, con sus IC 95%, de los 2modos de exploración ecográfica, de las escalas de valoración pronóstica (FINE13, CURB-6514, SOFA15 y qSOFA16) aplicadas al ingreso y de los parámetros analíticos (PCR y LDH) obtenidos tanto al ingreso como el mismo día de la ecografía. La comparación entre AUC mediante el test DeLong entre las clasificaciones ecográficas de 14 y 8 áreas y el valor de la LDH obtenida el mismo día mostró una p de 0,14 y 0,57, respectivamente y, frente a la PCR, de 0,13 y 0,36, respectivamente.
Áreas bajo la curva ROC las diferentes pruebas evaluadas
| AUC (IC 95%) | |
|---|---|
| Protocolo de ecografía de 14 espacios | 0,88 (0,75-0,99) |
| Protocolo de ecografía de 12 espacios | 0,87 (0,75-0,98) |
| Protocolo de ecografía de 8 espacios | 0,82 (0,68-0,95) |
| LDH al ingreso (UI/L) | 0,67 (0,51-0,83) |
| LDH el día de la ecografía (UI/L) | 0,74 (0,58-0,90) |
| PCR al ingreso (md/L) | 0,60 (0,43-0,76) |
| PCR el día de la ecografía (md/L) | 0,73 (0,58-0,88) |
| SOFA15 al ingreso | 0,72 (0,56-0,89) |
| qSOFA16 al ingreso | 0,68 (0,49-0,87) |
| FINE13 al ingreso | 0,53 (0,36-0,69) |
| CURB-6514 al ingreso | 0,64 (0,46-0,82) |
AUC: área bajo la curva; CURB-65: Community Acquired Pneumonia; FINE: Pronostic Severity Index; IC 95%: intervalo de confianza al 95%; LDH: lactato deshidrogenasa; LS: Lung Score; PCR: proteína C reactiva; qSOFA: quick SOFA; SOFA: Sequential Organ Failure Assessment Score.
El presente estudio aporta información novedosa ya que, hasta donde conocemos, es el primero que utiliza la ET a pie de cama para predecir la necesidad de cuidados críticos, SRNI o fallecimiento durante el ingreso de pacientes con neumonía por COVID-19. Aunque se trata de un estudio inicial, creemos que los hallazgos son relevantes para la práctica clínica, al ayudar a los profesionales sanitarios a tomar decisiones terapéuticas más precoces o definir la intensidad de cuidados que precisa cada paciente en los primeros días de ingreso hospitalario.
En este estudio preliminar la escala ecográfica del protocolo de 14 espacios utilizada presenta una excelente capacidad predictiva, aunque, debido posiblemente al tamaño de la muestra, no ha sido posible demostrar su superioridad frente a la puntuación obtenida con el protocolo de 8 espacios o frente al de biomarcadores como la LDH y la PCR, que son los que más consistentemente se han investigado4. Los resultados obtenidos con el protocolo de 8 espacios son peores, debido a que deja sin explorar los lóbulos inferiores en su región más posterior. Estas áreas son conocidas como «zonas calientes» para pacientes con COVID-19, ya que son las principalmente afectas, tal y como mostramos en este estudio.
El protocolo de exploración elegido ha sido extraído del documento de Consenso Internacional de Ecografía Torácica para pacientes con COVID-1911. Recientemente, la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), junto con la Asociación Española de Endoscopia Respiratoria y Neumología Intervencionista (AEER), ha publicado un excelente documento de consenso que recoge las recomendaciones del uso de la ecografía torácica en pacientes con COVID-1919. Este documento recomienda la exploración de 12 áreas pulmonares, sin incluir la exploración posterior de campos medios. Al excluir estas áreas, el AUC de la puntuación para la predicción de cuidados críticos o necesidad de SRNI es de 0,87 (IC 95%: 0,75-0,98) (datos no mostrados), lo que sin duda refuerza el valor de estas recomendaciones SEPAR-AEER, no solo para el diagnóstico sino también en la evaluación pronóstica.
En una reciente revisión sistemática y metaanálisis se describe de forma acumulada la evidencia publicada sobre la posibilidad de predecir la evolución desfavorable en pacientes con COVID-194. En este completo trabajo se concluye que diferentes combinaciones de parámetros demográficos y clínicos (edad, comorbilidades, gravedad de las alteraciones del intercambio gaseoso), valor basal o aumento de algunos biomarcadores (especialmente LDH y PCR) o grado de afectación en la TC torácica, ofrecen un importante valor pronóstico4. Sin embargo, los autores indican que existe una notable heterogeneidad tanto en el diseño de los estudios como en los criterios para definir un pronóstico desfavorable4. Sin embargo, en ninguna de las series incluidas, ni en la revisión bibliográfica actualizada en el momento de la escritura de este documento (20 de mayo de 2020), hemos encontrado ninguna referencia al posible papel que la ET a pie de cama tiene para predecir la progresión de la enfermedad o la intensidad del soporte ventilatorio necesario. Aunque en nuestra serie las escalas pronósticas y algunos biomarcadores podrían ser también útiles para predecir progresión, parece que la utilización de una clasificación ecográfica es, como mínimo, igual de útil, sin que quede demostrada su superioridad debido, posiblemente, al limitado tamaño muestral. Se precisan estudios con una mayor casuística para establecer comparaciones individuales entre diferentes variables, aunque probablemente la mayor utilidad sea la generación y validación de escalas que combinen varias de ellas, aspecto que no hemos analizado, ya que no era el objetivo de nuestro pequeño estudio.
La TC es la prueba de imagen estándar de oro para evaluar la afectación pulmonar de los pacientes con neumonías por SARS-CoV-2, con referencias sobre su posible papel pronóstico4. Liu et al.5, en un estudio que acaba de publicarse, han descrito que la cuantificación de las lesiones pulmonares, realizada entre el primer y cuarto día de hospitalización mediante TC, tiene una buena capacidad predictiva de la gravedad de las neumonías por COVID-19. Sin embargo, la TC es un método costoso, que requiere alta tecnología, personal entrenado y desplazamiento del paciente, aspecto clave en una enfermedad como la COVID-19, por los riesgos de transmisión nosocomial y el consumo de equipos de protección individual que ello conlleva. La ET a pie de cama permite a los operadores determinar en qué espectro clínico de afectación pulmonar se encuentra un paciente ingresado por COVID-1921. El Lung Score obtenido con ET es un potencial método para clasificar objetivamente las lesiones pulmonares, ya que informa de modo indirecto del grado de aireación pulmonar. Este sistema de puntuación sirve para monitorizar a los pacientes y, como hemos visto, para predecir una posible evolución desfavorable.
La enfermedad tromboembólica y el shock son otras de las 2complicaciones más frecuentes en este tipo de pacientes; por ello, convendría ampliar la exploración ecográfica a miembros inferiores y ecoscopia en casos sospechosos de estas entidades. En nuestra muestra, a 12 pacientes se les realizó una exploración para descartar trombosis venosa profunda en los miembros inferiores y ecoscopia con medición de tamaño de cavidades, estimación visual de FEVI, cálculo de TAPSE y onda S (datos no mostrados). La interpretación de estas exploraciones complementarias requiere, sin embargo, una mayor experiencia del ecografista, posiblemente muy superior a las necesarias para evaluar las alteraciones alvéolo-intersticiales que se detectan en esta enfermedad mediante ET.
El presente estudio presenta varias limitaciones, algunas, como su limitada casuística, ya ha sido comentada. Sin embargo, el trabajo no pretende establecer comparaciones entre diversas variables predictivas, sino solo compartir con los clínicos que atienden a estos pacientes los hallazgos descritos, que creemos que son suficientes para dar más valor aún si cabe a la ET como una técnica clave para un manejo más seguro y eficiente de los pacientes con COVID-19 y neumonías graves. Otra limitación es que todas las ET estuvieron a cargo de un solo operador con amplia experiencia en este campo, por lo que quizá estos hallazgos no sean reproducibles por profesionales menos expertos. Es necesario definir mejor mediante nuevos estudios, preferiblemente multicéntricos, la reproducibilidad de esta técnica.
Creemos que este trabajo puede dar lugar a nuevas líneas de investigación, ya que la ET podría ser un pilar importante a la hora de elaborar escalas multidimensionales que valoren la probabilidad de evolución desfavorable. Esto permitiría optimizar las estrategias de manejo, promover un mayor nivel de monitorización en unidades de cuidados respiratorios intermedios cuando los pacientes presenten un elevado Lung Score y gestionar altas precoces de forma segura en aquellos en quienes se prevé una buena evolución.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El trabajo se enmarca dentro del proyecto de tesis doctoral de la primera autora, incluida en el Programa de Doctorado de Epidemiología y Salud pública de la Universidad de Santiago de Compostela.
El trabajo se enmarca dentro del proyecto de tesis doctoral de la primera autora del trabajo incluida en el Programa de Doctorado de Epidemiología y Salud pública de la USC.