La enfermedad por coronavirus 2019 (COVID-19) es una infección del tracto respiratorio causada por un nuevo coronavirus emergente que se reconoció por primera vez en Wuhan, China, en diciembre de 2019. Actualmente la Organización Mundial de la Salud (OMS) ha definido la infección como pandemia y existe una situación de emergencia sanitaria y social para el manejo de esta nueva infección. Mientras que la mayoría de las personas con COVID-19 desarrollan solo una enfermedad leve o no complicada, aproximadamente el 14% desarrollan una enfermedad grave que requiere hospitalización y oxígeno, y el 5% pueden requerir ingreso en una Unidad de Cuidados Intensivos. En casos severos, COVID-19 puede complicarse por el síndrome de dificultad respiratoria aguda (SDRA), sepsis y shock séptico y fracaso multiorgánico. Este documento de consenso se ha preparado sobre directrices basadas en evidencia desarrolladas por un panel multidisciplinario de profesionales médicos de cuatro sociedades científicas españolas (Sociedad Española de Medicina Intensiva y Unidades Coronarias [SEMICYUC], Sociedad Española de Neumología y Cirugía Torácica [SEPAR], Sociedad Española de Urgencias y Emergencias [SEMES], Sociedad Española de Anestesiología, Reanimación y Terapéutica del Dolor [SEDAR]) con experiencia en el manejo clínico de pacientes con COVID-19 y otras infecciones virales, incluido el SARS, así como en sepsis y SDRA. El documento proporciona recomendaciones clínicas para el soporte respiratorio no invasivo (ventilación no invasiva, oxigenoterapia de alto flujo con cánula nasal) en cualquier paciente con presentación sospechada o confirmada de COVID-19 con insuficiencia respiratoria aguda.
Esta guía de consenso debe servir como base para una atención optimizada y garantizar la mejor posibilidad de supervivencia, así como permitir una comparación fiable de las futuras intervenciones terapéuticas de investigación que formen parte de futuros estudios observacionales o de ensayos clínicos.
Coronavirus disease 2019 (COVID-19) is a respiratory tract infection caused by a newly emergent coronavirus, that was first recognized in Wuhan, China, in December 2019. Currently, the World Health Organization (WHO) has defined the infection as a global pandemic and there is a health and social emergency for the management of this new infection. While most people with COVID-19 develop only mild or uncomplicated illness, approximately 14% develop severe disease that requires hospitalization and oxygen support, and 5% require admission to an intensive care unit. In severe cases, COVID-19 can be complicated by the acute respiratory distress syndrome (ARDS), sepsis and septic shock, and multiorgan failure. This consensus document has been prepared on evidence-informed guidelines developed by a multidisciplinary panel of health care providers from four Spanish scientific societies (Spanish Society of Intensive Care Medicine [SEMICYUC], Spanish Society of Pulmonologists [SEPAR], Spanish Society of Emergency [SEMES], Spanish Society of Anesthesiology, Reanimation, and Pain [SEDAR]) with experience in the clinical management of patients with COVID-19 and other viral infections, including SARS, as well as sepsis and ARDS. The document provides clinical recommendations for the noninvasive respiratory support (noninvasive ventilation, high flow oxygen therapy with nasal cannula) in any patient with suspected or confirmed presentation of COVID-19 with acute respiratory failure.
This consensus guidance should serve as a foundation for optimized supportive care to ensure the best possible chance for survival and to allow for reliable comparison of investigational therapeutic interventions as part of randomized controlled trials.
Este documento de consenso surge por la situación de alarma social y sanitaria y por la demanda de los profesionales de pautas de actuación, por lo que se centra en situaciones específicas fuera de la práctica clínica rutinaria en los centros hospitalarios. Por tanto, deberá ser adaptado a las circunstancias particulares de cada escenario.
Introducción generalEl documento que presentamos está elaborado en consenso con las sociedades científicas implicadas en el fracaso respiratorio agudo en el paciente adulto y se dirige a una descripción más minuciosa sobre las recomendaciones para el uso de soporte respiratorio no invasivo (SRNI) en el manejo de la insuficiencia respiratoria aguda (IRA) secundaria a la infección por el nuevo coronavirus SARS-CoV-2, que provoca la enfermedad denominada COVID-19,como complemento a la información que emite el Ministerio de Sanidad, Consumo y Bienestar Social (MSC)1,2, que se actualiza frecuentemente y que establece una serie de recomendaciones generales.
La Organización Mundial de la Salud (OMS) ha declarado recientemente la enfermedad por el SARS-CoV-2 (COVID-19)3 como una emergencia de salud pública de alarma internacional. Esta pandemia en curso de la enfermedad COVID-19 es devastadora, a pesar de la amplia implementación de medidas de control. En realidad, existen importantes disparidades regionales en la disponibilidad y accesibilidad de los recursos de atención médica entre los más de 70 países afectados actualmente. Tales disparidades podrían explicar en parte las bajas tasas de mortalidad, a pesar de la alta incidencia de casos. En este sentido, las diferentes autoridades sanitarias y los gobiernos han elaborado unos planes de contingencia para manejar los brotes locales4. Estas medidas son esenciales para controlar la epidemia, proteger a los profesionales sanitarios en primera línea y mitigar la gravedad de los desenlaces de los enfermos.
Los resultados del reciente análisis de las características clínicas en una cohorte seleccionada de 1.099 enfermos de COVID-19 en toda China5 han mostrado que hasta el 15% (173/1.099) desarrollaron enfermedad grave según los criterios clínicos de neumonía comunitaria grave de la American Thoracic Society6, y de estos con enfermedad grave, el 24,8% (43/173) tuvieron el desenlace compuesto de ingreso en las Unidades de Cuidados Intensivos (UCI), o uso de ventilación mecánica, tanto invasiva como no invasiva, o muerte. Complementariamente, el 2,9% (5/173) requirieron sistemas de oxigenación extracorpórea.
Este escenario, de ser extrapolado a la situación del actual brote en España, nos sitúa en la necesidad de anticipar y demandar un plan de contingencia a las autoridades sanitarias nacionales y territoriales para el manejo de los recursos sanitarios y de seguridad para los profesionales que incluyan los procesos de utilización de áreas específicas de los centros hospitalarios como son las unidades expertas capaces de atender a pacientes ventilados (UCI, unidades de cuidados respiratorios intermedios [UCRI]), los departamentos de urgencias, las plantas de hospitalización dotadas de medios y personal sanitario capaces de afrontar con seguridad y eficiencia el desafío epidemiológico del control y tratamiento del brote en España de la enfermedad COVID-19. Además, durante las epidemias previas por virus, SARS (síndrome respiratorio agudo grave) y MERS (síndrome respiratorio de Oriente Medio), el personal sanitario presentó una alta tasa de infección, del 18,6% de casos durante el brote de MERS y del 21% de casos durante el de SARS7,8.
Por ello, desde los grupos de trabajo y de las sociedades científicas responsables se deben establecer unos planes de contingencia que prevean la eventual situación crítica para la optimización de recursos materiales y humanos para estar preparados con anticipación ante posibles escenarios desmesurados de demanda imprevista. Concretamente, desde el Grupo de Consenso, dentro de este plan de contingencia, creemos que se debería incluir:
- 1.
Asegurar que las direcciones de los hospitales tengan un protocolo establecido sobre el equipo de protección individual (EPI) para profesionales sanitarios. Asegurarse de que el personal sanitario esté entrenado en los procedimientos de colocación y retirada de los EPI.
- 2.
Utilización de la educación, la capacitación y la simulación de escenarios para valorar la capacidad de respuesta en diferentes escenarios del brote en los centros sanitarios. Optimización y anticipación de los recursos humanos sanitarios para mejorar la seguridad del personal sanitario y planteamiento de las posibles bajas laborables ante la exposición de casos confirmados.
- 3.
Identificación de centros hospitalarios de referencia que puedan manejar un posible aumento de casos con seguridad.
- 4.
Aumentar la capacidad total de las UCI y UCRI, preparar con antelación los recursos materiales, las dotaciones de equipos y de personal sanitario, las áreas de hospitalización y de urgencias donde agrupar a enfermos con COVID-19 positivo en cada hospital, si es necesario.
- 5.
Establecer un protocolo de clasificación para identificar casos sospechosos, probables y confirmados para dirigir circuitos de actuación correcta dentro del hospital.
- 6.
Establecer un protocolo preestablecido del manejo de cualquier caso sospechoso de COVID-19 con criterios de gravedad.
- 7.
Establecer objetivos claros para el cuidado de los enfermos y sus familiares y política de visitas de los enfermos ingresados.
En conclusión, no podemos predecir cuántos enfermos graves afectados por la enfermedad por COVID-19 recibiremos, pero debemos anticipar los escenarios, ajustar los recursos de la forma más racional posible, en consonancia con experiencias de otros países afectados, hacer lo mejor que podamos para estar preparados y trabajar juntos para superar la epidemia.
Las recomendaciones de este documento de consenso, elaborado entre la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC), la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), la Sociedad Española de Medicina de Urgencias y Emergencias (SEMES) y la Sociedad Española de Anestesiología, Reanimación y Terapia del Dolor (SEDAR) están basadas, de forma análoga, en los estudios de otras pandemias víricas (gripe, SARS, MERS) y en las últimas publicaciones sobre el COVID-19. Por tanto, el nivel de evidencia actual es bajo dada la falta de robustez metodológica y por la propia naturaleza de la enfermedad. Este documento se actualizará según la evolución del conocimiento y los cambios de las recomendaciones de los organismos y sociedades nacionales e internacionales.
Recomendaciones generales para el manejo del fracaso respiratorio agudo secundaria a COVID-19Objetivos- •
Identificar adecuadamente a los pacientes con IRA susceptibles de iniciar soporte respiratorio no invasivo (SRNI).
- •
Conocer los procesos de alto riesgo de fracaso del SRNI.
La IRA es la causa más frecuente de mortalidad en los pacientes con gripe y con infecciones virales en general9. Con respecto a la COVID-19 (la enfermedad infecciosa causada por el SARS-CoV-2), el 3,4% de los pacientes infectados en China presentaron un síndrome de distrés respiratorio agudo, lo que supone el 40,3% de los pacientes que presentaron una patología grave5. Por tanto, es muy importante aplicar una estrategia terapéutica para de la insuficiencia respiratoria aguda secundaria a la infección por COVID-19.
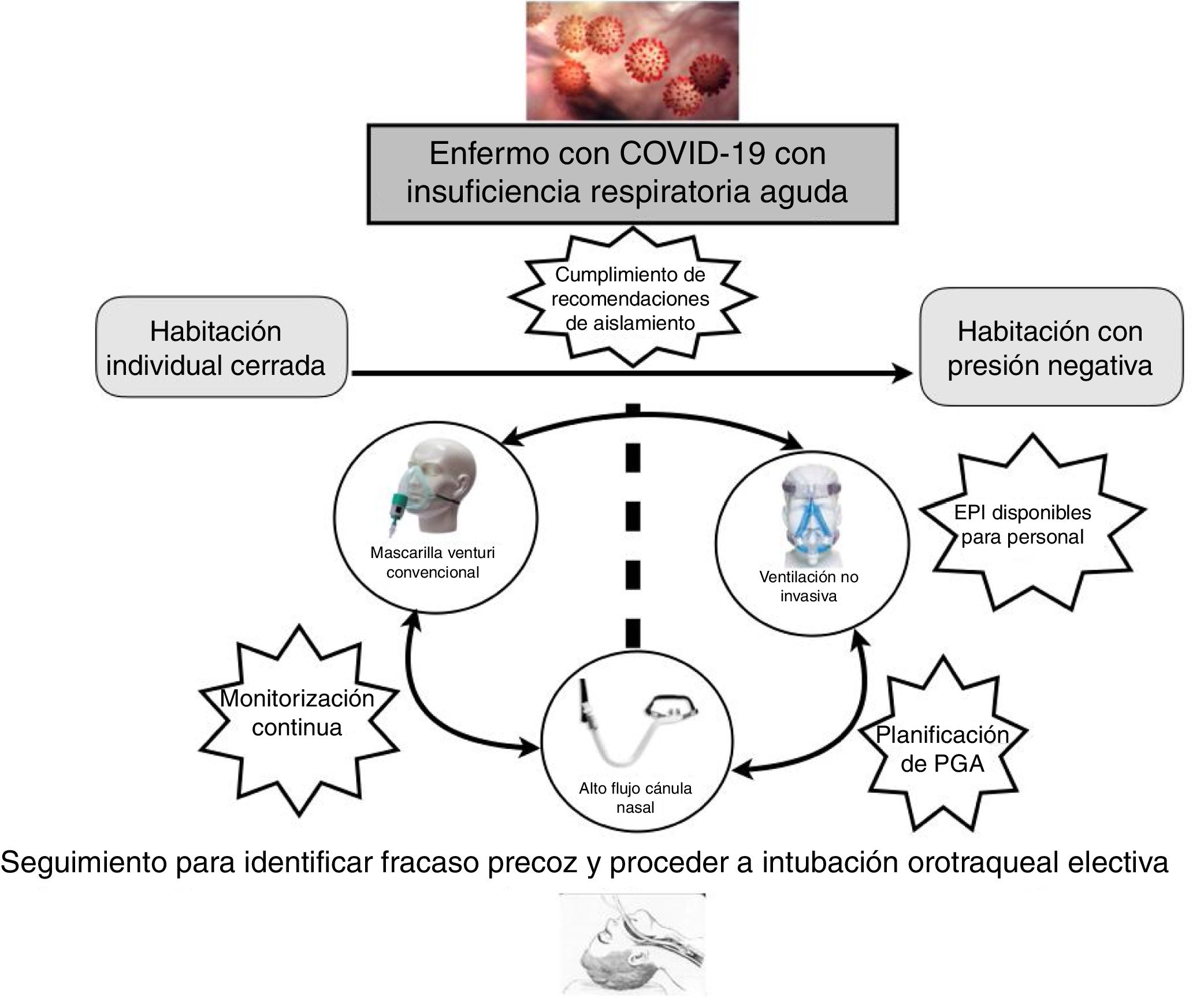
Una parte fundamental del manejo de la IRA en los pacientes con COVID-19 es la monitorización, preferiblemente no invasiva. Estos pacientes precisan ser ubicados en una habitación individual, idealmente con presión negativa, lo que conlleva la necesidad de un control centralizado de la monitorización (pulsioximetría, frecuencia respiratoria) y, preferentemente, con videovigilancia.
Estrategia terapéutica del SRNI en el COVID-19Al igual que otros procesos que provocan IRA, en la infección por SARS-CoV-2 se puede utilizar la estrategia terapéutica respiratoria propuesta por Scala y Heunks10. La oxigenoterapia convencional consiste en la administración de oxígeno a diferentes concentraciones y es la base de la pirámide terapéutica. El siguiente escalón es la terapia de alto flujo mediante cánulas nasales (TAFCN). Consiste en la utilización de una mezcla de gas a flujos altos (hasta 60lpm) con proporciones variables (FiO2) de aire y oxígeno administrados a través de una cánula nasal. Este gas administrado debe estar caliente y humidificado al 100%11. Las ventajas con respecto al oxígeno convencional son un aporte constante de FiO2, reducción del espacio muerto y generación de una presión positiva que conlleva una redistribución de líquido intraalveolar y el reclutamiento alveolar12. El siguiente escalón es la ventilación mecánica no invasiva (VMNI). La principal característica de la VMNI es su uso en ventilación espontánea, por lo que la sedación es nula o baja13. El penúltimo escalón es la ventilación mecánica invasiva (VMI). En este caso se suele utilizar una ventilación en modo controlado y precisa de intubación traqueal10. El último escalón es la membrana de oxigenación extracorpórea (ECMO)14. Actualmente las terapias respiratorias que definen el SRNI son la TAFCN y la VMNI.
A nivel orientativo, y teniendo en cuenta lo anteriormente expuesto, los criterios para iniciar el soporte respiratorio, en la IRA secundaria a COVID-19, serían los siguientes15:
Criterios clínicos:
- •
Disnea moderada-grave con signos de trabajo respiratorio y uso de musculatura accesoria o movimiento abdominal paradójico.
- •
Taquipnea mayor de 30rpm.
Criterios gasométricos:
- •
PaO2/FiO2 < 200 (o la necesidad de administrar una FiO2 superior a 0,4 para conseguir una SpO2 de al menos 92%).
- •
Fallo ventilatorio agudo (pH < 7,35 con PaCO2 > 45mm Hg).
En pacientes sin ninguno de los criterios previos el tratamiento indicado inicialmente sería la oxigenoterapia convencional. Ante la presencia de algún criterio se indicaría soporte respiratorio, ya sea invasivo o no invasivo. El uso del SRNI para el SARS y otras pandemias virales es controvertido, con tasas de fracaso de la VMNI de alrededor del 30%16.
Más recientemente, la VMNI también se usó en pacientes con la IRA por gripe A H1N1, con tasas de fracaso que oscilaron entre el 13 y el 77%17-19. A pesar de la incertidumbre de la evidencia y la ausencia de ensayos clínicos aleatorizados, los datos positivos de la mayoría de los estudios observacionales sugieren que se puede plantear su uso en pacientes cuidadosamente seleccionados en centros con experiencia y en un ambiente protegido (idealmente habitaciones con presión negativa). En la presente epidemia de China el 5,1% de los pacientes necesitaron VMNI, un 2,3% con VMI y un 0,5% ECMO5. Así, la elección terapéutica también dependerá de las patologías de base del paciente, principalmente respiratorias, de la ubicación del enfermo (habitación con presión negativa, habitación individual cerrada con recambio del aire) y de la posibilidad de la eventual necesidad de procedimientos generadores de aerosoles, por lo que, de forma global, podríamos encontrarnos con tres escenarios clínicos:
- 1.
Pacientes sin patología previa (IRA de novo) con insuficiencia respiratoria hipoxémica y, por tanto, susceptibles de escalar el tratamiento hasta la ECMO. La tasa de fracasos del SRNI en este escenario clínico, principalmente en la VMNI, es extremadamente alta. Además, existe evidencia de mayor mortalidad si se produce retraso en el inicio de la VMI. Por tanto, no recomendamos la utilización de SRNI en estos pacientes1,20,21. Solo se podría plantear en pacientes muy seleccionados, siempre y cuando se cumplan todos los siguientes criterios19,21-27:
- •
PaO2/FiO2 > 100 a pesar de oxigenoterapia convencional.
- •
Ausencia de fallo multiorgánico (APACHE < 20).
- •
Es necesario un equipo experto con monitorización continua, por lo que se recomienda realizarlo en unidades especiales con pre-especificado ratio de enfermería como las UCI y las UCRI.
- •
Intubación oro-traqueal (IOT) precoz en la siguiente hora si no existen criterios de mejoría. En este sentido, además de los criterios tradicionales de intubación, se podría considerar la intubación en los pacientes tratados con TAFCN que presenten un índice de ROX ([SpO2/FiO2] / Frecuencia respiratoria) <3, <3,5 y <4 a las 2, 6 y 12h del inicio del tratamiento con TAFCN. De la misma manera, se podría considerar la intubación en los pacientes que presenten un índice HACOR >5 después de 1h de iniciar el tratamiento con VMNI.
Extrapolando la evidencia en IRA de novo la TAFCN sería la modalidad de primera elección21,28. La VMNI se sitúa como segunda opción en caso de respuesta insuficiente y sin criterios inmediatos de VMI.
- 2.
Pacientes con fracaso hipoxémico, orden de no IOT y techo terapéutico en la VMNI. En estos pacientes estaría indicado el inicio de SRNI siempre y cuando estén aseguradas las medidas preventivas. En este contexto es fundamental establecer con el paciente y la familia los objetivos de tratamiento, delimitando el techo terapéutico. En general, se recomienda iniciar el tratamiento con TAFCN antes que con VMNI21,28. Para la utilización del SRNI recomendamos seguir las siguientes consideraciones29,30:
- •
Titular la FiO2 para conseguir una SpO2 objetivo en torno al 95%31.
- •
En caso de usar TAFCN, utilizar flujos superiores a 50lpm; si es posible, iniciar con 60 lpm.
- •
En caso de usar VMNI, utilizar PEEP altas y presiones de soporte bajas (con el objetivo de obtener un VTe <9ml/kg de peso ideal)31,32.
- 3.
Pacientes con exacerbación grave de la EPOC con fallo respiratorio hipercápnico agudo o agudizado: realizar una prueba terapéutica con SRNI, especialmente con VMNI. La TAFCN puede ser útil en estos pacientes en el caso de no tolerancia a la VMNI o para los descansos de la VMNI33-36.
Limitar la transmisión de la infección tanto al personal sanitario como a otros pacientes.
IntroducciónLa utilización del SRNI es una práctica de especial riesgo para la transmisión del SARS-CoV-237-40. La capacidad del SARS-CoV-2 para infectar los trabajadores sanitarios ha sido confirmada, aunque todavía no se pueden establecer comparaciones con MERS y SARS40. Por ello, desde el Ministerio de Sanidad, Consumo y Bienestar Social se han elaborado unas recomendaciones para el manejo de la enfermedad, y este documento pretende difundir las medidas que limiten la transmisión de la infección al personal sanitario2,39. Para poder utilizar el SRNI en un paciente con sospecha o infección por SARS-CoV-2 es indispensable seguir las recomendaciones generales preventivas. En este contexto, es necesario que las administraciones dispongan de los materiales necesarios para un uso seguro del SRNI.
Recomendaciones generales- a)
El personal sanitario que atienda casos en investigación o confirmados para infección por COVID-19 en tratamiento con SRNI debe llevar un equipo de protección individual (EPI) para la prevención de infección2,22,37,39,41 durante los procedimientos de generación de aerosoles que se han asociado con un aumento del riesgo de transmisión de patógenos aéreos. Las medidas preventivas deben estar dirigidas a microorganismos transmitidos por gotas y por contacto que incluya:
- •
Una mascarilla de alta eficacia FFP2 o preferiblemente FFP3 si hay disponibilidad.
- •
Gafas de protección de montura integral.
- •
Recoger el cabello largo en una coleta o moño bajo, pudiéndose ayudar de un gorro de quirófano.
- •
Guantes.
- •
Batas de protección microbiológica impermeables de manga larga.
- b)
La ubicación del paciente en el ámbito hospitalario se relaciona con la posibilidad de realizar procedimientos generadores de aerosoles. En este sentido, la evidencia disponible acerca de los dispositivos de SRNI como procedimientos invasivos y el riesgo de transmisión de patógenos respiratorios a los profesionales sanitarios se relacionan con más consistencia en los casos de intubación orotraqueal y pacientes con vía aérea artificial, así como con la ventilación no invasiva, aunque los resultados proceden de estudios limitados de muy baja calidad, lo que dificulta la interpretación (tabla 1). Por tanto, en los casos leves se recomienda ubicar al paciente en una habitación que disponga de presión negativa. Si este tipo de sala no está disponible, se atenderá al paciente en una habitación de uso individual con baño. La puerta de la habitación deberá permanecer siempre cerrada39. Los casos graves con hipoxemia grave quedarían ingresados en las unidades especiales.
Tabla 1.Resumen de los procedimientos de generación de aerosoles y riesgo de transmisión de enfermedades respiratorias agudas
Procedimientos de generación de aerosol Tipo de estudios Odds ratio (IC 95%) Intubación orotraqueal 4 estudios de cohorte 3,0 (1,4-6,7) 22,8 (3,9-131,1) 13,8 (1,2-167,7) 5,5 (0,6-49,5) Efecto agrupado (I2 = 39,6%) 6,6 (2,3-18,9) Intubación orotraqueal 4 estudios de casos-control 0,7 (0,1-3,9) 9,2 (4,2-20,2) 8,0 (3,9-16,6) 9,3 (2,9-30,2) Efecto agrupado (I2 = 61,4%) 6,6 (4,1-10,6) Aspiración previa a la intubación 2 estudios de cohorte 13,8 (1,2-161,7) 1,7 (0,7-4,2) Efecto agrupado (I2 = 59,2%) 3,5 (0,5-24,6) Aspiración tras la intubación 2 estudios de cohorte 0,6 (0,1-3,0) 1,8 (0,8-4,0) Efecto agrupado (I2 = 28,8%) 1,3 (0,5-3,4) Nebulizaciones 3 estudios de cohorte 6,6 (0,9-50,5) 0,1 (0-1,0) 1,2 (0,1-20,7) Efecto agrupado (I2 = 73,1%) 0,9 (0,1-13,6) Broncoscopia 2 estudios de cohorte 3,3 (0,2-59,6) 1,1 (0,1-18,5) Efecto agrupado (I2 = 0%) 1,9 (0,2-14,2) Aspiraciones endotraqueales 1 estudio de cohorte 1,0 (0,2-5,2) Terapia de alto flujo con cánulas nasales 1 estudio de cohorte 0,4 (0,1-1,7) Ventilación mecánica no invasiva 2 estudios de cohorte 2,6 (0,2-34,5) 3,2 (1,4-7,2) Efecto agrupado (I2 = 0%) 3,1 (1,4-6,8) Administración de oxígeno 1 estudio de casos-controles 1,0 (0,3-2,8) Compresiones torácicas 1 estudio de casos-controles 4,5 (1,5-13,8) Compresiones torácicas 2 estudios de cohorte 3,0 (0,4-24,5) 0,4 (0,0-7,8) Efecto agrupado (I2 = 27,3%) 1,4 (0,2-11,2) Desfibrilación 2 estudios de cohorte 0,5 (0,0-12,2) 7,9 (0,8-79,0) Efecto agrupado (I2 = 55,3%) 2,5 (0,1-43,9) Traqueotomía 1 estudio de casos-controles 4,2 (1,5-11,5) Manipulación de mascarilla de VMNI 1 estudio de cohortes 4,3 (0,6-27,4) Ventilación mecánica 1 estudio de cohortes 0,9 (0,4-2,0) Ventilación manual antes de la intubación 1 estudio de cohortes 2,8 (1,3-6,4) Recogida de muestra de esputo 1 estudio de cohortes 2,7 (0,9-8,2) Inserción de sonda nasogástrica 2 estudio de cohortes 1,7 (0,2-11,5) 1,0 (0,2-4,5) Efecto agrupado (I2 = 0%) 1,2 (0,4-4,0) I2: índice de heterogeneidad estadística; IC: intervalo de confianza.
Resultados de estudios seleccionados en la revisión sistemática que midieron el riesgo de la transmisión del SARS a los trabajadores de la salud que estuvieron expuestos a los procedimientos enumerados en comparación con los trabajadores que no estaban expuestos a los mismos procedimientos48,49.
- c)
Para el traslado intrahospitalario, el paciente y el profesional que traslade al paciente llevarán una mascarilla quirúrgica. Durante el traslado se cubrirá la cama del paciente con una sábana limpia desechable que se eliminará como residuo del grupoIII39.
El Ministerio de Sanidad, Consumo y Bienestar Social recomienda administrar el oxígeno a través de mascarillas con filtro de aire exhalado, pero estas mascarillas no están disponibles de forma universal en nuestro entorno. A falta de disponer de las mismas, podría emplearse de forma segura una mascarilla quirúrgica por encima de las gafas nasales o la mascarilla de oxígeno para limitar la dispersión del virus. No hay estudios que comparen la seguridad en la reducción de la dispersión del SARS-CoV-2 entre el primer tipo de máscara y la protección con mascarilla quirúrgica39, pero la administración de oxígeno se considera un procedimiento generador de aerosoles de riesgo bajo39,40.
Terapia de alto flujo con cánulas nasalesSe recomienda seguir las recomendaciones generales mencionadas y mantener una distancia mínima de 2m con otros pacientes y el personal sanitario no adecuadamente protegido42. Aunque en el momento actual existe incertidumbre en relación con la dispersión de partículas en este modo terapéutico, la colocación de una mascarilla quirúrgica por encima de las cánulas nasales, aunque no estudiada, podría ser una posibilidad ante una situación extrema.
Ventilación mecánica no invasivaSe recomienda mantener una distancia mínima de 2m con otros pacientes y el personal sanitario no adecuadamente protegido.
En general, de acuerdo con la evidencia disponible, no hay contraindicaciones para el uso de los SRNI en enfermos con COVID-19, pero la terapia respiratoria utilizada no solo dependerá de la gravedad de la insuficiencia respiratoria sino de la disponibilidad de una ubicación que cumpla las recomendaciones de aislamiento y seguridad de la Organización Mundial de la salud (OMS). Probablemente los casos más graves, que vaticinen una intubación probable y rápida, deberían ubicarse en las UCI para evitar posibles retrasos en la intubación que resulten desfavorables para la evolución de los enfermos (fig. 1).
- 1.
Elección de la configuración del respirador:
- •
Aunque en el momento actual existen dudas en relación con la dispersión de partículas en el COVID-19, en la epidemia del SARS se publicaron algunos artículos que mostraban una dispersión de partículas con la VMNI de circuito único y puerto exhalatorio de no más de 4pies (1,25m)8,43,44.
- •
Utilizar preferiblemente configuraciones de doble rama, ya que aportan hermetismo al circuito respiratorio tanto inspiratorio como espiratorio. Se deberán colocar filtros antimicrobianos de alta eficiencia en la rama espiratoria para evitar la contaminación inversa desde el paciente al respirador39.
- •
En caso de no disponer de sistemas de doble rama y tener que emplear ventiladores de rama única, deberemos localizar en la tubuladura única el orificio espiratorio y colocar un filtro antimicrobiano de alta eficiencia y baja resistencia para minimizar la dispersión del gas exhalado que pueda contaminar el aire ambiente. Parece factible, asimismo, interponer una pieza enT en el circuito para colocar el filtro y la fuga intencional distal al mismo, aunque debe tenerse en cuenta el incremento de espacio muerto.
- •
En caso de no poder acoplar un filtro antimicrobiano de alta eficiencia en el orificio espiratorio, se deberá colocar un filtro antimicrobiano de alta eficiencia entre la interfase paciente/ventilador (sin orificios espiratorios) y el circuito. En este caso, el aumento de la resistencia podría requerir modificar los parámetros del ventilador en el sentido de incrementar el nivel de presión de soporte.
- •
Una alternativa factible a los sistemas de doble rama o rama única con fuga es el empleo de sistemas monorrama con válvula activa y colocación de filtro antimicrobiano a la salida de la válvula activa.
- •
No recomendamos utilizar Heat and Moisture Exchangers (HME)45.
- 2.
Elección del tipo de interfase:
La interfase es el dispositivo de conexión que facilita la relación física pero también funcional entre dos elementos independientes: ventilador y paciente. Es un elemento indispensable en la VMNI, vehiculando la presión positiva hacia el enfermo sin ningún componente artificial introducido en la vía aérea. Las recomendaciones para el uso de la interfase en la infección por SARS-CoV-2 son40,41,46,47:
- •
La interfase recomendada es aquella sin orificio espiratorio, no utilizando puertos accesorios si los hubiera.
- •
La utilización del helmet debería ser prioritaria en caso de disponer de esta interfase y conocer su técnica de colocación y mantenimiento.
- •
En términos generales, se recomienda utilizar la máscara facial total como primera alternativa y, en su defecto, oronasal.
- •
Es preciso atender y vigilar de forma estricta los puntos de fuga perimáscara, especialmente en las interfaces oronasales, primero para evitar lesiones sobre la piel del paciente con la protección adecuada y, por otro lado, mantener el hermetismo al circuito que evita la exhalación del aire infectado. Debe evitarse los parches protectores por aumento de la fuga, recomendándose la aplicación repetida de aceites hiperoxigenados.
- •
No se recomienda hacer uso de la interfase nasal, ya que genera más aerosoles y porque, además, en general en la infección por SARS-CoV-2 se trata de un fallo hipoxémico agudo.
- 3.
Elección del tipo de codo46:
- •
Recomendamos el uso de codo sin válvula anti-asfixia. Por lo general son de color azul. El empleo de este tipo de codos nos obliga a extremar la vigilancia del paciente ante posibles fallos del equipo de ventilación. Considerando el balance riesgo/beneficio (asfixia vs dispersión) y que estos pacientes están ubicados en habitaciones de alta complejidad al cuidado continuo de personal sanitario especializado, es poco probable la desconexión accidental no detectada ni corregida a tiempo, pero es necesario una ratio de enfermería mínimo seguro.
- •
Desaconsejamos el uso de codo anti-rebreathing (que además alberga válvula anti-asfixia) por el riesgo de mayor dispersión del aire espirado.
La pandemia actual de los casos de COVID-19 exige mayores precauciones de control de infección. Los nebulizadores generan partículas de aerosol del tamaño de 1-5μm que pueden transportar bacterias y virus al pulmón. El riesgo de transmisión de infección a través de núcleos de gotitas y aerosoles puede aumentar durante los tratamientos con nebulizador debido al potencial de generar un alto volumen de aerosoles respiratorios que pueden ser propulsados a una distancia mayor que la involucrada en el patrón de dispersión natural. Además, las partículas más grandes pueden estimular la tos de pacientes y transeúntes y, por lo tanto, aumentar el riesgo de propagación de la enfermedad. La terapia con nebulizador en pacientes con infección pandémica por COVID-19 tiene el potencial de transmitir COVID-19 potencialmente viable a sujetos susceptibles.
En los últimos años ha habido un cambio, en algunos centros, del uso de nebulizadores a inhaladores de dosis medida (pMDI) con cámaras de retención con cámara-válvula espaciadora (de las siglas en inglés Valved-Holding Chambers [VHC]). La administración de terapia inhalada se realizará preferentemente con dispositivo MDI y cámara espaciadora. Sin embargo, es importante señalar que en pacientes con insuficiencia respiratoria aguda es difícil que puedan recibir el medicamento de forma efectiva con estos dispositivos.
La terapia con nebulización solo debería usarse en las siguientes situaciones:
- 1.
Enfermedad respiratoria grave y potencialmente mortal (p.ej., aquellos con hipoventilación o compromiso de ventilación, EPOC grave, fibrosis quística).
- 2.
Pacientes que no cooperan o no pueden seguir las instrucciones requeridas para un inhalador de dosis medida (MDI) con uso de cámara-válvula espaciadora.
- 3.
Pacientes con mala respuesta al MDI con cámara-válvula espaciadora.
Sin embargo, a pesar de la gran cantidad de evidencia que sugiere su falta de superioridad o inferioridad, en comparación con MDI +VHC, el nebulizador abierto todavía se usa ampliamente en los centros hospitalarios.
Dado el brote actual de COVID-19, para reducir el riesgo de transmisión de todas las enfermedades respiratorias infecciosas en los centros hospitalarios alentamos a todos los profesionales sanitarios a considerar seriamente evitar el uso de nebulizadores abiertos en los pacientes con respiración espontánea si no se dispone de los dispositivos mencionados anteriormente. Mantener la seguridad de nuestros pacientes y del personal debe ser nuestra prioridad.
Por tanto, si se precisa utilizar aerosolterapia, se recomienda utilizar dispositivos de malla vibrante con pipeta bucal o mascarilla, limitando la dispersión y poniendo encima una mascarilla quirúrgica. Debe tenerse en cuenta que si se utiliza pipeta bucal con sistema anti-dispersión las dosis de fármaco depositado (especialmente importante en el caso de los broncodilatadores beta2-adrenérgicos) pueden ser mayores y requerir un ajuste de dosis.
Se desaconsejan los sistemas jet por la mayor capacidad de dispersión de partículas al ambiente. De ser necesarios, es imprescindible colocar mascarilla quirúrgica al paciente durante la nebulización.
Para utilizar terapia inhalada junto con SRNI recomendamos observar los siguientes puntos:
- •
La recomendación general para administrar la terapia inhalada es utilizar cartuchos presurizados con un adaptador o cámara espaciadora. En caso de utilizar VMNI se colocará en la rama inspiratoria del circuito, coordinando la pulsación con la inspiración del paciente.
- •
Si utilizamos aerosolterapia son de elección los nebulizadores de malla vibrante con adaptación al codo de la interfase. Como segunda opción se puede utilizar el nebulizador de malla vibrante con una pieza enT al circuito de la VMNI. Al tratarse de un «sistema cerrado», no se dispersan al ambiente si la fuga perimascarilla está bien controlada.
- •
Los nebulizadores tipo jet con tubo enT generan mayores turbulencias y partículas de mayor tamaño y mayor facilidad de dispersión de partículas.
- •
Si utilizamos TAFCN, lo ideal es utilizar cartuchos presurizados con cámara espaciadora, pipeta con nebulizador tipo malla vibrante o un dispositivo de malla acoplado a la rama seca de la cámara reservorio de agua.
- •
En general reduciremos la presión soporte utilizada en VMNI y la temperatura si utilizamos TAFCN.
Este artículo se publica simultáneamente en: Archivos de Bronconeumología (https://doi.org/ 10.1016/j.arbres.2020.03.005), Medicina Intensiva (https://doi.org/ 10.1016/j.medin.2020.03.005) y Revista Española de Anestesiología y Reanimación (https://doi.org/ 10.1016/j.redar.2020.03.006), con el consentimiento de los autores y editores.
Las recomendaciones incluidas en el presente documento están en continua revisión y podrán ser modificadas si la situación epidemiológica y las opciones terapéuticas así lo requieren.