Con una prevalencia de 1:1.500-2.000 entre todos los recién nacidos de Europa Central y EE.UU., la fibrosis quística (FQ) es la enfermedad genética más frecuente en la raza blanca1,2. En Cataluña la cifra es de 1:5.750 recién nacidos vivos3. Desde 1985 se sabe que el gen de la FQ está localizado en el brazo largo del cromosoma 7, pero no fue hasta 1989 cuando un grupo canadiense especificó el defecto genético de la afección. En la actualidad se sabe, sin embargo, que no existe un defecto genético único. Mediante los análisis secuenciales del gen se han identificado más de 1.000 mutaciones relacionadas con los síntomas de la FQ4. La frecuencia y los tipos de mutaciones varían en función de las razas y etnias.
El anormal funcionamiento del gen de la FQ repercute en la proteína de membrana cystic fibrosis transmembrane conductance regulator (CFTR), que actúa como un canal de cloro que se puede activar a través de la adenosinmonofosfato cíclico (AMPc). La impermeabilidad al cloro de la membrana celular en epitelios ciliados en enfermos de FQ no se produce por la ausencia completa de canales de cloro, sino por un trastorno genético de la activación de los canales intracelulares y afecta sólo a los canales de cloro dependientes del AMPc. Su anormal funcionamiento hace que se excreten menos iones cloro al exterior de la célula y que se reabsorban más iones sodio, lo cual condiciona, por un lado, la concentración iónica del moco y, en consecuencia, establece una anormal diferencia de potencial entre el interior y el exterior de las células afectadas. Existen también otros canales de cloro alternativos, que se activan por el calcio intracelular y que se comportan en individuos con FQ igual que en personas sanas, si bien no son capaces de compensar de manera absoluta la secreción de cloro. En pacientes con FQ observamos una mayor diferencia de potencial nasal (DPN) por esta excesiva reabsorción de sodio, con pérdida de valencias positivas en la luz bronquial, lo que lleva a una mayor negativización de los valores de la DPN respecto al intersticio en comparación con los individuos sanos. La CFTR se expresa en las células epiteliales del pulmón, páncreas, glándulas sudoríparas y conductos deferentes, donde produce alteraciones concordantes con la clínica de la enfermedad, si bien los trastornos del transporte iónico repercuten de forma diferente en los distintos órganos.
Ventajas e inconvenientes de los métodos diagnósticos habituales
Hasta la introducción de la prueba de cribado neonatal para la FQ, en la mayoría de los pacientes (el 71% en EE.UU.) se establecía el diagnóstico de FQ en el primer año de vida y en un 8% de los pacientes no se establecía el diagnóstico hasta los 10 años de edad. El diagnóstico diferencial, desde el punto de vista respiratorio, incluye otras entidades como inmunodeficiencias primarias, discinesia ciliar primaria o el síndrome de Young1,5. Clásicamente se ha venido realizando el análisis del contenido de iones sodio y cloro del sudor por estimulación con pilocarpina; es la denominada "prueba del sudor", desarrollada por Gibson y Cooke en 19596-8. Actualmente, sin embargo, se sabe que una prueba del sudor normal no excluye de forma definitiva la enfermedad. En un 10% de los adolescentes sanos se obtienen valores falsamente positivos9 y el 2% de los pacientes con un fenotipo "atípico" suelen presentar una prueba del sudor normal2. En estos casos, la demostración de mutaciones de FQ en el gen de la CFTR (estudio genético lento y costoso) permite el diagnóstico definitivo. De ahí que se investigara en busca de un nuevo método para el diagnóstico de la FQ que fuera más sensible y específico en la demostración in vivo de un transporte iónico anormal debido a un comportamiento patológico de la proteína CFTR a través de algún epitelio del organismo, como es la prueba de la DPN. Esto motivó una serie de cambios en los criterios diagnósticos de FQ recogidos en el consenso de 199810. Además, el incremento del índice de sospecha de la enfermedad gracias a la prueba de la DPN, junto con un mejor y mayor desarrollo técnico de los estudios genéticos, ha hecho posible detectar un número creciente de mutaciones nuevas e inusitadas del gen de la FQ que en el pasado no se tipificaban como características de la enfermedad. Esto ha obligado a cambiar el concepto de esta enfermedad y a considerar que la FQ abarca un espectro clínico muy amplio, con lo cual ha aumentado el número de diagnósticos de FQ en un número creciente de adultos. La determinación de la DPN se ha introducido recientemente en el Estado español y parece cada vez más útil en el enfoque diagnóstico de la FQ dada su elevada sensibilidad, especificidad y valor pronóstico11.
Finalmente, hoy día en muchos países el diagnóstico de FQ se sospecha en el período neonatal, al incluir en los programas de cribado neonatal la determinación de la tripsina inmunorreactiva en sangre, y se confirma por la detección de 2 mutaciones en el estudio genético o por 2 pruebas del sudor positivas. Aunque la mayoría de estos lactantes están libres de síntomas en el momento del cribado neonatal, experimentarán en el futuro manifestaciones clínicas propias de FQ.
Medición de la diferencia de potencial nasal
Interés clínico
En los últimos años la capacidad para detectar mutaciones en el gen de la FQ y para medir las propiedades bioeléctricas transepiteliales que son consecuencia directa de estas mutaciones ha ampliado enormemente el espectro de la FQ. En 1981 el grupo de trabajo dirigido por Knowles12 desarrolló una técnica para diagnosticar la FQ, la denominada medición de la diferencia de potencial transepitelial nasal (DPN).
El epitelio ciliado respiratorio (incluido el epitelio nasal) regula la composición de fluidos de la superficie de las vías respiratorias mediante el transporte activo de iones sodio y cloro. Este transporte iónico genera una diferencia de potencial transepitelial que puede medirse in vivo, se expresa en milivoltios (mV), depende de la concentración de los diferentes iones y es negativa respecto a la submucosa. La submucosa de todos los epitelios respiratorios es isoeléctrica, al igual que el tejido celular subcutáneo. Por eso es posible tomar como valor de referencia (para establecer una diferencia de potencial transepitelial) cualquier tejido subcutáneo en zonas del cuerpo humano de fácil acceso.
Las anormalidades del transporte iónico en el epitelio respiratorio de pacientes con FQ se asocian con un patrón de DPN que es diferente del de individuos normales. Ésta es la razón fundamental para el uso del DPN como ayuda diagnóstica. Específicamente 3 rasgos distinguen a la FQ:
1. Mayor valor absoluto de diferencia de potencial --el valor de hecho es más negativo--, lo cual refleja un transporte de sodio aumentado a través de una membrana celular relativamente impermeable al cloro. Un valor absoluto de DPN basal ostensiblemente elevado es patognomónico de FQ. En individuos sanos los valores se sitúan en alrededor de -20 mV y en los enfermos afectados de FQ son mayores de -50 mV.
2. Mayor reducción de la diferencia de potencial después de perfusión nasal con un inhibidor del canal de sodio (amilorida), lo cual refleja la inhibición del transporte acelerado de sodio típico de los pacientes con FQ13,14. Las sustancias bloqueadoras de los canales de sodio como la amilorida impiden de forma selectiva el flujo de iones de sodio en células epiteliales tras la inhalación nasal. Al permanecer los iones sodio en el lado luminal del epitelio ciliado, se llega a un aumento de la carga positiva en esta zona, con disminución de los valores absolutos de DPN (que de hecho reflejan una menor negatividad).
3. Cambio mínimo o ausencia de cambio de la DPN en respuesta a la perfusión de la superficie epitelial nasal con una solución libre de cloro en conjunción con un betaagonista (isoproterenol o fenoterol), lo cual refleja la falta de secreción de cloro mediada por la CFTR14,15.
A través de los simpaticomiméticos que producen la activación de adenilciclasa y de la AMPc se consigue una estimulación de cloro en los individuos sanos, pero no en lo pacientes con FQ.
Las ventajas y limitaciones de la técnica se exponen en las tablas I y II.
Material y método
Material
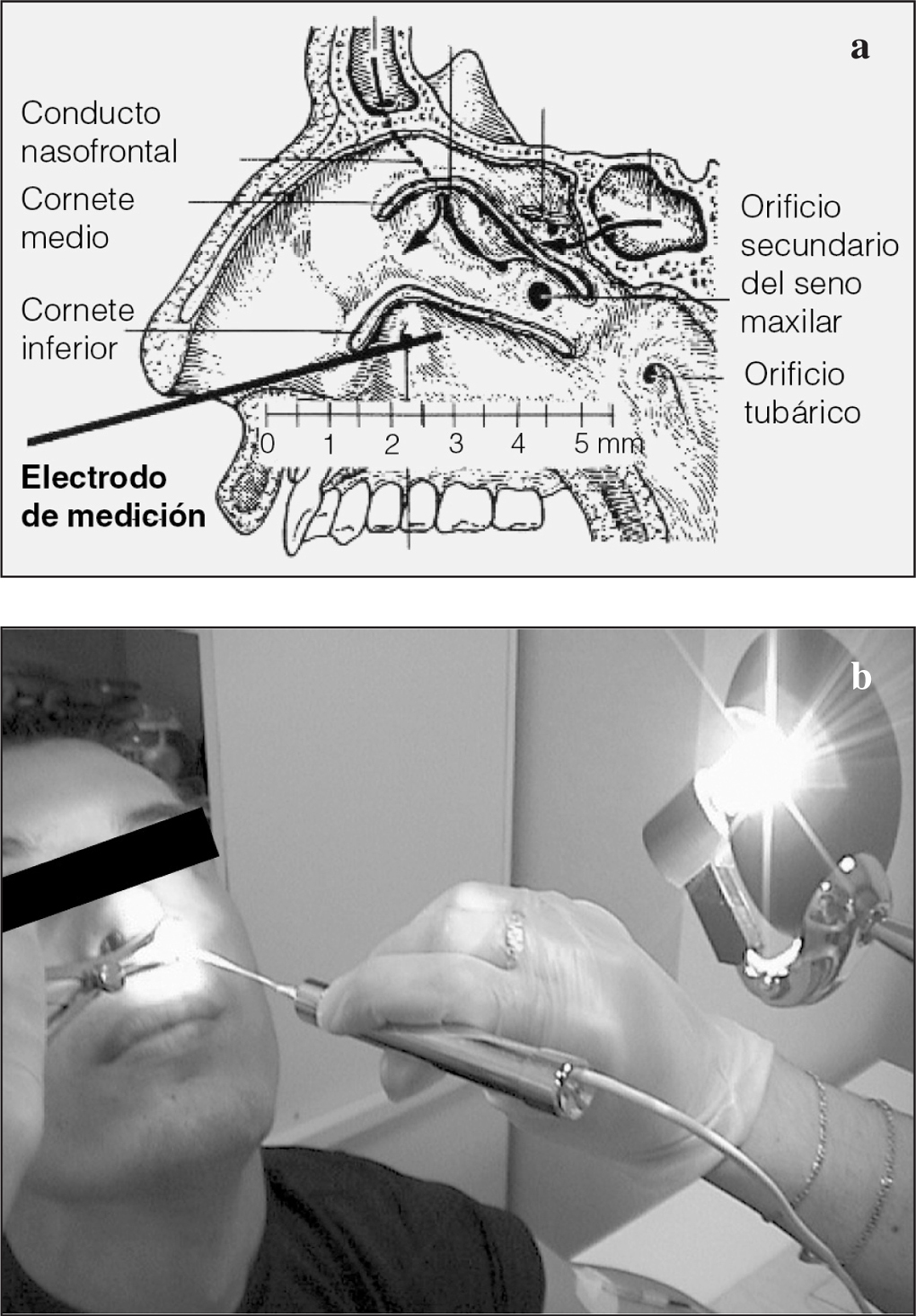
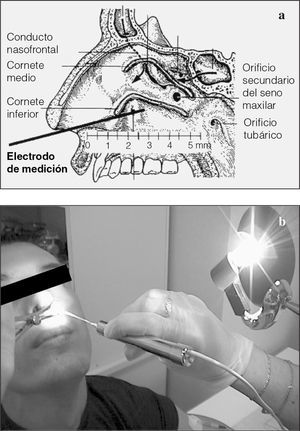
Dispositivos de medida de la diferencia de potencial nasal: Tholy. Para realizar correctamente la técnica se precisa un voltímetro de alta impedancia debidamente validado. Se utilizan diferentes aparatos de medida. Knowles et al16 describieron el dispositivo inicial y posteriormente Hofmann et al17, el grupo de trabajo dirigido por Lindemann, desarrolló un dispositivo simplificado (Tholy-Medicap®, Ulrichstein, Germany). Para el registro de la DPN mediante el Tholy se precisan un electrodo de medición para la toma de esta señal bioeléctrica, que se colocará en la superficie del epitelio, y un electrodo de referencia intravenoso o subcutáneo. Knowles et al16 demostraron que el epitelio ciliado respiratorio de la mucosa nasal se corresponde cualitativamente con la mucosa bronquial. La colocación del electrodo de medida sobre el epitelio ciliado respiratorio de la nariz debajo del cornete inferior es tan adecuada como en la mucosa bronquial, y aquél es un punto de medición relativamente fácil de alcanzar que permite objetivar además cambios en los valores de DPN tras la administración de fármacos locales.
Material necesario:
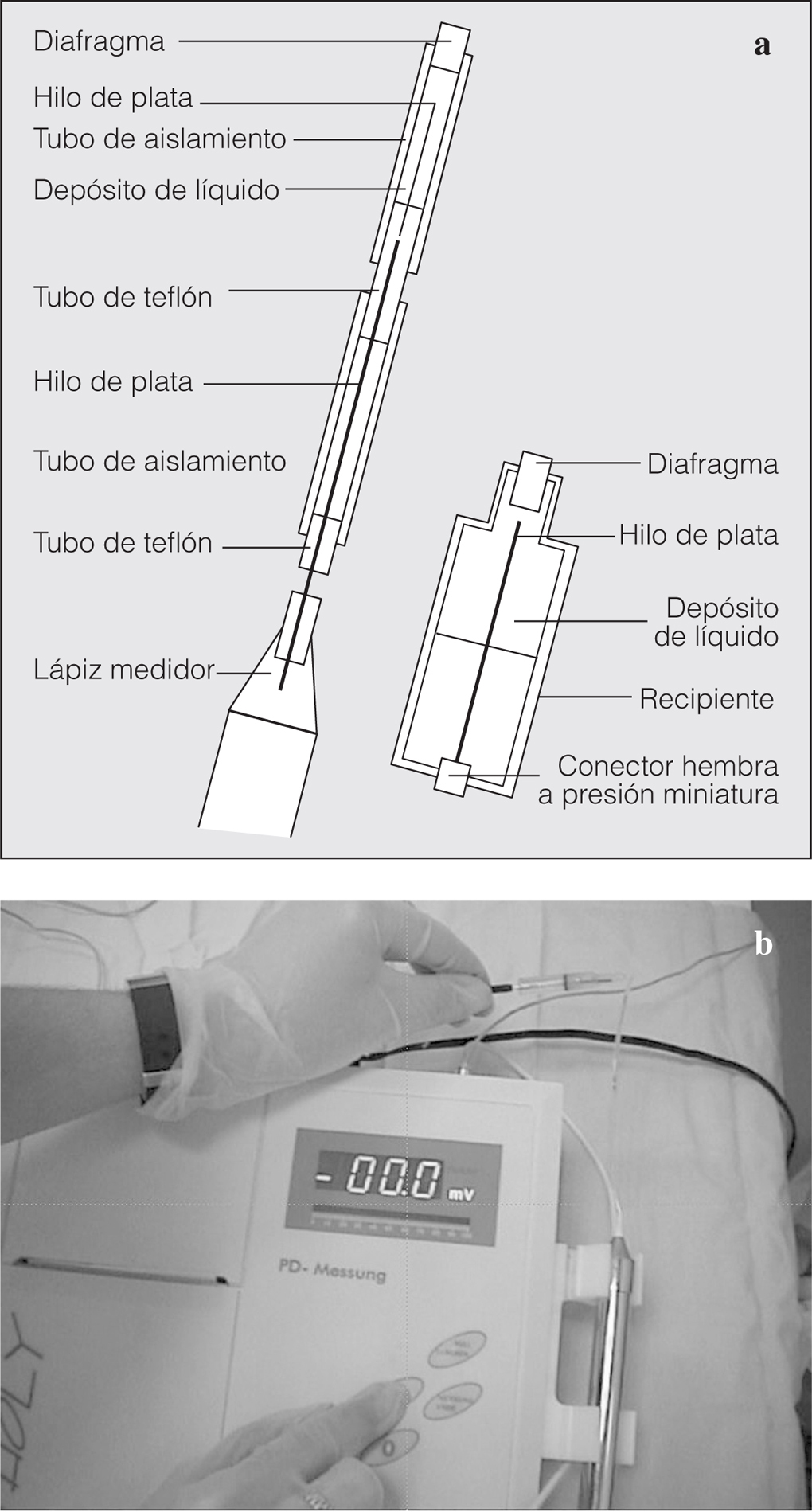
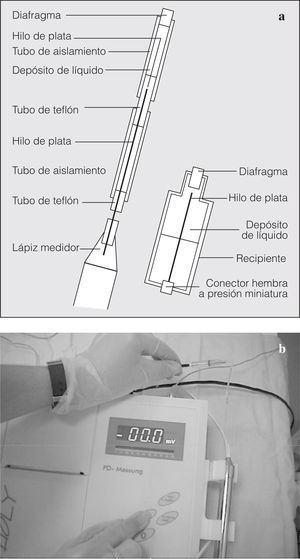
1. Un dispositivo de medida de la DPN Tholy, con lápiz medidor para el registro del electrodo de medición y un cable de conexión para la unión del electrodo de referencia (Medicap®) (fig. 1). Es un aparato portátil que se puede emplear allí donde exista corriente eléctrica (tanto 110 como 220 V). El suministro eléctrico llega a través de una unidad transformadora incorporada en el enchufe previsto.
Fig. 1. Dispositivo de medida Tholy.
2. Dos electrodos de plata/cloruro de plata (figs. 2a y b):
Fig. 2. Esquema de los electrodos de medida (a): el más largo se utiliza para el contacto con la mucosa nasal y el más corto se coloca por vía subcutánea o intravenosa. Obsérvense (b) los electrodos conectados al aparato de medición Tholy.
- Electrodo de medición colocado en el lápiz medidor.
- Electrodo de referencia (más pequeño) que permite conectar en su extremo un catéter subcutáneo intravenoso.
Los electrodos se conservan en tubos de plástico llenos de una solución de cloruro de plata saturada. Después de cada uso, esta solución se desecha y sustituye por una nueva solución de cloruro de plata.
3. Suero salino isotónico (0,9%).
4. Apósito para la fijación del catéter, algodón, alcohol para desinfección y jeringuillas.
5. Fuente fría de luz.
6. Espéculo nasal.
7. Papel térmico de impresión.
Instalación: descripción del aparato de medición. El principio del dispositivo simplificado de medida Tholy se basa en la conexión directa de un voltímetro de elevada resistencia con un electrodo de medición y un electrodo de referencia fijo, con lo que la diferencia de potencial transepitelial puede medirse más fácilmente.
El dispositivo Tholy contiene un registrador controlado por un microprocesador con una memoria integrada de los valores medidos, así como una impresora térmica para la impresión de los valores medidos.
Calibración del voltímetro. Para revisar, antes de una medición, la eficacia y la estabilidad de los electrodos utilizados se debe calibrar el aparato. El procedimiento es el siguiente: se ponen en contacto los extremos de los electrodos de referencia y de medición para crear un cortocircuito, de modo que el voltímetro no detectará corriente; entonces se consideran aptos estos electrodos. Es posible que la pantalla registre un valor de unos pocos milivoltios; entonces se debe pulsar el botón de "0" para equilibrar los electrodos asegurándose de que estén en contacto. Después de devolver los electrodos a 0, la pantalla deberá mostrar un valor de 0 mV cuando los electrodos estén en contacto.
Procedimiento de medición de la diferencia de potencial nasal
Preparación de los instrumentos de medición. Para impedir que los electrodos de medición y de referencia se sequen, el material se debe preparar justo antes de realizar la prueba. Se conecta el voltímetro a la red de corriente eléctrica y se conectan los electrodos. En caso de que la medición no se realice inmediatamente, se debe proteger el electrodo para que no se seque sumergiéndolo en la solución provista.
Preparación del paciente. En la cara externa de la parte superior del brazo del paciente, una vez desinfectada la piel, se introduce el catéter subcutáneo (preparado de forma aséptica) en el tejido adiposo subcutáneo y se extrae la aguja de la bránula que queda fijada con un apósito. Para una mejor toma de contacto, se inyecta con una jeringuilla un pequeño bolo (2 ml) de suero salino dentro del catéter. Posteriormente se conecta el catéter subcutáneo al electrodo de referencia. Éste queda en contacto con el tejido subcutáneo humedecido con la solución salina (como resultado del llenado del catéter), de tal modo que en la pantalla se debe visualizar un valor de DPN de unos pocos milivoltios que, al movilizar el electrodo, variarán ligeramente (pudiéndose alternar valores positivos con negativos). De no ocurrir así, se debe repetir el llenado del catéter con suero salino.
Realización práctica de la medición de la diferencia de potencial nasal. El conocimiento claro de la localización anatómica de la zona es decisivo para la determinación de la DPN de manera precisa. Se debe doblar lateralmente la punta del instrumento de medición unos 20° según la anatomía de la nariz, sin tocar la parte de cerámica del electrodo. Con la ayuda del espéculo nasal, conectado a una fuente de luz fría, se examina el interior de la nariz del paciente. Para reconocer el cornete inferior, la cabeza del paciente debe estar fija y ligeramente reclinada (figs. 3a y b). El electrodo de medida se introduce en la nariz aproximadamente de 3 a 5 cm bajo control visual por debajo del cornete inferior. Inmediatamente después de iniciada la medición, al tocar la parte posterior del cornete inferior con el electrodo de medición, la pantalla debe indicar valores entre -5 y -10 mV. Si no es así, se debe ajustar el electrodo de medición y/o recalibrar. En caso de estar bien calibrado, se debe asegurar que el contacto del electrodo de medición con la mucosa nasal sea correcto. Se debe movilizar lentamente el electrodo procurando mantener el máximo contacto con la mucosa, para buscar el punto con valores de medida más elevados y que permanezcan estables durante 2 s como mínimo. Cuando esto sucede se aprieta botón "End" para imprimir los valores registrados. Es mejor que una segunda persona pulse este botón para que la persona que realiza la medición continúe manteniendo la posición del electrodo de medición en contacto con el epitelio. Si se pierde el contacto epitelial antes de apretar el botón "End", no se registrará la DPN máxima. Este procedimiento no excederá de un tiempo de 15-20 s en cada fosa nasal. Para efectuar la medición de la DPN de la otra fosa nasal, se repite el procedimiento utilizando el mismo electrodo y cambiando únicamente la orientación del giro del electrodo.
Fig. 3. Obsérvense la anatomía de la zona y el trayecto del electrodo de medición hasta entrar en contacto con el cornete inferior (a), así como la posición del paciente durante la introducción del electrodo de medición (b).
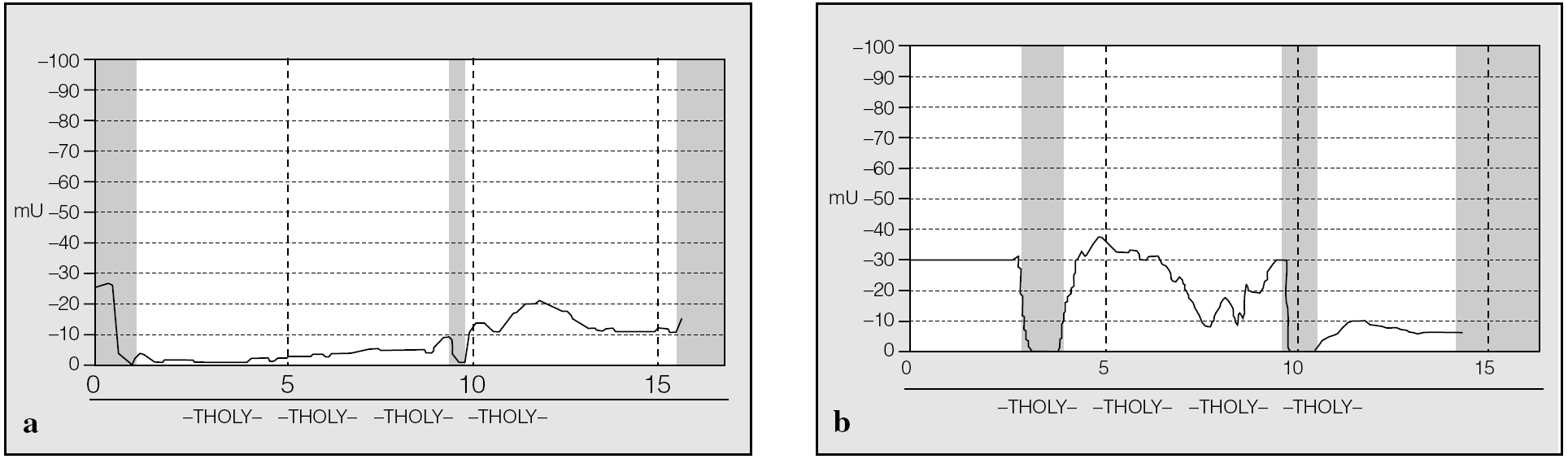
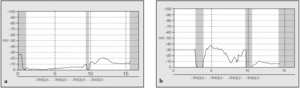
Tan importante como el valor de la DPN es la morfología del trazado (figs. 4a y b). Las diferencias de potencial previstas son de una magnitud de 0 a -100 mV. Si sobrepasan estos valores, se ha de comprobar la posición del electrodo de medición y del electrodo de referencia y repetir la medición.
Fig. 4. Para el diagnóstico de fibrosis quística mediante la determinación de la diferencia de potencial nasal, tan importante como el valor alcanzado es la morfología de la curva de medición: a) curva aplanada correspondiente a una persona sana; b) gráfica con una curva típicamente característica de fibrosis quística.
Interpretación de resultados
Como con cualquier prueba de laboratorio que se utilice para confirmar un diagnóstico, la DPN debe repetirse al menos una vez más para ser aceptada como criterio diagnóstico. Además, cualquier laboratorio que planifique establecer una DPN como herramienta diagnóstica debería realizar un número suficiente de estudios a fin de disponer de valores de referencia y asegurar un adecuado rigor de la técnica. La cifra oscilaría entre 300 y 400 determinaciones18.
En el estudio de Hoffman et al17 se efectuaron 312 mediciones de DPN en pacientes con FQ y 269 en controles sanos. Éstos mostraron unos valores medios (± desviación estándar) de -22,1 ± 7,3 mV, y los valores de los pacientes con FQ fueron de 58,8 ± 13,7 mV. Un valor umbral para una posible FQ podría establecerse a partir de -40 mV. Valores superiores (menos negativos) a -30 mV no apoyarían el diagnóstico de FQ. Valores entre -30 y -40 mV obligan a repetir una vez como mínimo la medición, especialmente en casos de infección. Un valor patológico unilateral (es decir, medido en una sola narina) no suele resultar suficiente. Se ha observado que en los pacientes con FQ pueden observarse falsos negativos cuando la integridad del epitelio está alterada; en cambio, los valores obtenidos en sujetos control no sobrepasan nunca los -40 mV.
En los pacientes con valores de DPN basal que se solapan, la administración de isoproterenol o fenoterol después de amilorida por vía nasal debe permitir discriminar entre sanos y afectados de FQ. Tras la aplicación de amilorida (bloqueador del flujo de sodio y acumulación de valencias positivas en el lumen) la diferencia de potencial se reduce en todos los pacientes, pero de manera mucho más intensa y llamativa en los casos de FQ. Después de la amilorida (bloqueador del transporte de sodio), se administra isoproterenol o fenoterol, que inducen una secreción de cloro a través de la apertura de los canales dependientes de cloro-AMPc. En el caso de pacientes con FQ no se obtiene respuesta tras el fenoterol, ya que, debido al defecto genético, este canal no puede activarse o se activa sólo parcialmente 14,15.
Estudio financiado por la beca Òscar Ravà, Fundació Catalana de Pneumologia (FUCAP) 1999.
Correspondencia: Dr. Ch. Domingo-Ribas.
Servicio de Neumología. Corporació Parc Taulí.
Parc Taulí, s/n. 08208 Sabadell. Barcelona. España.
Correo electrónico: cdomingo@cspt.es
Recibido: 14-1-2005; aceptado para su publicación: 1-3-2005.