La fibrosis pulmonar idiopática es una enfermedad intersticial fibrosante limitada al pulmón, con mal pronóstico. Su incidencia ha aumentado en los últimos años, probablemente por la optimización de los métodos diagnósticos y el aumento en la esperanza de vida. En 2013 se publicó la normativa SEPAR sobre el diagnóstico y tratamiento de la fibrosis pulmonar idiopática. Desde entonces, se han publicado los resultados de ensayos clínicos y metaanálisis que han supuesto, con base en la evidencia científica, la introducción de pirfenidona y nintedanib en el tratamiento de la enfermedad. En 2015 se ha actualizado el consenso internacional de 2011, en el que se describen los cambios en las recomendaciones terapéuticas. Debido a ello cabía actualizar el apartado de la normativa sobre el tratamiento farmacológico de la fibrosis pulmonar idiopática. No se tratarán aspectos diagnósticos ni el tratamiento no farmacológico, ya que no se han producido cambios relevantes desde la normativa de 2013.
Idiopathic pulmonary fibrosis is defined as chronic fibrosing interstitial pneumonia limited to the lung, with poor prognosis. The incidence has been rising in recent years probably due to improved diagnostic methods and increased life expectancy. In 2013, the SEPAR guidelines for the diagnosis and treatment for idiopathic pulmonary fibrosis were published. Since then, clinical trials and meta-analyses have shown strong scientific evidence for the use of pirfenidone and nintedanib in the treatment of idiopathic pulmonary fibrosis. In 2015, the international consensus of 2011 was updated and new therapeutic recommendations were established, prompting us to update our recommendation for the medical treatment of idiopathic pulmonary fibrosis accordingly. Diagnostic aspects and non-pharmacological treatment will not be discussed as no relevant developments have emerged since the 2013 guidelines.
En el año 2013 publicamos la «Normativa sobre el diagnóstico y tratamiento de la fibrosis pulmonar idiopática»1. Desde entonces, se han conocido los resultados de ensayos clínicos con pirfenidona, nintedanib y N-acetilcisteína (NAC)2–4, que han supuesto un cambio en las estrategias terapéuticas de esta enfermedad. En 2015 se ha publicado la actualización del consenso internacional sobre fibrosis pulmonar idiopática (FPI) de 2011, en la que se describen los cambios en las recomendaciones sobre el uso de los diferentes fármacos utilizados en el tratamiento de la enfermedad5. Debido a estos cambios en las estrategias terapéuticas, nos hemos propuesto elaborar la actualización de la normativa sobre el tratamiento farmacológico de la FPI.
Tratamiento farmacológicoEn 2015 se actualizaron las recomendaciones para el tratamiento de la FPI con base en la nueva evidencia científica desde la primera guía diagnóstico-terapéutica de 20115,6. Este hecho representa uno de los mayores hitos en la FPI, dado que por primera vez se establece una recomendación terapéutica grado A para 2 fármacos antifibróticos, pirfenidona y nintedanib, con base en un nivel 1 de evidencia científica (ensayos clínicos con resultados reproducibles y metaanálisis) siguiendo el sistema GRADE7, cuando en 2011 solo se habían podido establecer grados de recomendación C o D para el tratamiento (basados en opinión de expertos, estudios retrospectivos, prospectivos no validados o series de casos clínicos). En 2014 se objetivan posibles beneficios farmacológicos en cuanto a una reducción significativa de la mortalidad, posicionándose la FPI como uno de los pocos campos en neumología donde un tratamiento podría mejorar una variable clínicamente tan prioritaria.
Fármacos antifibróticos que han demostrado beneficio terapéuticoPirfenidona (Esbriet®)Pirfenidona es un fármaco pleiotrópico, con propiedades antifibróticas y antiinflamatorias, que inhibe la síntesis de factores de crecimiento profibrogénicos, como el transformador de crecimiento beta y el plaquetario, así como la proliferación de fibroblastos y la formación de colágeno8.
Su eficacia clínica ha sido evaluada a través de varios ensayos clínicos aleatorizados, doble ciego y controlados con placebo; 2 son orientales, uno en fase ii y otro en fase iii9,10, y 3 son occidentales, en fase iii (CAPACITY-1, CAPACITY-2 y ASCEND). Los 3 ensayos occidentales fueron diseñados para evaluar la eficacia y la seguridad de pirfenidona en pacientes con FPI leve-moderada. La tabla 1 resume las principales características metodológicas de los ensayos clínicos. Los 2 estudios CAPACITY se desarrollaron simultáneamente durante 72 semanas8. El metaanálisis de los resultados conjuntos de ambos estudios demostró la reducción en el descenso de FVC a las 72 semanas de tratamiento con pirfenidona respecto al placebo8. Un análisis Cochrane demostró que pirfenidona incrementaba un 30% la supervivencia libre de progresión de la enfermedad respecto a placebo. Las autoridades sanitarias europeas admitieron la molécula para uso comercial en la FPI leve-moderada (FVC>50, DLCO>35%), si bien en Estados Unidos se solicitó un nuevo estudio con las mismas características de los ensayos CAPACITY que permitiera reproducir los efectos favorables. Así, el ensayo clínico ASCEND se inició en 20112 y los pacientes fueron tratados durante 52 semanas. Este estudio demostró de nuevo una contención significativa del deterioro funcional respecto al grupo placebo, con una reducción relativa del 48% de casos en los que la enfermedad progresaba o fallecían durante el periodo de estudio. Igualmente, demostró que el grupo de tratamiento presentaba una supervivencia libre de progresión de la enfermedad significativamente mayor que la de los pacientes del grupo placebo. Además, se observó un menor número de pacientes fallecidos en el grupo de tratamiento, y al analizar conjuntamente los datos con los ensayos CAPACITY-1 y 2, reuniendo 1.247 pacientes, se demostró una reducción significativa de la mortalidad a las 52 semanas de tratamiento con pirfenidona2.
Características metodológicas y clínicas de los pacientes con fibrosis pulmonar idiopática incluidos en los ensayos clínicos CAPACITY-1 y 2, y ASCEND
| CAPACITY-1 y 2 (n=779) | ASCEND (n=555) | |
|---|---|---|
| Edad (años) | 40-80 | 40-80 |
| FVC (criterio inclusión) | ≥50% | 50-90% |
| DLCO (criterio inclusión) | ≥35% | ≥30% |
| Fase | III | III |
| Tiempo estudio (semanas) | 72 | 52 |
| TCAR NIU | 92% | 95,7% |
| FVC al inicio (media) | 74,1% | 67,8% |
| DLCO al inicio (media) | 47% | 43,7% |
DLCO: capacidad de transferencia del monóxido de carbono; FVC: capacidad vital forzada; NIU neumonía intersticial usual; TCAR: tomografía axial computarizada de alta resolución.
Un metaanálisis que evalúa los resultados obtenidos en los estudios CAPACITY y ASCEND al año de tratamiento con pirfenidona ha demostrado una reducción en la proporción de pacientes con caída de la FVC≥10% o muerte (43,8%) y un incremento en la proporción de casos con estabilidad en la FVC (59,3%)11. Se observó un beneficio en el tiempo libre de progresión de la enfermedad, así como en la capacidad de ejercicio (medida por los metros recorridos en la prueba de la marcha de los 6 minutos) y en la disnea. El análisis de estos resultados por subgrupos de pacientes objetivó que la reducción en la caída de la FVC se da en pacientes con una FVC al inicio tanto por encima como por debajo del 80% del predicho11.
La dosis de pirfenidona recomendada es de 2.403mg/día dividida en 3 tomas coincidentes con las comidas. La dosis plena se alcanza a las 3 semanas, al ir incrementando de forma progresiva la dosificación: la primera semana, un comprimido de 267mg/8h; la segunda semana, 2 comprimidos de 267mg/8h, y la tercera semana, 3 comprimidos de 267mg/8h. Los efectos adversos más relevantes son los gastrointestinales (náuseas, dispepsia, anorexia y pérdida de peso), seguidos de rash, fotosensibilidad y, en menor proporción, alteraciones de la función hepática (tabla 2). La toma del fármaco con las comidas reduce el pico plasmático máximo y, por lo tanto, el riesgo de efectos adversos12. Cuando la sintomatología gastrointestinal sea relevante la dosis puede reducirse o incluso suspenderse transitoriamente hasta el control de los síntomas; logrado esto, se puede intentar reescalar hasta alcanzar la dosis plena12. El uso de procinéticos o inhibidores de la bomba de protones (IBP) puede ayudar al control de los síntomas gastrointestinales, teniendo presente que omeprazol puede interaccionar con pirfenidona, por lo que se aconseja pantoprazol o esomeprazol en caso de requerir un IBP. Para minimizar la posibilidad de reacciones cutáneas en forma de rash o fotosensibilidad, se recomienda evitar la exposición directa y prolongada al sol, hacer uso de cremas con filtro solar (+50), gafas y gorro, y reducir las áreas expuestas con vestimenta apropiada, especialmente tras 1-2h de la toma12.
Dosis y principales efectos adversos de los fármacos antifibróticos recomendados
| Fármaco | Dosis recomendada | Efectos adversos más frecuentes |
|---|---|---|
| Pirfenidona | 2.403mg/día (801mg en cada comida) | Náuseas/vómitos Dispepsia Anorexia/pérdida de peso Rash/fotosensibilidad Alteraciones de la función hepática |
| Nintedanib | 300mg/día (150mg en desayuno y cena) | Diarrea Náuseas/vómitos Dispepsia Anorexia/pérdida de peso Alteraciones de la función hepática |
La experiencia acumulada tras más de 5 años de uso indica que la frecuencia de efectos adversos y suspensión del fármaco por efectos graves es similar a la descrita en los ensayos clínicos y alcanza un 3-4% de los casos13,14.
Las principales contraindicaciones para el uso de pirfenidona son la hipersensibilidad al fármaco, el uso concomitante de fluvoxamina y la hepatopatía o nefropatía grave. El consumo de zumo de pomelo debe evitarse durante su uso. No hay datos sobre su utilización durante el embarazo (tabla 3). En la tabla 4 se especifican las interacciones medicamentosas de pirfenidona.
Contraindicaciones y sugerencias en el uso de los fármacos antifibróticos recomendados
| Fármaco | Contraindicación absoluta | Sugerencias adicionales |
|---|---|---|
| Pirfenidona | Hipersensibilidad al fármaco Hepatopatía grave Nefropatía grave | Evitar su uso durante el embarazo y la lactancia |
| Nintedanib | Hipersensibilidad al fármaco Alergia al cacahuete o a la soja Insuficiencia hepática grave | Precaución en caso de: Diátesis hemorrágica Doble antiagregación Anticoagulación crónica Cardiopatía isquémica Ictus cerebrovascular Cirugía abdominal (<4 sem) Evitar su uso durante el embarazo y la lactancia |
Principales interacciones medicamentosas de los antifibróticos recomendados
| Fármaco | Aumentan la biodisponibilidad | Reducen la biodisponibilidad |
|---|---|---|
| Pirfenidona | Zumo de pomelo Fluvoxamina Ciprofloxacino Amiodarona/propafenona Fluoxetina/paroxetina | Tabaco Omeprazol Rifampicina |
| Nintedanib | Ketoconazol Eritromicina Ciclosporina | Rifampicina Carbamazepina Fenitoína |
Nintedanib es un inhibidor triple de los receptores de la tirosina cinasa que presenta actividad antifactor de crecimiento derivado de las plaquetas, antifactor de crecimiento de los fibroblastos y antifactor de crecimiento vascular endotelial, relacionados con los mecanismos patogénicos de la fibrosis. Tres ensayos aleatorizados, doble ciego y controlados con placebo avalan la utilidad del fármaco en la FPI.
En 2011 fueron publicados los resultados de un ensayo fase ii (TOMORROW)15. Demostró que nintedanib, a dosis de 150mg/12h, enlentecía significativamente la caída de la función pulmonar a lo largo de un año en comparación con placebo y reducía la frecuencia de exacerbaciones agudas. Ello condujo a la realización de los estudios INPULSIS 1 y 2 en fase iii cuyos resultados fueron publicados en 20143. La tabla 5 resume las características metodológicas de estos estudios.
Características metodológicas y clínicas de los pacientes con fibrosis pulmonar idiopática incluidos en los ensayos clínicos TOMORROW e INPULSIS
| TOMORROW (n=422, 85 a dosis 150mg/12h) | INPULSIS-1 y 2 (n=1.066) | |
|---|---|---|
| Edad (años) | 40-80 | 40-80 |
| FVC (criterio inclusión) | ≥50% | ≥50% |
| DLCO (criterio inclusión) | 30-79% | 30-79% |
| Fase | II | III |
| Tiempo estudio (semanas) | 52 | 52 |
| TCAR NIU | 38,8% | 76% |
| FVC al inicio (media) | 78,1% | 79,5% |
| DLCO al inicio (media) | - | 47% |
DLCO: capacidad de transferencia del monóxido de carbono; FVC: capacidad vital forzada; NIU neumonía intersticial usual; TCAR: tomografía axial computarizada de alta resolución.
En los estudios INPULSIS los pacientes fueron asignados a recibir nintedanib (150mg/12h) o placebo durante 52 semanas. Sus resultados demostraron que la reducción de la FVC era significativamente menor bajo tratamiento con nintedanib. En el ensayo INPULSIS-2 se observó un porcentaje menor de pacientes con exacerbaciones agudas a favor del tratamiento, así como un menor descenso del deterioro de la calidad de vida. Si bien la mortalidad fue menor en el grupo de tratamiento, esta diferencia no fue estadísticamente significativa3.
Un análisis realizado sobre el conjunto de pacientes incluidos en los ensayos TOMORROW e INPULSIS puso de manifiesto que nintedanib disminuye significativamente la pérdida de función pulmonar, alarga el tiempo hasta la primera exacerbación aguda y mejora los índices de calidad de vida16. El análisis por subgrupos de los datos obtenidos en los 2 estudios INPULSIS, con un total de 1.066 pacientes, objetivó que el enlentecimiento en la progresión de la enfermedad (caída de la FVC) se observaba independientemente de la edad (mayores y menores de 65 años), de la FVC en el momento del inicio terapéutico (inferior y superior al 70 y al 90%) y de la existencia o no de enfisema asociado3,17,18.
El efecto adverso más frecuente de nintedanib, que llega a presentarse hasta en el 60% de los casos, es la diarrea, la cual suele ser de leve a moderada intensidad. Solo en aproximadamente un 4-5% llega a ser lo suficientemente intensa o recurrente como para obligar a la retirada definitiva del fármaco. Otros efectos adversos menos frecuentes son las náuseas y vómitos, la anorexia, la pérdida de peso y las alteraciones en la función hepática (tabla 2).
Para minimizar los efectos secundarios gastrointestinales, especialmente la diarrea, la dosis diaria puede reducirse a 100mg/12h o incluso suspenderse transitoriamente, hasta el control de los síntomas; una vez logrado, se deberá reintroducir la medicación hasta alcanzar la dosis plena. Una dieta astringente, la toma de probióticos, así como loperamida, asociada o no a codeína, pueden contribuir a controlar la frecuencia y la intensidad de la diarrea.
Las principales contraindicaciones de nintedanib son la hipersensibilidad al fármaco o antecedentes de haber presentado reacciones alérgicas al cacahuete o la soja, así como la insuficiencia hepática grave. Debe administrarse con precaución en pacientes con diátesis hemorrágica, doble antiagregación o anticoagulación crónica, cardiopatía isquémica, o antecedentes de ictus cerebrovascular y cirugía abdominal reciente (menos de 4 semanas). En los estudios INPULSIS, los pacientes con riesgo cardiovascular fueron excluidos y, por tanto, no se conoce con certeza la seguridad (tabla 3). En la tabla 4 se especifican las interacciones medicamentosas de nintedanib.
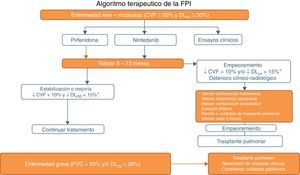
Pirfenidona y nintedanib en la práctica clínicaUna vez se ha establecido el diagnóstico de FPI es razonable comenzar el tratamiento antifibrótico tan pronto como sea posible con el fin de enlentecer el deterioro de la función que se produce sin tratamiento19. En pacientes asintomáticos y con mínima repercusión funcional o radiológica podría adoptarse una conducta expectante, pero después de sopesar el riesgo/beneficio de tal actitud20. Con base en la evidencia clínica y atendiendo a los criterios de inclusión en los ensayos clínicos realizados para los 2 fármacos (tablas 1 y 2), el uso de pirfenidona y nintedanib se recomienda en pacientes con FPI con deterioro funcional leve-moderado (FVC≥50% y DLCO≥30%)1–3,5,8 (tabla 6; fig. 1). En caso de contraindicaciones o intolerancia a estos fármacos, es aconsejable incluir a los pacientes en ensayos clínicos. La duración recomendable del tratamiento es de 12 meses. Si existe mejoría o estabilización de la enfermedad, debe continuarse el tratamiento. En caso de empeoramiento, debe considerarse en cada paciente si es aconsejable continuar el tratamiento o instaurar otras estrategias terapéuticas. Es recomendable remitir a unidades de trasplante pulmonar a los pacientes con mal pronóstico en el momento del diagnóstico o con progresión rápida de la enfermedad. En aquellos en lista de espera para trasplante es recomendable no interrumpir el tratamiento antifibrótico, ya que se ha demostrado que puede disminuir la progresión de la enfermedad y no aumenta la incidencia de complicaciones postrasplante21. En la enfermedad grave (FVC<50%, DLCO<30%), el tratamiento de elección es el trasplante pulmonar. En estos pacientes, para los que no se ha demostrado aún ningún beneficio terapéutico farmacológico, es preciso el desarrollo de ensayos clínicos. Además, se debe valorar la necesidad de cuidados paliativos (fig. 1).
Recomendaciones para el tratamiento antifibrótico de la fibrosis pulmonar idiopática
| Agente | Mecanismo de acción | Recomendaciones |
|---|---|---|
| Recomendados en pacientes seleccionados | ||
| Pirfenidona | Antifibrótico+antiinflamatorio+antioxidante+anti-TGFβ 1 | Sí. Evidencia científica |
| Nintedanib | Inhibidor tirosina cinasa | Sí. Evidencia científica |
| No recomendados | ||
| Esteroides+azatioprina+NAC | Inmunosupresor+antioxidante+antiinflamatorio | No utilizar |
| Anticoagulación | Anticoagulante | No utilizar |
| Bosentán | Antagonismo dual del receptor de la endotelina | No utilizar |
| Esteroides en monoterapia | Inmunosupresor | No utilizar |
| Esteroides+terapia inmunomoduladora | Inmunosupresor | No utilizar |
| Colchicina | Inhibidor proliferación/síntesis de colágeno | No utilizar |
| Ciclosporina | Inmunosupresor | No utilizar |
| Etanercept | Anti-TNF-alfa | No utilizar |
| Interferón gamma | Antifibrótico e inmunomodulador | No utilizar |
| Ambrisentán | Antagonista selectivo del receptor de endotelina A | No utilizar |
| NAC en monoterapia | Antioxidante | No utilizar |
NAC: N-acetilcisteína.
En 2003 un metaanálisis Cochrane sobre el uso de corticoides en la FPI concluyó que no existía evidencia clínica para justificar su uso22. Sin embargo, hasta hace escasos años el uso de corticoides orales no era infrecuente en la práctica clínica, probablemente porque hasta el 2000-2002 otras entidades fibrosantes pulmonares con respuesta parcial al tratamiento corticoideo, como la neumonía intersticial no específica, eran indistinguibles de la FPI. Además, el ensayo clínico IFIGENIA, que evaluó el efecto de NAC, determinó que su uso, en asociación con corticoides y azatioprina, mostraba una reducción en el descenso de la DLCO en comparación con el uso de estos mismos sin NAC23. Este estudio propició la utilización de esta triple terapia en FPI. En 2011 se inició el estudio PANTHER, en el que se evaluó el efecto del tratamiento triple en comparación con placebo y con NAC en monoterapia. Antes de un año de iniciado el estudio, la rama de triple terapia tuvo que ser suspendida por seguridad, ya que ocasionaba mayor mortalidad y número de ingresos hospitalarios que el uso de placebo24. Las ramas placebo y NAC en monoterapia llegaron hasta la finalización del estudio, y a las 60 semanas de seguimiento se comprobó que no había beneficio terapéutico alguno de la NAC4. Por lo tanto, existe evidencia suficiente para desaconsejar el uso de corticoides asociados a azatioprina como tratamiento de la FPI5. Actualmente, el uso de corticoides en FPI queda limitado a: 1) exacerbaciones agudas de la enfermedad, tal como se especifica en el apartado correspondiente, y 2) casos de sintomatología de difícil control, como la tos incoercible que no mejora con antitusígenos, a dosis bajas (5-10mg/día), en ocasiones como parte del tratamiento paliativo. En ambos casos, hay un bajo nivel de evidencia clínica sobre su beneficio terapéutico.
Fármacos antifibróticos en fase de ensayo clínicoLos ensayos clínicos con antifibróticos que actualmente se llevan a cabo están planteados en 2 situaciones:
1) En fases de la FPI en las que aún no se ha demostrado beneficio terapéutico con los antifibróticos comercializados, como son los estadios subclínicos o incipientes de la enfermedad, o en las fases más avanzadas (FVC<50%, DLCO<30%). En estas situaciones, tanto los antifibróticos comercializados como los nuevos antifibróticos se pueden plantear en monoterapia o en combinación (www.clinicaltrials.gov).
2) En fase leve-moderada de la FPI (FVC>50%, DLCO>30%), los nuevos antifibróticos en ensayo clínico siempre se plantean en combinación con alguno de los 2 fármacos comercializados. Dada la complejidad de las múltiples vías implicadas en la patogenia de la enfermedad, el uso de diferentes líneas de tratamiento simultáneamente podría, teóricamente, actuar de forma sinérgica y generar un mayor beneficio clínico25,26. La primera combinación ensayada ha sido pirfenidona+NAC a partir de estudios preliminares que evidenciaban el potencial efecto sinérgico de la combinación27. Los datos preliminares de seguridad con ambos fármacos son positivos; sin embargo, no existe beneficio clínico de añadir NAC a pirfenidona28. Otra combinación que se ha empezado a ensayar es nintedanib+pirfenidona. Un reciente ensayo clínico oriental fase ii para valorar la seguridad, la tolerancia y la farmacocinética muestra que la combinación a corto plazo es segura, aunque aumentan los efectos secundarios gastrointestinales, especialmente las náuseas y los vómitos29. Actualmente, se está llevando a cabo el ensayo clínico COMBO (fase iv) para evaluar su seguridad durante 32 semanas. Existen también otras combinaciones de pirfenidona o nintedanib con nuevos fármacos antifibróticos que se habían empezado a evaluar antes de la comercialización de ambos fármacos (www.clinicaltrials.gov). Entre estas combinaciones están: pirfenidona±lebrikizumab (estudio RIFF), pirfenidona o nintedanib±PRM-151 (estudio PROMEDIOR), pirfenidona±vismodegib (estudio GB29764), pirfenidona±sildenafilo.
Tratamiento de las comorbilidades asociadasReflujo gastroesofágicoExisten algunos estudios que muestran un papel beneficioso del tratamiento médico y quirúrgico del reflujo gastroesofágico (RGE). En una pequeña serie de 4 pacientes con FPI y RGE, el tratamiento de este último mediante IBP o funduplicatura mostró una estabilización de la FVC30. En otro estudio retrospectivo con 204 pacientes con FPI, Lee et al. observaron un aumento de la supervivencia en los pacientes tratados para el RGE, principalmente con IBP31.
En un análisis de los datos de 242 pacientes incluidos en los brazos placebo de 3 ensayos clínicos aleatorizados se observó que aquellos que recibían IBP o antagonistas de los receptores de la histamina-2 tenían una disminución menor de la FVC con respecto a los que no recibían terapia antiácida, además de menos exacerbaciones agudas32. En la guía de ATS/ERS/JRS/ALAT del 2011 y en la actualización de tratamiento publicada en 2015 se aconseja el uso regular del tratamiento con IBP en los pacientes con FPI, siendo la recomendación condicional debido al muy bajo nivel de evidencia en la estimación del efecto5.
En otro estudio se evalúa el efecto de la terapia antiácida en la progresión de la enfermedad de los pacientes asignados a los brazos placebo de 3 ensayos clínicos fase iii con pirfenidona (ensayos CAPACTY y ASCEND). De los 624 pacientes del grupo placebo, solo 291 recibían terapia antiácida. No se encontraron diferencias entre los pacientes tratados y los no tratados en la progresión de la enfermedad, la mortalidad por todas las causas o un descenso superior al 10% en la FVC. Se observó un aumento no significativo de las infecciones pulmonares en los pacientes con tratamiento antiácido33. También se ha evaluado el efecto del tratamiento del RGE mediante funduplicatura laparoscópica en la progresión de la enfermedad en pacientes con FPI con empeoramiento clínico y funcional a pesar de tratamiento antiácido. Los resultados no mostraron diferencias significativas en el descenso de la FVC, previa a la cirugía y tras un año de seguimiento34. Para valorar el beneficio del tratamiento antiácido en los paciente con FPI se requieren estudios aleatorizados que lo comparen frente a placebo.
Enfisema pulmonarEn la actualidad, no existen tratamientos eficaces para el síndrome CPFE (coexistencia de enfisema y FPI)35,36, de tal manera que parece lógico tomar decisiones terapéuticas basadas en las recomendaciones por separado para el enfisema y la FPI. Dejar de fumar debe ser la primera recomendación para el tratamiento de la EPOC y la FPI. Si CPFE se asocia con otras exposiciones ambientales, estas deben evitarse. La oxigenoterapia es el tratamiento más adecuado para la hipoxemia y la hipertensión pulmonar (HP) en caso de estar asociadas. Con el fin de disminuir las exacerbaciones agudas y las infecciones, se recomienda la vacunación antigripal y frente a Streptococcus pneumoniae.
Para los pacientes que tienen una disfunción funcional obstructiva o mixta, pueden utilizarse broncodilatadores inhalados tal como se prescriben para la EPOC. El uso de agentes de acción prolongada asociados a corticoides inhalados ha mostrado beneficios en algunos pacientes37,38 al mejorar la función pulmonar y reducir la gravedad de la enfermedad durante el episodio agudo. Sin embargo, no está demostrado fehacientemente el beneficio de los broncodilatadores en CPFE. Además, el deterioro de la función pulmonar puede ser diferente entre los pacientes de CPFE con o sin obstrucción del flujo aéreo y, por tanto, puede ser distinta la eficacia de uno u otro broncodilatador. Aún sin evidencia clara, los broncodilatadores inhalados se prescriben en menos de la mitad de los casos39, pero dado que la FPI carece de tratamiento definitivo, el manejo de sus comorbilidades puede ser un recurso terapéutico para mejorar su evolución39.
Respecto a la eficacia de los nuevos fármacos antifibróticos, en los estudios CAPACITY (pirfenidona) e INPULSIS (nintedanib) se incluyeron casos con CPFE, aunque el número era reducido y no suficiente para realizar ninguna afirmación al respecto. Una investigación reciente ha mostrado que la mayoría de los pacientes con FPI, incluidos aquellos con enfermedades cardiovasculares y enfisema, toleraron bien pirfenidona y mantuvieron un curso estable de la enfermedad. Sin embargo, la eficacia expresa en CPFE tanto de pirfenidona como de nintedanib no está demostrada11,17.
Es necesario establecer criterios clínicos y de diagnóstico específicos para CPFE, y es apremiante una mejor comprensión de la patogenia, la fisiopatología y los factores pronósticos del síndrome CPFE para explorar, diseñando estudios prospectivos de cohortes, nuevas y efectivas estrategias terapéuticas39.
Hipertensión pulmonarLa HP suele aparecer en fases avanzadas de la FPI y es generalmente leve, pero empeora el pronóstico de la enfermedad. El tratamiento de los pacientes con HP asociada a FPI debe incluir la oxigenoterapia domiciliaria si existe hipoxemia crónica (recomendación fuerte, nivel de evidencia bajo) y la valoración del trasplante pulmonar si no existe contraindicación por edad o comorbilidades. En 2015 se publicaron 2 guías que hacen referencia al tratamiento de la HP asociada a FPI: la actualización de la normativa ATS/ERS/JRS/ALAT de FPI5, en la que se aplaza la recomendación sobre este tratamiento, y la guía ESC/ERS sobre diagnóstico y tratamiento de la HP40, en la que no se recomienda el uso de fármacos aprobados para la HP causada por enfermedad pulmonar (recomendación fuerte, nivel de evidencia bajo).
Los fármacos antagonistas duales de los receptores de la endotelina (bosentán, macitentán) no han demostrado eficacia en el tratamiento de la HP asociada a FPI. El antagonista selectivo ambrisentán, valorado en el ensayo clínico ARTEMIS-IPF41, está contraindicado por falta de eficacia y aumento en la progresión de la enfermedad y en el número de hospitalizaciones por complicaciones respiratorias (recomendación fuerte, nivel de evidencia bajo).
El estudio fase ii RISE-IIP (NCT02138825) con riociguat, un fármaco estimulador de la guanilato ciclasa soluble que actúa en la vía del óxido nítrico, desarrollado con el objetivo de investigar su eficacia y seguridad en HP sintomática asociada a neumonías intersticiales idiopáticas, se ha interrumpido tras haberse detectado un incremento de la mortalidad y de eventos adversos graves en el grupo de pacientes tratados con riociguat.
Sildenafilo, un inhibidor de la fosfodiesterasa 5, ha sido evaluado en el estudio STEP-IPF en pacientes con FPI avanzada (DLCO<35%); en el subgrupo de pacientes con disfunción sistólica del ventrículo derecho mejora la distancia recorrida en la prueba de la marcha de los 6 minutos y la calidad de vida42. Se puede considerar el tratamiento individualizado de los pacientes con HP o disfunción del ventrículo derecho graves (recomendación débil, calidad de la evidencia baja). Los ensayos clínicos actuales que asocian fármacos vasodilatadores pulmonares a los antifibróticos demostrarán si este abordaje es beneficioso o no.
Tratamiento de las agudizacionesHasta la fecha, no se dispone de ningún ensayo aleatorizado específicamente diseñado para el tratamiento de las agudizaciones de FPI, así que las recomendaciones actuales se basan en los resultados de las pocas series publicadas. Con base en estos estudios, se recomienda únicamente optimizar el soporte vital (recomendación débil, calidad de evidencia muy baja), aunque diversos estudios han demostrado que la ventilación mecánica en pacientes con FPI e insuficiencia respiratoria no es eficaz en la mayoría de los casos. Se recomienda valorar la administración de altas dosis de glucocorticoides en los primeros días del evento (bolos de metilprednisolona 500-1.000mg/día durante 3 días, seguidos de dosis altas de prednisona: 0,5mg/kg/día; grado recomendación débil)43. La suma de un segundo fármaco inmunosupresor (azatioprina, ciclofosfamida o ciclosporina) carece de estudios aleatorizados que apoyen su indicación. No hay estudios controlados que avalen el uso de la heparina de bajo peso molecular para el tratamiento de las exacerbaciones, excepto si se sospecha una enfermedad tromboembólica venosa asociada. En la práctica clínica, además, se admite el uso empírico de antibióticos de amplio espectro, dada la dificultad en muchas ocasiones de descartar un proceso infeccioso subyacente43–46. Respecto a los nuevos fármacos antifibróticos, hay que mencionar que no hay estudios que evalúen su efecto como tratamiento de las agudizaciones de FPI, pero sí hay datos que evidencian un posible efecto preventivo3. Por lo tanto, quizás el paso más importante en las agudizaciones de la FPI es la prevención, insistiendo en la vacunación antigripal y antineumocócica, tratando los síntomas del RGE y evitando las biopsias quirúrgicas en pacientes con función pulmonar deteriorada y hallazgos típicos de neumonía intersticial usual en la tomografía axial computarizada de alta resolución.
Conflicto de interesesTodos los autores han participado en actividades científicas y simposiums sobre FPI de Boehringer-Ingelheim y Roche y forman parte del comité asesor de FPI de Boehringer-Ingelheim y Roche.