Los aislamientos de micobacterias no tuberculosas (MNT) son cada vez más frecuentes. El objetivo principal de nuestro estudio fue conocer el número y la variedad de especies de MNT en nuestra región, su distribución según el origen de la muestra, y la edad y sexo de los pacientes; asimismo, analizar pormenorizadamente los aislamientos clínicamente significativos.
MetodologíaEstudio prospectivo que incluye todas las MNT aisladas en Asturias durante el período 2005-2012. Las muestras se procesaron siguiendo directrices internacionalmente aceptadas. Para el tratamiento estadístico de los datos se utilizaron tablas de contingencia 2×2 aplicando el test exacto de Fisher.
ResultadosSe aislaron 3.284 micobacterias: 1.499 Mycobacterium tuberculosis complex (MTB) y 1.785 MNT. A lo largo del estudio se incrementaron los aislamientos de MNT y se redujeron los de MTB. Los aislamientos de MNT fueron más numerosos en hombres que en mujeres (p<0,001). M.gordonae, la especie más frecuentemente aislada, no originó enfermedad en ningún caso. El aislamiento fue clínicamente significativo en 212 pacientes (17,1%), siendo M.kansasii y M.avium las especies que más frecuentemente causaron enfermedad. La diferencia de aislamientos de M.kansasii entre mujeres y hombres fue estadísticamente significativa (p<0,01).
ConclusionesEn nuestro estudio, los aislamientos de MNT se incrementaron un 35%, frente a un descenso del 21% de los casos de MTB. Tanto los aislamientos de MNT como los casos clínicamente significativos fueron más frecuentes en hombres. Solo un 17,1% de las MNT aisladas, principalmente M.avium complex (MAC) y M.kansasii, ocasionaron enfermedad.
Non-tuberculous mycobacteria (NTM) isolates are becoming more common. The main objective of our study was to establish the number and diversity of NTM species in our region and their distribution according to the source sample, age and gender of the patients, and to analyse clinically significant isolates.
MethodologyProspective study of all NTM isolated in Asturias from 2005 to 2012. Samples were processed following internationally accepted guidelines. Statistical analysis was based on Fisher's exact test for 2×2 contingency tables.
ResultsA total of 3,284 mycobacteria were isolated: 1,499 Mycobacterium tuberculosis complex (MTB) and 1,785 NTM.During the study, NTM isolation rates increased while MTB isolation decreased. NTM were more frequent in men (P<.001). M.gordonae was the most frequently isolated species but did not cause disease in any case. NTM isolates from 212 patients were associated with clinically significant disease (17.1%). M.kansasii and M.avium were most commonly associated with disease. The number of M.kansasii isolates from men was statistically significant (P<.01).
ConclusionsIn our study, NTM isolates increased by 35%, compared with a 21% decline in cases of MTB. Both isolation of NTM and clinically significant cases were more common in men. Only 17.1% of NTM isolates were associated with disease, most commonly M.avium complex and M.kansasii.
Las micobacterias no tuberculosas (MNT) han cobrado protagonismo en los últimos años, y en la actualidad representan entre el 30 y el 50% del total de micobacterias aisladas en los laboratorios de microbiología1, lo que podría asociarse a un aumento de la incidencia de enfermedad por MNT. No están del todo claros los motivos que justifican dicho incremento ya que, aunque la introducción de los medios de cultivo líquidos automatizados en los laboratorios de micobacterias podría considerarse que ha jugado un papel decisivo en la mejora del rendimiento diagnóstico2-4, su implantación ya se había producido al principio de los años noventa y, sin embargo, a lo largo de una década de uso sistemático no se habían registrado incrementos tan llamativos de aislamientos de MNT como los que empiezan a notificarse5-15. En general, los datos acerca de la incidencia y prevalencia de MNT son escasos2, probablemente, por estar condicionados por las posibilidades de aislamiento de cada laboratorio en relación con los medios diagnósticos disponibles.
Actualmente hay descritas más de 170 especies de micobacterias (http://www.bacterio.cict.fr/m/mycobacterium.html).
Las especies aisladas más frecuentemente son Mycobacterium avium complex (MAC), M.gordonae, M.kansasii, M.marinum, M.xenopi, M.fortuitum, M.chelonae y M.abscessus.
A menudo la mayoría de los aislamientos no suelen tener significación clínica, sin embargo un estudio reciente realizado en Estados Unidos demostró que el número de muertes por enfermedad debido a MNT se estaba incrementando5. Es importante valorar el significado de los aislamientos analizando el contexto clínico en el que tiene lugar cada uno de ellos de acuerdo a las recomendaciones de las sociedades científicas reconocidas internacionalmente: American Thoracic Society (ATS), British Thoracic Society (BTS) y Sociedad Española de Neumología y Cirugía Torácica (SEPAR)16-18.
Entre los factores de riesgo relacionados con las micobacteriosis suelen citarse algunas enfermedades: enfermedad pulmonar obstructiva crónica (EPOC), neumoconiosis, bronquiectasias, tuberculosis previa, fibrosis posradioterapia, aspiración pulmonar crónica (enfermedad esofágica), fibrosis quística, alteraciones del sistema inmune, infección por VIH, alcoholismo, presencia de neoplasias (pulmonares o extrapulmonares) o diabetes mellitus. Sin embargo, hay que destacar que en un elevado porcentaje de pacientes no se identifican factores de riesgo2,5,16.
El objetivo del presente estudio era conocer el número y la variedad de aislamientos de especies de MNT en nuestra región, así como su distribución en relación con el origen del aislamiento y con la edad y el sexo de los pacientes. Asimismo, se analizaron de manera pormenorizada los aislamientos considerados clínicamente significativos.
MetodologíaEstudio prospectivo en el que se incluyeron todas las micobacterias aisladas en Asturias (España) durante el período 2005-2012. Los aislamientos procedían de los 8 hospitales públicos de la región (población media de 1.079.626 habitantes) que remiten de manera sistemática a la Unidad de Referencia Regional de Micobacterias las cepas aisladas para realizar pruebas de identificación y/o sensibilidad.
En el procesamiento inicial de las muestras clínicas se utilizaron los protocolos habituales siguiendo directrices internacionalmente aceptadas (American Society for Microbiology [ASM])19.
Para la fase de pretratamiento de descontaminación-digestión se empleó el preparado comercial BBL MycoPrep® (Specimen Digestion/Descontamination KIT, Becton-Dickinson).
Para el cultivo de micobacterias se emplearon simultáneamente medios de cultivo sólidos (Löwenstein-Jensen) y líquidos de lectura automatizada (Sistema BACTEC™ MGIT™ 960 [Mycobacterial Growth Indicator Tube] y/o Bact/ALERT® MP), de acuerdo a la metodología propia de cada hospital.
La identificación a nivel de especie se llevó a cabo mediante técnicas comerciales que combinan PCR e hibridación reversa (INNO-LiPA® Mycobacteria V2 y GENOTYPE® Mycobacterium CM/AS) y técnicas caseras (PRA20 16S-23S rRNA21) que combinan PCR-RFLP. No se necesitó recurrir a la secuenciación en ninguno de los casos clínicamente significativos.
Para definir un caso como clínicamente significativo se utilizaron los criterios recogidos en la guía 2007 ATS/IDSA16. Con respecto al tratamiento estadístico de los datos, para comprobar la independencia de las variables dicotómicas empleadas se utilizaron tablas de contingencia 2×2 aplicando el test exacto de Fisher. Se consideró una p<0,05 como estadísticamente significativa.
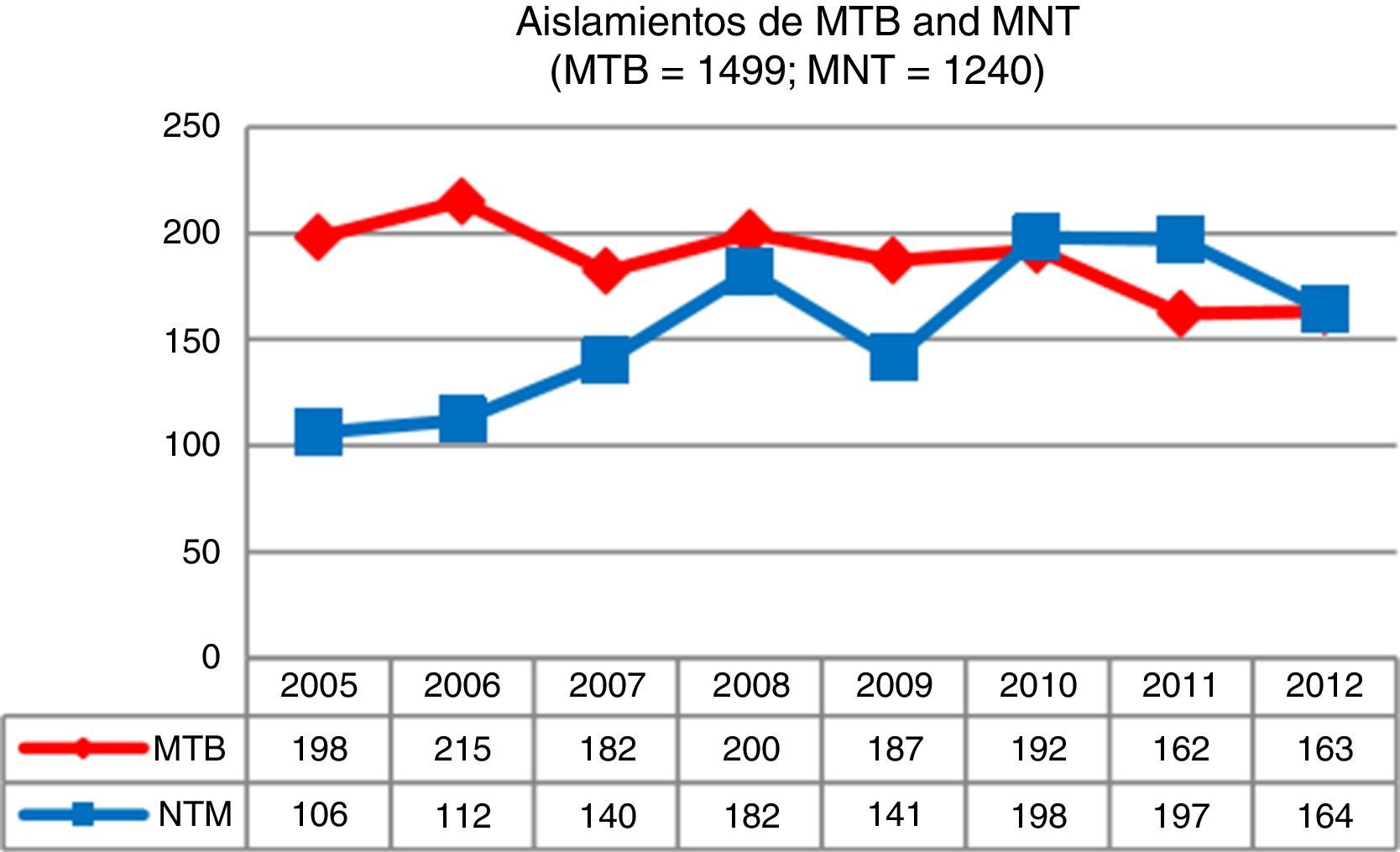
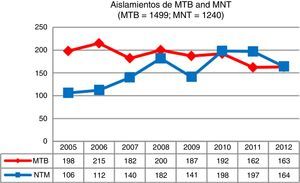
ResultadosDurante el período de estudio se identificaron 3.284 micobacterias aisladas a partir de 37.041 muestras clínicas; 1.499 correspondían a M.tuberculosis complex (MTB) (45,7%) y 1.785 a MNT (54,3%). En la figura 1 se presenta la evolución del número de aislamientos por persona de ambos grupos de micobacterias a lo largo de los 8 años analizados, apreciándose una tendencia creciente en el caso de MNT y decreciente para MTB.
Los 1.785 aislamientos de MNT se correspondían con muestras de 1.240 pacientes; 898 eran hombres (72,4%) y 342 mujeres (27,6%). La edad media de los pacientes fue de 65años (66,6 hombres y 63,6 mujeres).
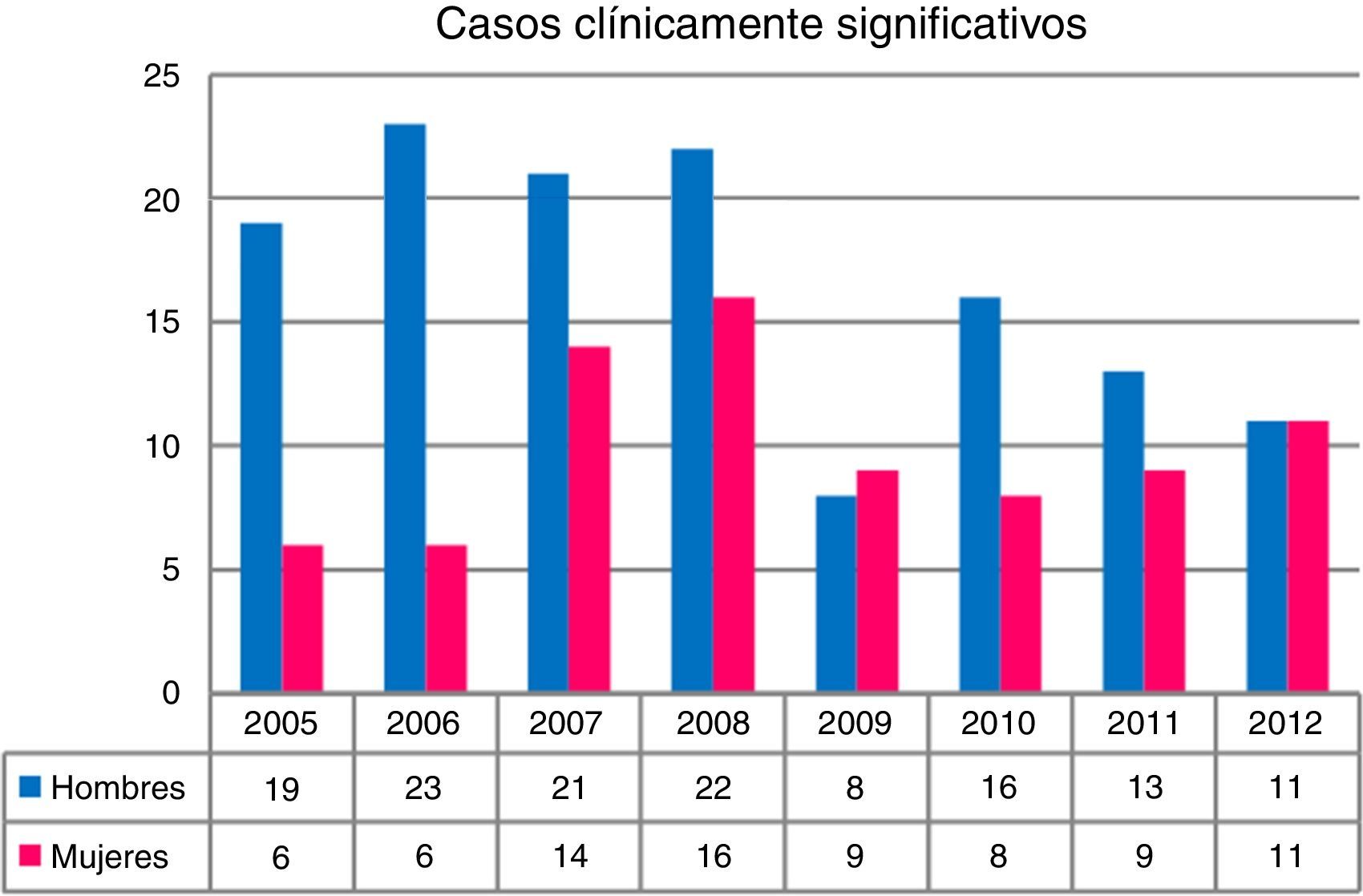
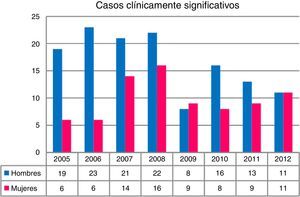
En conjunto, los aislamientos fueron más numerosos en hombres que en mujeres (p<0,001). En los 4 primeros años de estudio (2005-2008) se produjeron el 43,5% de los aislamientos y se registraron las mayores diferencias con relación al sexo de los pacientes, mientras que en los 4 siguientes (2009-2012) las diferencias se redujeron, llegando a igualarse en el último año (fig. 2). En 212 pacientes (17,1% del total de pacientes con aislamientos de MNT) el hallazgo fue considerado clínicamente significativo, mientras que en el resto fue considerado como una colonización.
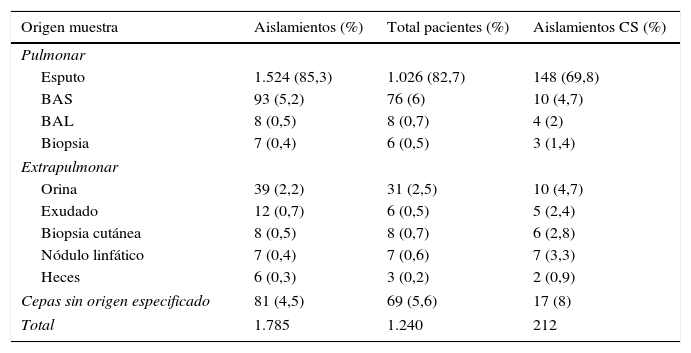
Las MNT aisladas procedían en su mayoría del tracto respiratorio (91,4%), un 4% de diferentes localizaciones extrapulmonares y un 4,6% correspondían a cepas remitidas a nuestro laboratorio sin especificar el origen de la muestra clínica (tabla 1).
Aislamientos de MNT según el origen de la muestra
| Origen muestra | Aislamientos (%) | Total pacientes (%) | Aislamientos CS (%) |
|---|---|---|---|
| Pulmonar | |||
| Esputo | 1.524 (85,3) | 1.026 (82,7) | 148 (69,8) |
| BAS | 93 (5,2) | 76 (6) | 10 (4,7) |
| BAL | 8 (0,5) | 8 (0,7) | 4 (2) |
| Biopsia | 7 (0,4) | 6 (0,5) | 3 (1,4) |
| Extrapulmonar | |||
| Orina | 39 (2,2) | 31 (2,5) | 10 (4,7) |
| Exudado | 12 (0,7) | 6 (0,5) | 5 (2,4) |
| Biopsia cutánea | 8 (0,5) | 8 (0,7) | 6 (2,8) |
| Nódulo linfático | 7 (0,4) | 7 (0,6) | 7 (3,3) |
| Heces | 6 (0,3) | 3 (0,2) | 2 (0,9) |
| Cepas sin origen especificado | 81 (4,5) | 69 (5,6) | 17 (8) |
| Total | 1.785 | 1.240 | 212 |
BAL: lavado broncoalveolar; BAS: aspirado bronquial; CS: clínicamente significativos.
Dentro de las muestras de origen respiratorio, el esputo fue la más frecuente, seguido de aspirado bronquial (BAS), lavado broncoalveolar (BAL) y biopsia pulmonar (tabla 1). En cuanto a la significación clínica de los aislamientos de MNT en muestras respiratorias, fue mayor en biopsia pulmonar (42,8%) y BAL (50%). El porcentaje más bajo se registró en esputo (9,5%).
En muestras extrapulmonares la mayor parte de los aislamientos se obtuvieron de orina, seguidas de exudado/absceso, biopsia cutánea, biopsia ganglionar y heces. La significación clínica de los aislamientos de MNT en muestras extrarrespiratorias fue del 100% en biopsias ganglionares, del 75% en biopsias de piel, del 41,6% en exudados/abscesos, del 33,3% en heces y del 25,6% en orina.
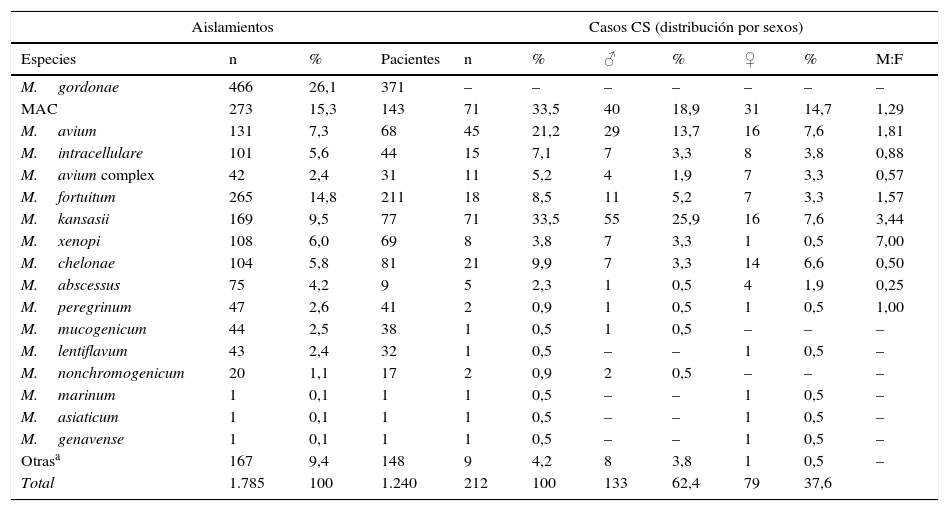
Las especies aisladas con mayor frecuencia fueron M.gordonae (26,1%), MAC (15,4%), M.fortuitum (14,8%), M.kansasii (9,5%), M.xenopi (6,1%), M.chelonae (5,8%) y M.abscessus (4,2%). En conjunto suponían el 81,8% del total de los aislamientos. En la tabla 2 se muestran las frecuencias de los aislamientos de las diferentes especies de MNT por paciente, y su distribución por sexo, en los casos considerados clínicamente significativos. M.gordonae fue la especie aislada con mayor frecuencia en nuestro medio, pero en ningún caso originó enfermedad. M.kansasii y M.avium fueron las dos especies de MNT que causaron enfermedad con mayor frecuencia (33,5 y 21,2% de los casos, respectivamente). Se encontraron diferencias en cuanto a las especies aisladas en hombres y en mujeres. En el caso de hombres, M.kansasii (25,7%), M.avium (13,6%), M.fortuitum (5,1%), M.xenopi (3,3%) y M.chelonae (3,3%) fueron las más frecuentes. En mujeres lo fueron M.avium (7,5%), M.kansasii (7,5%), M.chelonae (6,5%), M.fortuitum (3,3%) y M.abscessus (1,9%). La diferencia en número de aislamientos entre mujeres y hombres referidos a M.kansasii fue estadísticamente significativa (p<0,01).
Especies identificadas por aislamiento, referidas a pacientes y distribución por sexos en los casos clínicamente significativos
| Aislamientos | Casos CS (distribución por sexos) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Especies | n | % | Pacientes | n | % | ♂ | % | ♀ | % | M:F |
| M.gordonae | 466 | 26,1 | 371 | – | – | – | – | – | – | – |
| MAC | 273 | 15,3 | 143 | 71 | 33,5 | 40 | 18,9 | 31 | 14,7 | 1,29 |
| M.avium | 131 | 7,3 | 68 | 45 | 21,2 | 29 | 13,7 | 16 | 7,6 | 1,81 |
| M.intracellulare | 101 | 5,6 | 44 | 15 | 7,1 | 7 | 3,3 | 8 | 3,8 | 0,88 |
| M.avium complex | 42 | 2,4 | 31 | 11 | 5,2 | 4 | 1,9 | 7 | 3,3 | 0,57 |
| M.fortuitum | 265 | 14,8 | 211 | 18 | 8,5 | 11 | 5,2 | 7 | 3,3 | 1,57 |
| M.kansasii | 169 | 9,5 | 77 | 71 | 33,5 | 55 | 25,9 | 16 | 7,6 | 3,44 |
| M.xenopi | 108 | 6,0 | 69 | 8 | 3,8 | 7 | 3,3 | 1 | 0,5 | 7,00 |
| M.chelonae | 104 | 5,8 | 81 | 21 | 9,9 | 7 | 3,3 | 14 | 6,6 | 0,50 |
| M.abscessus | 75 | 4,2 | 9 | 5 | 2,3 | 1 | 0,5 | 4 | 1,9 | 0,25 |
| M.peregrinum | 47 | 2,6 | 41 | 2 | 0,9 | 1 | 0,5 | 1 | 0,5 | 1,00 |
| M.mucogenicum | 44 | 2,5 | 38 | 1 | 0,5 | 1 | 0,5 | – | – | – |
| M.lentiflavum | 43 | 2,4 | 32 | 1 | 0,5 | – | – | 1 | 0,5 | – |
| M.nonchromogenicum | 20 | 1,1 | 17 | 2 | 0,9 | 2 | 0,5 | – | – | – |
| M.marinum | 1 | 0,1 | 1 | 1 | 0,5 | – | – | 1 | 0,5 | – |
| M.asiaticum | 1 | 0,1 | 1 | 1 | 0,5 | – | – | 1 | 0,5 | – |
| M.genavense | 1 | 0,1 | 1 | 1 | 0,5 | – | – | 1 | 0,5 | – |
| Otrasa | 167 | 9,4 | 148 | 9 | 4,2 | 8 | 3,8 | 1 | 0,5 | – |
| Total | 1.785 | 100 | 1.240 | 212 | 100 | 133 | 62,4 | 79 | 37,6 | |
CS: clínicamente significativos.
En «Otras» incluimos las especies que no se pudieron identificar a nivel de especie (61), aislamientos con dos especies simultáneamente (31) y aquellas especies identificadas con muy baja frecuencia (75), que en ningún caso se consideraron patógenas: M.smegmatis (9), M.simiae (7), M.terrae (7), M.celatum (7), M.goodii (6), M.chitae (5), M.malmoense (4), M.neoaurum (3), M.scrofulaceum (3), M.triviale (3), M.szulgai (3), M.interjectum (3), M.confluentis (2), M.flavescens (2), M.phlei (2), M.thermoresistibile (2), M.immunogenum (1), M.gadium (1), M.gilvum (1), M.heckeshornense (1), M.parafortuitum (1), M.parascrofuleaceum (1) y M.pulveris (1).
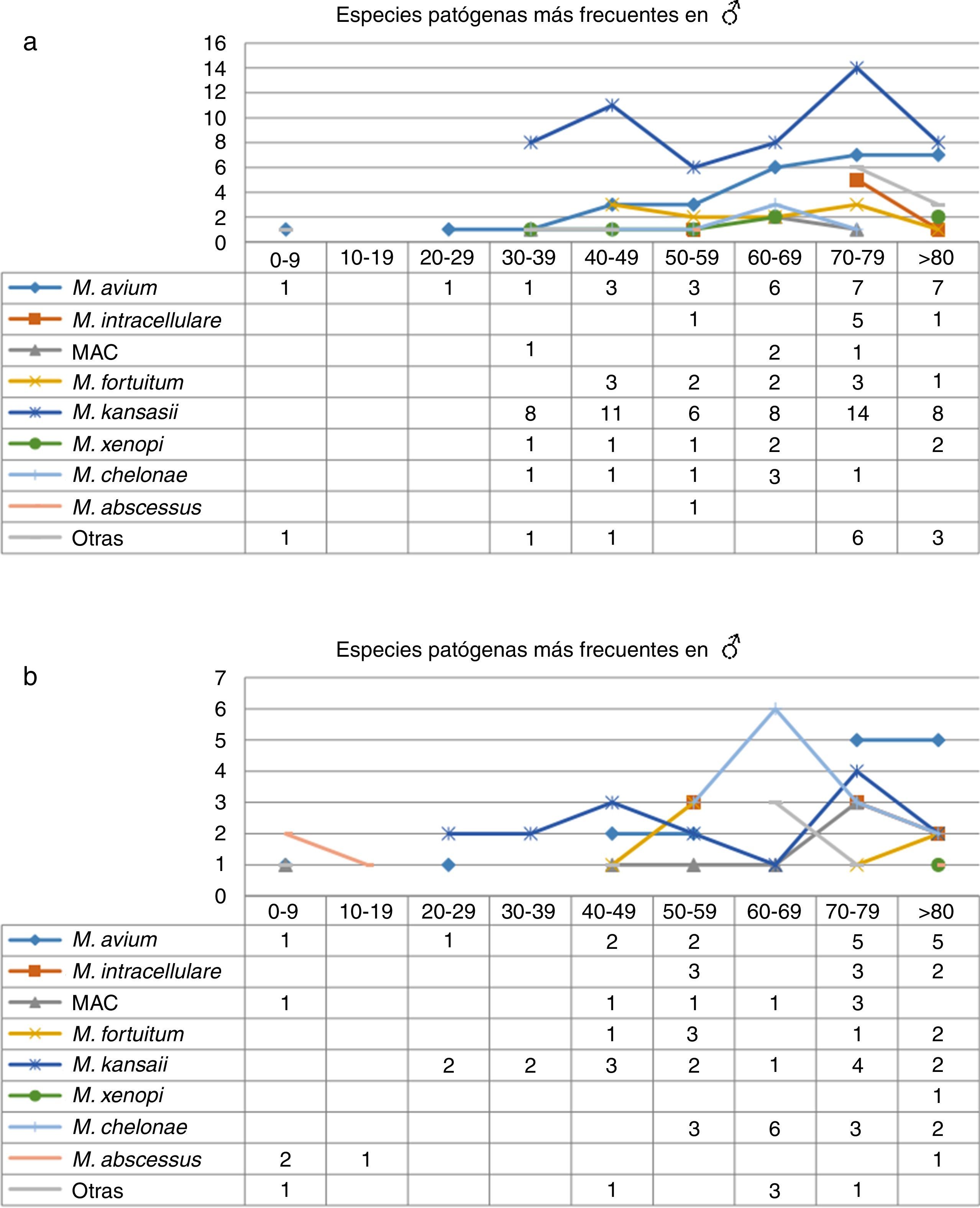
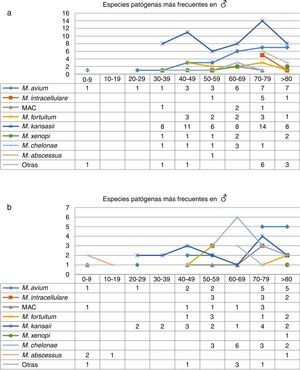
Analizando los datos por sexos e intervalos de edad (fig. 3), el mayor número de aislamientos de MNT se registró en pacientes mayores de 70años, mayoritariamente hombres, mientras que en edades tempranas eran más frecuentes en mujeres, como ocurre en el caso de los menores de 30años (p=0,01). Con respecto a la correlación entre las especies aisladas y los intervalos de edad, observamos que M.kansasii, M.avium, MAC y M.abscessus se aislaron en mujeres a edades tempranas, mientras que en los hombres en ese rango de edades solo se aisló M.avium. En cuanto a M.intracellulare, los primeros aislamientos en mujeres se produjeron por encima de los 50años, alcanzando sus valores máximos en mayores de 70años. En los hombres, el mayor número de aislamientos de M.intracellulare y MAC se produjeron en mayores de 60años. Con respecto a M.xenopi, salvo en un caso, todos los aislamientos procedían de hombres. Por el contrario, M.chelonae duplicaba en las mujeres el número de aislamientos obtenidos en hombres.
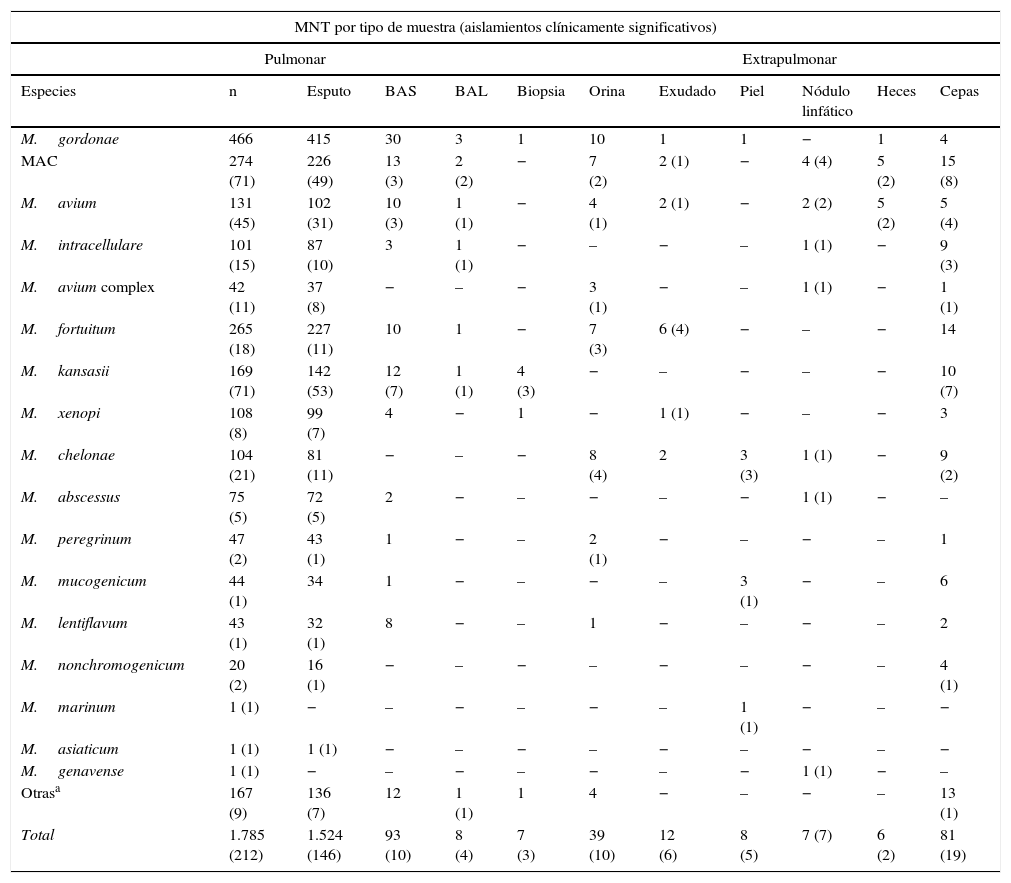
En lo que se refiere al origen de la muestra (tabla 3), prácticamente todas las MNT se aislaron a partir de muestras pulmonares (91,42%), mayoritariamente en esputos, excepto M.marinum y M.genavense aisladas en biopsia de piel y ganglio, respectivamente. En pacientes menores de 20años las localizaciones fueron mayoritariamente extrapulmonares.
Especies de MNT identificadas distribuidas por tipo de muestra
| MNT por tipo de muestra (aislamientos clínicamente significativos) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Pulmonar | Extrapulmonar | ||||||||||
| Especies | n | Esputo | BAS | BAL | Biopsia | Orina | Exudado | Piel | Nódulo linfático | Heces | Cepas |
| M.gordonae | 466 | 415 | 30 | 3 | 1 | 10 | 1 | 1 | − | 1 | 4 |
| MAC | 274 (71) | 226 (49) | 13 (3) | 2 (2) | − | 7 (2) | 2 (1) | − | 4 (4) | 5 (2) | 15 (8) |
| M.avium | 131 (45) | 102 (31) | 10 (3) | 1 (1) | − | 4 (1) | 2 (1) | − | 2 (2) | 5 (2) | 5 (4) |
| M.intracellulare | 101 (15) | 87 (10) | 3 | 1 (1) | − | – | − | – | 1 (1) | − | 9 (3) |
| M.avium complex | 42 (11) | 37 (8) | − | – | − | 3 (1) | − | – | 1 (1) | − | 1 (1) |
| M.fortuitum | 265 (18) | 227 (11) | 10 | 1 | − | 7 (3) | 6 (4) | − | – | − | 14 |
| M.kansasii | 169 (71) | 142 (53) | 12 (7) | 1 (1) | 4 (3) | − | – | − | – | − | 10 (7) |
| M.xenopi | 108 (8) | 99 (7) | 4 | − | 1 | − | 1 (1) | − | – | − | 3 |
| M.chelonae | 104 (21) | 81 (11) | − | – | − | 8 (4) | 2 | 3 (3) | 1 (1) | − | 9 (2) |
| M.abscessus | 75 (5) | 72 (5) | 2 | − | – | − | – | − | 1 (1) | − | – |
| M.peregrinum | 47 (2) | 43 (1) | 1 | − | – | 2 (1) | − | – | − | – | 1 |
| M.mucogenicum | 44 (1) | 34 | 1 | − | – | − | – | 3 (1) | − | – | 6 |
| M.lentiflavum | 43 (1) | 32 (1) | 8 | − | – | 1 | − | – | − | – | 2 |
| M.nonchromogenicum | 20 (2) | 16 (1) | − | – | − | – | − | – | − | – | 4 (1) |
| M.marinum | 1 (1) | − | – | − | – | − | – | 1 (1) | − | – | − |
| M.asiaticum | 1 (1) | 1 (1) | − | – | − | – | − | – | − | – | − |
| M.genavense | 1 (1) | − | – | − | – | − | – | − | 1 (1) | − | – |
| Otrasa | 167 (9) | 136 (7) | 12 | 1 (1) | 1 | 4 | − | – | − | – | 13 (1) |
| Total | 1.785 (212) | 1.524 (146) | 93 (10) | 8 (4) | 7 (3) | 39 (10) | 12 (6) | 8 (5) | 7 (7) | 6 (2) | 81 (19) |
BAL: lavado broncoalveolar; BAS: aspirado bronquial.
En «Otras» incluimos las especies que no se pudieron identificar a nivel de especie (61), aislamientos con dos especies simultáneamente (31) y aquellas especies identificadas con muy baja frecuencia (75), que en ningún caso se consideraron patógenas: M.smegmatis (9), M.simiae (7), M.terrae (7), M.celatum (7), M.goodii (6), M.chitae (5), M.malmoense (4), M.neoaurum (3), M.scrofulaceum (3), M.triviale (3), M.szulgai (3), M.interjectum (3), M.confluentis (2), M.flavescens (2), M.phlei (2), M.thermoresistibile (2), M. immunogenum (1), M.gadium (1), M.gilvum (1), M.heckeshornense (1), M.parafortuitum (1), M.parascrofuleaceum (1) y M.pulveris (1).
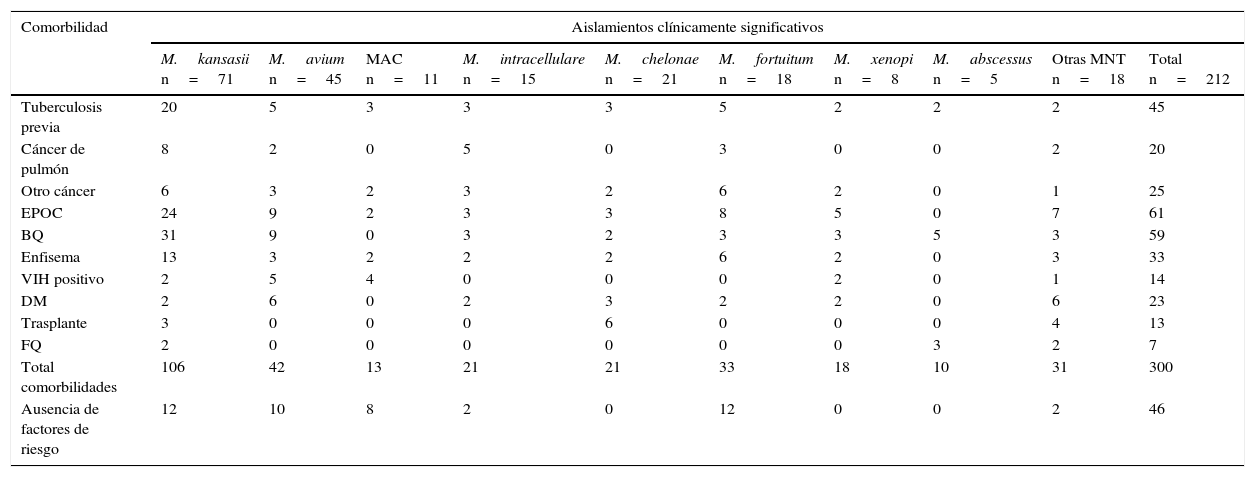
Los factores de riesgo/comorbilidad identificados en los 212 pacientes con aislamientos de MNT clínicamente significativos se muestran en la tabla 4 distribuidos por especies de MNT. Es destacable que 166 pacientes (78,3%) presentaban comorbilidad, a menudo con 2 o más factores de riesgo. Salvo en el caso de M.abscessus, con asociación frecuente a fibrosis quística/bronquiectasias, en el resto de especies no se encontró una asociación entre una patología de base concreta y el tipo de MNT identificada.
Comorbilidad evidenciada en los 212 pacientes con aislamientos de MNT clínicamente significativos
| Comorbilidad | Aislamientos clínicamente significativos | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| M.kansasii n=71 | M.avium n=45 | MAC n=11 | M.intracellulare n=15 | M.chelonae n=21 | M.fortuitum n=18 | M.xenopi n=8 | M.abscessus n=5 | Otras MNT n=18 | Total n=212 | |
| Tuberculosis previa | 20 | 5 | 3 | 3 | 3 | 5 | 2 | 2 | 2 | 45 |
| Cáncer de pulmón | 8 | 2 | 0 | 5 | 0 | 3 | 0 | 0 | 2 | 20 |
| Otro cáncer | 6 | 3 | 2 | 3 | 2 | 6 | 2 | 0 | 1 | 25 |
| EPOC | 24 | 9 | 2 | 3 | 3 | 8 | 5 | 0 | 7 | 61 |
| BQ | 31 | 9 | 0 | 3 | 2 | 3 | 3 | 5 | 3 | 59 |
| Enfisema | 13 | 3 | 2 | 2 | 2 | 6 | 2 | 0 | 3 | 33 |
| VIH positivo | 2 | 5 | 4 | 0 | 0 | 0 | 2 | 0 | 1 | 14 |
| DM | 2 | 6 | 0 | 2 | 3 | 2 | 2 | 0 | 6 | 23 |
| Trasplante | 3 | 0 | 0 | 0 | 6 | 0 | 0 | 0 | 4 | 13 |
| FQ | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 2 | 7 |
| Total comorbilidades | 106 | 42 | 13 | 21 | 21 | 33 | 18 | 10 | 31 | 300 |
| Ausencia de factores de riesgo | 12 | 10 | 8 | 2 | 0 | 12 | 0 | 0 | 2 | 46 |
BQ: bronquiectasias; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; FQ: fibrosis quística; VIH: virus de la inmunodeficiencia humana.
Con respecto al tratamiento instaurado (tabla 5), en la mayoría de los casos se siguieron las recomendaciones que aparecen en las guías clínicas habituales. La duración media de los tratamientos fue de 12 meses (rango 6-36meses). Un 3% de los pacientes no llegó a recibir tratamiento.
Pautas de tratamiento administradas a los pacientes con micobacteriosis
| MNTa | Tratamiento | Duración |
|---|---|---|
| M.kansasii | R+H+EMB (+CL+LZ) | ≥ 12 meses |
| M.avium | R+CL+EMB (+H) | 6-12 meses |
| MAC | R+EMB(+CL+H) | ≥ 12 meses |
| M.intracellulare | R+CL+bem (+RB+AZ+H) | 12-36 meses |
| M.chelonae | CL+LF+DX (+R+H) | 6 meses |
| M.fortuitum | R+H (+EMB+CL+LF+CP) | 6-24 meses |
| M.xenopi | R+H (+CL/EMB) | 6-24 meses |
| M.abscessus | CL+AK (+CP+CF) | ≥ 12 meses |
| M.marinum | R+CL+EMB | 6 meses |
| M.genavense | R+CL+EMB | 6 meses |
AK: amikacina; AZ: azitromicina; CF: cefoxitina; CL: claritromicina; CP: ciprofloxacino; DX: doxiciclina; EMB: etambutol; H: isoniazida; LF: levofloxacino; R: rifampicina; RB: rifabutina.
MNT con aislamientos clínicamente significativos no incluidos en la tabla (16 casos); 6 no recibieron tratamiento, y en los 10 restantes: M.asiaticum (1), M.lentiflavum (1), M.mucogenicum (1), M.peregrinum (2), M.immunogenum (1), M.malmoense (1), M.szulgai (2), M.interjectum (1), aunque la pauta dependió de la especie, la combinación más frecuente fue quinolona+macrólido con/sin etambutol y/o rifampicina.
En lo referente a la evolución clínica, destacar que 50 pacientes (23,6%) fallecieron (43hombres y 7mujeres; media de edad, 73años), principalmente por causas relacionadas con su patología de base. Asimismo es reseñable que un 5,1% de los pacientes, a pesar del tratamiento antimicobacteriano, presentaron persistencia en los aislamientos de MNT.
DiscusiónEn Asturias, a lo largo de los 8años incluidos en nuestro estudio hemos constatado un incremento de los aislamientos de MNT del 35%, frente a un descenso del 21%, durante el mismo período, de los casos de MTB. En otros estudios recientes7,9,11,12 también se describen resultados similares.
Esta misma tendencia ha sido observada en la mayoría de los países industrializados, siendo las tasas de incidencia muy variables dependiendo del país considerado: 4,8-5,6 casos por 100.000 habitantes entre 2007 y 2012, respectivamente, en Oregón6; 2,06 a 2,71 casos por cada 100.000 habitantes en Escocia, entre los años 2000 y 20107; en Inglaterra, Gales y Norte de Irlanda pasaron de 0,9 a 2,9 aislamientos por cada 100.000 habitantes de 1995 a 20069, y en Queensland (Australia) aumentaron de 2,2 (1999) a 3,2 (2005) casos por cada 100.000 habitantes10.
En Asturias el incremento se ha producido de manera progresiva, pasando de un total de 106 aislamientos al inicio de nuestro estudio hasta los 164 en el último año. Con respecto a las tasas de aislamiento, en 2005 se registraron 9,82 aislamientos por cada 100.000 habitantes, cifra que en 2012 fue de 15,19. Los casos clínicamente significativos registraron una ligera disminución, pasando de 2,31 casos por 100.000 en 2005 a 2,03 en 2012, con un valor máximo de 3,52 en 2008. La tasa media de aislamiento en los 8años de estudio fue de 2,46 episodios registrados por cada 100.000 habitantes, muy similar a la obtenida en Escocia dentro del mismo período7 y en Nueva York8, pero un poco por debajo a la registrada en Oregón6.
En lo referente a la distribución por sexos de los aislamientos de MNT, se observó que los aislamientos en hombres triplicaban a los de las mujeres. Las diferencias eran más evidentes los primeros años del estudio, pero con tendencia a igualarse a lo largo del tiempo, hecho también observado por otros autores7,10,12. En los casos con significación clínica ocurría lo mismo. Sin embargo, también se han publicado series en las que predominan los aislamientos en mujeres13.
En relación a la edad, la mayor proporción de aislamientos (aproximadamente el 80%) procedía de muestras clínicas de personas mayores de 50años, siendo en los mayores de 70años donde se concentraba el mayor número de especies aisladas, dato similar a los de otros estudios recientes7,9,13-15.
La especie de MNT más frecuentemente aislada fue M.gordonae, que es la segunda micobacteria más frecuentemente aislada a nivel mundial11, pero en ninguno de los casos fue considerada patógena. El complejo MAC, que a su vez es la MNT más frecuente a nivel mundial, en nuestra serie ocupaba el segundo lugar (15,29%). En otro estudio realizado en España durante el período 1976-199622 también se obtuvieron porcentajes elevados de MAC en prácticamente todas las regiones excepto en Canarias, aunque el impacto de la enfermedad por el VIH en esa época debe ser tenido en cuenta. M.fortuitum y M.kansasii ocuparon el tercer y cuarto lugar, respectivamente, en Asturias, mientras que a nivel mundial ocupan el cuarto y el sexto lugar. En el continente europeo, Eslovaquia, Polonia y Reino Unido11 registran las tasas más altas de aislamientos de M.kansasii. Con respecto a la distribución geográfica, en el caso de España22M.kansasii se ha descrito principalmente en las regiones meridionales, especialmente en la Comunidad Valenciana, y también en regiones septentrionales, como el País Vasco, donde un estudio llevado a cabo en Bilbao en 200523 evidenció altas tasas de aislamiento de esta especie, mientras que en las provincias limítrofes los aislamientos eran prácticamente inexistentes.
En cuanto a la correlación aislamiento/patogenicidad encontrada en nuestra serie, MAC y M.kansasii fueron las especies que más a menudo ocasionaron enfermedad, representando entre ambas el 67% del total de casos (142 pacientes). M.kansasii predominaba en hombres, siendo la diferencia estadísticamente significativa (p<0,01). Los casos por M.xenopi y M.abscessus fueron similares a los de otros estudios7,12. M.marinum, M.asiaticum y M.genavense representaron ejemplos de aislamiento único y hallazgo considerado clínicamente significativo.
En 166 pacientes (78,3%) se identificó comorbilidad, más habitual en los casos por M.xenopi y M.abscessus; por el contrario, en 46 pacientes (21,7%) no se identificaron factores de riesgo, dato similar al publicado en Nueva York8, siendo M.kansasii la MNT más frecuentemente aislada en casos sin comorbilidad24. En pacientes trasplantados, M.chelonae y M.kansasii fueron las MNT más habituales, a diferencia de otros estudios5, donde eran más frecuentes MAC y M.abscessus.
Con respecto al tratamiento, el 97% de los pacientes recibieron una combinación de 3fármacos, y la duración media de los tratamientos fue de 12meses. Un 5,1% de los pacientes, a pesar del tratamiento instaurado, presentaron persistencia en los aislamientos de MNT. Al tratarse de un estudio que aglutina pacientes diagnosticados en 8 hospitales diferentes, las pautas a menudo no fueron uniformes, especialmente en lo relativo a la duración del tratamiento y a la inclusión —o no— de determinados fármacos recomendados en la literatura25.
En conclusión, podemos confirmar que en nuestra región también se ha producido un notable aumento en el número de aislamientos de MNT, siendo estos más frecuentes en hombres que en mujeres, al igual que el número de casos con significación clínica. Solo un 17,1% de las MNT aisladas ocasionaron enfermedad, siendo MAC y M.kansasii las MNT más frecuentemente aisladas en estos casos.
Finalmente, cabe reseñar que, paradójicamente, a pesar del incremento del número de aislamientos de MNT registrado en nuestra región, el número de casos en los que el aislamiento se consideró clínicamente significativo no solo no se incrementó, sino que disminuyó en los últimos años de nuestro estudio, debido principalmente al aumento de aislamientos de MNT con bajo potencial patógeno.
AutoríaJuan José Palacios Gutiérrez, responsable de la Unidad de Referencia Regional de Micobacterias del HUCA, se encargó de la dirección del estudio, revisión y corrección final del manuscrito.
Susana Martínez González realizó la recogida de datos, su posterior análisis e interpretación y la elaboración del manuscrito.
Arantxa Cano Cortés y Luis Alfonso Sota Yoldi participaron en la recopilación de datos clínicos y en la revisión crítica del artículo.
José María García García realizó el asesoramiento del estudio y la revisión crítica del artículo.
Luz María Alba Álvarez se encargó de la revisión bibliográfica.
Red de laboratorios de Microbiología del SESPA: aislamiento y envío de cepas a la Unidad de Referencia Regional de Micobacterias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Ángela Menéndez González, Ángeles Díaz Escalada, Macarena Álvarez Fernández, M.J. Rodríguez y Zulima Velasco por su ayuda y apoyo en todo momento en la realización de la parte técnica de este trabajo, sin la cual no habría sido posible llevarlo a cabo.
La Red de Laboratorios de Microbiología del SESPA incluye los Servicios de Microbiología de: Hospital de Jarrio, Hospital Carmen y Severo Ochoa, Hospital San Agustín, Hospital de Cabueñes, Hospital de Jove, Hospital Grande Covián, Hospital Álvarez-Buylla, Hospital Valle del Nalón y Hospital Universitario Central de Asturias (HUCA).