Introducción
La fibrosis quística (FQ) es una enfermedad genética, autosómica recesiva, cuya incidencia, en estudios de detección temprana neonatal, es variable en los diferentes países y razas1. En los últimos 50 años la supervivencia de los pacientes con FQ se ha visto incrementada por los avances en el tratamiento de la infección pulmonar crónica y por el seguimiento en unidades monográficas multidisciplinarias. El defecto en el sistema respiratorio de una proteína de membrana (CFTR, reguladora de la conductancia transmembrana de la FQ) ocasiona la acumulación de secreciones espesas en las vías respiratorias, lo que permite la invasión bacteriana, a través del epitelio dañado, por bacterias como Staphylococcus aureus, Haemophilus influenzae o Pseudomonas aeruginosa, que, a su vez, estimulan una respuesta inflamatoria mediada básicamente por neutrófilos, que incrementa aún más la lesión tisular2.
Como consecuencia de los múltiples ciclos antibióticos que reciben estos pacientes para tratar las infecciones de repetición, especialmente en los adultos, se comienzan a aislar microorganismos multirresistentes. Entre ellos se identifican cada vez con mayor frecuencia, aunque con importancia patógena aún por determinar, Achromobacter xylosoxidans, Stenotrophomonas maltophilia y micobacterias ambientales (MA)3,4.
Las MA son organismos ampliamente distribuidos en la naturaleza, fundamentalmente en el agua y en la tierra, que funcionan como reservorios. Diversos estudios indican que la transmisión persona-persona es rara; el mecanismo de adquisición más aceptado es el de la aerosolización5. En general, se está observando un incremento de la incidencia de infecciones por este tipo de micobacterias, que tienden a englobarse, en los últimos años, dentro del concepto de patógenos emergentes6,7. En los pacientes afectados de FQ se está advirtiendo un aumento de las MA, dado que concurren en ellos factores tales como una mayor supervivencia, la mejora en las técnicas diagnósticas y el reconocimiento por parte del clínico de la enfermedad por estos patógenos3,8.
El objetivo de nuestro estudio ha sido valorar el hallazgo de MA en las muestras de esputo de pacientes con FQ, así como evaluar las características de estos enfermos (síntomas clínicos, función pulmonar, radiografía de tórax, evolución y valoración de tratamiento específico) comparándolas con las de los pacientes sin aislamientos de MA.
Pacientes y métodos
Pacientes
Se realizó un estudio prospectivo desde marzo de 1997 a diciembre de 2001 en todos los pacientes procedentes de la unidad monográfica de FQ de adultos del Hospital Universitario de la Princesa, la cual está directamente coordinada con la Unidad Pediátrica del Hospital Universitario del Niño Jesús, de la que los enfermos proceden una vez cumplidos los 18 años.
Variables clínicas
Se recogieron los siguientes datos de los pacientes: edad, sexo, presencia de insuficiencia pancreática, diabetes, uso de aerosolterapia antibiótica y colonización bacteriana de la vía respiratoria. Se consideró que el enfermo presentaba insuficiencia pancreática cuando la determinación de grasa en heces de 72 h o test de van de Kamer estaba alterada (esteatorrea leve de 6-10 g de grasa/24 h, moderada de 10-20 g de grasa/24 h y grave con más de 20 g de grasa/24 h)9 y el paciente precisaba enzimas pancreáticas para la digestión de los alimentos. Se definió colonización bronquial cuando se aisló un mismo microorganismo en más de 3 muestras respiratorias consecutivas, con un intervalo mínimo de un mes entre ellas. Además, se registraron los porcentajes sobre el valor teórico estándar de los siguientes parámetros de función pulmonar: capacidad vital forzada (FVC), volumen espiratorio forzado en el primer segundo (FEV1) y FEV1/FVC en cada visita médica. Al final del estudio se realizó Mantoux-PPD (Evans RT-23, Celltech Group, Berkshire, Reino Unido), el cual se consideró positivo cuando el diámetro de la zona indurada a las 48-72 h era superior a 5 mm.
La gravedad de la enfermedad se valoró al inicio y una vez al año (fecha próxima al cumpleaños del enfermo) por la puntuación clínica de Shwachman. Esta escala evalúa 4 ítems con puntuación máxima de 25 cada uno de ellos: actividad general, exploración física, crecimiento y nutrición, y radiografía de tórax. La puntuación ideal es 100. El estado de los enfermos se clasificó, según esta puntuación, en excelente (86-100 puntos), bueno (71-85), leve (56-70), moderado (41-55) o grave (≤ 40)10.
Evaluación radiológica
Las radiografías de tórax se realizaron al inicio del estudio, una vez al año (fecha próxima al cumpleaños del enfermo), en caso de deterioro clínico y funcional respiratorio, en ausencia de mejoría clínica a pesar de antibioterapia con cobertura de bacterias colonizantes y en caso de sospecha de complicaciones respiratorias no infecciosas. Para la valoración de la radiografía de tórax se utilizó la puntuación de Brasfield, que evalúa de 0 a 5 (de menor a mayor afectación) 5 signos radiológicos: atrapamiento aéreo, sombras lineales, lesiones noduloquísticas, consolidaciones segmentarias o lobulares y la impresión general de gravedad. La puntuación global obtenida se le resta a 25. A menor valor obtenido, mayor gravedad radiológica11.
Evaluación microbiológica
Se realizaron tinción de auramina-rodamina y cultivos en medio de Coletsos (BioMérieux, Lyon, Francia) y líquido MGIT 960 (Becton-Dickinson, Sparks, EE.UU.) que contiene un caldo de Middlebrook 7H9 (BioMérieux, Lyon, Francia) modificado, además de los cultivos habituales bacterianos y de hongos, en todos los esputos recogidos en este período. Se analizó la contaminación bacteriana de las muestras. La descontaminación de las muestras respiratorias se realizó mediante la técnica de Kubica et al12, que consiste en la digestión y descontaminación de la muestra con hidróxido sódico al 2% y utilizando como agente mucolítico N-acetilcisteína; se obtiene una concentración final de sosa en la muestra del 1%, la cual es menos tóxica para las micobacterias.
Las muestras se recogían en cada visita ambulatoria del paciente, incluso durante las exacerbaciones respiratorias.
Protocolo de actuación
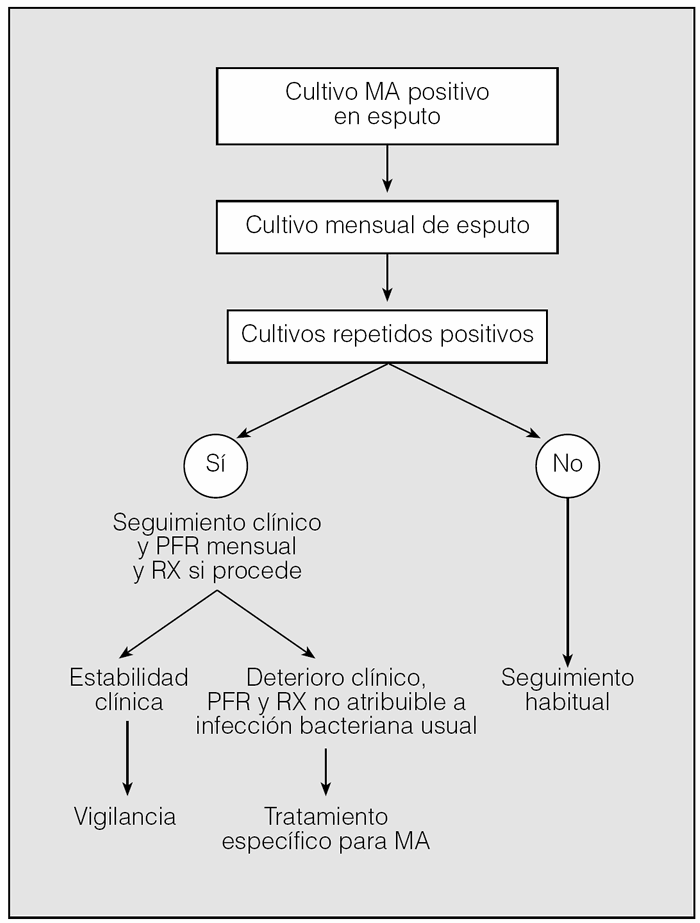
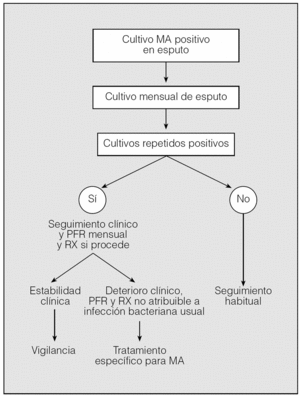
Si se detectaba una tinción o cultivo positivo para MA se realizaban recogida mensual de esputo y seguimiento estricto para valorar la existencia de deterioro clínico, funcional respiratorio o radiológico y se estimaba la necesidad de tratamiento específico para la MA detectada (fig. 1).
Fig. 1. Algoritmo de toma de decisiones ante el aislamiento de una micobacteria ambiental (MA) en la muestra respiratoria. PFR: pruebas de función pulmonar; RX: radiografía de tórax.
Si las tinciones o cultivos eran negativos, habitualmente se evaluaba a los pacientes cada 3 meses (valoración de síntomas, análisis de esputo y realización de espirometría) y en caso de exacerbación clínica.
Se definió como deterioro clínico de un enfermo la coincidencia de 3 o más de los siguientes síntomas y signos: incremento de la tos, cambios en el volumen y aspecto del esputo, aparición de disnea, presencia de hemoptisis, astenia, sudación nocturna, pérdida de peso y apetito, fiebre y cambios en la auscultación pulmonar habitual13. Se consideró que había deterioro funcional con una disminución del FEV1 superior al 10% con respecto al valor previo, y deterioro radiológico como la aparición o progresión de una consolidación alveolar, cavitación o nódulos pulmonares.
Análisis estadístico
Se describieron las variables cuantitativas mediante la media ± desviación estándar y las variables cualitativas calculando los porcentajes de las distintas categorías. Para la comparación de medias se aplicó la prueba de la t de Student. Todos los cálculos se realizaron con la ayuda del programa SPSS versión 11,5 y se consideraron estadísticamente significativos los valores de correlación de p < 0,05.
Resultados
El estudio se realizó en 28 pacientes diagnosticados de FQ, 12 mujeres y 16 varones, con una edad media de 25,3 ± 6,7 años14. El 81% de los enfermos presentaba insuficiencia pancreática y el 7,1% tenía diabetes. Los pacientes fueron controlados en la unidad durante un período que oscilaba entre 1 y 58 meses, con una media de 40,3 ± 22,1 meses. El principal microorganismo colonizante fue S. aureus (67,9%), seguido de P. aeruginosa (53,6%), H. influenzae (4,3%) y otros bacilos gramnegativos (10,7%). Uno de los pacientes tenía el antecedente de infección por MA (Mycobacterium abscessus) y había recibido tratamiento previamente con isoniazida y claritromicina durante 14 meses y, posteriormente, con claritromicina y rifampicina durante 9 meses.
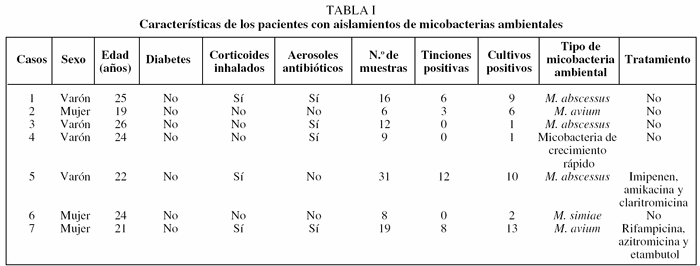
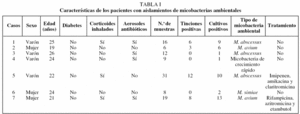
Se cultivaron para micobacterias un total de 251 muestras de esputo (rango por paciente de 1 a 31) y en 29 de ellas (4 pacientes) la tinción fue positiva para auramina. En 7 enfermos el cultivo fue positivo, aunque sólo en 4 lo fue en más de 3 muestras. En el 18,8% (47 muestras) el cultivo estaba contaminado. En ningún caso se aisló M. tuberculosis. Las cepas aisladas se identificaron como: M. abscesuss en 3 casos, M. avium complex en 2, M. simiae en uno y una micobacteria de crecimiento rápido no identificada. En 5 enfermos el Mantoux fue positivo y en 4 de los enfermos los aislamientos fueron de MA (tabla I). De los 4 pacientes que presentaron aislamientos repetidos, únicamente 2 presentaron deterioro clínico, funcional y radiológico, indicándose en ambos tratamiento específico.
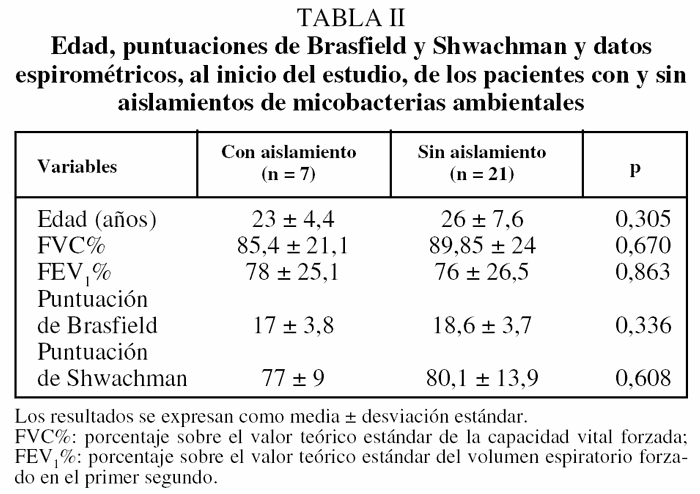
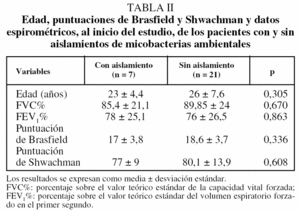
La comparación de la edad, puntuaciones clínicas y radiológicas y datos de función pulmonar, al inicio del estudio, de los enfermos con/sin aislamiento de MA se muestra en la tabla II. No se observaron diferencias en ninguno de los parámetros analizados.
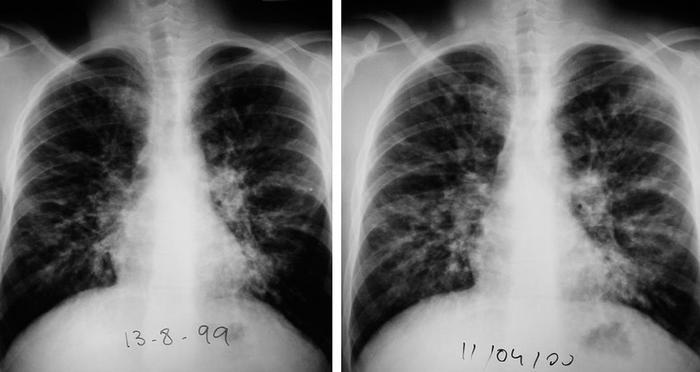
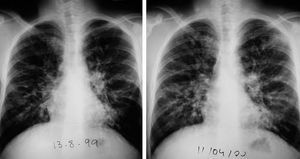
El paciente número 5, colonizado crónicamente por S. aureus, presentaba una función pulmonar en fase estable con un FEV1 de 2,30 l (57%) y una saturación de oxígeno (SaO2) del 95%. Seis meses después del primer aislamiento de M. abscessus, comenzó de forma progresiva con aumento de la tos y la expectoración, febrícula, disnea, astenia intensa e incremento de los crepitantes en la auscultación pulmonar; la SaO2 era del 91%, el FEV1 descendió hasta 1,64 l (40%) y la radiografía de tórax mostró un incremento de las imágenes nodulares en campos medios e inferiores (fig. 2). Se prescribó un ciclo de tratamiento por vía oral con amoxicilina-ácido clavulánico, sin que experimentara mejoría. Este enfermo ya había sido tratado en 2 ocasiones de infección por M. abscessus, por lo que, dada la similitud clínica con episodios anteriores, se instauró tratamiento intravenoso durante 3 semanas con imipenem y amikacina, más claritromicina por vía oral durante 36 meses. Al mes de iniciar el tratamiento el enfermo mejoró clínicamente de forma paulatina, al igual que la función pulmonar. La negativización de la tinción y los cultivos se obtuvo a los 3 y 5 meses, respectivamente.
Fig. 2. Radiografías posteroanterior de tórax de uno de los enfermos que precisó tratamiento específico contra una micobacteria ambiental. Se observa un aumento del patrón nodular en los campos medios e inferiores de ambos hemitórax (imagen de la derecha).
La paciente número 7, colonizada de forma crónica por P. aeruginosa y con aerosolterapia antibiótica continua con colimicina, presentaba una función pulmonar en fase estable con un FEV1 de 1,76 l (57%) y SaO2 del 96%. Siete meses después del primer aislamiento de M. avium complex comenzó con fiebre alta, aumento de la tos y la expectoración, cambios en las características de las secreciones, disnea, pérdida de apetito, descenso de la SaO2 al 92% y del FEV1 hasta 1,50 l (44%). Se instauró tratamiento con ceftazidima y tobramicina por vía intravenosa durante 14 días, con lo que se produjo una mejoría clínica y funcional. Dos meses más tarde se reiniciaron los síntomas y se volvió a instaurar tratamiento antibiótico frente a Pseudomonas. En esta ocasión la enferma no mejoró, el FEV1 descendió hasta 1,20 l (38%) y en la radiografía de tórax se observó una consolidación alveolar en el lóbulo superior izquierdo, por lo que se decidió prescribir tratamiento con azitromicina, rifampicina y etambutol durante 17 meses, con el cual se consiguió la mejoría clínica a las 2 semanas, y funcional y radiológica aproximadamente a los 3 meses; la negatividad de las tinciones y cultivos se logró a los 2 y 6 meses, respectivamente, del inicio del tratamiento.
Discusión
Nuestro trabajo demuestra una alta prevalencia de MA en adultos con FQ, que llega a alcanzar el 25% en los pacientes controlados en nuestra unidad. En el 42,8% de los casos en los que se aislaron MA la baciloscopia fue negativa. Un 50% de los pacientes con aislamientos repetitivos presentaron clínica relacionada con la MA y precisaron tratamiento específico, con el cual mejoraron. La MA aislada con más frecuencia fue M. abscessus. Ninguno de los pacientes con MA era diabético, el 57,1% utilizaba antibióticos en aerosol y el 42,8% corticoides inhalados de forma crónica. Cuando, al inicio del estudio, comparamos los valores de la función pulmonar y las puntuaciones de Brasfield y Shwachman entre los enfermos en los que aislamos MA y el resto, no observamos variaciones significativas.
Según los estudios publicados, las MA más comúnmente aisladas en el esputo de pacientes con FQ son M. avium complex, M. abscessus, M. kansasii y M. fortuitum15. Desde la descripción de los primeros casos en FQ por Wood et al16 en 1976, se han sucedido las publicaciones en las que cada vez con mayor frecuencia se describe la presencia de estas MA en las secreciones respiratorias, fundamentalmente en pacient es adultos, aunque con un significado clínico controvertido, sobre todo en los casos en los que el aislamiento es único17-30. En una reciente publicación que incluye a 986 enfermos con FQ de 21 centros de EE.UU. y que analiza 2.955 muestras de esputo, se describe una prevalencia de MA del 13%. Cuando se compara a los enfermos con aislamientos de MA con el resto de pacientes, se observa que los primeros presentan más edad, tienen mejor función pulmonar y mayor proporción de colonización por S. aureus que P. aeruginosa8. En nuestro trabajo no se encontraron diferencias en cuanto a la edad y la función pulmonar, y tampoco en las puntuaciones clínicas y radiológicas.
En realidad, el diagnóstico de enfermedad por MA en la FQ es difícil de establecer. Los criterios diagnósticos establecidos por la American Thoracic Society (ATS) en 1997 se basan en datos clínicos, radiológicos y microbiológicos. Estos criterios no son fácilmente aplicables a los enfermos con FQ31. Así, la clínica habitual que puede presentarse en pacientes sin FQ infectados por MA se ve solapada en el enfermo con FQ por los síntomas habituales asociados a la presencia de bronquiectasias y a la colonización persistente de la vía aérea. Quizá, como señalan Olivier et al25, la presencia de fiebre persistente o de sudoración nocturna puede poner en alerta acerca de una posible infección. Lo mismo ocurre con las imágenes radiológicas descritas habitualmente en las micobacteriosis (nódulos, consolidaciones alveolares y pequeñas cavitaciones). Todas ellas son lesiones que se observan con frecuencia en el enfermo con FQ, por lo que estos hallazgos resultan de poca ayuda para establecer el diagnóstico. Quizá resulte orientativo el hecho de que en la FQ los nódulos asociados a bronquiectasias suelen afectar a los lóbulos superiores, mientras que los debidos a MA se localizan en los campos medios e inferiores. Probablemente las tomografías computarizadas seriadas, como defiende el estudio multicéntrico estadounidense8, junto con los síntomas clínicos, puedan ayudar a establecer el diagnóstico y la necesidad de un tratamiento antimicobacteriano. En nuestro estudio los pacientes que precisaron tratamiento presentaban datos indicativos de exacerbación pulmonar de origen bacteriano, a lo que se añadía febrícula persistente en uno de ellos. El dato más orientativo para iniciar tratamiento específico contra MA fue la falta de respuesta a la antibioterapia frente a los gérmenes colonizantes habituales, más evidente en uno de nuestros pacientes.
Un trabajo publicado hace 8 años sobre autopsias de pacientes con FQ y cultivos positivos para MA proporcionó algunas claves de lo que puede ocurrir en el pulmón de estos enfermos. En 12 de los 18 pacientes en los que se habían aislado MA en una única ocasión no se encontró ninguna alteración clínica o histológica atribuible a la micobacteria, mientras que la mitad de los enfermos en quienes se cultivó una MA en más de una muestra presentó síntomas pulmonares y sólo un tercio evidencias histológicas de infección granulomatosa. De ahí que sea al paciente con múltiples cultivos positivos de una misma especie de MA al que haya que vigilar y tratar en caso de deterioro clínico32.
Por otro lado, la ATS incluye entre sus criterios diagnósticos la confirmación de granulomas en muestras histológicas. La realización de técnicas invasivas, como la biopsia transbronquial o la biopsia pulmonar, multiplicaría el riesgo de complicaciones (hemorragia) en estos enfermos, dada la existencia en muchas ocasiones de hipertensión pulmonar e hipertrofia de las arterias bronquiales.
Un problema añadido es la dificultad de cultivar las micobacterias, dado el elevado sobrecrecimiento de otros patógenos que coexisten en las vías respiratorias del enfermo con FQ, especialmente Pseudomonas. En nuestro caso el porcentaje de contaminación fue del 18,8%, inferior al descrito en la bibliografía, quizá debido a la baja incidencia de colonización por P. aeruginosa en nuestros pacientes21,24. Es por ello que se propugna la utilización de 2 pasos en el proceso de descontaminación de las muestras previa al cultivo en medios selectivos (un 0,25% de N-acetilcisteína con un 1% de hidróxido sódico seguido de un 5% de ácido oxálico), lo que reduce la contaminación bacteriana hasta en un 3-5%33. En nuestro laboratorio se introdujo en el año 2002, para el tratamiento de las muestras de enfermos con FQ, un método de descontaminación con ácido oxálico con el que se han obtenido tasas sensiblemente inferiores de contaminaciones.
Los resultados con pruebas cutáneas de antígenos específicos de una determinada micobacteria han mostrado poca especificidad, pues se han evidenciado reacciones cruzadas entre unas y otras, incluido M. tuberculosis. Entre los pacientes de nuestro estudio en quienes se aisló MA, 4 presentaron, por reacción cruzada posiblemente, un Mantoux positivo. En un trabajo de Pinto-Powell et al34 con antígeno de M. avium, se encuentra una buena sensibilidad del test cutáneo, aunque no permite distinguir entre el simple aislamiento y la verdadera infección. Hoy día, por tanto, el papel de las pruebas cutáneas está aún por determinar.
Nuestro estudio presenta algunas limitaciones. Así, el período de seguimiento no es homogéneo en todos los enfermos, ya que aproximadamente el 35% de ellos se fueron incorporando al estudio conforme cumplían 18 años y se transferían desde el hospital pediátrico a nuestra unidad. Por otra parte, tal como ocurrió en uno de nuestros pacientes, la auramina podía ser positiva en la primera muestra de esputo y desconocíamos si ya lo era previamente, dado que en la unidad pediátrica no se solicitan de forma sistemática técnicas microbiológicas específicas para la detección de MA.
En definitiva, la prevalencia de MA en los pacientes adultos con FQ es elevada y, aunque su implicación clínica aún está por establecer, es importante su diagnóstico e identificar a los enfermos que precisarán tratamiento. Ante los problemas existentes para establecer el diagnóstico, se deben definir criterios más concretos que los propuestos por la ATS para el diagnóstico de enfermedad por MA en la FQ. Así, en primer lugar, es preciso sospechar la enfermedad en los pacientes en quienes se obtengan múltiples tinciones (sobre todo) o cultivos positivos, por lo que deberemos solicitar a los microbiólogos el estudio periódico (anual o semestral) de MA en secreciones respiratorias. En segundo lugar, debe sospecharse en enfermos que presenten síntomas pulmonares, febrícula, pérdida de peso o incremento del volumen de la expectoración, acompañados de un deterioro de la función pulmonar y/o una radiografía de tórax que muestre lesiones progresivas nodulares o cavitarias. Por último, debe plantearse ante la falta de respuesta clínica al tratamiento antimicrobiano convencional frente a las bacterias colonizantes.
Este artículo está financiado por Red Respira (RTIC C03/011)-SEPAR