Introducción
El cáncer de pulmón (CP) se diagnostica a menudo en estadios avanzados, debido a su elevada propensión a producir metástasis. Entre los lugares de destino de las metástasis del CP, el encéfalo es una localización común1 y, entre todas las metástasis encefálicas, el CP es la fuente primaria más habitual2. La detección de metástasis cerebrales (MC) suele alterar el plan terapéutico, salvo cuando el estado general del paciente está tan deteriorado que sólo cabe considerar medidas paliativas. Por lo general hay acuerdo en recomendar pruebas diagnósticas en pacientes que presentan signos o síntomas sospechosos de MC, debido al bajo valor predictivo positivo de la evaluación clínica (alrededor del 50%)3. Las sociedades de neumología europea y norteamericana (European Respiratory Society y American Thoracic Society) recomendaron hace años la tomografía axial computarizada craneal (TACC) en presencia de síntomas neurológicos4, pero hay dudas sobre la utilidad de esta prueba en ausencia de dichos síntomas o signos5,6. Por su parte, la American Society of Clinical Oncology ha modificado levemente sus recomendaciones previas y en la actualidad afirma: "Se recomienda TACC o resonancia magnética craneal (RMC), con y sin infusión de contraste, en pacientes con síntomas o signos de afectación del sistema nervioso central, así como en pacientes con estadio III asintomáticos en los que se considere la posibilidad de tratamiento local agresivo (cirugía o radioterapia torácicas)"7 (la cursiva es nuestra). El American College of Chest Physicians también ha coincidido recientemente en esta recomendación y excluye de ella a los pacientes con estadios I y II y una evaluación clínica negativa5. En estas guías relevantes, no hay recomendaciones específicas para considerar otras circunstancias (estirpe tumoral, sexo, edad, etc.) con vistas a practicar o no estudios de imagen craneal (TACC o RMC). La mayor parte de la evidencia previa para sustentar estas guías se basaba en estudios con TACC y, como señalan Silvestri et al5, el uso sistemático de la RMC en la estadificación del CP no microcítico todavía no ha sido suficientemente estudiado. No obstante, algunos trabajos, casi siempre con muestras pequeñas, señalan la utilidad de la RMC para detectar MC ocultas, en especial cuando se plantea la posibilidad de aplicar tratamientos agresivos8-11.
El objetivo del presente estudio ha sido evaluar el rendimiento de la TACC y la RMC para detectar MC silentes durante la estadificación inicial de pacientes con CP, así como su valor en función de otras características tales como la edad, el sexo, la estirpe histológica y el estadio TNM.
Pacientes y métodos
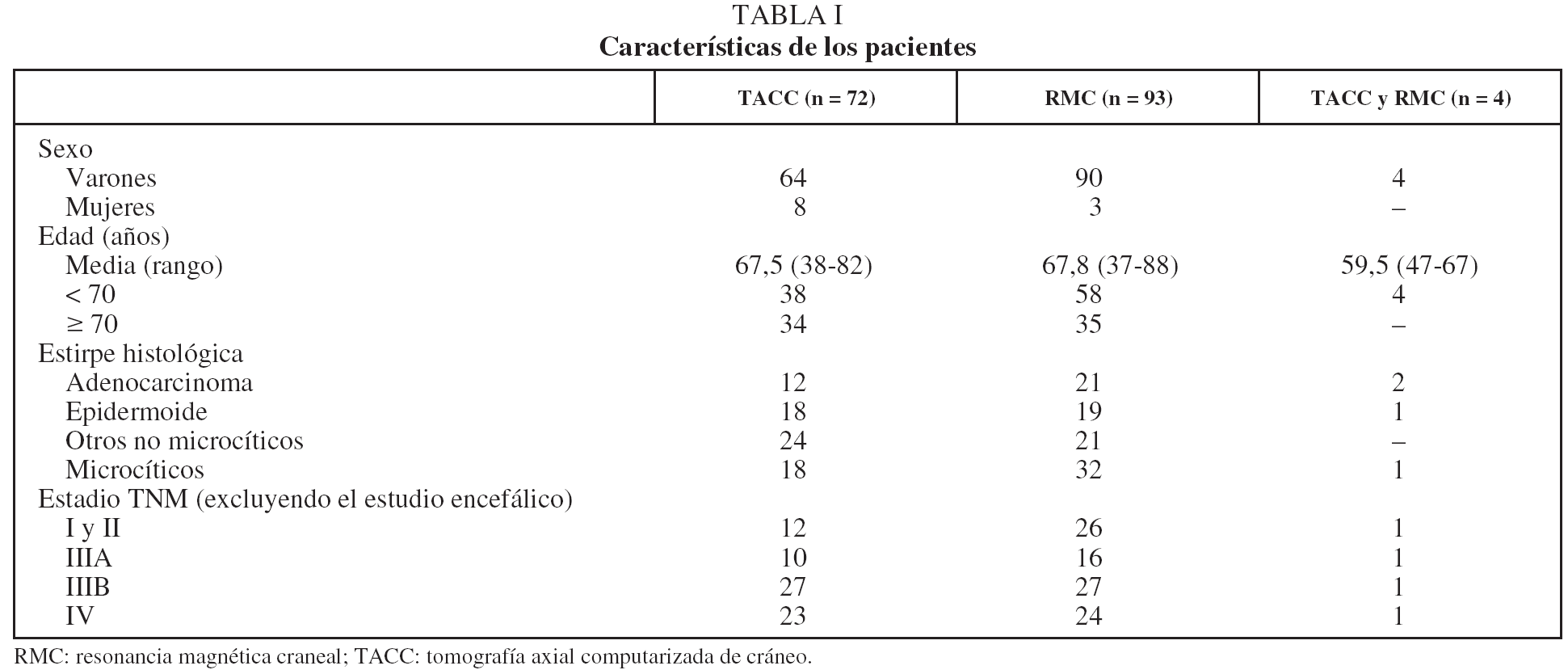
En este estudio retrospectivo se han analizado las historias de los pacientes con CP a quienes se realizó TACC o RMC durante la estadificación inicial, desde enero de 2000 hasta junio de 2005. Se excluyó del análisis a los pacientes con síntomas o signos neurológicos sospechosos de MC, de modo que se incluyó finalmente a 169. Todos ellos tenían CP confirmado mediante muestra citohistológica. En 72 se efectuó TACC; en 93, RMC, y en 4, ambos procedimientos.
La TACC se efectuó con una Tomoscan AV (Philips Medical Systems, Best, Holanda). Se estudió el encéfalo mediante cortes contiguos de 5 a 10 mm. El contraste usado fue Iopramida (Larograf, Juste, España), 50 ml en inyección intravenosa. La RMC se realizó con un Gyroscan NT (1T) (Philips, Medical Systems, Holanda). Se emplearon secuencias T1 precontraste (tiempo de repetición: 600 ms; tiempo de eco: 17 ms) y T2 (tiempro de repetición: 4.900 ms; tiempo de eco: 120). El campo de visión fue de 20 × 20 cm y la matriz, de 256 × 256 mm. Las secciones fueron de 6 mm, y los puentes intersección, de 1 mm. Las secuencias T1 se repitieron después de administrar contraste paramagnético (gadolinio-DTPA, 0,2 ml/kg; Magnograph, Juste, España).
En nuestra sección de neumología, a los pacientes con sospecha de CP, además de la anamnesis y exploración física general, en una primera etapa se les realizan pruebas básicas (radiografía de tórax, electrocardiograma, espirometría, análisis hematológico y bioquímico básico); en una segunda etapa, se les programa habitualmente para efectuar una tomografía axial computarizada (TAC) de tórax y abdomen superior y fibrobroncoscopia. Además, en esa misma fase del estudio (antes, por tanto, de disponer de la TAC torácica y resultados citohistológicos), si tras la evaluación inicial se considera que los pacientes podrían ser candidatos a tratamientos radicales, como cirugía o radioterapia torácicas, se programa un estudio de imagen craneal aun cuando no haya síntomas o signos neurológicos detectados en la evaluación clínica. No se efectúa sistemáticamente una evaluación por un neurólogo. Otras pruebas, como la gammagrafía, la radiografía ósea o la punción aspirativa transtorácica, se indican en función de los síntomas o tipo y localización de la lesión observada en la radiografía. Durante el período comprendido en este estudio (años 2000 a 2005), pudimos emplear TACC y RMC, y la elección de una u otra prueba dependió de la disponiblidad de los equipos en cada momento. En 4 pacientes se realizaron las 2, con la finalidad de precisar mejor mediante RMC algunas imágenes dudosas observadas en la TACC. Para conocer la frecuencia de MC en función del grado de extensión, al final del proceso de estadificación se clasificó a los pacientes según la clasificación TNM12, excluyendo la posible afectación encefálica.
En nuestra sección de neumología se realiza sistemáticamente el seguimiento de los pacientes con CP, lo cual nos ha permitido repetir TACC o RMC en: a) en pacientes sin MC iniciales que desarrollaron posteriormente síntomas o signos neurológicos sospechosos de MC, y b) pacientes con MC iniciales que fueron tratados, para evaluar la eficacia del tratamiento. Los datos observados durante este seguimiento nos sirvieron como referencia para verificar los resultados positivos o negativos de la prueba inicial.
Además de obtener la autorización del comité ético de nuestro centro, a todos los pacientes se les solicitó el consentimiento informado antes de la realización de las pruebas.
Las comparaciones entre proporciones se analizaron mediante la prueba de la Χ2 o el test exacto de Fisher.
Resultados
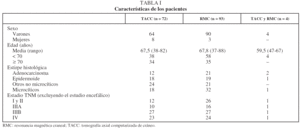
De un total de 596 pacientes diagnosticados de CP en el período analizado (desde enero de 2000 hasta junio de 2005), se revisaron las historias clínicas de 226 que disponían de estudio craneal. De éstos, 57 presentaban síntomas y/o signos neurológicos en la evaluación clínica, motivo de solicitud de la prueba, y por tanto se excluyeron del presente estudio. En los 169 restantes, sin síntomas ni signos neurológicos, se solicitó un estudio craneal ante la posibilidad de que estuviesen indicadas la cirugía o la radioterapia torácica con intención radical. Las características de estos 169 pacientes finalmente incluidos se presentan en la tabla I. El subgrupo de otros CP no microcíticos incluye 5 indiferenciados de células grandes, 3 adenoescamosos, uno bronquioloalveolar y 36 diagnosticados de "no microcíticos" sin mayor especificación.
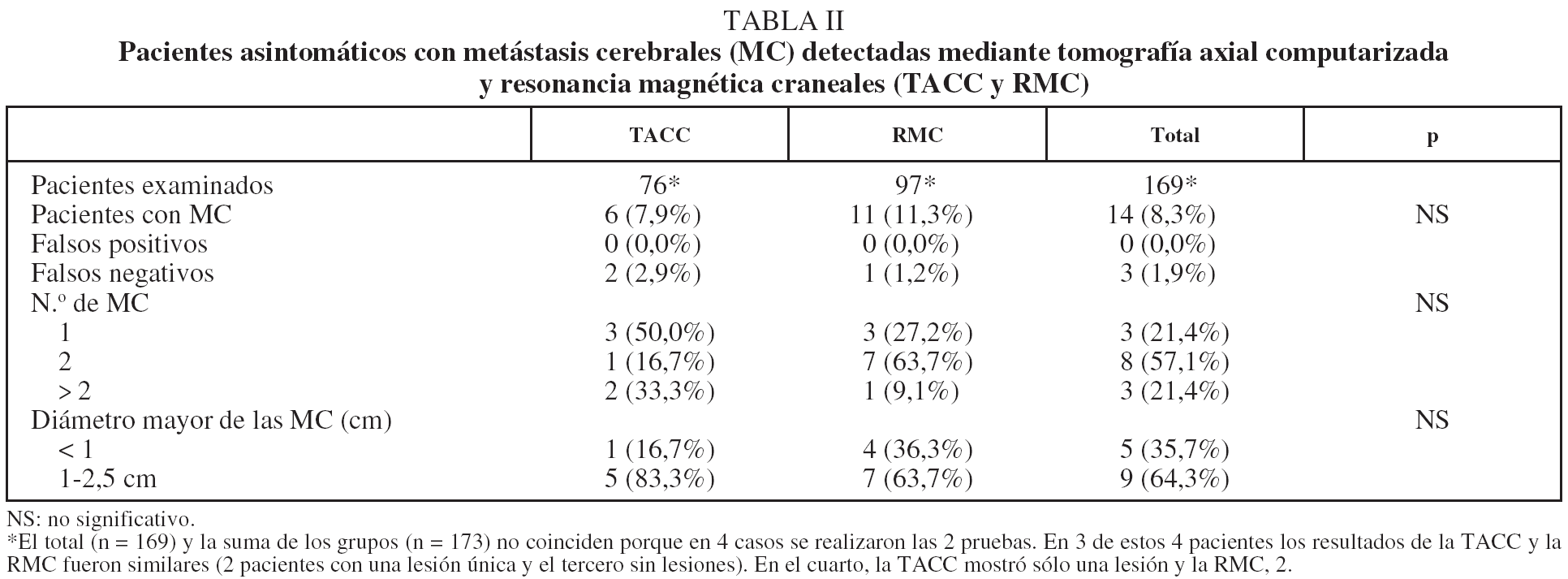
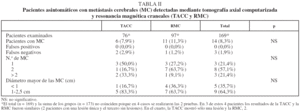
Presentaron MC silentes un total de 14 pacientes (8,3%): un 7,9% de los 76 con TACC y un 11,3% de los 97 con RMC. La suma de casos de ambos grupos, 17, no coincide con el total, 14, porque en 4 casos se realizaron ambas pruebas. Entre estos 4, la TACC y la RMC dieron resultados similares en 3 pacientes y diferentes en uno (tabla II).
Se observó mayor proporción de metástasis múltiples (≥ 2) en los casos con RMC (72,8%) que en aquéllos con TACC (50%). Aunque todas las lesiones fueron pequeñas (≤ 2,5 cm), el porcentaje de muy pequeñas (< 1 cm) fue mayor en el grupo de RMC (tabla II).
Seguimiento y verificación de resultados
1. Pacientes con resultado positivo. En un paciente sometido a intervención neuroquirúrgica el examen de la pieza confirmó el diagnóstico de MC. Recibieron radioterapia holocraneal (RTH) 11 pacientes. Los otros 2 la rechazaron y sólo recibieron corticoides y quimioterapia. Seis de los 13 no operados experimentaron rápidamente (< 3 meses tras la estadificación inicial) la aparición de síntomas neurológicos (los 2 que recibieron quimioterapia y 4 del grupo de RTH). Además, en 3 de ellos una nueva TACC o RMC evidenció crecimiento de las lesiones iniciales. Los otros 7 tratados con RTH presentaron remisión completa o parcial, comprobada mediante un nuevo estudio de imagen craneal. Estos datos de la evolución nos hicieron concluir que todos los resultados positivos eran verdaderos.
2. Pacientes con resultados negativos. Cuatro pacientes sin evidencia de MC en la evaluación inicial (3 con TACC y uno con RMC) presentaron más adelante síntomas neurológicos y evidencia de MC en un nuevo examen radiológico. En 3 los síntomas comenzaron menos de 6 meses después de la evaluación inicial y en el restante, 17 meses después. Los 3 primeros casos se consideraron resultados falsos negativos (FN) de la prueba inicial, lo que da una tasa de FN del 1,9% (3/155) (tabla II).
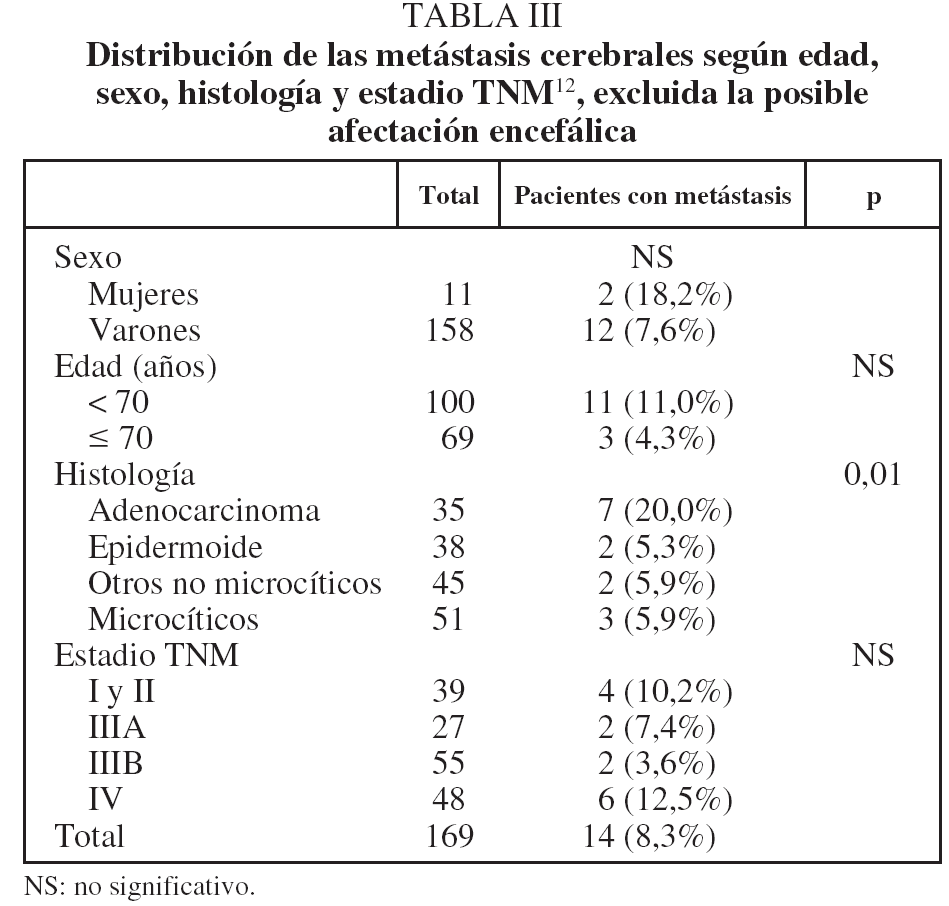
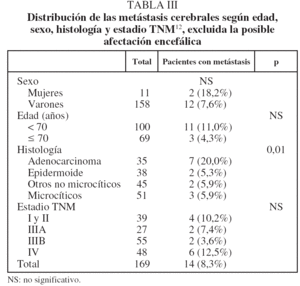
En la tabla III se muestra la distribución de pacientes con MC según sexo, edad, estadio TNM y estirpe histológica. El sexo femenino, la edad menor de 70 años y la estirpe adenocarcinoma se asociaron a mayor porcentaje de MC, aunque la asociación sólo alcanzó significación estadística para la estirpe: un 20% en adenocarcinomas frente a un 5,3-5,9% en los restantes tipos. En cuanto al grado de extensión, no se observó tendencia a una mayor frecuencia de MC en los estadios TNM más avanzados.
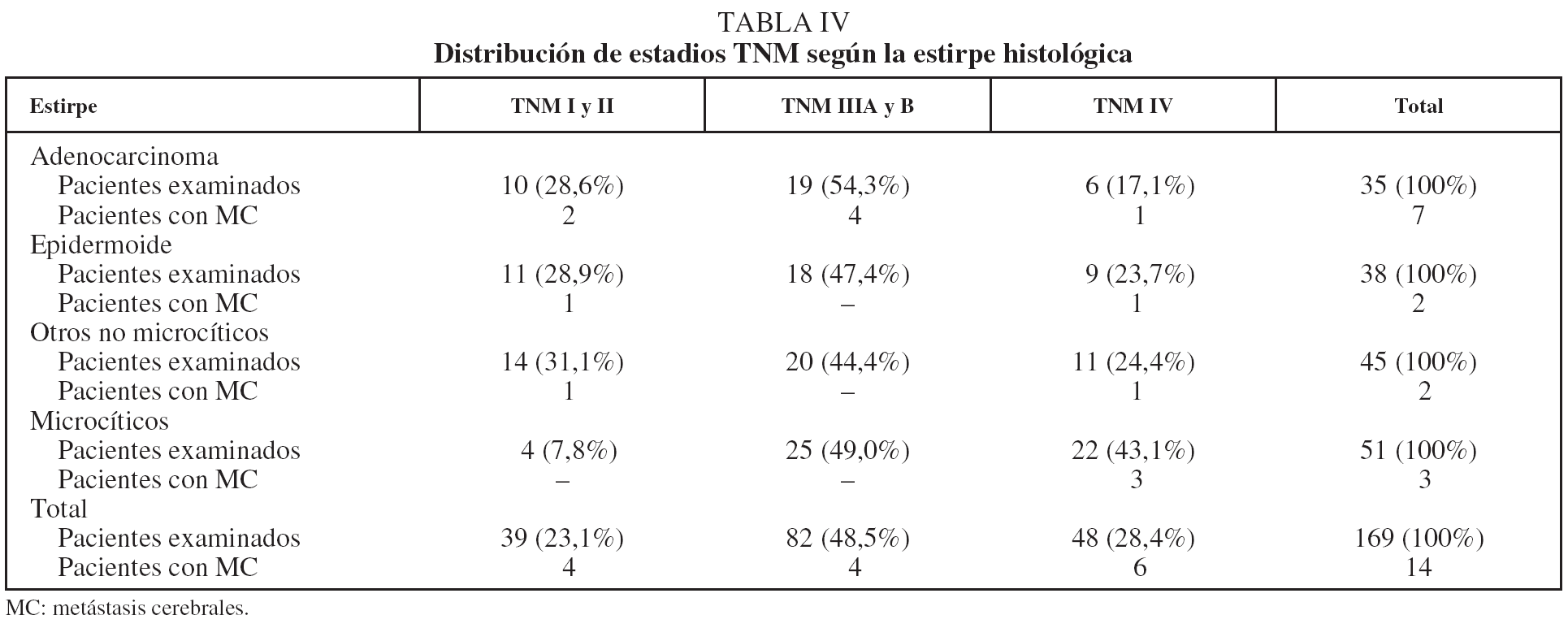
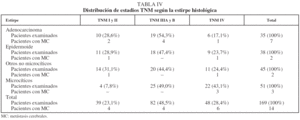
En la tabla IV se indica la distribución del total de pacientes examinados y de los que presentaron MC, según la estirpe y el estadio. Salvo los microcíticos, la distribución de estadios fue similar en los distintos grupos histológicos. En cuanto a los casos con MC, sólo en la variedad microcítica hubo asociación entre estadio IV y frecuencia de MC, aunque el pequeño tamaño de estos subgrupos impide efectuar comparaciones al respecto.
Además de las lesiones características de MC, se observaron otro tipo de lesiones isquemia punteada (n = 16), pequeños infartos lacunares (n = 5), hematoma intraparenquimatoso (n = 1) y leucoaraiosis (n = 2) que suelen ser fáciles de diferenciar de las MC.
Discusión
La incidencia de MC en la evaluación inicial de pacientes con CP es elevada. En un registro europeo de ámbito poblacional, la incidencia de MC en el momento del diagnóstico y durante el primer mes siguiente fue del 7,8%2. Usando TACC sistemáticamente en la estadificación inicial del CP Salbeck et al13 y Ferrigno y Buccheri14 observaron MC en el 14 y el 13,6%, respectivamente. En esos trabajos, los porcentajes observados en los subgrupos de pacientes sin síntomas neurológicos fueron del 10,8%13 y del 8,7%14. Yokoi et al9, también en pacientes asintomáticos y operables del CP primario, detectaron un 3,4% de MC antes de la cirugía y un 3,4% adicional durante los 12 meses siguientes, mediante el uso sistemático de RMC. Nosotros hemos registrado un porcentaje de MC silentes más elevado, del 8,3%, pero nuestros pacientes, a diferencia de los de Yokoi et al9, no eran exclusivamente quirúrgicos y muchos de ellos tenían estadios TNM avanzados. En nuestro hospital, carente de servicio de cirugía torácica, es una prioridad obtener lo más rápidamente posible resultados de estadificación del CP mediante pruebas no invasivas, para evitar procedimientos o intervenciones (mediastinoscopia, toracoscopia, etc.) quirúrgicos innecesarios. Por ello se efectuaron estudios intracraneales (mediante TACC o RMC) a pacientes cuya evaluación inicial provisional (antes de disponer de TAC torácica) indicaba un estadio TNM III o menor, pero que finalmente tenían estadio IV, con independencia del estado del sistema nervioso central. Aunque la alternativa de solicitar la prueba de imagen craneal al final del estudio de extensión, una vez conocidos los resultados de todas las otras pruebas, habría ahorrado algunos de tales estudios y puede parecer más racional, en nuestras circunstancias implica prolongar, a menudo excesivamente, el proceso diagnóstico.
Al igual que en otros trabajos9,13-15, tampoco se solicitó en el presente una evaluación neurológica especializada en pacientes asintomáticos, evaluación que aumenta el valor predictivo negativo del examen clínico5. Por ello no podemos descartar del todo la presencia de alguna anormalidad clínica sutil (detectable sólo mediante una exploración neurológica exhaustiva) en los clasificados como portadores de MC silentes. Sin embargo, la evolución observada durante el seguimiento posterior de nuestros pacientes invita a considerar improbable dicha posibilidad.
Al analizar el grado de extensión no pudimos encontrar una relación positiva entre el estadio TNM y la proporción de MC (tabla IV), a diferencia de muchos otros estudios11,13,15,16 que sí han observado más metástasis en los estadios más avanzados. Es posible que las características de nuestro trabajo, que se centra en pacientes sin síntomas neurológicos y, por tanto, ha excluido a muchos pacientes con MC sintomáticas en estadios avanzados, hayan influido en tales resultados.
Con respecto al método radiológico, encontramos mayor porcentaje de metástasis múltiples con la RMC que con la TACC, y en el grupo de 4 pacientes a quienes se practicaron ambas pruebas hubo discrepancias relevantes en uno de ellos, en el que la TACC evidenció sólo una MC y la RMC, 2 (tabla II). Schellinger et al17 observaron, mediante RMC, MC múltiples en el 31% de los pacientes con MC aparentemente única mediante TACC, por lo que proponen que la RMC debe ser la prueba inicial de cribado de MC en neoplasias de origen extracraneal. Las series recientes muestran que el 65-80% de las MC, de cualquier origen, detectadas con RMC son múltiples, lo que contrasta con la experiencia previa basada en la TACC, según la cual sólo lo era aproximadamente el 50%18,19. Es probable que esta diferencia se deba a la existencia de lesiones muy pequeñas y/o de localización infratentorial, que sólo se detectan con RMC17. A este respecto, de cara a seleccionar la mejor opción terapéutica, es crucial diferenciar correctamente las lesiones únicas de las múltiples. En nuestro trabajo encontramos, mediante RMC y TACC, un 36,3 y un 16,7% de lesiones menores de 1 cm, respectivamente, lo que concuerda con la mayor sensibilidad de la primera para lesiones pequeñas.
Aunque conviene ser cautos ante la posibilidad de resultados FP en caso de lesión única (Patchell1 comunicó un 11%), cuando las lesiones son múltiples, y en el contexto de un tumor primario confirmado, es fácil establecer el diagnóstico de MC. En nuestra experiencia, el seguimiento estrecho de los pacientes permitió descartar la existencia de FP. En cuanto a la tasa de FN, la repetición frecuente de pruebas a lo largo de la evolución, como hicieron Yokoi et al9, permite un cálculo aproximado, aunque a menudo será difícil distinguir entre un resultado FN y la detección de una MC de nueva aparición. Nosotros, al igual que Kormas et al15, repetimos los estudios radiológicos durante el seguimiento sólo si aparecieron síntomas o signos neurológicos y, usando los mismos criterios que dichos autores y que Ferrigno y Buccheri14, definimos como caso FN a cualquier paciente cuya MC (evidenciada por síntomas recientes y TACC o RMC positivas) fuese detectada en los 12 meses siguientes a la primera prueba negativa. De este modo obtuvimos una tasa de FN del 2,9% para la TACC y del 1,2% para la RMC. Hochstenbag et al11 establecen como criterio al respecto un intervalo de 6 meses.
Entre las mujeres observamos mayor frecuencia de MC, aunque no podemos extraer conclusiones, debido al pequeño número de mujeres de nuestra serie, situación que está en concordancia con las características epidemiológicas del CP en nuestro país20. En los mayores de 70 años observamos un porcentaje menor de MC (el 4,3 frente al 11%) y, aunque la diferencia no alcanzó la significación estadística, pensamos, al igual que Schouten et al2, que este dato puede ser reflejo de una conducta menos agresiva del CP en los ancianos.
En lo que respecta a la estirpe histológica, coincidimos con muchos otros autores3,11,13-16,21 en la mayor incidencia de MC en el adenocarcinoma. Con el uso de la TACC, Salbeck et al13 y Salvatierra et al16 detectaron en esa estirpe un 12,1 y un 32% de MC, respectivamente. Mediante RMC, Hochstenbag et al11 diagnosticaron MC en el 14% de 91 pacientes sin síntomas neurológicos que presentaban CP de tipo adenocarcinoma o indiferenciado de células grandes. El 20% de las MC silentes observado en nuestros pacientes con adenocarcinoma fue significativamente superior al 5,6% de los tipos restantes (tabla III), y la diferencia no se debe a variaciones en la distribución de estadios (tabla IV). Por consiguiente, opinamos que en la programación de pruebas para detectar metástasis en los pacientes con CP, además del TNM provisional, también debería considerarse la estirpe. La detección de MC probablemente cambiará la estrategia terapéutica: en los pacientes con buenas condiciones y posibles candidatos a cirugía del CP, la neurocirugía debería considerarse en primer lugar para las lesiones únicas1,19,21. Si las MC son múltiples o irresecables, puede recurrirse a la radiocirugía en lesiones de menos de 3 cm19,22. En la mayoría de los casos, la RTH será la única opción adecuada1.
En conclusión, la incidencia observada de MC silentes (8,3%) nos parece lo bastante elevada para justificar su búsqueda mediante pruebas de imagen que, si bien aumentan el coste, no son invasivas y pueden alterar sustancialmente el plan terapéutico. Este posible cambio puede ser especialmente relevante en los estadios TNM inferiores al IV y candidatos a cirugía o tratamientos combinados (quimioterapia y radioterapia). Su mayor frecuencia en menores de 70 años y, sobre todo, en adenocarcinomas aconseja que estas características deban tenerse en cuenta al planificar las pruebas de estadificación. La RMC detectó un porcentaje ligeramente mayor de MC silentes que la TACC y una mayor proporción de lesiones muy pequeñas, y precisó con mayor exactitud el número de lesiones. Aunque estas diferencias no alcanzaron la significación estadística, todas juntas apuntan a una mayor exactitud diagnóstica de la RMC, por lo que debe contemplarse como método de elección en pacientes candidatos a neurocirugía o radiocirugía.
Correspondencia: Dr. J. Sánchez de Cos Escuín.
Isla de Hierro, 2, 3.o C. 10001 Cáceres. España.
Correo electrónico: jsd01cc@saludalia.com
Recibido: 22-5-2006; aceptado para su publicación: 7-11-2006.