El microARN (miR) se ha relacionado con la génesis tumoral en muchos tipos de cáncer, pero ningún estudio ha examinado el rol exacto del miR-133 en el cáncer de pulmón.
MétodosIdentificamos el miR-133 como posible regulador de la expresión de la FOXQ1 e investigamos la posible implicación del miR-133 en la migración y la invasión de células de cáncer de pulmón, y el mecanismo molecular subyacente.
ResultadosEl miR-133 se dirigió directamente y redujo la expresión de la FOXQ1, que a su vez redujo la concentración de TGF-β. El miR-133 disminuyó en líneas celulares de cáncer de pulmón A549 y HCC827, y su reexpresión inhibió significativamente la migración y la invasión de células de cáncer de pulmón. Investigaciones subsiguientes revelaron que dicha inhibición estaba provocada por una inversión de la transición epitelio-mesenquimatosa, constatada por una elevación del marcador epitelial E-cadherina inducida por el miR-133 y una reducción del marcador vimentina.
ConclusionesNuestro estudio es el primero que ha identificado el miR-133 como biomarcador del cáncer de pulmón. Su función es reducir la FOXQ1 e inhibir la transición epitelio-mesenquimatosa, la cual antagoniza la génesis tumoral en el cáncer de pulmón. Por consiguiente, nuestros datos respaldan el papel del miR-133 como posible instrumento terapéutico molecular en el tratamiento del cáncer de pulmón.
MicroRNA (miR) was implicated in the tumorigenesis of many types of cancer, but no study was conducted on the exact role of miR-133 in lung cancer.
MethodsWe have identified miR-133 as a putative regulator of FOXQ1 expression, and investigated the potential involvement of miR-133 in the migration and invasion of lung cancer cells, as well as the underlying molecular mechanism.
ResultsMiR-133 directly targeted and down-regulated FOXQ1 expression, which in turn reduced TGF-β level. MiR-133 was down-regulated in lung cancer cell lines A549 and HCC827, and its re-expression significantly inhibited the migration and invasion of the lung cancer cells. Further investigation revealed that this inhibition was caused by reversing the epithelial-mesenchymal transition, evidenced by miR-133 induced elevation of epithelial marker E-cadherin, and reduction of mesenchymal marker Vimentin.
ConclusionsOur study is the first to identify miR-133 as a biomarker for lung cancer. It functions to down-regulate FOXQ1, and inhibit epithelial-mesenchymal transition, which antagonizes lung cancer tumorigenesis. Therefore our data support the role of miR-133 as a potential molecular therapeutic tool in treating lung cancer.
El cáncer de pulmón es la primera causa de muerte por cáncer en todo el mundo1, y la transición epitelio-mesenquimatosa (TEM) juega un papel crucial en la formación de metástasis de los cánceres humanos, incluido el cáncer de pulmón2. Durante la TEM, las células epiteliales adquieren el fenotipo mesenquimatoso y se desprenden del tumor primario, se diseminan a través de la circulación y llegan hasta tejidos secundarios, donde causan metástasis3. La TEM implica cambios fenotípicos y una reprogramación molecular. Durante la transición, las células epiteliales inmóviles polarizadas cambian su morfología para convertirse en células mesenquimatosas móviles, que tienen mayor motilidad y capacidad de invasión4. Esta transición también se caracteriza por una reducción de los marcadores epiteliales que incrementan el contacto entre células, como la E-cadherina, y también de los marcadores mesenquimatosos, como la vimentina o la N-cadherina5.
Se ha afirmado que distintas vías de señalización pueden desencadenar la TEM. Se ha observado que el factor de transcripción Forkhead FOXQ1 induce la TEM en el cáncer de mama6, y también se ha descrito que en el cáncer colorrectal media la comunicación cruzada entre el TGF-β y las vías de señalización Wnt7. En el cáncer de pulmón en particular, la expresión del FOXQ1 es indicativa de mal pronóstico, promueve la TEM e incrementa la quimiosensibilidad8,9.
Los microARN (miARN o miR) son pequeñas moléculas de ARN no codificante, normalmente de unos 20-25 nucleótidos. Reconocen secuencias complementarias específicas que suelen encontrarse en la región 3’ no traducida (UTR) de los ARNm diana, reprimiendo la traducción o degradando el ARNm diana10,11. Los miARN participan en la TEM de muchos tipos de cáncer, como el cáncer de pulmón, alterando la expresión de oncogenes o genes supresores tumorales12. Se ha observado, por ejemplo, que el miR-19 desencadena la TEM y promueve la migración y la invasión de las líneas celulares de cáncer de pulmón A549 y HCC82713. Contrariamente, otros miARN inhiben este proceso, como por ejemplo el miR-129, el cual, según la literatura, antagoniza la TEM y las metástasis del cáncer de pulmón no microcítico reduciendo el MCRS114. De manera similar, también se ha observado que una baja expresión del miR-30c afecta negativamente a la TEM del cáncer de pulmón15. A pesar de esto, todavía no se conoce bien el papel exacto del miR-133 en la regulación de la TEM.
En nuestro estudio nos propusimos investigar si el miR-133 está involucrado en la regulación de la TEM de células de cáncer de pulmón y los posibles mecanismos subyacentes. Constatamos que el miR-133 disminuía en las líneas celulares de cáncer de pulmón humano A549 y HCC827, y que actuaba directamente sobre el FOXQ1 reduciendo su expresión. El aspecto más importante es que la expresión del miR-133 invirtió las características de la TEM, inhibiendo la capacidad migratoria e invasiva de las células de cáncer de pulmón. Así, el miR-133 podría ser un instrumento terapéutico molecular novedoso capaz de invertir la TEM en el cáncer de pulmón.
Materiales y métodosLíneas celulares, anticuerpos y microARNSe obtuvieron líneas celulares de pulmón humano normal CCD-19Lu y MRC-9, y líneas celulares de cáncer de pulmón humano A549 y HCC827 mediante el método de colección americana para cultivo tipo (ATCC). Las células se mantuvieron en un medio completo con RPMI-DMEM (Hyclone; GE Healthcare) de alto contenido en glucosa y un 10% de suero bovino fetal (FBS; Gibco), a 37¿C y en una atmósfera humidificada que contenía un 5% de CO2. Todos los anticuerpos anti-FOXQ1 (ab194564), anti-TGF-β (ab9758), anti-Smad2/3 total (ab63672), anti-fosfo-Smad2/3 (ab63399), anti-E-cadherina (ab76055), anti-N-cadherina (ab18203), anti-vimentina (ab92547) y anti-GAPDH (ab181602) se adquirieron de Abcam. El hsa-miR-133 mirVana miRNA mimic (MC10029) y el control negativo mirVana miRNA (4464061) se adquirieron de Life Technologies. La transfección de las líneas celulares se efectuó siguiendo las instrucciones del fabricante. Después de la transfección, las células se incubaron durante 48h antes de realizar otras pruebas experimentales.
Western blotLas células se sembraron en placas de 6 pocillos con una densidad de 1×106 células/pocillo con 2 ml de medio DMEM completo. Transcurridas 24h desde la transfección del hsa-miR-133 o control negativo, se extrajo la proteína total utilizando un tampón RIPA (50 mM Tris-HCl, pH 7,4, 150 mM NaCl, 1 mM EDTA, 1% Triton X-100, 1% desoxicolato de sodio, 0,1% SDS e inhibidores de la proteasa). La concentración de proteínas se determinó mediante una prueba BCA. Cantidades iguales de proteínas se separaron mediante SDS-PAGE y se transfirieron a una membrana de nitrocelulosa utilizando una unidad de transferencia semiseca (Bio-Rad Laboratories). A continuación, la membrana se sumergió en un tampón bloqueador (PBS, 0,1% Tween-20) con leche desnatada al 5% durante 20min y luego se incubó con los anticuerpos primarios correspondientes durante toda la noche y a 4¿C. Después de los lavados con el tampón bloqueador, las células se incubaron con un anticuerpo secundario conjugado con HRP (Life Technologies) a temperatura ambiente durante 1h, se volvieron a lavar con el tampón bloqueador y se visualizaron con el sustrato Luminata Forte Western HRP (EMD Millipore).
Prueba de curación de dañosDespués de la transfección, se sembraron 1×105 células transfectadas con control miARN negativo o hsa-miR-133 en una placa con 6 pocillos. Con la punta de una pipeta estéril de 100μl se efectuó un daño lineal a través de la monocapa celular confluyente, y el detritus celular se eliminó lavándola con PBS. La distancia migrada del borde de crecimiento de las monocapas dañadas se determinó 24h después de causar el daño, y la tasa de migración se expresó como porcentaje respecto a los controles respectivos.
Prueba de invasión celularLa prueba de invasión celular se llevó a cabo en una placa de 24 pocillos con cámara de relleno con un tamaño del poro de 8μm (BD Biosciences). Se colocaron 1×105 células transfectadas con control miARN negativo o hsa-miR-133 en la cámara superior de cada pocillo con membrana recubierta de Matrigel, diluidas en un medio de cultivo sin suero. El compartimento inferior se rellenó con 500μl de un medio que contenía un 10% de FBS para atraer a las células. Las células se incubaron a 37¿C en una incubadora humidificada con un 5% de CO2 durante 24h, a lo que siguió una exposición a 20μM de 5-etinil-2-desoxiuridina (EdU) durante 4 h más y a 37¿C. Los insertos de membrana se retiraron de la placa y se tiñeron mediante el kit ENU (Invitrogen). Las células de cada pocillo se contaron en 6 campos microscópicos aleatorios, y la tasa de invasión se expresó como el porcentaje respecto a los controles respectivos.
Prueba de fijación y desprendimiento celularLas células se sembraron en una placa de 24 pocillos (1×105 células/pocillo). En resumen, para la prueba de fijación, tras 1h de incubación, las células no fijadas se lavaron 2 veces con PBS y las células fijadas se contabilizaron tras una tripsinización. La tasa de fijación se expresó como el porcentaje del número de células fijadas respecto al número total de células, y normalizado respecto al control correspondiente. Para la prueba de desprendimiento, las células se desprendieron con tripsina al 0,05% durante 3min, y se contabilizaron tras la incubación de las células sembradas durante 24h. Las células fijadas restantes se volvieron a tripsinizar con la enzima al 0,25% y se contabilizaron. La tasa de desprendimiento celular se expresó como el porcentaje de células desprendidas respecto del total de células, y normalizado respecto al control correspondiente.
Análisis estadísticoTodos los valores se presentaron mediante la media ±EEM. Para establecer diferencias significativas entre grupos se utilizó la prueba de la t de Student bilateral. Se determinó que existían diferencias entre los datos si el valor de p era <0,05.
ResultadosEl miR-133 disminuye en líneas celulares de cáncer de pulmónMediante el recurso de microRNA.org, identificamos que la secuencia del miR-133 tiene un supuesto sitio de unión en el 3’-UTR del ARNm de FOXQ1. Además, mediante RT-PCR, tras un examen de su expresión en las líneas celulares de cáncer de pulmón humano A549 y HCC827, encontramos que la de miR-133 es significativamente más baja, en comparación con los niveles que se observan en las líneas celulares de pulmón normal CCD-19Lu y MRC-9. Las concentraciones de MiR-133 en CCD-19Lu y MRC-9 fueron similares, mientras que en A549 la concentración había disminuido hasta aproximadamente el 30% de las líneas celulares normales, y en HCC827 alrededor del 40% de las líneas celulares normales. Estos resultados sugirieron que, en comparación con las de las líneas celulares de pulmón humano normales, la expresión de miR-133 había disminuido significativamente en las líneas celulares de cáncer de pulmón.
El miR-133 apunta directamente al 3’-UTR del FOXQ1A continuación validamos el supuesto sitio de unión del miR-133 en el 3’-UTR de FOXQ1 mediante una prueba de luciferasa. Las secuencias de 3’-UTR natural (WT-luc) del ARNm de FOXQ1 y su versión mutada (mut-luc) se fusionaron con el derivado de ORF luciferasa, respectivamente. Posteriormente, los 2 constructos de luciferasa se transfectaron por separado en células A549 y HCC827, junto con un control miARN negativo miR-133 mimic. Luego se evaluó la actividad de la luciferasa. Como consecuencia, el miR-133 redujo drásticamente la actividad del WT-luc hasta aproximadamente el 30% del valor obtenido en los experimentos de controles transfectados, de forma sistemática en las líneas celulares A549 y HCC827. Por otro lado, la actividad del mut-luc en gran medida no resultó afectada en las células transfectadas con miR-133 o con miARN de control. Por consiguiente, las secuencias complementarias del 3’-UTR FOXQ1 fueron una diana directa del miR-133.
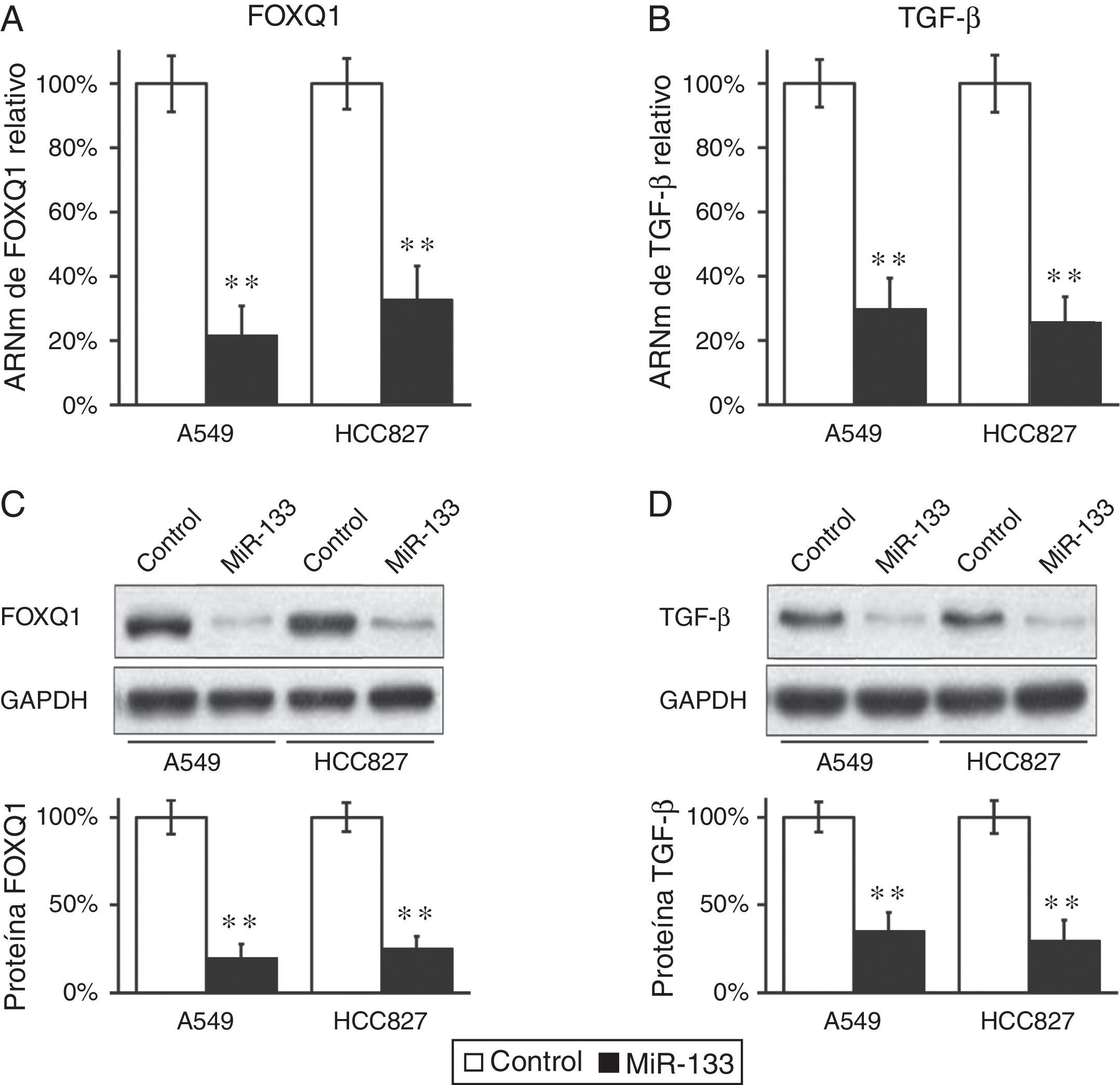
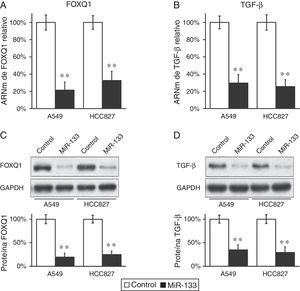
El miR-133 reduce la expresión del FOXQ1 y el TGF-β en líneas celulares de cáncer de pulmónContinuamos probando si el FOXQ1 era una diana in vivo del miR-133. El miR-133, y el control miARN negativo, fueron transfectados en células A549 y HCC827, que posteriormente se sometieron a RT-PCR para examinar las concentraciones de ARNm de FOXQ1. Los niveles de miR-133 en células A549 y HCC827 aumentaron de manera importante tras la transfección. En comparación con las transfecciones de ARNm de control, el miR-133 redujo significativamente los niveles del mensajero FOXQ1 en las 2 líneas celulares de cáncer de pulmón examinadas (fig. 1A), lo que indicó claramente que el ARNm de FOXQ1 es una diana buena del miR-133. Mediante un anticuerpo anti-FOXQ1, confirmamos que su nivel de proteínas también se encontraba marcadamente reducido en células transfectadas con miR-133 pero no en las transfectadas con control (fig. 1C).
El FOXQ1 disminuye por la transfección del miR-133 en líneas celulares de cáncer de pulmón. A,B) Concentraciones relativas de ARNm FOXQ1 (A) y TGF-β (B) en líneas celulares A549 y HCC827, tras transfección con control miARN negativo o miR-133. C, D) Concentraciones de proteínas FOXQ1 (C) y TGF-β (D) en líneas celulares A549 y HCC827, tras transfección con control miARN negativo o miR-133. Como control de carga se empleó GAPDH. La cuantificación de la expresión de las proteínas FOXQ1 y TGF-β normalizadas a GAPDH también se muestra en los paneles inferiores. Los valores son medias ± EEM de 3 experimentos independientes.
** p < 0,01 frente al control respectivo.
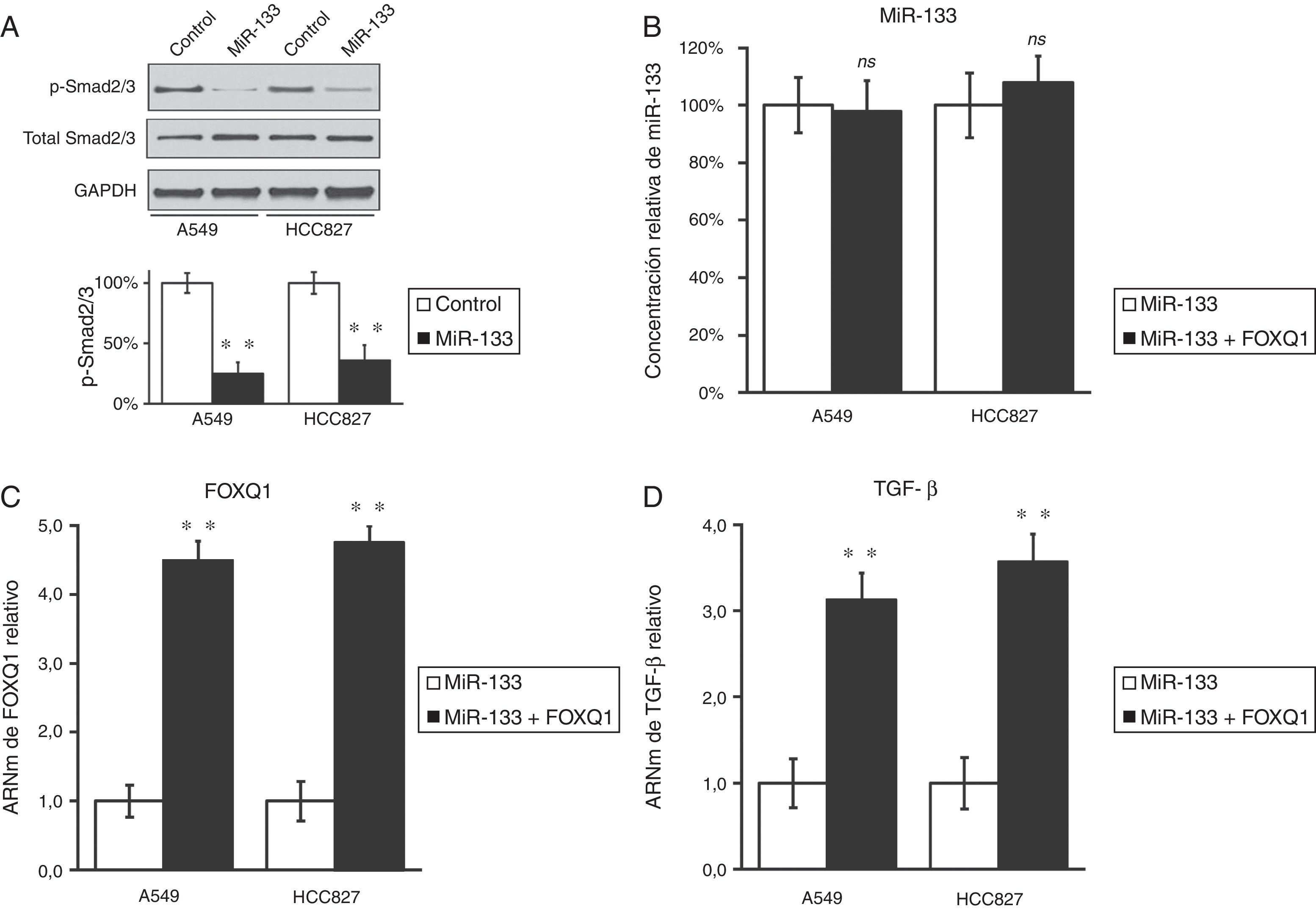
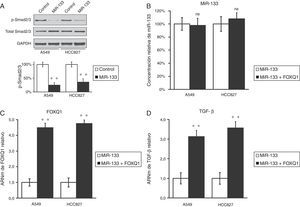
Previamente, se había comunicado que el FOXQ1 podría promover la expresión del TGF-β16 y se había relacionado con la comunicación cruzada entre el TGF-β y las vías de señalización Wnt en la progresión del cáncer colorrectal7. Teníamos curiosidad por investigar si en el cáncer de pulmón también existía una correlación similar entre estos 2 genes. Resultó interesante comprobar que la disminución del FOXQ1 por transfección de miR-133 también redujo marcadamente la expresión del TGF-β en ambas líneas celulares de cáncer de pulmón (fig. 1B,D), lo que sugirió que es probable que tanto el FOXQ1 como el TGF-β participen en la génesis tumoral del cáncer de pulmón. Más importante todavía fue el hallazgo de que, en ambas líneas celulares de cáncer de pulmón (A549 y HCC827), la expresión miR-133 causó una inhibición significativa de la vía del TGF-β, indicada por una fosforilación reducida de la Smad2/3 (fig. 2A), ambos efectores derivados de la vía del TGF-β17. Cabe señalar que confirmamos de nuevo que la regulación de la vía del TGF-β por el miR-133 estaba mediada por el FOXQ1. Debido que en un experimento de cotransfección en el que se empleó el miR-133 y un plásmido que expresa el FOXQ1 sin su 3’-UTR, la concentración de TGF-β también aumentó después de la expresión del FOXQ1, incluso en presencia de miR-133 (fig. 2B-D).
El miR-133 inhibe la vía del TGF-β, disminuyendo el FOXQ1 en líneas celulares de cáncer de pulmón. A) Concentraciones de proteína Smad2/3 totales y fosforiladas en líneas celulares A549 y HCC827, tras transfección con control miARN negativo o miR-133. Como control de carga se utilizó GAPDH. La cuantificación de la expresión de p-Smad2/3 normalizada a GAPDH también se muestra en los paneles inferiores. B-D) Concentraciones relativas de miR-133 (B), FOXQ1 ARNm (C) y TGF-β ARNm (D) en líneas celulares A549 y HCC827, tras transfección con miR-133 solo o cotransfección con miR-133 y FOXQ1 con expresión de plásmidos en ausencia de su 3’-UTR Los valores son medias ± EEM de 3 experimentos independientes.
* n.s.: no significativo frente al control respectivo.
** p < 0,01 frente al control respectivo.
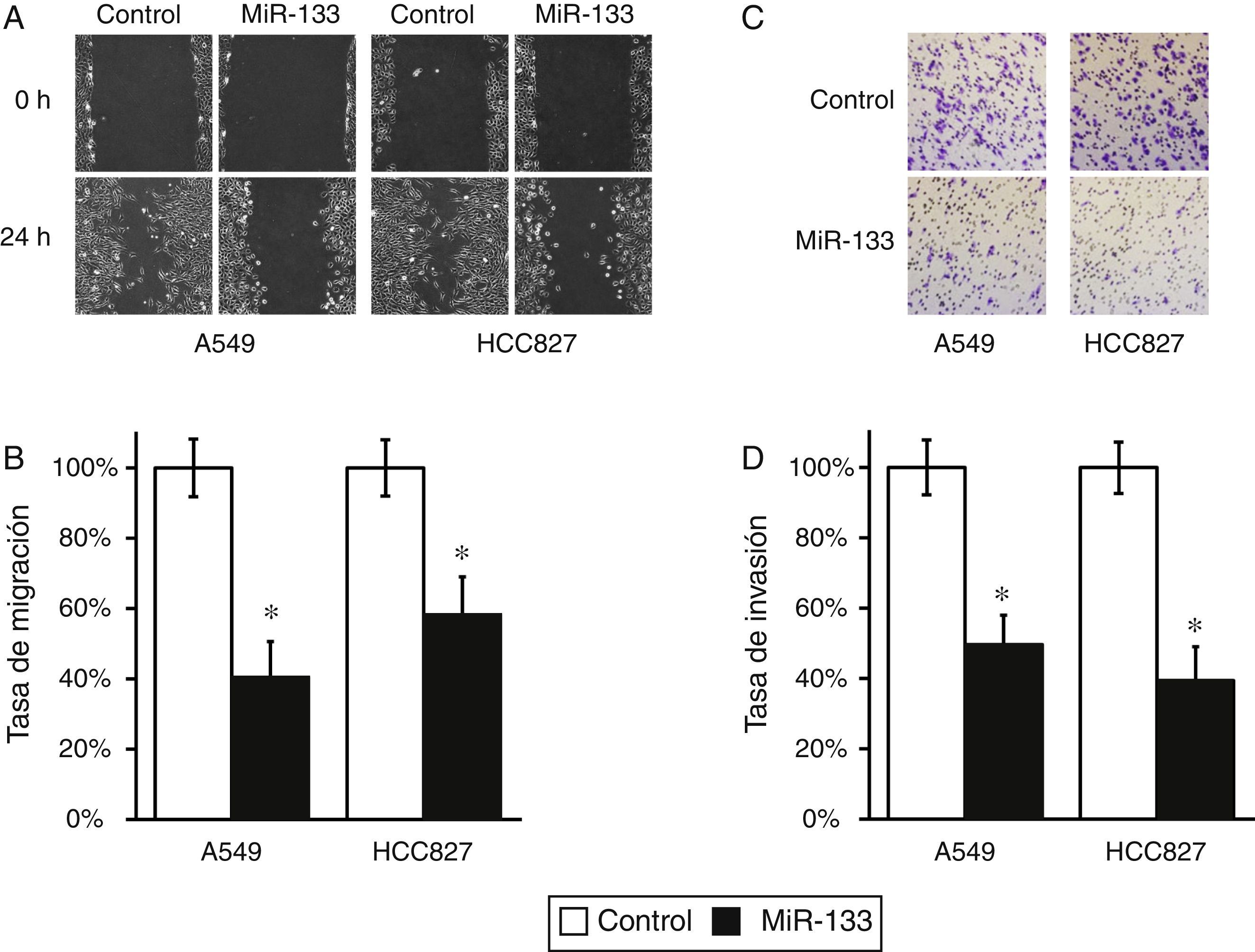
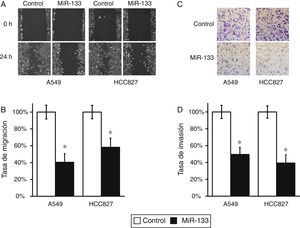
El FOXQ1 se asoció a metástasis y a mal pronóstico del cáncer de pulmón8,9, por lo que la introducción de miR-133 para disminuir el FOXQ1 debería inhibir la migración y la invasión de células de cáncer de pulmón. Para probar esta hipótesis, llevamos a cabo experimentos de curación de daños y de invasión celular en células A549 y HCC827 transfectadas con miR-133 y miARN de control. Tal como esperábamos, ambas líneas celulares exhibieron una tasa de migración significativamente reducida tras la transfección de miR-133, en comparación con los experimentos de control (fig. 3A,B). Además, en la prueba de invasión celular, el miR-133 también redujo sistemáticamente las tasas de invasión de ambas células A549 y HCC827, en comparación con los experimentos con transfección de control (fig. 3C,D). En su conjunto, estos resultados demuestran sólidamente el papel del miR-133 en la inhibición de la génesis tumoral del cáncer de pulmón.
La expresión del MiR-133 inhibe la migración y la invasión de células de cáncer de pulmón. A) Prueba de cicatrización de heridas con líneas celulares A549 y HCC827, tras transfección con control miARN negativo o miR-133. B) Las distancias de migración respecto al control en la prueba de cicatrización de heridas se determinaron 24h después del daño. C) Prueba de invasión celular con líneas celulares A549 y HCC827, tras transfección con control miARN negativo o miR-133. D) El número de células invadidas respecto al control se cuantificó 24h después de sembrar las células. Los valores son medias ± EEM de 3 experimentos independientes.
* p < 0,05 frente al control respectivo.
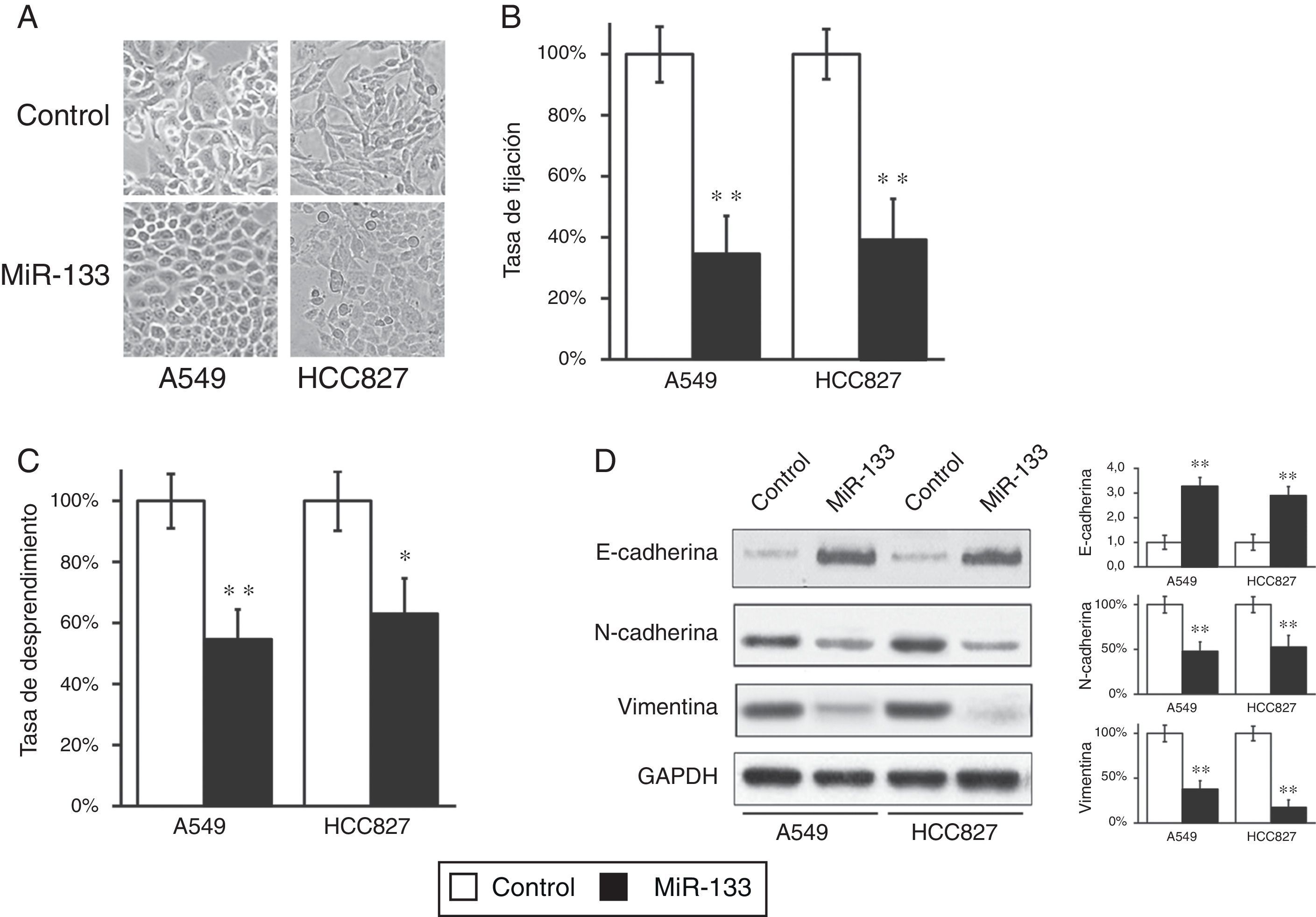
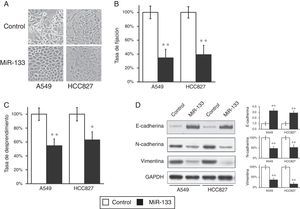
Mientras efectuábamos los experimentos de cicatrización de heridas y de invasión celular, observamos frecuentes cambios morfológicos en las células transfectadas con miR-133. Inicialmente, tanto las células A549 como las HCC827 mostraban una morfología alargada y fibroblastoide, pero después de la transfección de miR133 ambas líneas celulares tomaron una forma redondeada (fig. 4A), lo que sugirió una pérdida del fenotipo de la TEM. Durante la transición, las células epiteliales del tumor primario adquieren el fenotipo mesenquimatoso, lo que resulta en un mayor grado de invasión y metástasis, diseminándose a través de la circulación hasta alcanzar otros tejidos secundarios. Para confirmar esta observación, realizamos pruebas de fijación y desprendimiento celular en 2 líneas celulares de cáncer de pulmón transfectadas con un control miARN negativo o con miR-133. Como se muestra en la figura 4B,C, el miR-133 redujo significativamente las tasas de fijación y desprendimiento en ambos tipos de células A549 y HCC827, en comparación con las células transfectadas de control. Estos resultados indican la pérdida de las características de la TEM a nivel morfológico.
La expresión del MiR-133 inhibe la transición epitelio-mesenquimatosa (TEM) de células de cáncer de pulmón. A) Morfología celular observada en líneas celulares A549 y HCC827, tras transfección con control miARN negativo o miR-133. B,C) Las pruebas de fijación (B) y despegue celular (C) se efectuaron en líneas celulares A549 y HCC827, tras transfección con control miARN negativo o miR-133. D) La expresión de los marcadores proteicos fenotípicos de la TEM se analizó en líneas celulares A549 y HCC827, tras transfección con control miARN negativo o miR-133. La cuantificación de las expresiones de proteínas normalizadas a GAPDH también se muestra en los paneles de la derecha. Los valores son medias ± EEM de 3 experimentos independientes.
* p < 0,05.
** p < 0,01 frente al control respectivo.
A nivel molecular, la TEM se caracteriza por una disminución del marcador epitelial E-cadherina y un aumento del marcador mesenquimatoso vimentina. Así, evaluamos si este cambio en los fenómenos de la TEM también podría observarse a nivel molecular. Como estaba previsto, el miR-133 elevó la expresión de la E-cadherina y redujo la expresión de la vimentina y N-cadherina, en comparación con las células transfectadas de control (fig. 4D), que demostraron una inversión clara del fenotipo de la TEM a nivel proteico.
DiscusiónUn número cada vez mayor de estudios han demostrado el papel crucial de los diferentes miARN en la génesis tumoral del cáncer de pulmón. Por consiguiente, conocer los patrones anómalos de expresión de los miARN en células de cáncer de pulmón y los programas moleculares subyacentes podría contribuir al desarrollo de nuevos tratamientos clínicos para el cáncer de pulmón. En nuestro estudio, demostramos que el miR-133 disminuye en las líneas celulares de cáncer de pulmón humano A549 y HCC827, en comparación con las líneas celulares de pulmón normal CCD-19Lu y MRC-9. Curiosamente, mediante un análisis de silicio pudimos observar que el miR-133 tiene un supuesto sitio de unión en el 3’-UTR del ARNm FOXQ1. Un experimento realizado con luciferasa confirmó que la secuencia del 3’-UTR es una diana directa del miR-133. Asimismo, al reintroducir la expresión miR-133 en las líneas celulares de cáncer de pulmón A549 y HCC827, observamos que tanto las concentraciones de ARNm como de proteínas de FOXQ1 disminuían de manera sistemática, lo que sugirió que, in vivo, la expresión FOXQ1 estaba reprimida por el miR-133. Por otro lado, la transfección miR-133 también redujo la expresión TGF-β, lo que concuerda con una publicación anterior que afirmaba que es un efector derivado del FOXQ116. Además, la expresión miR-133 redujo significativamente la migración y la invasión de células de cáncer de pulmón, probablemente por inhibición de la TEM, tal como constató la llamativa elevación del marcador epitelial E-cadherina y la reducción de los marcadores mesenquimatosos N-cadherina y vimentina.
Estudios recientes han apuntado el importante papel de los miARN en la TEM de células cancerosas. El grupo miR-134/487b/665, por ejemplo, regula la TEM mediada por TGF-β dirigiéndose a la guanilato-cinasa invertida 2 de membrana de células de cáncer de pulmón18. También se constató que, en el cáncer de mama, el miR-125b/489 regula la vía de la TEM19,20. Se vio que la disminución de miR-200c es responsable de la resistencia adquirida a los inhibidores del EGFR, a través de la manifestación de las características de la TEM21. Además, en el cáncer hepático se ha observado que el miR-216a/217 induce la TEM dirigiéndose al PTEN y Smad722.
Estudios muy recientes han apuntado el papel del miR-133 en diversos tipos de cánceres humanos. En el carcinoma hepatocelular, el miR-133 actúa como supresor tumoral, dirigiéndose al IGF-1R23. En el cáncer colorrectal, la expresión ectópica del miR-133 suprimió significativamente el crecimiento del cáncer in vitro e in vivo, apuntando a la E3-ubiquitina proteína-ligasa y aumentando así la expresión de p5324. El miR-133 también disminuyó en diferentes líneas celulares de cáncer gástrico, en las que se observó que su reexpresión inhibía la vía de señalización CDC42-PAK e inhibía la migración y la invasión de células cancerosas25. Algunos estudios recientes han notificado de manera sistemática que el miR-133 también podría dirigirse directamente al receptor del factor de crecimiento epidérmico (EGFR) en los cánceres de próstata26, vejiga urinaria27, gástrico28 y el glioblastoma multiforme29, en los que el miR-133 inhibió la proliferación, la migración y la invasión de estas células tumorales diversas. En conjunto, todos los estudios anteriores han señalado el papel crítico del miR-133 en la regulación de la progresión de diferentes cánceres humanos, afectando a diferentes vías de señalización.
Para concluir, nuestro estudio es el primero que involucra al miR-133 en la TEM del cáncer de pulmón. Dado que la TEM a menudo se ha asociado a la agresividad de las células tumorales, como la migración y la invasión, el hecho de inhibir o invertir esta transición podría conducir a nuevos abordajes terapéuticos para el tratamiento del cáncer. En este contexto, constatamos que el miR-133 podría invertir la TEM de las líneas celulares de cáncer de pulmón A549 y HCC827, lo que probablemente propició que el miR-133 pudiese inhibir de manera significativa la migración y la invasión de las células de cáncer de pulmón. Por consiguiente, nuestros resultados respaldan el papel del miR-133, a través de la inhibición de la transición epitelio-mesenquimatosa, como posible instrumento terapéutico molecular para el tratamiento del cáncer de pulmón.
FinanciaciónEste estudio ha sido financiado por National Natural Science Foundation of China (31300969), Natural Science Foundation of Jiangsu Province (BK20130302) y China Postdoctoral Science Foundation (2013M540461 y 2013M541717).
Contribuciones de los autoresTodos los autores participaron en el diseño e interpretación de los estudios, el análisis de los datos y la revisión del manuscrito; Bo Xiao, Huazhen Liu y Zeyun Gu efectuaron los experimentos, Bo Xiao y Cheng Ji redactaron el manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.