La infección pulmonar crónica por Pseudomonas aeruginosa constituye el factor de riesgo más importante de mala evolución respiratoria en los pacientes con fibrosis quística y se asocia a una mayor morbimortalidad, que es peor cuanto más tempranamente se produce1-4.
Para evitar la colonización crónica es imprescindible la erradicación del patógeno, que solo se puede producir en los momentos iniciales de la colonización, por lo que es fundamental el diagnóstico precoz de la infección y el tratamiento intensivo con el objetivo de impedir la progresión a infección crónica5-7.
En España, el cribado neonatal se inició en 1999 en Cataluña, Castilla-León y Baleares y en 2015 se extendió a todas las comunidades8. El diagnóstico de la fibrosis quística en el período neonatal permite la detección precoz de la primoinfección bronquial por P. aeruginosa. Si se instaura un tratamiento intensivo y persistente ante el primer aislamiento de dicho patógeno, en la mayoría de los casos se logra su erradicación y, por consiguiente, retrasa la colonización crónica, lo que mejora la supervivencia9-11.
El objetivo principal del estudio es describir la prevalencia de primoinfección, infección intermitente e infección crónica por P. aeruginosa (según criterios de Leeds12) de los pacientes con fibrosis quística diagnosticados por cribado neonatal (DCN) comparada con los pacientes no diagnosticados por cribado neonatal (NDCN) que están o han estado en seguimiento en nuestra Unidad de Fibrosis Quística Pediátrica. El objetivo secundario es describir la prevalencia en ambos grupos en función de las mutaciones.
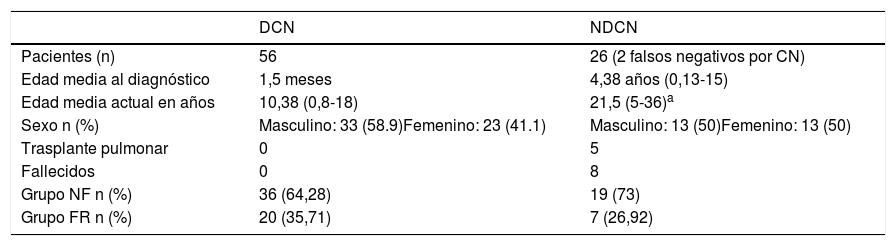
Es un estudio descriptivo retrospectivo, en el que se incluyó a todos los pacientes diagnosticados de fibrosis quística antes de los 18 años, de 1985 a 2018. Se compararon los pacientes DCN con los NDCP (incluyendo los falsos negativos por cribado neonatal). Los subclasificamos en grupo NF (no función): pacientes portadores de 2mutaciones con nula o mínima función del CFTR (mutaciones del grupo I, II o III) y grupo FR (función residual): pacientes portadores de una mutación con nula o mínima función del CFTR y una mutación con función residual del CFTR (mutación del grupo IV, V, VI o VII) o pacientes con 2mutaciones con función residual del CFTR. En la tabla 1 se pueden observar las características de los pacientes.
Características de los pacientes diagnosticados de fibrosis quística por cribado neonatal y los no diagnosticados por cribado neonatal
| DCN | NDCN | |
|---|---|---|
| Pacientes (n) | 56 | 26 (2 falsos negativos por CN) |
| Edad media al diagnóstico | 1,5 meses | 4,38 años (0,13-15) |
| Edad media actual en años | 10,38 (0,8-18) | 21,5 (5-36)a |
| Sexo n (%) | Masculino: 33 (58.9)Femenino: 23 (41.1) | Masculino: 13 (50)Femenino: 13 (50) |
| Trasplante pulmonar | 0 | 5 |
| Fallecidos | 0 | 8 |
| Grupo NF n (%) | 36 (64,28) | 19 (73) |
| Grupo FR n (%) | 20 (35,71) | 7 (26,92) |
CN: cribado neonatal; DCN: diagnosticados por cribado neonatal; FR: función residual, pacientes portadores de una mutación con nula o mínima función del CFTR y una mutación con función residual del CFTR (mutación del grupo IV, V, VI o VII) o pacientes con 2 mutaciones con función residual del CFTR; NDCN: no diagnosticados por cribado neonatal; NF: no función, pacientes portadores de 2 mutaciones con nula o mínima función del CFTR (mutaciones del grupo I, II o III).
Se revisan las historias clínicas de los pacientes, así como todos los cultivos de secreciones respiratorias (desde el nacimiento hasta los 18 años o hasta enero de 2018 si eran menores). Los cultivos se hicieron mensualmente y, cuando eran positivos, semanalmente hasta su negativización. El tratamiento utilizado para la infección bronquial por P. aeruginosa fue, en la primoinfección, inhalado con colistina, tobramicina o aztreonam (3-6 meses) junto con ciprofloxacino oral (3 semanas). En la infección crónica, por vía inhalada en tratamiento continuo con colistina o ciclos on-off de 28 días con tobramicina o aztreonam. Durante las exacerbaciones leves-moderadas, tratamiento oral con ciprofloxacino (2-3 semanas) y en las graves, tratamiento intravenoso (β-lactámico asociado a un aminoglicósido según el antibiograma).
Desde la perspectiva estadística, las variables cuantitativas se describen mediante media y rango, y las variables cualitativas mediante frecuencias relativas y absolutas. Para la comparación de prevalencias entre grupos se utiliza la prueba χ2.
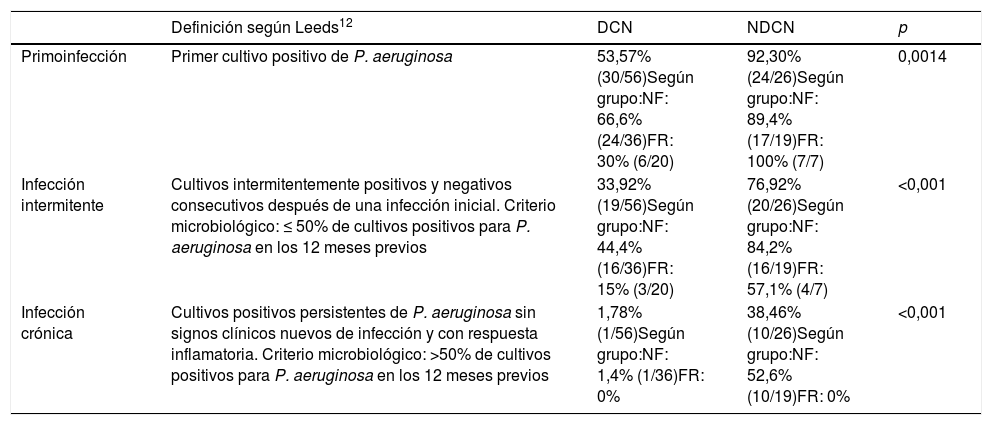
En la tabla 2 se pueden observar las prevalencias de infección por P. aeruginosa tanto en los pacientes DCN como en los NDCN, así como en los subgrupos de pacientes NF y FR.
Prevalencia de infección por Pseudomonas aeruginosa en pacientes diagnosticados de fibrosis quística por cribado neonatal y los no diagnosticados por cribado neonatal
| Definición según Leeds12 | DCN | NDCN | p | |
|---|---|---|---|---|
| Primoinfección | Primer cultivo positivo de P. aeruginosa | 53,57% (30/56)Según grupo:NF: 66,6% (24/36)FR: 30% (6/20) | 92,30% (24/26)Según grupo:NF: 89,4% (17/19)FR: 100% (7/7) | 0,0014 |
| Infección intermitente | Cultivos intermitentemente positivos y negativos consecutivos después de una infección inicial. Criterio microbiológico: ≤ 50% de cultivos positivos para P. aeruginosa en los 12 meses previos | 33,92% (19/56)Según grupo:NF: 44,4% (16/36)FR: 15% (3/20) | 76,92% (20/26)Según grupo:NF: 84,2% (16/19)FR: 57,1% (4/7) | <0,001 |
| Infección crónica | Cultivos positivos persistentes de P. aeruginosa sin signos clínicos nuevos de infección y con respuesta inflamatoria. Criterio microbiológico: >50% de cultivos positivos para P. aeruginosa en los 12 meses previos | 1,78% (1/56)Según grupo:NF: 1,4% (1/36)FR: 0% | 38,46% (10/26)Según grupo:NF: 52,6% (10/19)FR: 0% | <0,001 |
Se analizan también en subgrupos de pacientes: grupo NF: 2 mutaciones con nula o mínima función del CFTR (mutación del grupo I, II o III) y grupo FR: una mutación con nula o mínima función del CFTR y una mutación con función residual del CFTR (mutación del grupo IV, V, VI o VII) o 2 mutaciones con función residual del CFTR.
CN: cribado neonatal; DCN: diagnosticados por cribado neonatal; FR: función residual; NDCN: no diagnosticados por cribado neonatal; NF: no función.
Si comparamos las prevalencias de infección por P. aeruginosa entre los pacientes DCN y los NDCN encontramos diferencias estadísticamente significativas tanto en primoinfección (p = 0,0014), como en infección intermitente (p < 0,001) y crónica (p < 0,001). En parte puede ser debido a las diferencias de edad entre los 2grupos, ya que la edad media de los DCN es de 10,38 años y los NDCN fueron seguidos hasta los 18 años.
Los pacientes con mutaciones más graves (grupo NF) diagnosticados por cribado neonatal tienen más prevalencia de primoinfección por P. aeruginosa que el grupo FR (p = 0,018). Cabe resaltar que ningún paciente del grupo FR (ni los DCN ni los NDCN) presentó infección crónica por P. aeruginosa.
De los pacientes DCN, el 53,57% (30/56) presentaron infección por P. aeruginosa en alguna ocasión. La edad media de la primoinfección fue de 6 años y la tasa de erradicación del 100%. El tiempo mediano entre la primera y la segunda infección fue de 29 meses (rango: 1,4-96,8). Solo un 1,78% (1/56) de este grupo presenta infección crónica.
De los pacientes NDCN, el 92,30% (24/26) han presentado infección por P. aeruginosa en alguna ocasión. El 19,23% (5/26) ya tenían infección crónica al diagnóstico, sin erradicación. La edad media de diagnóstico de estos 5 pacientes fue de 5,66 años, en cambio, la edad media de diagnóstico de todo el grupo fue de 4,38 años. Otro 19,23% (5/26) presentaba infección intermitente al diagnóstico, pero con el tiempo pasó a infección crónica. En total, el 38,46% (10/26) de este grupo presenta infección crónica.
Nuestros resultados concuerdan con otras publicaciones, que también objetivan una disminución de la prevalencia de infección crónica por P. aeruginosa tras la implantación del cribado neonatal13-15. En Canadá13, la prevalencia de infección crónica por P. aeruginosa fue del 28,4% en los DCN y del 61,8% en los NDCN (p < 0,001). En el Reino Unido14, la prevalencia en menores de 15 años fue de un 16% en los DCN y del 20% en los NDCN. En el registro de la fundación americana de fibrosis quística del 2018 se recoge que el 46,2% de los pacientes con esta enfermedad menores de 18 años tenían infección por P. aeruginosa (17% intermitente y 28,3% crónica) con una mediana de edad de primoinfección de 5,2 años15. Si comparamos los resultados de estas publicaciones con los nuestros, podemos observar que, aunque en todos ellos se objetiva una disminución de la prevalencia de infección crónica por P. aeruginosa en los pacientes DCN, nuestros resultados muestran una menor prevalencia. Esto podría ser debido a un seguimiento muy estrecho, con visitas y cultivos de secreciones respiratorias mensuales, con tratamientos precoces e intensivos de la primoinfección por P. aeruginosa y también porque hay mayor cantidad de pacientes del grupo FR.
En conclusión, observamos un cambio en la historia natural de la infección bronquial por P. aeruginosa en la fibrosis quística tras la implantación del cribado neonatal, con una disminución significativa (p < 0,001) de la prevalencia de infección crónica por dicho patógeno en estos pacientes.
FinanciaciónLos autores no han recibido ayudas de financiación.
Conflicto de interesesLos autores declaramos que no hay conflicto de intereses.