La histoplasmosis es una infección producida por Histoplasma capsulatum, un hongo dimórfico endémico en el continente americano y algunas zonas de África y Asia. En Europa se presenta principalmente como infección importada, habiendo casos autóctonos publicados en Italia y Turquía1. En los últimos años, debido al aumento de los viajes a zonas endémicas y a la inmigración, su diagnóstico en zonas no endémicas ha aumentado, como ha ocurrido en España2. Los casos importados suceden mayoritariamente en adultos jóvenes, siendo muy infrecuente en niños o adolescentes. En un registro europeo1, solo 4 de 118 casos se diagnosticaron en individuos menores de 20 años. Presentamos el caso de un adolescente inmunocompetente con histoplasmosis pulmonar aguda tras un viaje a México.
Se trata de un varón de 15 años previamente sano, con calendario vacunal completo, que consultó por fiebre de hasta 39,5°C de 9 días de evolución. Había regresado 20 días antes de la Riviera Maya, donde había estado 10 días de turismo. Asociaba astenia, hiporexia, mialgias generalizadas y cefalea, junto con tos leve sin rinorrea. La exploración física fue normal. La analítica sanguínea mostró una discreta elevación de reactantes de fase aguda (PCR 2,8mg/dL), sin otras alteraciones, siendo el hemocultivo estéril.
Se amplió el estudio con serologías (virus de Epstein-Barr, citomegalovirus, hepatitis A y B, VIH, Toxoplasma, Entamoeba histolytica, Brucella, Borrelia, dengue, parvovirus B19, Echinococcus, Leishmania, sífilis, Legionella y Mycoplasma pneumoniae) que resultaron negativas; antígeno de la malaria, gota gruesa, QuantiFERON® y cultivos de sangre, exudado faríngeo y orina negativos; cultivo viral en exudado nasofaríngeo negativo; Mantoux de 0mm; frotis de sangre periférica normal. Serología de virus Zika IgG+/IgM− y PCR en sangre negativa. Serologías de hongos endémicos (Blastomyces, Coccidioides, Histoplasma, Paracoccidioides) negativas. En la ecografía abdominal destacaba una esplenomegalia de 15,6cm, y en la radiografía de tórax presentaba un aumento de densidad a nivel paracardiaco derecho, compatible con una consolidación neumónica, iniciando tratamiento empírico con amoxicilina.
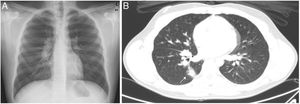
Debido a la persistencia de la fiebre (total de 14 días), fue valorado por cardiología (ECG y ecocardiografía) y oftalmología (fondo de ojo), sin objetivarse alteraciones. El paciente asoció a los síntomas iniciales sudoración profusa de predominio nocturno y pérdida de 3kg de peso. A las 3 semanas del inicio del cuadro se repitieron las serologías de hongos endémicos; en la radiografía de tórax destacaban adenopatías hiliares bilaterales y paratraqueales (fig. 1A) y en la ecografía abdominal, un incremento de la esplenomegalia hasta 17cm y adenopatías en el hilio hepático. Se realizó TAC toracoabdominal (fig. 1B), donde se evidenció un nódulo parenquimatoso derecho, junto con adenopatías hiliares y mediastínicas (paratraqueales derechas, ventana aortopulmonar, subcarinales y receso pleuroacigoesofágico) voluminosas ipsilaterales. Ante la posibilidad de un síndrome linfoproliferativo, se realizó un lavado broncoalveloar y aspirado de la médula ósea a los 29 días del inicio de los síntomas. En ambas muestras, los estudios anatomopatológicos fueron normales, sin aislamientos en los cultivos fúngicos ni bacterianos, con PCR panfúngica (18S ARNr) y específica de Aspergillus y Mycobacterium tuberculosis negativas. Finalmente, se objetivó la seroconversión de los anticuerpos frente a Histoplasma mediante inmunodifusión en la segunda muestra extraída.
Ante el diagnóstico de histoplasmosis aguda y por la persistencia de los síntomas durante más de 4 semanas, se pautó tratamiento con itraconazol durante 6 semanas. En los controles sucesivos el paciente presentó resolución completa de los síntomas, junto con la normalización de las alteraciones radiológicas.
Hasta donde sabemos, se trata del primer caso pediátrico publicado de histoplasmosis en España. La infección ocurre por inhalación de las conidias durante actividades que impliquen contacto con la superficie contaminada. La gravedad depende de la intensidad de la exposición y del estado inmunológico del huésped, teniendo un amplio espectro clínico. En la mayoría de los individuos inmunocompetentes ocurre de forma asintomática. En el caso de las formas agudas sintomáticas en inmunocompetentes, suelen consistir en un cuadro seudogripal, con fiebre y tos, que se autolimita a las 2 semanas3. La presentación radiológica es muy inespecífica, con infiltrados reticulonodulares difusos, junto con adenopatías hiliares y mediastínicas. La forma más grave es la progresiva diseminada, que puede ocurrir tras una infección aguda o debido a la reactivación de una infección pasada. Se produce por la diseminación hematógena del hongo en individuos inmunodeprimidos o en edades extremas de la vida.
En zonas no endémicas, la infección puede observarse en 2 tipos de poblaciones con diferente perfil clínico: viajeros e inmigrantes procedentes de zonas endémicas4. En España, la mayoría proceden de América Central y del Sur5. En el caso de los viajeros, es frecuente identificar una actividad de riesgo que implica exposición al hongo (espeleología, construcciones, excavaciones, etc.), suelen ser individuos inmunocompetentes y, en el caso de ser sintomáticos, se presenta como una infección pulmonar aguda iniciada dentro de los 2 meses de la exposición y que no suele ser grave. Puede ocurrir de forma agrupada en varios casos6. Nuestro paciente refirió haber realizado una excursión a cenotes durante el viaje, lo que explicaría la exposición de riesgo.
La confirmación diagnóstica se obtiene mediante el aislamiento del hongo, siendo muy infrecuente en las formas agudas. En estos casos, el diagnóstico microbiológico habitual suele ser serológico. Los anticuerpos frente a Histoplasma empiezan a detectarse a las 2-4 semanas de la infección, alcanzando una sensibilidad del 90%7, por lo que en casos sospechosos con una primera serología negativa, como el que presentamos, conviene repetirla posteriormente. Otras opciones diagnósticas incluyen el estudio anatomopatológico, la detección de antígeno (no disponible fuera de EE. UU.) o, más recientemente, mediante PCR, solo disponible en laboratorios de referencia. El tratamiento depende de la forma clínica, la gravedad y el estado inmunológico del individuo. La Sociedad de Enfermedades Infecciosas de EE. UU. (IDSA) recomienda el tratamiento en las formas pulmonares agudas moderadas o graves y en las leves cuyos síntomas se prolonguen más de 4 semanas8.
Debería considerarse el diagnóstico de histoplasmosis en viajeros procedentes de zonas endémicas con fiebre y síntomas respiratorios que han realizado actividades de riesgo, o tras el diagnóstico en otros acompañantes. Debido al curso autolimitado, es probable que se trate de una infección infraestimada en zonas no endémicas, siendo necesario un alto índice de sospecha.